Introducción
La utilización de β2-agonistas principalmente el clembuterol (Clb), zilpaterol y la ractopamina, están produciendo un incremento en las intoxicaciones en humanos y animales, principalmente por el uso desmedido de estos componentes que son utilizados como aditivos alimenticios (Sumano et al., 2002, Caicedo et al., 2009, 2011, Valladares et al., 2013 y Caicedo et al., 2021). Por otro lado, también se han desarrollado otros componentes que mejoran la calidad corporal de los animales como: antibióticos, prebióticos, enzimas, antimicrobianos, modificadores del sistema inmunitario, modificadores metabólicos o agentes anabolizantes. En los últimos años, se ha incrementado el uso de los β2-agonista-adrenérgicos (β2-AA) en animales de importancia económica; considerar que el uso excesivo de este fármaco como el clembuterol (Clb) han tenido y sigue teniendo un impacto toxico muy significativo a nivel humano y animal (alterando el bienestar animal y humano, respectivamente). Su utilización aumenta la producción de carne a corto plazo, en tres meses se puede aumentar el peso vivo del animal en un 50-80%, esto dependerá de la concentración de Clb que se le suministre al animal, al igual que el tiempo de administración (Caicedo et al., 2021), ya que el Clb tiende a retener compuestos nitrogenados, incrementado la masa muscular (Smith, 1998). Los agonistas de β2AA aumentan el metabolismo degradativo de los lípidos en los adipocitos in vitro e in vivo. En los tejidos de los mamíferos, existen hasta el momento tres subtipos distintos de receptores-βAR de los β2AA, como: β1 (β1AR), β2 (β2AR) y β3 (β3AR). Los tejidos individuales (ejemplo: hígado, corazón) tienen diferentes proporciones de subtipos, esto dependerá de la especie de vertebrados, y que varía entre diferentes especies. Consecuentemente, se espera que ciertos agonistas de β2AA tengan efectos diferentes en el mismo tejido en diferentes especies debido a las diferencias en la distribución de los subtipos de βAR y (o) secuencia de aminoácidos(Mersmann, 2002); por tal motivo, se puede agregar que los efectos producidos por un agonista (o antagonista) de βAR en el tejido adiposo in vivo dependen no solo de la especie y la distribución de los subtipos de βAR del adipocito, sino también de la farmacocinética y farmacodinámica del compuesto en esa especie, incluido el flujo sanguíneo al tejido, y los múltiples efectos metabólicos y endocrinos del compuesto en otros tejidos del cuerpo (Mersmann, 2002).
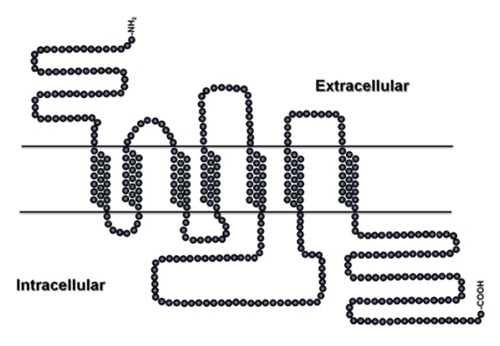
Estos fármacos β2-AA, son además agentes químicos que actúan específicamente a nivel de los receptores adrenérgicos celulares (β-AR), metabolizando los nutrientes e incrementan la energía, aumentan el metabolismo de las proteínas y de grasas, modifican la permeabilidad de la membrana celular, aumento de la lipólisis, y la glucogenólisis (Meyer y Rinke,1991), debido a la ubicación de sus receptores (dominios hidrofóbicos transmembranales) en la membrana celular en donde actúan. Figura 1.
Figura 1: Todos los receptores β-AR contienen siete dominios hidrofóbicos transmembranales que permite que este componente como el Clb, su efecto sea mucho más prolongado principalmente en los adipocitos. Según Johnson et al., 2014, (Asian Australasian J. Anim. Sci., Vol.27, No. 5: 757-766)
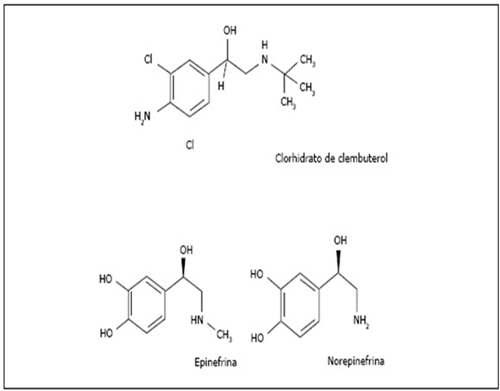
Además, traen consigo un incremento en la formación de masa muscular, y esto debido a que el grupo OH que poseen otros β2-AA, en el caso del Clb, es sustituido por un halógeno llamado cloro (Cl), este ion Cl evita la biotransformación por las enzimas COMT (catecol-O-metil-transferasa) a nivel tisular y se hace lenta la biotransformación hepática (Courtheyn et al., 1996), este ion cloro en el clembuterol, lo hace más liposoluble que sus análogos (zilpaterol, salbutamol y ractopamina) y como resultado tiende a difundirse más profundamente en los tejidos y en la grasa animal (Martin 1971, Ruffolo, 1991, Waldeck y Widmark, 1995). Figura 2.
Figura 2: Comparación de la estructura química de tres componentes llamados fenetanolaminas dos producidos fisiológicamente producidos por el organismo: la Epinefrina y Norepinefrina y un componente sintético llamado clembuterol, este se caracteriza por tener dos átomos de cloro-Cl en su estructura, el cual, le da una acción prolongada. (Tomado de Valladares et al., 2015).
La aplicación de β2-AA a mamíferos, amplifica una ganancia de peso, esto posiblemente se deba al aumento de la cantidad de ARNt (ácido ribonucleico de transferencia) para varias proteínas del músculo esquelético, en este caso, después del tratamiento con β2-AA se incrementa el ARNm para la miosina de cadena ligera (Smith et al., 1998), el ARNm de la a-actina (Helferich et al., 1990) y el inhibidor de la proteasa calpaina-calpastina (Higgins et al.,1988). Los β2-AA, pueden incrementar el flujo sanguíneo en ciertas regiones del cuerpo, el mismo permite el proceso de hipertrofia del músculo esquelético al contener mayores cantidades de sustrato y fuentes de energía para la síntesis de proteína. Teóricamente la utilización de estas sustancias presenta una serie de ventajas relacionadas, no solo con la mejora de la productividad, sino también de la calidad de la carne, puesto que las carnes procedentes de animales tratados con β2-AA presentan un mayor porcentaje de tejido magro (Beermann, 1993; Waldeck y Widmark 1995 y Mersmann, 1998). Sin embargo, el aumento del uso de β2-AA está relacionado con el incremento de intoxicaciones en humanos, según Kuri, et al (2007); se considera como dosis terapéutica (DT) 0.8 µg/kg de peso corporal dos veces por día. La duración máxima del tratamiento en ganado no lactante permitido es de 10 días por vía oral o intravenosa. El uso ilegal del Clb y análogos en el ganado, es toda dosis que supere la dosis terapéutica (Sauer et al, 1995). En base a lo anterior se muestra que hasta el momento se desconoce las rutas metabólicas (biotransformación y biodisponibilidad) de degradación de este aditivo alimentico, por lo tanto, el objetivo de este estudio fue determinar las posibles rutas metabólicas del Clb en bovinos y su efecto en el deterioro homeostático del animal.
Materiales y Métodos
Animales: Se utilizaron 2687 bovinos (Bos taurus X Bos indicus), el 85 % fueron machos y 15% hembras, procedente de diferentes zonas zoogeográficas del país y de diferentes rastros municipales como de fincas privadas. Todas las fincas en estudio fueron georreferenciadas con un GPS. Las edades de los animales fluctuaron desde los 22-38 meses, las razas predominantes: razas cruzadas: Angus X Brahman=Brangus, Brahman-cebú, Gir, Simmental,Angus, Cebú, Holstein, Charoláis y criollos.
Toma de muestras: Se emplearon tubos de ensayo al vacío, el primer tubo sin anticoagulante, para obtener el suero sanguíneo para la determinación del perfil metabólico y perfil hormonal de esteroides principalmente (progesterona y 17β-estradiol) y otro tubo con EDTA, para la realización de frotis sanguíneos y así determinar la biometría hemática (el recuentro diferencial de leucocitos y medición de hemoglobina). La sangre sin EDTA fue centrifugada a 2,500 rpm/10min, el suero obtenido se separó en tubos eppendorf y fueron congelados a –20ºC para su posterior análisis de metabolitos sanguíneos, se utilizaron kit-Bio-System-USA y se midieron 18 metabolitos tales como: macrominerales: calcio, fosforo, enzimas hepáticas: Gamma-glutamil transferasa (γGT), deshidrogenasa láctica (L-DH), Fosfatasa alcalina (FA); transaminasas como: alanina amino-transferasa (ALT/GPT) y aspartato amino-transferasa (AST/GOT), metabolitos como: albumina, Bilirrubina directa y total, colesterol total, Glucosa, proteínas totales, Urea/BUN, enzimas prostáticas: fosfatasa ácida total (FAt), no prostática y prostática; las mediciones se realizaron en un espectrofotómetro (Spectronic 20). Para la determinación del clembuterol se utilizó el kitRIDASCREEN, Clenbuterol Fast (R-Biopharm AG, Darmstadt, Germany), para medir las concentraciones de esteroides: progesterona (P4) y 17β-estradiol (E2), se utilizó la técnica de inmunodiagnóstico de ELISA (Enzyme-linked immunosorbent assay), se utilizaron los kits diagnostica, USA, se midieron en un lector de ELISA (Stat Fax-2100, Microplate Reader).
Análisis Estadístico: los datos obtenidos se les realizado un análisis de varianza (ANOVA), con el programa estadístico Stat-2 (Olivares 1984) y para determinar la significancia entre promedios se utilizó Duncan New Multiple Range Test.
Resultados
1. Efecto de las concentraciones administradas en bovinos con Clb
Los resultados muestrearon que el Clb, (β2-AA) altera el crecimiento y la composición del músculo, al parecer, decrecer el incremento del musculo cuando la lipogénesis decrece, estimula la lipólisis; el incremento de la masa muscular, el cual, está asociado con la proliferación de células satélites, estimulando las miofibrillas en la síntesis de proteínas y la supresión de la degradación de miofibrillas en la degradación de proteínas. Los animales muestreados incrementaron su peso corporal entre un 50 a 70 % de su peso inicial, en un tiempo de 90 a 112 días de tratamiento, la alimentación diaria con Clb fue de dos veces al día, a concentración entre 5 a 10 veces la dosis terapéutica (0.8µg/Kg-peso corporal), ósea a dosis anabólica.
Un primer muestreo de animales bovinos llevados a rastro con un peso de sacrificio entre 457±21.6 a 672.8±39.9 kg, en un periodo de tratamiento entre 75.8±8.9 días a 121.7±11.3 días y con edades que fluctuaron entre los 25±1.0 a 38.9±2.2 meses, en la figura 3 se muestran las concentraciones de Clb detectadas en estos animales ya listo para su distribución y venta, las concentraciones de Clb fluctuaron entre 112.4±5.9 a 778±12.5 ng/kg. Figura 3 .
Figura 3. Se muestra las concentraciones de Clb de 17 bovinos en un rastro, donde la mayoría de los animales se detectaron con concentraciones de Clb por arriba de los permitidos por el Codex alimentarius-FAO (125ng/kg), la linea roja indica la concentración máxima permitida para consumo humano
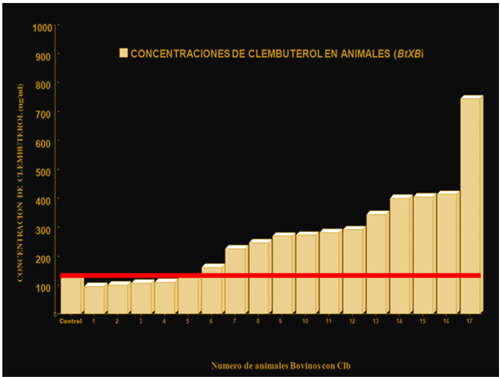
Un segundo muestreo realizado 12 meses después del primero, se detectaron concentraciones de Clb en tejido sanguíneo estos fluctuaron entre los 245±34.5 a 1623±146.6 ng/kg, si se analizan estos valores corresponde a animales bovinos listos para ser distribuidos en los diferentes supermercados para ser consumidos por el hombre, sin embargo, estos valores no coinciden con los valores aceptados por la FAO/OMS-(Codex Alimentarious), cuyos valores no deben rebasar a los 125.0 ng/kg, si el animal ha sido tratado con Clb, y supera este valor, entonces deberá someterse a periodo de cuarentena, para que estos valores presente en sangre bajen a través de su degradación a nivel sanguíneo y hepático, sin embargo, las altas concentraciones del Clb detectados en este estudios han coincidido con casos de intoxicaciones en humanos por la ingesta de vísceras de bovinos que es donde más se concentra este β2-AA-Clb en bovinos, existen casos de intoxicaciones de Clb en humanos desde el año 2002 al año 2022, con más de 4500 casos a nivel nacional, por ejemplo en México.
2. Efectos del Clb al Perfil Metabólico:
Se recalca que existen muy pocos trabajos o casi ningún tipo de información del efecto del Clb los diferentes metabolitos y enzimas a nivel del suero sanguíneo de los animales bovinos destinados al consumo humano, sin embargo, este estudio realizo la medición de los varios metabolitos, el cual, fueron detectados y en la cual mostramos a continuación:
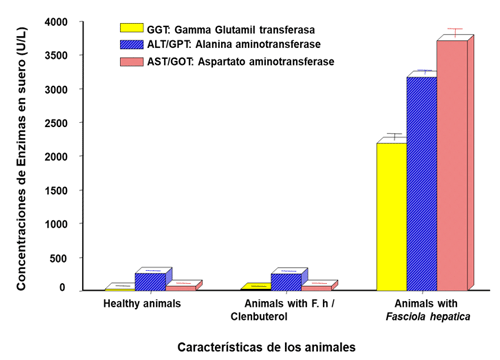
En cuanto al perfil metabólico se obtuvieron concentraciones elevadas de las enzimas transaminasas: la AST/GOT se tuvieron valores de animales clínicamente sanos (ACS) de 533.9±0.26 U/L en comparación con animales tratados con Clb, cuyo valor detectado fue de 264.7±0.22 U/L, hubo un descenso significativo p< 0.01, el cual, indica que hay un enorme cambio fisiológico a nivel hepático, a nivel del parénquima hepático, posiblemente degradación del parénquima hepático sin destrucción de tejido, ya que estas enzimas son intracelulares, lo mismo ocurrió con la ALT/GPT, cuyo valor en animales no tratados con Clb fue de 345.5±0.60 U/L en comparación con bovinos tratados con Clb se detectó valores de 277.9±0.50 U/L, hay también una disminución significativa de p< 0,05; por otro lado, la enzima hepatica la Gamma-glutamil transferasa (γGT), se detectó valores significativamente muy bajos (p< 0.01) con referente a los animales ACS, entre 16.7±0.34 y 26.5±0.30 U/L, respectivamente, el Clb también es capaz de disfrazar ciertas patológicas hepáticas trabajo ya presentado en el 2011. (Figura 4), estos animales presentaron muchas patologías hepáticas como: quistes, obstrucción de canalículos hepáticos y probablemente renal y aunque no se haya determinado para este caso muy particular a la fosfatasa alcalina-(FA).
Figura 4: Se muestra como el Clb disfraza las enfermedades hepáticas en bovinos, donde los valores de animales con Fasciola hepatica más Clb tienen valores enzimáticos muy similares a los animales clínicamente sanos, mientras que los animales con Fasciola hepatica si muestran daños hepáticos- fibrosis hepatica-cirrosis, por los valores enzimáticos muy elevados en comparación con los otros grupos experimentales.
Otros metabolitos como la glucosa sus valores detectados fueron para ACS 115.8±0.31 mg/dL y en animales tratados tuvieron valores de 195.4±0.34 mg/dL son bajo, debido a la alta demanda metabólica que este Clb exige a las diferentes estructuras incluyendo al hígado, páncreas, glándulas tiroides y glándulas suprarrenales, ya que, inicialmente este parámetros metabólicos es muy elevado, al transcurrir las horas y días después de la ingesta de este aditivo alimenticio esta actividad disminuye, pero ciertos componentes procedentes de la degradación del Clb se acumulan incluyendo parte del Clb ingerido y que no llega degradarse en su totalidad, indicando que las biodisponibilidad de este es lo suficiente útil para seguir acumulándose en tejidos y continuar con la degradación de los lípidos, con acumulación de nitrógenos, a través de los adipocitos, estos como reserva energética del organismo y al degradarse liberan ácidos grasos y triglicéridos al torrente sanguíneo. La degradación de los adipocitos conllevan el incremento de la lipolisis, disminución de la lipogénesis e incremento de termogénesis, mientras que el músculo, tiende a acumular las altas concentraciones de Clb, la cual, lo convierte en un anabólico para el animal con un periodo de acción prolongado, considerar que la biotransformación a nivel muscular esto conlleva posiblemente, el aumento de la fibras muscular, esta obedece a que hay un incremento de la síntesis de proteínas, disminución de la degradación de proteínas, aumento de la glucolisis, en la producción de lactato y de la utilización de oxígeno. En el páncreas hay una disminución en la producción de insulina y en el aumento del glucagón, provocando en el animal una diabetes; mientras que en el hígado ocurre un incremento de la glucogenólisis y de la gluconeogénesis, esto conlleva en el animal daños hepáticos como la fibrosis-cirrosis, el cual, se detectó en un 62.3% de los animales estudiados, al igual que la presencia de quistes a nivel hepático.
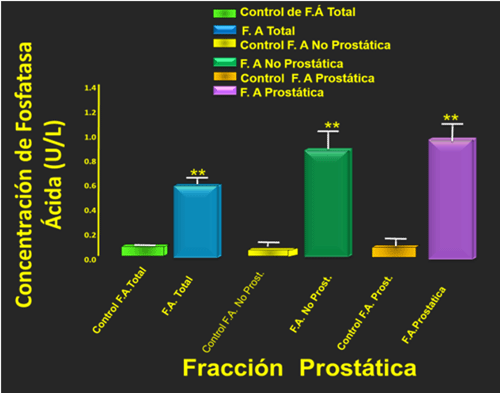
La fosfatasa ácida prostática de los animales ACS su valor detectado fue de 3.87±0.30 U/L, en comparación con los animales tratados con Clb, cuya concentración fue detectada fue de 11.3±1.2 U/L. En su mayoría de los animales presentaron valores muy elevados en la fosfatasa acida total, no prostática y prostática, esto inducido probablemente a la termogénesis testicular, produciendo alteraciones en la morfología espermática. Todos los valores detectados con respecto al control de cada uno de estos parámetros son significativos p< 0.01. Figura 5
Figura 5:se muestras los valores de la Fosfatasa Ácida: total, No prostática y Prostática, demostrando que el Clb produce una elevación de esta enzima prostática, produciendo alteraciones en la morfología espermática. Si los valores de la fosfatasa ácida prostática son elevados como se demuestra en este estudio, indica presencia de un inicio de cáncer prostático si esto valores continúan elevados por un período de tiempo muy prolongado, por ende, se detectó malformaciones de espermatozoides en caso todas las regiones de este.
Además, las concentraciones de colesterol para este estudio disminuyeron de 264.5±0.33 mg/dL a 207.8±0.48 mg/dL, esta disminución es significativa a p< 0.01. El colesterol suele bajar cuando hay disfunción toroidal inducida por exceso de aditivos alimenticios-Clb, ya que se sabe que las glándula tiroides estimula la eliminación del colesterol por secreción directa en la bilis y los ácidos biliares y también estimula su síntesis mediante su control del nivel funcional del hepatocito, donde se forma aproximadamente el 90% del colesterol endógeno y esto puede aclarar la variabilidad de los cambios en la concentración sérica en patologías como hipertiroidismo e hipotiroidismo en los bovinos tratados con este β2AA-Clb, por un periodo de tiempo más allá de lo reglamentados, ya que muchos productores someten a sus animales a más de 100 días de tratamiento y a concentraciones más elevada que la dosis anabólica, entre un 12 y 15 % más.
En cuanto a la Urea/Bun, constituye uno de los componentes nitrogenados más abundante no proteico en el organismo de los rumiantes, es el principal producto nitrogenado de desecho del catabolismo de las proteínas y solo se sintetiza en el hígado, los valores obtenidos para este estudio fluctuaron entre 30.4±0,23 mg/dL en ACS y en animals tratados en 95.8±0,28 mg/dL. Estos últimos valores muy incrementado y significativos (p< 0.01). mostrando una deficiencia renal, ya sea por el incremento de la presión arterial a nivel del aparato yuxtaglomerular.
Cabe también mencionar que los restantes metabolitos medidos no mostraron cambios significativos por tal motivo, en este estudio no lo mencionaremos, pero si queremos recalcar que todos los 17 metabolitos medidos hubo cambios de acuerdo con los valores de los ACS.
3. Efectos del Clb a las Hormonas esteroideas
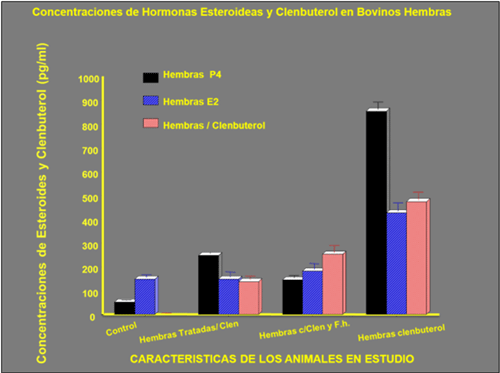
Cuando se detectaron los valores de hormonas esteroideas ligadas con la capacidad reproductiva en hembra se detectó valores de estradiol (E2) entre 152.1±8.91 a 1152.3±89.74 pg/ml, y valores de progesterona (P4), fluctuaron entre 248.51±12,51 a 852.42±90.2 pg/ml estos valores tan elevados de estrógenos y progesterona fueron obtenidos de hembras con anestros post parto muy prolongados mayor a 120 días (postparto).Figura 6
Figura 6:Se muestra las concentraciones de hormonas esteroideas en bovinos hembra: a) animales controles, b) hembras tratadas con Clb, c) hembras con Clb y Fasciola hepatica-Fh y d) hembras con clembuterol, se aprecia que los valores de hembras con Clb y Fh. muestrearon valores de hormonas P4 y E2 más bajos que las hembras con Clb, demostrando que el Clb disfraza las afecciones hepáticas, ya que hembras con Clb y Fh, mostraron una alta prevalencia de quistes- fibrosis-cirrosis y tumores hepáticos, cosa que no se vio en hembras tratadas con Clb
Discusión
1. Que es el clorhidrato de Clembuterol y como actúa en animales de importancia alimentaria:
El Clb posee una estructura química muy relacionada a las catecolaminas capaz de interactuar con receptores adrenérgicos, generalmente del tipo β2. Químicamente es un amino-4-amino alfa T butilamino metil 3, 5 diclorobenzil alcohol (Figura 2). Su vida media es de acción prolongada, con la particularidad de poder almacenarse en hígado y riñón. Según Boato, (2000); Dimaano, (2008) y Valladadares et al., (2013b), se metaboliza por medio de reacciones de N-oxidación en hidroxyclenbuterol y conjugados glucurónicos.
El Clb considerado como un aditivo sintético y que pertenece a una clase de medicamentos análogos fisiológicamente a la adrenalina (Mersmann, 1998). Químicamente se describe como polvo blanco, anhidro, muy soluble en agua y altamente estable a temperatura ambiente, su punto de fusión es de 174 a 175.5 ºC, tiene la capacidad de interactuar con receptores adrenérgicos, generalmente del tipo β2 (β2-agonista), (Ishikawa, 2009; Valladares et al., 2013 a y 2014a, b y c).
Los agonistas adrenérgicos fisiológicos (β-adrenérgicos) son la noradrenalina y la adrenalina; la noradrenalina, constituye una catecolamina del grupo de las fenetanolaminas, también y se considerada como un neurotransmisor del sistema nervioso simpático, que se biosintétisa a partir de la tirosina y circula en el suero sanguíneo en concentraciones relativamente elevadas. La adrenalina del mismo grupo se sintetiza y secreta en la médula adrenal; circula en menores concentraciones que la noradrenalina en la mayoría de los mamíferos, pero en situaciones de estrés responde en mayor proporción que la noradrenalina. La noradrenalina es más selectiva de receptores α y la adrenalina actúa sobre ambos, con mayor selectividad por los receptores β, pero con un efecto α más dominante. Las respuestas fisiológicas se producen cuando estos agonistas β2-adrenérgicos se unen a los receptores específicos (Badino et al., 2005). Estas son moléculas orgánicas y los β2-adrenérgicos que se unen a los receptores β2-adrenérgicos-, dando lugar al complejo agonista-receptor (β2AR), que a su vez activa a la proteína Gs. La subunidad ά de la proteína Gs activa a la adenilato-ciclasa-(ADC-asa), enzima que produce el monofosfato de adenosina cíclico (AMPc), está considerada como una de las principales moléculas de señalización intracelular. Esta molécula, produce sus efectos al unirse a la subunidad reguladora de la cinasa proteica A, para liberar la subunidad catalítica que fosforila a un buen número de proteínas intracelulares (Mazzanti et al., 2003). Estas proteínas tienen papeles funcionales vitales para una variada gama de funciones que van a permitir la entrada de Ca++ a la célula, hasta mediar la síntesis de proteínas clave para el funcionamiento celular (Mazzanti et al., 2003).
El Clb es administrado a dosis entre y diez veces superiores a la terapéutica, a estas concentraciones ha de presentan una acción anabólica, esto va a favorecer a la síntesis de proteína y disminuye a las grasas en la musculatura esquelética del bovino. Los receptores βAR, están presentes en la mayoría de las células de los mamíferos, aunque la distribución de los subtipos (β1, β2 y β3) y la proporción de cada uno de estos varía según el tejidos y especie de animal (Mitchell and Glora, 1998). Se considera a los β1 que predominan en el corazón estimulando su inotropismo (fuerza de contracción) y en el músculo liso intestinal induciendo relajación y los β2AR se localizan en los bronquios y músculo uterino, provocando relajación en ambos casos, por ende, la magnitud de la actividad fisio-farmacológica de un agonista o agonista parcial β adrenérgico, dependerá de su denominada actividad intrínseca en el receptor y distribución en los tejidos blanco (Valladares et al., 2014 a, b).
El Clb su efecto en condiciones fisiológicas produce el crecimiento del músculo esquelético, el cual, es el resultado primario de una hipertrofia y se detecta con el aumento de la síntesis proteica muscular y con una disminución en la degradación de proteína muscular o una combinación de ambas producen aumento de la masa muscular (Mersmann, 1998). Este permite el incrementar el flujo sanguíneo a ciertas regiones del cuerpo, lo cual, permite el proceso de hipertrofia en el músculo esquelético al transportar mayores cantidades de sustratos (Proteínas) y fuentes de energía para la síntesis de proteína (Ramos, 2009). Otra de sus principales acciones a nivel muscular es la disminución en la cantidad de la grasa en la canal. Se ha demostrado “in vitro” la degradación de triacilgliceroles en adipocitos y la inhibición de la síntesis de ácidos grasos-AG y de triacilglicerol, el tejido de los animales presenta una actividad lipolítica aumentada (disminución de la grasa muscular), una actividad hipogénica disminuida, o ambas (Valladares et al., 2013 a y c). La elevación de la concentración plasmática de ácidos grasos no esterificados después de la administración del Clb, confirma la actividad lipolítica que ocurre en los adipocitos (Caicedo et al., 2011 y 2021).
El Clb acrecienta la perfusión sanguínea hacia el músculo, así como una mayor disponibilidad de energía y aminoácidos; como resultado se produce un aumento en la síntesis y retención de proteínas y que favorecerá la hipertrofia muscular, principalmente de los músculos de los cuartos traseros del animal. En el músculo, además de la hipertrofia, ocurren cambios en el tipo de fibra muscular, también hay cambios en la proporción de ARN de trascripción para proteínas musculares como la miosina y actina (Meyer and Rinke, 1991). En ovinos y bovinos se ha observado que aumenta el peso de los músculos en 40%, y que la magnitud de la respuesta varía dependiendo del β adrenérgico suministrado, así como de la influencia de factores como la especie, la raza, la edad, el sexo y la dieta (Barry y Graham, 2013 y Caicedo et al., 2021).
Según Mersmann, (1998) y Caicedo et al., (2021), el Clb es considerado como un Beta2-agonista-adrenérgico (β2-AA) y un anabólico no esteroideo utilizado en la actualidad para el dopaje en el deporte. Esta sustancia es conocida por el inducir hipertrofia del tejido musculoesquelético. El mecanismo preciso de cómo produce este efecto de hipertrofia no está muy bien dilucidado; sin embargo, la hipótesis más aceptada es que induce a este efecto a través de los receptores β2-adrenérgicos, por la regulación controlada de la expresión de los factores de crecimiento de la insulina (IGFs) que juegan un papel esencial en el desarrollo, el crecimiento y la regeneración del tejido musculoesquelético.
Histológicamente, las células satélites de los músculos esquelético son mononucleadas y residen entre el sarcolema y la lámina basal de las miofibrillas adultas. En respuesta a los estímulos como son la carga mecánica, descarga, denervación, y lesión son activadas a través de varios factores de crecimiento que contienen IGFs (Boato, 2000; Mersmann, 1998), esta activación permite que haya cambios adaptativos como es la hipertrofia, la alteración del tipo de fibras y la regeneración (Valladares et al., 2014b).
Para los β2AA es muy importante el reemplazo del anillo aromático, el reemplazo de este permite una actividad biológica especifica a nivel muscular, ya que se hace para obtener una actividad biológica definida. Hay que considerar, que cuando los OH (hidroxilo) son sustituidos por un halógeno como en el caso del Clb por cloro, se evita la biotransformación por las enzimas COMT (catecol-O-metiltransferasas), a nivel tisular y se hace muy lenta la biotransformación hepática (Boato, 2000), la presencia de este halógeno cloro, lo hace más liposoluble que sus análogos, y, por ende, tiende a difundir más en los tejidos y en la grasa animal (Mersmann, 1998; Valladares et al., 2014b, Caicedo et al.,2021).
2. Efecto del Clb detectados en este estudio
Para este estudio hay que considerar que una de las características más importantes en cuanto a la estructura del Clb es que posee un halógeno en su estructura química el cual es el ión cloro, este ión cloro (Cl), permite retardar la actividad metabólica del Clb, por ello, su efecto es mucho más prolongado que otros agonistas β2-AA y su excreción total también es más retardada (Martin 1971, Ruffolo, 1991, Waldeck y Widmark, 1995). Además, no está muy bien dilucidado el efecto que tiene el Clb en las actividades del sistema reproductor en hembras y machos, porque en los animales con una alta ingesta de Clb, la actividad reproductiva disminuye, (Caicedo et al., 2010 y 2011, Paz-Calderón et al., 2011), por otro lado, hay aumento de la fosfatasa acida prostática posiblemente por el efecto termogénico del Clb, este fenómeno calórico lo que hace es alterar la morfología del esperma (Paz-Calderón et al., 2011). Además, podemos considerar que los β2-AA estimulan a la glándula suprarrenal al producir glucocorticoides y corticoides (dexametasona y betametasona); el efecto del Clb a nivel de esta glándula adrenal aún no está bien claro. Es probable que en hembras estimule la producción de esteroides (P4y E2) a nivel de los ovarios como progesterona y estradiol y en machos incrementa los niveles de testosterona (T) y fosfatasa ácida prostática, sin embargo, se desconoce el daño probable que puede producir el clembuterol en los órganos reproductivos (Caicedo et al., 2011 y 2021), debido a que en ellos se producen estos esteroides, es probable que el Clb en las glándula suprarrenal, incremente los glucocorticoides y mineralcorticoides, que también pueden llegar a incrementar los esteroides (estrógenos y progestanos) a través de este órgano (Caicedo et al., 2011 y 2021).
Se puede considerar que el Clb produce un incremento de la actividad del sistema nervioso, que conduce a la pérdida del apetito, el cual, puede ser debido a la sensación de malestar del animal o a la actividad glucogenolítica y lipolítica, bloqueando los centros del apetito mediante señales de sobrecarga procedentes de los receptores quimiostáticos (Caicedo et al., 2009 y Saavedra et al., 2019). Al ser capaz de atravesar la barrera hemato-encefálica, es viable que la reducción del consumo de alimentos pueda ser atribuida a un exceso de la estimulación de receptores ß2-adrenérgicos (β-AR) a nivel del sistema nervioso central. Los efectos promotores del crecimiento ejercidos por el Clb son fuertemente mediatizados por la estimulación directa de los receptores β2-adrenérgicos (β2-AR) (Helferich et al., 1990, Ni et al., 2010), localizados en el tejido muscular y también, indirectamente por las variaciones de las concentraciones plasmáticas de hormonas catabólicas o anabólicas (Higgins et al., 1988), como puede ser el caso de los glucocorticoides, la hormona del crecimiento (GH) o la insulina. Si las hormonas pueden alterar la respuesta del tejido adiposo frente a las catecolaminas endógenas, también pueden afectar a la respuesta de la musculatura esquelética frente a los agonistas β2 exógenos, (Sumano et al., 2002). El estudio comprueba que el clembuterol, por lo tanto, modifica la composición muscular de los animales, puesto que en animales tratados con β2-AA, se observa un aumento en el depósito de proteína (15%) y una disminución en la de grasa (18%) (Lueso y Gómez, 1990).
El crecimiento muscular, como respuesta al tratamiento con β2-AA, es una hipertrofia del tejido muscular esquelético estriado, lo que se demuestra por los estudios realizados por Beermann et al., (1983 y 1986) en ratas y por Martinet al., (1990) en vacas. Los efectos de los β2-AA sobre el sistema endocrino, son debidos en gran parte a la liberación de otras hormonas (Caicedo et al., 2009, 2011 y Saavedra et al., 2019).
Entre las acciones de las catecolaminas están la inhibición de la secreción de insulina, el aumento de glucagón y el estímulo de la liberación de hormona adrenocorticótropa (ACTH), somatototropa (STH) y gonadotropinas como: FSH y LH, (Beermann et al., 1987). Sin embargo, existe una sorprendente falta de información sobre los efectos del Clb en la glándula adrenal, que es aún más sorprendente, si se piensa que existen receptores β-adrenérgicos (β-AR) en esta glándula, que la médula adrenal es uno de los tejidos que sintetizan y secretan las catecolaminas naturales adrenalina y noradrenalina y que la glándula adrenal sintetiza y secreta los glucocorticoides, por último, hay que considerar que la implicación directa de esta glándula en los mecanismos de adaptación del organismo al estrés, tanto, a corto como a largo plazo.
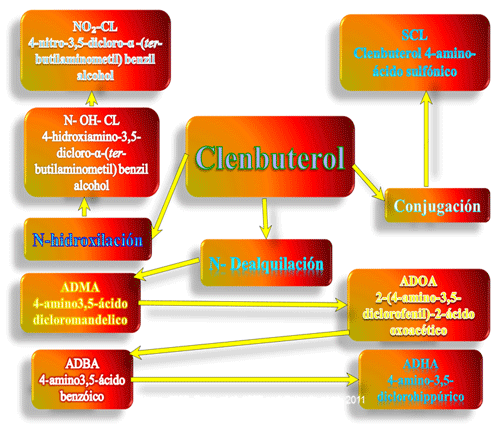
Los efectos de los β2-AA en el metabolismo de las grasas son muy difíciles de definir, sin embargo, actúan indirectamente en la deposición de grasa, al aumentar la velocidad metabólica y el gasto energético de los animales tratados y al reflejarse con la termogénesis, parte de la energía ingerida evita la formación de grasa y por otra parte el efecto directo está en el aumento de los niveles de AMP cíclico en el tejido adiposo, el ATP se transforma en AMP cíclico que activa a ciertas proteínas como las proteínas quinasas que por fosforilación estimulan a una lipasa intracelular que transforma los triglicéridos en ácidos grasos y glicerol. Este mecanismo aumenta la lipólisis y disminuye la lipogénesis, igualmente este mecanismo dependerá de la especie animal en que estemos tratando, es por ello, que el aumento de la concentración administrada y el tiempo en que los animales son sometidos a este β2-AA, juega un papel muy importante en el efecto a corto y mediano plazo, para la administración de este. En base a los estudios previos y los datos que se han obtenido en este estudio se puede agregar lo siguiente: La administración de Clb, a dosis anabolizante, causa una alteración de la funcionalidad del eje hipotálamo-hipófisis-adrenal-gonadal-hepático en bovinos, que en algunos casos es reversible, después de un período de retirada o cuarentena. Además, que las rutas del Clb en bovino, el cual, conlleva la formación de: 4-nitro-clenbuterol, hidroxilamina de clenbuterol, ácido 4-amino sulfónico de clenbuterol, alcohol–hidroxilamina 2,5-dicloro-a-bencil y ácido 4-amino-3,5-dicloromandelico, todos estos componentes son altamente tóxicos para la fisiología animal según Fiems (1987), Zalko 1997 a y b; Caicedo et al., (2021). Figura 7.
Se puede considerar que la respuesta máxima de β2-AA-clembuterol se ve afectada por la dosis administrada y la duración de una dosis sostenida (Ricks et al., 1984). Esto ha sido bien documentado y que el aumento de cAMP mediado por β-AR es temporal y que la activación continua del receptor por el ligando β-AA es necesaria para mantener los niveles de cAMP para sostener la respuesta. La exposición a una dosis constante de βAA para el receptor eventualmente causará una desensibilización o inactivación aguda de la señalización mediada por el receptor. La fosforilación tanto de la proteína quinasa A-(PKA) como de las quinasas β-AR son los pasos principales para iniciar la cascada de señalización que sigue a la activación de cAMP por β-AR (Hausdorff et al., 1990). La desensibilización aguda puede evitarse hasta cierto punto aumentando la dosis y potenciando la señal. La exposición a largo plazo (crónica) a dosis elevadas de β2-AA conduce a la internalización o pérdida del receptor de la superficie celular y a la disminución de la abundancia de ARNm de β-AR (Hausdorff et al., 1990). Estas alteraciones parecen ser irreversibles al menos en el período de alimentación a corto plazo. Sin embargo, adicionalmente a todo esto Sauer et al., (1995) detecto que al evaluar la cinética de Clb en becerros holstein-friesian, a los que se les suministraron una dosis de 10 µg/kg de peso cada 12 h durante 21 días, encontraron residuos en suero sanguíneo a las 6 h, 1, 2, 4, 8 y 16 días después de iniciado el tratamiento. Desde el día 2 de retiro del Clb, al sacrificio de los bovinos, las concentraciones más elevadas detectadas se encontraron en hígado, riñón, bilis y orina. En estudios realizados en Rattus novergicus, según FAO-OMS, consideraron que la administración de Clb aumentó la incidencia de leiomiomas meso-ováricos después de haber recibido dosis de hasta 25 mg/kg de peso al día. Concluyeron que estos se deben más a una estimulación adrenérgica y no tanto a factores de tipo genotóxico, lo mismo se puede decir que sucedió con ratones expuesto con el Clb, según Valladares-Carranza et al., (2017), donde hubo incremento de la masa muscular y alteraciones a nivel del hígado y corazón en este se detectóa través del estudio histopatológico de las fibras cardiacas engrosamiento y rizamiento de fibras musculares, pleomorfismo e hileración nuclear, esto relacionado con lo hipertrofia muscular del músculo cardiaco. Mientras que a nivel hepático de los animales tratados con Clb las lesiones observadas fueron: tumefacción y degeneración hidrópica de moderada a difusa, mitosis, picnosis y megalocitosis con megacariosis de hepatocitos, esto provoca lesiones a través de los hepatocitos provocando alteraciones de estos en la producción de la bilis, por ello las altas concentraciones en bovinos de la bilirrubina detectados en este estudio. En el hígado de los ratones expuestos a Clb se observaron alteraciones importantes, que ponen de manifiesto su efecto tóxico (Valladares-Carranza et al., 2014a y b y 2015). El Clb en el organismo de los animales tiene una función y acción prolongada, como se ha mencionado tiende a almacenarse primordialmente en hígado y riñón (por ser estos órganos de filtración de componente y reguladores de la homeostasis) y se metaboliza por medio de reacciones de N-oxidación en hidroxiclembuterol y conjugados glucurónicos (Mazzanti et al., 2003 y Valladares-Carranza et al., 2015). Zalko et al., (1997a), manifestó que los metabolitos del Clb: N-hidroxilarilamina y N-nitroso clembuterol, poseen propiedades tóxicas de riesgo tanto para la salud animal como para el humano. Otro caso muy particular del efecto del Clb en conejos a los que se les administraron dosis de 30 µg-50 mg/kg de peso al día se observaron signos de feto toxicidad, como retraso de la osificación y paladar hendido. Por otro lado, estudios realizados por Carrola et al., (2003), en dos casos humanos estos presentaron signos de tremor muscular, náuseas e incoordinación; a la auscultación mostraron un incremento de la frecuencia cardiaca, incremento de la presión arterial y en el examen hematológico presentaron: leucocitosis, acompañada de neutrofilia, hipercalemia e hiperglucemia, mismos que se dan a nivel de los bovinos que son sometidos a la alimentación con el β2AA-Clb. Sería muy interesante realizar investigaciones de este tipo en bovinos, aves o porcinos, además de que son las especies en las que más se llega a usar, y las que se consumen en mayor frecuencia y cantidad en el mercado nacional (SIAP, 2009).Según estudios de Avilés-Martínez et al., (2019) detectaron valores de Clb en altas concentraciones en bovinos un 69.3% de los animales muestreados entres rastros municipales, otros estudios por Caicedo et al., (2021) detectaron un 62.3% de animales positivo a Clb de una población de 36,000 bovinos muestreados en rastros municipales, indicando que no hay medidas pertinentes al uso de este componente (Caicedo et al., 2021), a pesar de que la norma de prohibición existe en México (Norma Oficial Mexicana NOM061-ZOO-1999, que prohibió su empleo, producción, comercialización y administración en animales de consumo humano en el país (SAGARPA, 2000) y que desde el año 2002 se vienen presentando intoxicaciones en humanos por el consumo de vísceras y carne procedentes de este producto proteico contaminado con este Clb.
Finalmente, los β2-agonista-adrenérgicos son análogos de las catecolaminas epinefrina y norepinefrina. Pueden funcionar a través de adrenoceptores beta específicos (βAR) en la superficie de los adipocitos y las células del músculo esquelético. Está comprobado que el β2AA. Clembuterol promueve el crecimiento, de igual manera esta dilucidado hasta cierto punto que estos medicamentos Clb y zilpaterol reducen la grasa total de la canal y aumentan la proteína total de la canal en cuatro especies: bovinos, ovejas, ave doméstica y ratas. Muchos agonistas β-adrenérgicos reducen los lípidos de la canal estimulando la lipólisis y bloqueando la lipogénesis en el tejido adiposo.
Figura 7: Biodisponibilidad y Biotransformación del Clembuterol en bovinos y posibles rutas metabólicas del Clembuterol en las diferentes estructuras del bovino: hígado principalmente, páncreas, riñón, y pulmón a nivel del sistema nervioso y glándulas suprarrenal, según Fiems (1987), Zalko 1997 a y b y Caicedo et al., 2011 y 2021.
Conclusiones
Para este estudio podemos considerar las siguientes conclusiones:
El Clb contribuye al incrementar la masa muscular en bovinos a expensas de alterar su bienestar, provocando alteraciones en los metabolitos sanguíneos ligados a sus procesos de homeóstasis,
Por ende, afecta los genes que regulan el metabolismo celular y de órganos en los bovinos,
La hipertrofia acelerada producida por este β2AA no es la ideal por el tiempo en que se presenta, alterando los proceso hormonales y procesos del sistema nervioso central y periférico,
El Clb contribuye a alteraciones en la producción de hormonas esteroideas inhibiendo la actividad ovárica en hembras, produciendo anestro muy prolongados,
Mientras que en macho produce alteraciones a nivel de las células precursoras de la espermatogénesis, las espermatogonias, produciendo malformaciones a nivel de cola y cabeza del espermatozoide,
Un exceso en la dosis del Clb produce alteraciones en los niveles de fosfatasa ácida provocando posiblemente cáncer prostático en bovinos, produciendo atrofia testicular
El órgano que mayores alteraciones se producen es el hígado, provocando quistes, fibrosis hepática, telangiectasias, alterando la función de los hepatocitos en producir bilisy acumulándose esta en los canalículos biliares produciendo alteraciones a nivel estructural del hígado, posible Granulomatosis hepatica.
El Clb enmascara muchas patologías hepáticas como la fasciolosis bovina, produciendo en los animales que la padecen hepatitis.
Sin embargo:
a) El β2-AA-Clembuterol mejora consistentemente el rendimiento del ganado de carne y aumenta el crecimiento muscular cuando se mezcla con raciones de terminación.
b) Cambios en la abundancia del ARNm de múltiples genes asociados con la diferenciación miogénica pueden indicar un efecto importante de β₂AA sobre la proliferación, diferenciación y / o el reclutamiento de las células satélite en las fibras musculares para promover la hipertrofia muscular
c) La actividad fisiológica del Clb, depende de la actividad inherente del receptor y su absorción, tasa de metabolismo, eliminación y distribución en el tejido blanco
d) Hay que considerar que el ganado bovino que recibe β2-AA-clembuterol tiende a tener puntajes de marmoleo muy bajos, menor cantidad de la grasa dorsal y mayor dureza de la carne y altos niveles en el contenido de H2O, alrededor de un 30% más que un animals alimentado orgánicamente.
e) La elevación de los tipos de fibras glucolíticas con el tratamiento con β2-AA-clembuterol es la principal responsable del aumento de la hipertrofia muscular, sin embargo, se correlaciona negativamente con la cantidad de tejido adiposo, tanto intramuscular como intermuscular,
f) Finalmente, la disponibilidad y la biotransformación del Clb en tejidos y órganos dependerá de la concentración y tiempo en la que los bovinos son sometidos a este anabólico, el cual, se tienen pruebas que se les administrar más de las dosis anabólicas permitida, y por mayor tiempo estipulados en los lineamientos de la administración de anabólicos sintéticos en animales domestico de importancia alimentaria, el cual, no debe ser, ya que afecta al propio animal, su bienestar y finalmente al consumidor, al hombre.
A pesar, que existe una prohibición (normatividad) en su aplicación a animales de importancia alimentaria se sigue dando, esta administración no está regulada con personal profesional
Agradecimientos
A las autoridades de investigación de la Benemérita Universidad Autónoma de Puebla, a los rastros municipales que participaron en autorizar la toma de muestras sanguíneas y órganos de los bovinos y fincas privadas involucradas, como también a todos los estudiantes que participaron en este estudio de investigación a todos, gracias.
Aclaramos que este trabajo no tiene ningún tipo de interés particular, solo se quiere demostrar que hace falta muchas investigaciones en pro de incrementar la calidad-sustentable de la vida del animal y su bienestar, para asegurar la producción de alimentos inocuos en nuestra región y mejorar el medio ambiente.
Igualmente, hay que aclarar que las dosis de Clb administradas no fueron dadas por los autores de este estudio, sino que ya los ganaderos administraban dosis desde 5 a más de 10 veces su concentración terapéutica, y que los autores realizaban supervisión sobre la administración de este β2AA, en fincas donde se nos autorizaba, ya que en muchas no se nos permitía entrar. Cabe recalcar que muchos muestreos fueron realizados en fincas particulares y en su mayoría en rastros municipales, donde este aditivo ya es un problema, por ende, no tenemos ningún tipo de responsabilidad e inherencia en la administración de este componente β2AA-Clb, y los animales antes de realizarle su muestreo pasaban por inspección veterinaria del patólogo de cada rastro, nuestra función fue solo y únicamente el muestreo de sangre, palpación de hígados y ganglios linfáticos y obtención de órganos principalmente de aquellos con signos patológicos visibles.