Evaluación de diferentes esquemas de vacunación con una vacuna viva contra Salmonella Enteritidis administrada durante las recrías de gallinas ponedoras para reducir la excreción, colonización de órganos y contaminación de los huevos
La salmonelosis causada por Salmonella Enteritidis es una zoonosis muy extendida y los productos avícolas son una fuente importante de infección. Este estudio se realizó para evaluar la protección de diferentes esquemas de vacunación en gallinas ponedoras utilizando una vacuna comercial viva atenuada de Salmonella Enteritidis a base de la cepa Sm24/Rif12/Ssq (AviPro® Salmonella Vac E, ELANCO) durante la recría y producción de huevos. Se distribuyeron 350 pollos libres de Salmonella sp. en 7 grupos vacunados y 1 grupo no vacunado. Se realizaron diferentes esquemas de vacunación combinando 1, 2 o 3 dosis de la vacuna administrada por sonda oral.
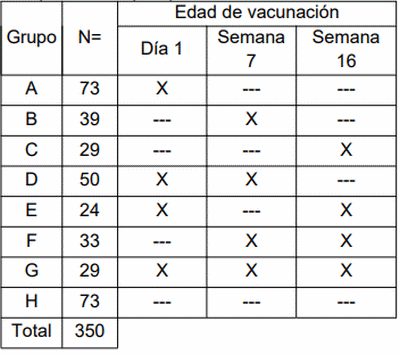
Los pollos del Grupo A, B y C fueron vacunados una vez, ya sea al primer día, a las 7 o a las 16 semanas de edad, respectivamente. Los pollos del Grupo D fueron vacunados dos veces: al primer día y a las 7 semanas de edad. Los pollos del Grupo E fueron vacunados dos veces: al primer día y a las 16 semanas de edad. Los pollos del Grupo F fueron vacunados dos veces, a las 7 y 16 semanas de edad. Los pollos del Grupo G fueron vacunados 3 veces, siguiendo la recomendación del fabricante: al primer día, a las 7 y 16 semanas de edad. Los pollos del Grupo H permanecieron sin vacunar. Se llevaron a cabo cinco pruebas de desafío numeradas del 1 al 5 a las 8, 12, 16, 29 y 55 semanas de edad, respectivamente.
Quince días después del desafío, se tomaron muestras de los pollos mediante hisopado cloacal y, después de la eutanasia, se cultivaron los hígados, ovarios, bazos y contenido cecal para aislar S. Enteritidis. Además, los huevos se recolectaron después del desafío y se cultivaron para aislar S. Enteritidis en cáscaras de huevo (ensayos 4 y 5). La protección contra la infección experimental con una cepa virulenta K285/94 de S. Enteritidis resistente al ácido nalidíxico se evaluó midiendo la reducción de la excreción, la colonización, la invasión de órganos, la contaminación de la cáscara del huevo y la producción de huevos.
La vacuna viva de S. Enteritidis protegió a las gallinas al reducir la excreción de S. Enteritidis, el aislamiento de los órganos y la contaminación de los huevos. Se logró una mayor protección durante el período de puesta después de la administración de tres dosis de vacuna durante el período de recría.
Palabras claves: gallinas ponedoras, Salmonella Enteritidis, vacunas vivas, Salmonelosis, pruebas de desafío
A nivel mundial, las infecciones causadas por Salmonella son un grave problema médico y veterinario (47). Desde la década de 1980, Salmonella Enteritidis causa la mayoría de los brotes de Salmonella humana transmitida por los alimentos. El organismo se ha aislado de una amplia gama de alimentos, incluida la carne de aves de corral (1), huevos (31), porcinos (34), y productos lácteos (61). Numerosas serovariedades de Salmonella, incluida S. Enteritidis, se aislaron de las cáscaras de los huevos, pero S. Enteritidis también se aisló del contenido de los huevos (42). En los Estados Unidos, se estima que se producen anualmente un millón de incidentes de salmonelosis humana. Esta enfermedad fue la infección más común que se notificó y tuvo el mayor número de hospitalizaciones y muertes asociadas (17,6 enfermos por cada 100.000 personas) y S. Enteritidis (22%) representó el serotipo más común. Sin embargo, los esfuerzos regulatorios y de salud no fueron muy eficientes para reducir la carga de salmonelosis y el control de esta enfermedad infecciosa (17). Además, la contaminación interna de los huevos comercializados con cáscara por S. Enteritidis ha tenido un gran impacto en la salud pública (8). De manera similar, en la UE, los casos de salmonelosis humana confirmados desde 2008 estaban disminuyendo, pero durante 2012-2016 aumentó la proporción de casos humanos de Salmonella Enteritidis. En 2016, se notificaron 94.530 casos confirmados de salmonelosis en la UE (20,4 casos por 100.000). La cantidad de brotes de salmonelosis humana debidas a S. Enteritidis siguió aumentando en 2016, aunque hubo muchos otros serotipos involucrados en casos humanos (24).
En Argentina, a partir de 1986 se observó un aumento significativo de S. Enteritidis en brotes humanos (10) y se informaron cepas septicémicas de S. Enteritidis en pollos de engorde jóvenes (52). Además, el 1,8% (29 de 1.643 muestras) de las muestras de empaque, cascarón y contenido de huevo comercializado en la provincia de Entre Ríos, Argentina estaban contaminadas con Salmonella spp. De estos alimentos, durante 2000-2005, el Laboratorio Nacional de Referencia de Argentina reportó que sobre un total de 443 aislamientos de Salmonella 140 (31,8%) pertenecían a la especie S. Enteritidis (9).
En investigaciones anteriores, realizadas con esta cepa vacunal Sm24/Rif12/Ssq, se demostró una reducción significativa de la contaminación interna de los huevos por S. Enteritidis después de la vacunación. Además, de la contaminación interna del huevo, S. Enteritidis se aísla con frecuencia de la cáscara del huevo y también constituye una fuente de infección humana a través de los alimentos (26). En ponedoras, la colonización de diferentes regiones del tracto reproductivo por S. Enteritidis es una forma muy común de contaminación de los huevos ya que la bacteria puede penetrar a través de la membrana vitelina durante o después de la ovoposición (31). Además, debido a que S. Enteritidis puede contaminar los huevos sin causar signos clínicos evidentes de enfermedad o una reducción severa en la producción de huevos, su presencia tiende a pasar desapercibida a menos que se implementen estudios bacteriológicos de rutina. La cantidad de S. Enteritidis recuperada de los huevos contaminados suele ser baja pero, según la temperatura y el tiempo de almacenamiento, esta cantidad puede aumentar (42).
Es posible obtener granjas libres de Salmonellausando estrictas medidas de bioseguridad que incluyen alto costo de alojamiento, estricto control de la calidad del alimento y muy estrictas prácticas de higiene, manejo e impedir la entrada de roedores, insectos y aves silvestres a la granja, así como evitar la recría de pollas en granjas de edades múltiples. Todas estas medidas son necesarias para evitar la introducción de Salmonella en las granjas avícolas (18,32). Sin embargo, en muchos países la mayoría de estas medidas no son económicamente factibles de implementar (63).
Además, el uso generalizado de antibióticos ha llevado a la aparición de bacterias multiresistentes a los antibióticos (20,35). De hecho, todas las medidas de control que han logrado controlar y erradicar S. Gallinarum en el pasado (2) se encontraron inútiles y no aplicables para una erradicación completa de S. Enteritidis. Por lo tanto, la inmunización de pollos es uno de los mejores enfoques, junto con la implementación estricta de medidas sanitarias y de bioseguridad cuya ejecución debe ser monitoreada mediante muestreo y análisis de laboratorio. Además, debido a la creciente importancia de la salmonelosis en la salud pública y la producción avícola, existe una necesidad real de herramientas de control seguras y eficaces, entre ellas vacunas, para proteger a los consumidores al reducir las infecciones por S. Enteritidis en las granjas avícolas (6). Un buen ejemplo se describió en 1997 en el Reino Unido: después de la introducción de vacunas en las parvadas de aves de corral británicas, donde hubo una disminución en la incidencia de S. Enteritidis acompañada de una disminución en el número de casos de intoxicación alimentaria humana debido a S. Enteritidis (59) en ocho países europeos, donde la vacunación contra S. Enteritidis no está prohibida ni es obligatoria, la proporción de muestras positivas de S. Enteritidis fue significativamente mayor en las parvadas no vacunadas contra S. Enteritidis, en comparación con las parvadas vacunadas (23).
Se probaron muchas vacunas para el control de Salmonella en aves de corral obteniendo resultados variables; se están utilizando 3 tipos principales de vacunas: bacterias muertas, vacunas de subunidades y vacunas vivas atenuadas. Las vacunas inactivadas, incluyendo una vacuna monovalente de S. Enteritidis restringida en hierro, se elaboran con adyuvantes a base de aceite o gel de hidróxido de aluminio (5,33,62) y pueden ser bivalentes basadas en las serovariedades Enteritidis y Typhimurium (14,50) o trivalentes basadas en las serovariedades Enteritidis, Typhimurium y Gallinarum (19) o Enteritidis, Typhimurium y Kentucky (43). Todas éstas redujeron la eliminación fecal y la contaminación de los huevos, aunque otros trabajos han informado resultados inconsistentes sobre la eliminación fecal y la colonización del intestino y los órganos internos (55). Además, las vacunas muertas brindan protección específica de serovariedad y pueden producir tanto larga (62) como corta duración de la protección (55). Sin embargo, la presencia de anticuerpos no necesariamente significa una resistencia a la infección (47); Los títulos de IgY provocados por las vacunas inactivadas no están relacionados con la muerte intracelular de S. Enteritidis y la respuesta inmunitaria mediada por células disminuye tres semanas después de una segunda dosis de refuerzo (57). A pesar de que las vacunas inactivadas de células enteras, membrana proteica o subunidades son las más seguras, las cepas vivas atenuadas de Salmonella brindan una mayor protección en comparación con las vacunas inactivadas (6,62,63).
El presente estudio evalúa la protección otorgada por una, dos o tres dosis orales de la cepa viva atenuada Sm24/Rif12/Ssq de Salmonella Enteritidis. La vacunación se llevó a cabo durante la recría y la protección se evaluó después del desafío con una cepa virulenta de S. Enteritidis midiendo la reducción de la excreción, la colonización de órganos y la contaminación de los huevos a lo largo de cinco ensayos de infección que se llevaron a cabo desde las 7 hasta las 55 semanas de edad.
MATERIALES Y MÉTODOS
Pollitas
Pollitas de 1 día de vida libres de Salmonella (n=350), de la línea de ponedoras Lohmann Brown Classic layers (Lohmann Tierzucht GmbH, Cuxhaven, Germanya). Los huevos se importaron de Alemania y se incubaron en un criadero local libre de Salmonella. El estado libre de Salmonella se confirmó mediante cultivo bacteriológico de meconio obtenido por compresión abdominal, inmediatamente después de la eclosión. Todas las aves utilizadas en estos ensayos pertenecían al mismo lote de pollas que se criaron en condiciones ambientales uniformes para el crecimiento y la producción.
Los pollitos se alojaron bajo estrictas condiciones de bioseguridad en tres habitaciones separadas ubicadas en la misma instalación. Estos cuartos cuentan con paredes de azulejo, puertas de madera, pisos de cerámica, ventanas de vidrio y aluminio con mosquiteros para evitar la entrada de insectos y sistema eléctrico de ventilación de aire. La temperatura de las salas se ajustó de acuerdo con la edad de los pollos siguiendo la recomendación para esta línea genética. Antes de ingresar a las instalaciones, todo el personal debía ducharse y usar ropa y botas limpias; en el interior de cada habitación se utilizaron guantes y prendas desechables.
Alimento y agua de bebida
Los animales recibieron alimento balanceado libre de Salmonella spp. basado en una dieta de proteínas vegetales, libre de carnes o harinas de pescado, sin adición de ningún antibiótico o coccidiostático. Se suministró alimento y agua ad libitum. Para asegurar la ausencia de Salmonella spp. en el alimento, los cultivos de todos los lotes se efectuaron utilizando caldo de lactosa que se preparó mezclando 3g de Lab-Lemco (Oxoid, LP0029, Basingstoke, Inglaterra), 5g de peptona (Oxoid, LP0037) y 5 g de lactosa (Oxoid, LP0070) en 1.000 ml de agua destilada. Este caldo se incubó a 37ºC durante 24 h seguido de sub-cultivos en caldo de tetrationato (CM0029B, Oxoid) más 10 μg/mL (p/v) de Verde Brillante (B-4014, Sigma-Aldrich, EE. UU.) y 40 μg/mL (p/v) v) de novobiocina (N-1628, Sigma Aldrich) (TB), que se añadieron inmediatamente después de la solución yodada de Lugol. El caldo TB se incubó a 37ºC durante 48h y, después de la incubación, se cultivó una ansada de este caldo en placas de agar Xilosa-LisinaDesoxicolato (CM0469, Oxoid) con agregado de Tergitol-4 al 0,4% (v/v) (XLDT4) y en agar MacConkey (CM0115B, Oxoid). Todas las placas se incubaron a 37ºC durante 24 hs (Pascual Anderson, 1992). Las colonias que fueron similares a Salmonella spp. se analizaron por medio de las siguientes pruebas bioquímicas: agar de Kligler, reacción de ureasa en cultivos inclinados de agar de urea, prueba de orto-nitrofenil-β-D-galactopiranósido (ONPG), agar de lisina y hierro, reducción de nitratos en caldo, desaminación de fenilalanina en cultivos inclinados de agar y producción de indol en caldo con triptófano detectado con el reactivo de Kovac
Monitoreo de Salmonella spp.
Hasta la 12° semana de edad, se tomaron al azar hisopados cloacales semanales de diez pollos por grupo. Los hisopos de cada grupo, en conjunto, se sumergieron en 40 ml de TB y, después de incubarlos durante 18-24hrs, se sub-cultivaron en agar XLDT4, tal como se describió anteriormente. A la 12° semana de vida las gallinas se transfirieron a jaulas para ponedoras y cada dos semanas se recolectaron de forma aleatoria muestras fecales del piso que se cultivaron como se mencionó anteriormente.
Siguiendo las instrucciones del fabricante, la vacuna liofilizada se diluyó en agua para obtener una concentración final entre 1 a 5 x 108 Unidades Formadoras de Colonias (UFC) por dosis (37,49). Las aves fueron vacunadas individualmente por sonda oral en el buche de acuerdo con los esquemas de vacunación asignados para cada ensayo (Tabla 1), de la siguiente manera: Los pollos de Grupos A, B y C fueron vacunados una sola vez, al primer día, a las 7 y 16 semanas de vida, respectivamente. Los pollos del Grupo D fueron vacunados dos veces: al primer día de vida y a las 7 semanas de edad. Los pollos del Grupo E fueron vacunados dos veces: al primer día de vida y a las 16 semanas de edad. Los pollos del Grupo F fueron vacunados dos veces, a las 7 y a las 16 semanas de edad. Los pollos del Grupo G fueron vacunados tres veces: al primer día de vida y a las 7 y 16 semanas de edad. Los pollos del Grupo H permanecieron sin vacunar. Para evitar una vacunación cruzada indeseada, los pollos vacunados se mantuvieron separados del grupo H sin vacunar.
Re-aislamiento de la cepa vacunal después de la vacunación
Se tomaron hisopados cloacales individuales de todas las gallinas cada dos o tres días, hasta que dos muestras consecutivas resultaron negativas para la presencia de la cepa vacunal. Estos hisopos cloacales se sembraron directamente en agar verde brillante con 100 µg/mL de rifampicina y 100 µg/mL de estreptomicina, medio que es lo suficientemente inhibidor como para permitir el cultivo directo de los hisopados en el momento del muestreo (37). Además, después de la segunda y la tercera vacunación, estos hisopados se combinaron y cultivaron en TB de 40 ml y, después de la incubación, el caldo TB cultivado se sembró en placas de agar Verde Brillante con rifampicina y estreptomicina y en agar XLDT4
Se realizaron cinco ensayos de infección. El número de pollas en cada ensayo se definió de acuerdo con la disponibilidad de aves. Los ensayos 1 y 2 se realizaron desafiando a las pollas a las 8 o 12 semanas de edad respectivamente, utilizando 50 pollitos del Grupo A y H (Ensayo 1, n=30;
Ensayo 2, n=20); en cada ensayo la mitad de las pollas se distribuyeron en el Grupo A y la otra mitad en el Grupo H. El Ensayo 3 se realizó con otras 68 pollas de los Grupos A, B, D y H (17 pollas de cada Grupo) y todas las pollas fueron desafiadas a las 16 semanas de edad. Los ensayos 4 y 5 se realizaron con 114 y 118 gallinas que fueron respectivamente desafiadas a las 29 y 55 semanas de edad; las aves utilizadas provenían de los ocho grupos experimentales. Las tasas de aislamiento de Salmonella de cada muestra del mismo grupo experimental fueron comparadas con los otros grupos dentro de un mismo ensayo.
Unidad de aislamiento experimental
Cinco días antes del desafío, las pollas se transportaron en jaulas móviles desinfectadas a una unidad de aislamiento ubicada en un edificio separado. Cada cubículo de aislamiento es de cemento y está completamente separado de los demás. Las puertas delanteras están hechas de vidrio. Para evitar el contacto con las aves infectadas, el agua se suministró automáticamente mediante niples, mientras que la alimentación se efectuó a través de un conducto conectado con el exterior. El piso tiene una red de alambre elevada sobre un piso de cemento que tiene un sistema de drenaje especial para desechar materiales infecciosos. La ventilación por aire forzado se suministró continuamente desde el exterior
Para incrementar su virulencia (3), la cepa de desafío, ácido nalidíxico resistente Salmonella Enteritidis K 285/94 (37), fue primero pasada in vivo mediante inoculación oral de un pollo SPF. Posteriormente, esta cepa se volvió a aislar del hígado y se mantuvo congelada sumergida en nitrógeno líquido hasta su uso. Dos días antes de cada desafío, se descongeló una alícuota del vial y se sembró en una placa de agar Verde Brillante con 100 µg/ml de ácido nalidíxico. Después de la incubación durante 18-24hrs a 37ºC, se tomó una sola colonia y se diluyó en solución salina tamponada con fosfato pH 7,2 y esa suspensión bacteriana se usó para sembrar un caldo de triptona soja (CM 0129, Oxoid), que se incubó a 37ºC durante la noche.
Después de la incubación, con este caldo se inocularon las pollas por sonda en el buche. La enumeración viable de Salmonella se realizó según (49). En los Ensayos 1, 2 y 3, cada polla recibió 1 mL del caldo que contenía alrededor de 2 x 109 UFC/mL. En los Ensayos 4 y 5, cada gallina recibió 2,5 mL del caldo que contenía alrededor de 5 x 109 UFC/mL.
Detección de Salmonella Enteritidis después del desafío
Cultivo de hisopados cloacales. Se tomaron muestras de hisopados cloacales individuales, cada dos o tres días hasta el 15° día posterior al desafío (PD), de todas las gallinas inoculadas. Cada hisopo se sumergió en 5 mL de TB, que se incubó a 37ºC por 48 hs; luego, una ansada del caldo se sembró en placas de agar XLDT4.
Eutanasia de los pollos. En el día 15 PD todas las aves fueron sacrificadas, ya sea por dislocación cervical (ensayos 1 y 2) o decapitación (ensayos 3, 4 y 5) (4).
Cultivo de órganos. Se agruparon el hígado, el bazo y los ovarios de cada ave y se diluyeron 1:2 (p/v) en caldo L. El caldo L se preparó de la siguiente manera: 7,4 g de infusión de cerebro y corazón (Oxoid, CM0225), 17,05 g de sacarosa (Fluka 84100, Alemania), 20 mL de suero equino estéril inactivado y 1 mL de sangre equina hemolizada en 180 mL de agua destilada (41) y macerado dentro de una bolsa de plástico estéril. De esta dilución, se transfirieron 0,5 mL a un tubo que contenía 5 mL de Caldo L y se incubó durante la noche a 37ºC. De cada uno de estos tubos incubados, se transfirieron 250 μL a otro tubo que contenía 5 mL de caldo de lactosa y después de 18-24hrs de incubación a 37ºC, se transfirieron 125 μL a un tubo nuevo que contenía 5 mL de TB para una incubación adicional a 37ºC durante 48 h, seguido de un sub-cultivo en una placa de agar XLDT4. Posteriormente, se seleccionaron algunas colonias similares a Salmonella spp. productoras de sulfuro de hidrógeno (con centro negro) y se transfirieron del agar XLDT4 a agar Verde Brillante con ácido nalidíxico para verificar que las colonias aisladas correspondiesen a la cepa de desafío resistente al ácido nalidíxico.
Cultivo de cáscaras de huevo. En los Ensayos 4 y 5, se recogieron huevos de los cubículos de aislamiento durante los días 2, 4, 6, 8, 12 y 14 PD. De acuerdo a la disponibilidad, se recolectaron y procesaron juntos tres huevos por cada grupo experimental que fueron considerados como una unidad. De igual modo, se examinaron hasta tres grupos de huevos por cada grupo de pollas. Los tres huevos se colocaron en un recipiente estéril y se los cubrió con caldo de lactosa precalentado (a 43°C). Este recipiente se dejó a temperatura ambiente durante 15 min. Posteriormente, se retiraron los huevos y el caldo se incubó a 37ºC durante la noche, luego, se transfirieron 0,5 mL a TB de 5 mL. Después de la incubación a 37°C durante 48 h, se sembró una ansada del caldo TB en agar Verde Brillante con ácido nalidíxico.
Estadística
Las aves fueron vacunadas e inoculadas individualmente y cada ave se consideró como una unidad experimental. Las tasas de aislamiento de Salmonella se compararon entre los grupos experimentales utilizando la Prueba Exacta de Fisher no paramétrica con un nivel de significancia α=0.05 (36,60).
El manejo de las aves se realizó de acuerdo con la Guía para el cuidado y uso de animales de laboratorio (15) y la eutanasia se realizó de acuerdo con el Manual de eutanasia de la American Veterinary Medical Association (AVMA, 2013). La realización de estos ensayos fue previamente aprobada por el Consejo Regional del Instituto Nacional de Agrotecnología (INTA) y se realizaron en consecuencia (approval #10205).
RESULTADOS
Generales
Todas las gallinas permanecieron saludables y libres de cualquier infección externa por Salmonella hasta el desafío. Antes del desafío, las tasas de producción de huevos entre todos los grupos experimentales no difirieron estadísticamente entre sí (datos no mostrados). Todas las muestras de alimentos y agua, así como las muestras de meconio tomadas el primer día de vida resultaron negativas para Salmonella spp.
La cepa inoculada pudo reaislarse de muestras de hisopados cloacales hasta el 10° día post-vacunación (PV) después de la primera dosis de la vacuna (administrada al 1° día de edad), hasta el 5° PV después de la segunda dosis (a las 7 semanas de edad) y también hasta el 5° día PV después de la tercera dosis (a las 16 semanas de edad).
Ambos ensayos se llevaron a cabo administrando una única dosis oral de vacuna al primer día de vida (Grupo A). Los datos se compararon con los de las aves sin vacunar del Grupo H. Los desafíos se realizaron a las 8 (Ensayo 1) y 12 (Ensayo 2) semanas de edad. En ambos ensayos, no hubo diferencias estadísticamente significativas entre las tasas de aislamiento de órganos o contenido cecal entre las pollas vacunadas y las sin vacunar. Por el contrario, en ambos ensayos, las tasas de aislamiento de los hisopados cloacales de las pollitas sin vacunar fueron significativamente más altas: en el Ensayo 1, trece hisopados cloacales fueron positivos sobre un total de 60 de pollas vacunadas en comparación con 25/60 de las que no habían sido vacunadas, mientras que en el Ensayo 2 hubo 7/35 de pollitas vacunadas en comparación con 15/35 de las aves sin vacunar (Tabla 2).
Se llevó a cabo con pollas de los grupos vacunados A, B y D y pollas del grupo H sin vacunar. Todas las pollas se desafiaron a las 16 semanas de edad. Las tasas de aislamiento de la cepa de desafío de hígados, ovarios y contenido cecal de los cuatro grupos no difirieron entre sí. Por otro lado, la tasa de aislamiento de la cepa de desafío de los bazos de pollas vacunadas de los Grupos B y D (3/17 y 6/17, respectivamente) fue significativamente menor que la obtenida de las pollas sin vacunar del Grupo H (13/17). De manera similar, las tasas totales de aislamiento de hígado, bazo y ovarios de las aves sin vacunar (23/51) fueron significativamente más altas que las tasas de los grupos vacunados B y D (12/51 y 9/51, respectivamente). La cepa de desafío se aisló significativamente de más hisopados cloacales de las pollas sin vacunar del Grupo H (39/67 hisopos) que de los hisopados de cualquiera de los otros tres grupos que habían sido vacunados. Además, se obtuvieron significativamente más hisopados cloacales positivos de las pollitas del Grupo A (28/67) en comparación con las del Grupo D (18/67), mientras que la tasa de aislamiento de los hisopados cloacales del Grupo B (23/67) fue diferente al de los otros dos grupos que habían sido vacunados.
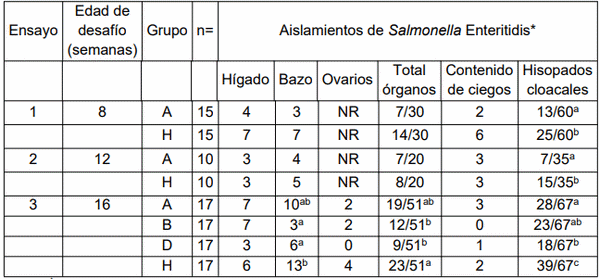
* En cada ensayo, las tasas en la misma columna con diferente superíndice son significativamente diferentes según la prueba exacta de Fisher (p< 0,05). NR – No Realizado
En cuanto a las tasas de aislamiento total de hígados, bazos y ovarios (Tabla 3), se observaron diferencias estadísticamente significativas al comparar los Grupos C, E y F vacunados (30/45, 22/36 y 28/45, respectivamente) con el Grupo no vacunados. H (37/45).
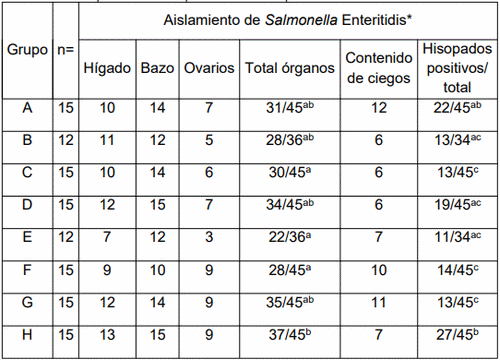
En cada ensayo, diferentes superíndices son significativamente diferentes según la prueba exacta de Fisher (p< 0,05)
En cuanto a las tasas de aislamiento de hígados, bazos y ovarios, el número total de órganos positivos para S. Enteritidis (Tabla 4) del Grupo H (22/48) fue estadísticamente superior a los de los Grupos C, D, E, F y G (3/42, 15/54, 9/36, 12/54 y 4/42, respectivamente). La tasa de aislamiento total del Grupo A (16/48) y B (12/30) no fue estadísticamente diferente de los otros grupos experimentales.
Además, en ambos ensayos, Salmonella sólo se recuperó de las cáscaras de huevo hasta el 8° día PD, excepto por un grupo positivo en el día 12 PD (Grupo F, Ensayo 5).
DISCUSIÓN
En coincidencia con los reportes previos (12,13,31), en estos ensayos se demostró que la cepa atenuada de la vacuna S. Enteritidis Sm24/Rif12/Ssq es segura, ya que ésta no se pudo recuperar de los hisopados cloacales luego de 10 días después de la vacunación administrada al primer día de vida o cinco días después de la vacunación administrada a las 7 y 16 semanas de vida. Sin embargo, en otro reporte se señala que fue posible aislar la cepa vacunal hasta 21 días después de la primera dosis de vacunación al día de edad (37). Además, esta vacuna se administró al primer día de vida sin causar ningún signo clínico de depresión o enfermedad en las pollitas.
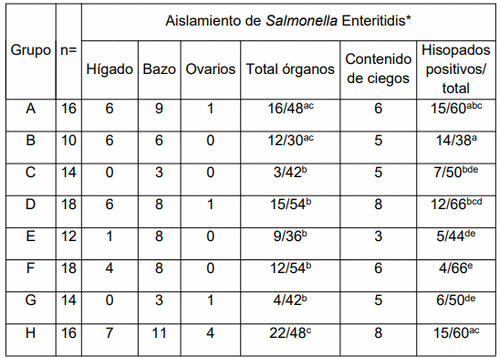
* En cada ensayo, diferentes superíndices son significativamente diferentes según la prueba exacta de Fisher (p< 0,05)
El nivel y la duración de la colonización bacteriana están estrechamente relacionados con la edad de las aves y la vía de inoculación (51). La respuesta inmunitaria innata depende de varios factores, incluida la edad de las aves infectadas (53). La mayor susceptibilidad a la invasión de
En el Ensayo 3, la cepa de desafío se aisló con más frecuencia de hisopados cloacales de las pollitas no vacunadas del Grupo H que de cualquiera de los otros grupos que fueron vacunados, ya sea cuando recibieran una o dos dosis de vacuna. Sin embargo, se encontró que la administración de dos dosis orales era más eficaz que una sola dosis. La administración de la primera y segunda dosis, ya sea al primer día de vida y/o a las 7 semanas de edad, ejerce tanto inmunidad mucosa (44) como exclusión competitiva intestinal bacteriana. Con respecto a la invasión de
órganos, la administración de una dosis única al primer día de vida no fue suficiente para proteger a las pollitas cuando fueron desafiadas 16 semanas después. Por otro lado, la protección conferida por la vacuna podría mejorarse si se hubiera administrado una dosis única más cercana (7 semanas de edad) a la de la fecha de desafío (16 semanas de edad).
En el Ensayo 4, las gallinas fueron mucho más susceptibles al desafío que en los Ensayos 1, 2 y 3, así como también en el Ensayo 5, probablemente debido al estrés causado por la producción de huevos. Además, al examinar los datos del aislamiento de los órganos internos y de los hisopados cloacales de los Ensayos 4 y 5, quedó claro que una mayor protección depende de que la fecha de vacunación esté lo más cercana posible a la fecha de exposición. Las tasas de excreción (hisopados cloacales) de S. Enteritidis variaron entre un 29% y un 60% en el ensayo 4, mientras que en las gallinas más viejas del ensayo 5, la contaminación fecal se redujo entre un 6% y un 37%. De la misma manera, estas gallinas se volvieron más resistentes a la colonización de órganos internos a medida que su sistema inmunológico madura con la edad: la tasa total de aislamiento de los órganos varió entre el 60% y el 76% en las gallinas más jóvenes del Ensayo 4, mientras que en las gallinas más viejas del ensayo 5, estas tasas de aislamiento se redujeron entre un 14 % y un 42 %.
Inmediatamente después del desafío, la tasa de producción de huevos de todos los grupos fue menor que la registrada antes del desafío. Después de 15 días PD, las tasas totales de producción de huevos se mantuvieron bajas en los pollos que no fueron vacunados (Grupo H), que fueron vacunados solamente una vez (Grupos A, B y C) o fueron vacunados dos veces al primer día y a las 7 semanas de edad (Grupo D). Tal retraso en la recuperación de la producción de huevos no se observó en los pollos de los grupos que recibieron su segunda dosis a las 16 semanas (Grupos E y F) o su tercera dosis a las 16 semanas (Grupo G). Resultados similares se obtuvieron por Gantois et al. (31) quienes encontraron que la administración de una tercera dosis de la vacuna a las 16 semanas de edad es crucial para recuperar la tasa de producción de huevos después de la infección, siempre que las aves hayan recibido previamente una dosis inicial al primer día de edad, seguida de una segunda dosis a las 7 semanas de vida.
Analizando los resultados de todos estos ensayos, queda claro que las revacunaciones aumentan la protección de esta vacuna que consiste en reducir la excreción fecal y la invasión de los órganos. En general, una sola dosis no confiere suficiente protección. Otra observación es que cuanto más cerca esté la administración de la vacuna de la fecha de exposición, mejor será la protección. En estos ensayos se ha demostrado que la tercera dosis de la vacuna protege frente a la infección por S. Enteritidis, al menos hasta las 55 semanas de vida; aunque este estudio finalizó en esa fecha, la duración de la inmunidad podría extenderse aún más.
En conclusión, la evaluación de varios calendarios de vacunación demostró que un esquema de vacunación triple administrado durante el período de recría, tal como lo sugiere el fabricante, proporciona una protección temprana y duradera de las gallinas durante la puesta, produciendo una reducción de la excreción fecal, de la colonización de los órganos y de la contaminación del huevo cuando las gallinas son desafiadas por una cepa salvaje de S. Enteritidis. En general, esta investigación muestra que el uso de una vacuna viva de S. Enteritidis, asociada a medidas generales de manejo y bioseguridad, puede ser una herramienta importante para reducir las infecciones por S. Enteritidis en gallinas ponedoras.
Agradecemos a Alejandra Méndez, Jorgelina Lomónaco, Laura Méndez y Rosana Malena por la colaboración en el laboratorio de bacteriología y a Abel Gulle y Cristian Gulle por la asistencia en la crianza de las aves y mantenimiento de las unidades avícolas del INTA Balcarce. También agradecemos al Dr. Dante Bueno (INTA Concepción del Uruguay) por la revisión del manuscrito.
1. Altekruse, S. F., N. Bauer, A. Chanlongbutra, R. Desagun, A. Naugle, W. Schlosser, R. Umholtz, and P. White. Salmonella Enteritidis in Broiler Chickens, United Sates, 2000-2005. Emerg. Infect. Dis. 12: 1848–1852. 2006.
2. Anderson, L. A., D. A. Miller, and D. W. Trampel. Epidemiological Investigation, Cleanup, and Eradication of Pullorum Disease in Adult Chickens and Ducks in Two Small-Farm Flocks. Avian Dis. 50: 142–147. 2006.
3. Audisio, M. C., and H. R. Terzolo. Virulence analysis of a Salmonella gallinarum strain by oral inoculation of 20-day-old chickens. Avian Dis. 46: 186–191. 2002.
4. AVMA. Guidelines for the Euthanasia of Animals: 2013 Edition. 2013.
5. Babu, U., R. A. Dalloul, M. Okamura, H. S. Lillehoj, H. Xie, R. B. Raybourne, D. Gaines, and R. A. Heckert. Salmonella enteritidis clearance and immune responses in chickens following Salmonella vaccination and challenge. Vet. Immunol. Immunopathol. 101: 251–257. 2004.
6. Barrow, P. A. Salmonella infections: immune and non-immune protection with vaccines. Avian Pathol. 36: 1–13. 2007.
7. Barrow, P. A., M. A. Lovell, and B. A. Stocker. Protection against experimental fowl typhoid by parenteral administration of live SL5828, an aroA-serC (aromatic dependent) mutant of a wild-type Salmonella Gallinarum strain made lysogenic for P22 sie. Avian Pathol. 29: 423–431. 2000.
8. Braden, C. R. Salmonella enterica serotype Enteritidis and eggs: a national epidemic in the United States. Clin. Infect. Dis. 43: 512–517. 2006.
9. Bueno, D. J., M. A. Soria, M. C. Soria, F. Procura, F. I. Rodriguez, and E. I. Godano. Egg Production Systems and Salmonella in South America. In: Producing Safe Eggs - Microbial Ecology of Salmonella. S. C. Ricke, and R. K. Gast, eds. Academic Press - Nikki Levy, London, UK. pp. 87–110. 2017.
10. Caffer, M. I., and T. Eiguer. Salmonella enteritidis in Argentina. Int. J. Food Microbiol. 21: 15–19. 1994.
11. Cerquetti, M. C., and M. M. Gherardi. Orally administered attenuated Salmonella enteritidis reduces chicken cecal carriage of virulent Salmonella challenge organisms. Vet. Microbiol. 76: 185–192. 2000.
12. Chacana, P. A., and H. R. Terzolo. Protection Conferred by a Live Salmonella Enteritidis Vaccine Against Fowl Typhoid in Laying Hens. Avian Dis. 50: 280–283. 2006.
13. Chappell, L., P. Kaiser, P. Barrow, M. A. Jones, C. Johnston, and P. Wigley. The immunobiology of avian systemic salmonellosis. Vet. Immunol. Immunopathol. 128: 53–59. 2009.
14. Clifton-Hadley, F. a, M. Breslin, L. M. Venables, K. a Sprigings, S. W. Cooles, S. Houghton, and M. J. Woodward. A laboratory study of an inactivated bivalent iron restricted Salmonella enterica serovars Enteritidis and Typhimurium dual vaccine against Typhimurium challenge in chickens. Vet. Microbiol. 89: 167–179. 2002.
15. Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the care and use of laboratory animals 8th ed. The National Academies Press, Washington DC, USA. 2011.
16. Cooper, G. L., L. M. Venables, M. J. Woodward, and C. E. Hormaeche. Vaccination of chickens with strain CVL30, a genetically defined Salmonella enteritidis aroA live oral vaccine candidate. Infect. Immun. 62: 4747–4754. 1994.
17. Cummings, P. L., F. Sorvillo, and T. Kuo. The Burden of Salmonellosis in the United States. In: Salmonella - A Dangerous Foodborne Pathogen. S. M. M. Barakat, ed. InTech, Rijeka, Croatia Copyright. pp. 1–20. 2012.
18. Davies, R. H., and M. Breslin. Persistence of Salmonella Enteritidis Phage Type 4 in the environment and arthropod vectors on an empty freerange chicken farm. Environ. Microbiol. 5: 79–84. 2003.19. Deguchi, K., E. Yokoyama, T. Honda, and K. Mizuno. Efficacy of a Novel Trivalent Inactivated Vaccine Against the Shedding of Salmonella in a Chicken Challenge Model. Avian Dis. 53: 281–286. 2009.
20. Djordjevic, S. P., A. K. Cain, N. J. Evershed, L. Falconer, R. S. Levings, D. Lightfoot, and R. M. Hall. Emergence and evolution of multiply antibioticresistant Salmonella enterica serovar paratyphi B D-tartrate-utilizing strains containing SGI1. Antimicrob. Agents Chemother. 53: 2319–2326. 2009.
21. Dórea, F. C., D. J. Cole, C. Hofacre, K. Zamperini, D. Mathis, M. P. Doyle, M. D. Lee, and J. J. Maurer. Effect of Salmonella Vaccination of Breeder Chickens on Contamination of Broiler Chicken Carcasses in Integrated Poultry Operations. Appl. Environ. Microbiol. 76: 7820–7825. 2010.
22. Eeckhaut, V., F. Haesebrouck, R. Ducatelle, and F. Van Immerseel. Oral vaccination with a live Salmonella Enteritidis/Typhimurium bivalent vaccine in layers induces cross-protection against caecal and internal organ colonization by a Salmonella Infantis strain. Vet. Microbiol. 218: 7–12. 2018.
23. EFSA. Preliminary Report Analysis of the baseline study on the prevalence of Salmonella in laying hen flocks of Gallus gallus. EFSA J.: 1–71. 2006.
24. EFSA. The European Union summary report on trends and sources of zoonoses, zoonotic agents and food‐borne outbreaks in 2016. EFSA J. 15: 5077. 2017.
25. Feberwee, A., E. G. Hartman, J. J. de Wit, and T. S. de Vries. The Spread of Salmonella gallinarum 9R Vaccine Strain Under Field Conditions. Avian Dis. 45: 1024–1029. 2001.
26. Gantois, I., R. Ducatelle, F. Pasmans, F. Haesebrouck, R. Gast, T. J. Humphrey, and F. Van Immerseel. Mechanisms of egg contamination by Salmonella Enteritidis. FEMS Microbiol. Rev. 33: 718–738. 2009.
27. Gantois, I., R. Ducatelle, L. Timbermont, F. Boyen, L. Bohez, F. Haesebrouck, F. Pasmans, and F. van Immerseel. Oral immunisation of laying hens with the live vaccine strains of TAD Salmonella vac E and TAD Salmonella vac T reduces internal egg contamination with Salmonella
Enteritidis. Vaccine 24: 6250–6255. 2006.
28. Gast, R., and J. Guard-Bouldin. Effect of prior passage through laying hens on invasion of reproductive organs by Salmonella enteritidis. Int. J. Poult. Sci. 8: 116–121. 2009.
29. Gast, R. K., R. Guraya, J. Guard-Bouldin, P. S. Holt, and R. W. Moore. Colonization of Specific Regions of the Reproductive Tract and Deposition at Different Locations Inside Eggs Laid by Hens Infected with Salmonella Enteritidis or Salmonella Heidelberg. Avian Dis. 51: 40–44. 2007.
30. Gast, R. K., R. Guraya, and P. S. Holt. Frequency and persistence of fecal shedding following exposure of laying hens to different oral doses of Salmonella enteritidis. Int. J. Poult. Sci. 10: 750–756. 2011.
31. Gast, R. K., P. S. Holt, and T. Murase. Penetration of Salmonella enteritidis and Salmonella heidelberg into egg yolks in an in vitro contamination model. Poult. Sci. 84: 621–625. 2005.
32. Gast, R. K. R. K. Microbiology of Shell Egg Production in the United States. In: Producing Safe Eggs: Microbial Ecology of Salmonella. S. C. Rickie, and R. K. Gast, eds. Academic Press, Cambridge, MA, USA. pp. 25–44. 2017.
33. Gast, R. K., H. D. Stone, P. S. Holt, and C. W. Beard. Evaluation of the Efficacy of an Oil-Emulsion Bacterin for Protecting Chickens against Salmonella enteritidis. Avian Dis. 36: 992–999. 1992.
34. Gebreyes, W. A., P. R. Davies, W. E. Morrow, J. A. Funk, and C. Altier. Antimicrobial resistance of Salmonella isolates from swine. J. Clin. Microbiol. 38: 4633–4636. 2000.
35. Glynn, M. K. A., C. Bopp, W. Dewitt, P. Dabney, M. Mokhtar, and F. Angullo. Emergence of Multidrug-Resistant Salmonella Enterica Serotype Typhimurium DT104 Infections in the United States. N. Engl. J. Med. 338: 1333–1338. 1998.
36. Gomez, K. A., A. A. Gomez, and K. A. Gomez. Statistical procedures for agricultural research Second. Wiley, NYC, New York. 1984.
37. Hahn, I. A contribution to consumer protection : TAD Salmonella vac ® E - A new live vaccine for chickens against Salmonella Enteritidis. Lohmann Inf. 23: 29–32. 2000.
38. Hassan, J. O., and R. Curtiss. Development and evaluation of an experimental vaccination program using a live avirulent Salmonella typhimurium strain to protect immunized chickens against challenge with homologous and heterologous Salmonella serotypes. Infect. Immun. 62: 5519–5527. 1994.
39. Hassan, J. O., and R. Curtiss. Efficacy of a live avirulent Salmonella typhimurium vaccine in preventing colonization and invasion of laying hens by Salmonella typhimurium and Salmonella enteritidis. Avian Dis. 41: 783–791. 1997.
40. He, G. Z., W. Y. Tian, N. Qian, A. C. Cheng, and S. X. Deng. Quantitative studies of the distribution pattern for Salmonella Enteritidis in the internal organs of chicken after oral challenge by a real-time PCR. Vet. Res. Commun. 34: 669–676. 2010.
41. Huberman, Y. D., and H. R. Terzolo. Evaluación de un método de aislamiento de Salmonella Enteritidis para Formas “L” empleando Órganos de Gallinas Experimentalmente Infectadas. In: XVII Congreso Latinoamericano y X Congreso Argentino de Microbiología. Asociación Argentina de Microbiología. Buenos Aires. 2004.
42. Humphrey, T. J., A. Baskerville, S. Mawer, B. Rowe, and S. Hopper. Salmonella enteritidis phage type 4 from the contents of intact eggs: a study involving naturally infected hens. Epidemiol. Infect. 103: 415–423. 1989.
43. Ibrahim, H., R. Sayed, and A. Shereen. Efficacy of a Locally Prepared Inactivated Trivalent Vaccine against Salmonellosis in Poultry. Int. J. Vet. Sci. 7: 82–87. 2018.
44. Van Immerseel, F., U. Methner, I. Rychlik, B. Nagy, P. Velge, G. Martin, N. Foster, R. Ducatelle, P. A. Barrow, and R. Ducatelle. Vaccination and early protection against non-host-specific Salmonella serotypes in poultry: exploitation of innate immunity and microbial activity. Epidemiol. Infect. 133: 959–978. 2005.
45. Kilroy, S., R. Raspoet, R. Devloo, F. Haesebrouck, R. Ducatelle, and F. Van Immerseel. Oral administration of the Salmonella Typhimurium vaccine strain Nal2/Rif9/Rtt to laying hens at day of hatch reduces shedding and caecal colonization of Salmonella 4,12:i:-, the monophasic variant of Salmonella Typhimurium. Poult. Sci. 94: 1122–1127. 2015.
46. Linde, K., J. Beer, and V. Bondarenko. Stable Salmonella live vaccine strains with two or more attenuating mutations and any desired level of attenuation. Vaccine 8: 278–282. 1990.
47. Mastroeni, P., J. A. Chabalgoity, S. J. Dunstan, D. J. Maskell, and G. Dougan. Salmonella: immune responses and vaccines. Vet. J. 161: 132–164. 2000.
48. Methner, U., P. a Barrow, A. Berndt, and I. Rychlik. Salmonella Enteritidis with double deletion in phoPfliC-A potential live Salmonella vaccine candidate with novel characteristics for use in chickens. Vaccine 29: 3248–3253. 2011.
49. Miles, a a, S. S. Misra, and J. O. Irwin. The estimation of the bactericidal power of the blood. J. Hyg. (Lond). 38: 732–49. 1938.
50. Okamura, M., H. Tachizaki, T. Kubo, S. Kikuchi, A. Suzuki, K. Takehara, and M. Nakamura. Comparative evaluation of a bivalent killed Salmonella vaccine to prevent egg contamination with Salmonella enterica serovars Enteritidis, Typhimurium, and Gallinarum biovar Pullorum, using 4 different challenge models. Vaccine 25: 4837–4844. 2007.
51. Sadeyen, J. R., J. Trotereau, P. Velge, J. Marly, C. Beaumont, P. A. Barrow, N. Bumstead, and A. C. Lalmanach. Salmonella carrier state in chicken: Comparison of expression of immune response genes between susceptible and resistant animals. Microbes Infect. 6: 1278–1286. 2004.
52. Sandoval, V. E., H. R. Terzolo, A. R. Moreira, G. L. Micheo, T. Eiguer, M. I. Caffer, and B. Fronchowsky. Paratifosis aviaria causada por Salmonella inmoviles (4, 12: -) y moviles (Enteritidis y Typhimurium). Rev. Argentina Prod. Anim. 9: 393–399. 1989.
53. Setta, A. M., P. A. Barrow, P. Kaiser, and M. A. Jones. Early immune dynamics following infection with Salmonella enterica serovars Enteritidis, Infantis, Pullorum and Gallinarum: cytokine and chemokine gene expression profile and cellular changes of chicken cecal tonsils. Comp. Immunol. Microbiol. Infect. Dis. 35: 397–410. 2012.
54. Shivaprasad, H. L., J. F. Timoney, S. Morales, B. Lucio, and R. C. Baker. Pathogenesis of Salmonella enteritidis infection in laying chickens. I. Studies on egg transmission, clinical signs, fecal shedding, and serologic responses. Avian Dis. 34: 548–557. 2012.
55. Singh, B. R. Salmonella Vaccines for Animals and Birds and Their Future Perspective. Open Vaccine J. 2: 100–112. 2009.
56. Smith, H. W. The immunity to Salmonella gallinarum infection in chickens produced by live cultures of members of the Salmonella genus. J. Hyg. (Lond). 54: 433–439. 1956.
57. Tran, T. Q. L. L., S. Quessy, A. Letellier, A. Desrosiers, and M. Boulianne. Immune response following vaccination against Salmonella Enteritidis using 2 commercial bacterins in laying hens. Can. J. Vet. Res. 74: 185–192. 2010.
58. Wigley, P., and P. Barrow. Salmonella in Preharvest Chickens: Current Understanding and Approaches to Control. In: Producing Safe Eggs. Microbial Ecology of Salmonella. S. C. Rickie, and R. K. Gast, eds. Academic Press, Cambridge, MA, USA. pp. 139–159. 2017.
59. Wigley, P., P. Barrow, and B. Villareal-Ramos. Immunity to Salmonella in domestic (food animal) species. Vaccines against S. enterica infections. Vaccines for chickens. In: Salmonella Infections. Clinical, Immunological and Molecular Aspects. P. Mastroeni, and D. Maskell, eds. Cambridge. pp. 308–309. 2006.
60. Winters, R., A. Winters, and R. G. Amedee. Statistics : A Brief Overview. Ochsner J. 10: 213–216. 2010.
61. Wood, J. D., G. A. Chalmers, R. A. Fenton, J. Pritchard, M. Schoonderwoerd, and W. L. Lichtenberger. Persistent shedding of Salmonella enteritidis from the udder of a cow. Can. Vet. J. 32: 738–741. 1991.
62. Woodward, M. J., G. Gettinby, M. F. Breslin, J. D. Corkish, and S. Houghton. The efficacy of Salenvac, a Salmonella enterica subsp. Enterica serotype Enteritidis iron-restricted bacterin vaccine, in laying chickens. Avian Pathol. 31: 383–392. 2002.
63. Zhang-Barber, L., A. K. Turner, and P. A. Barrow. Vaccination for control of Salmonella in poultry. Vaccine 17: 2538–2545. 1999.








.jpg&w=3840&q=75)