
Disbiosis: ¿cuáles son las causas y síntomas, y cómo se alivia su impacto en el desempeño de los pollos de engorde?
Información clave
- Las principales causas de la disbiosis y los síntomas asociados son complejos y están interrelacionados.
- Las principales causas son: los antibióticos, bacterias patógenas, contaminantes del alimento balanceado, dieta no balanceada, factores antinutricionales, estructura y tamaño de la partícula del alimento, así como también las condiciones ambientales.
- El problema de la disbiosis es complejo y multifactorial, y para aliviarlo necesitamos un enfoque holístico que gestione y controle los factores causantes y ofrezca una solución efectiva.
- 1. Antibióticos
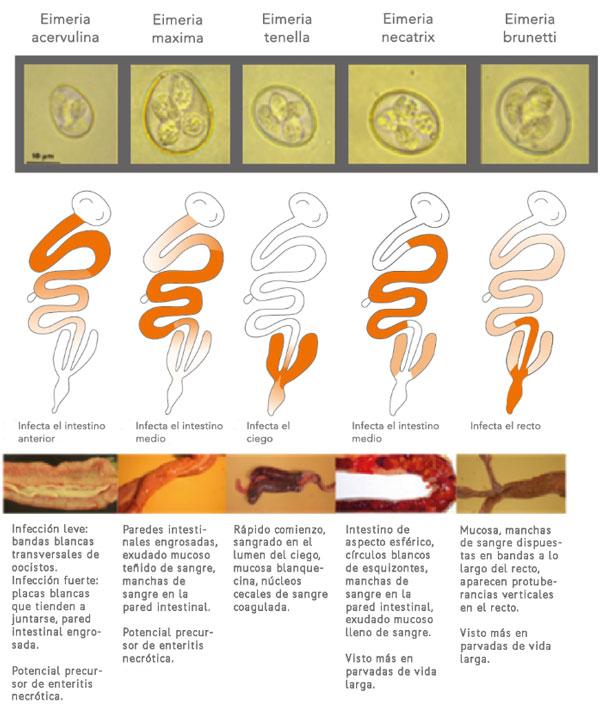
- 2. Bacterias y parásitos patógenos
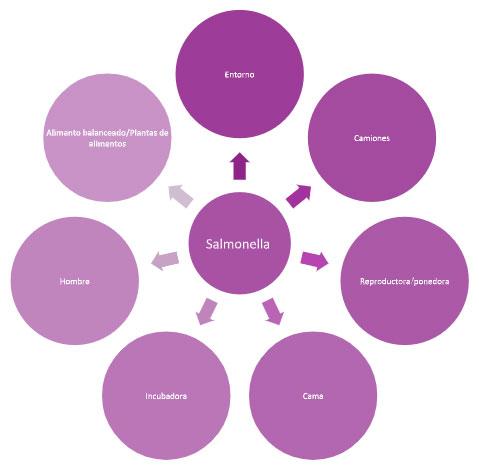
- 3. Contaminantes del alimento balanceado
- 4. Dieta desbalanceada
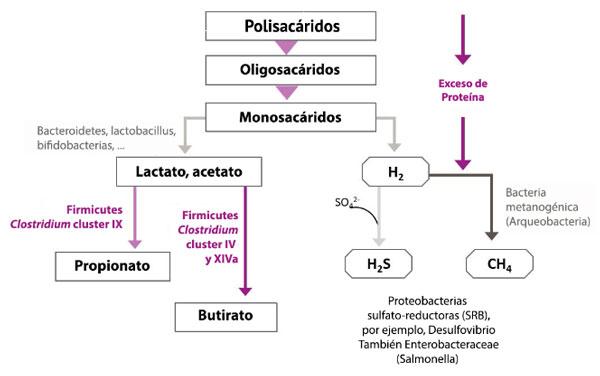
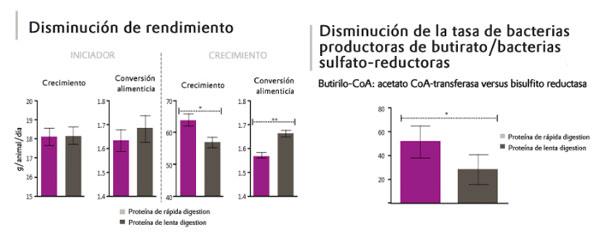
- 5. Factores antinutricionales
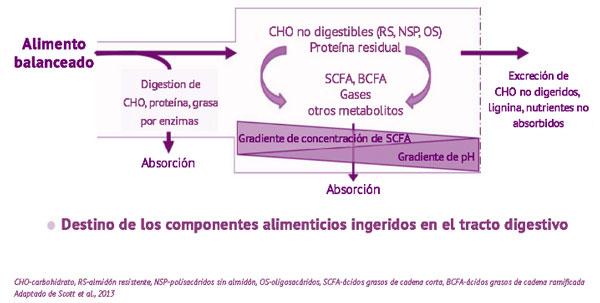
- 6. Estructura del alimento balanceado y tamaño de partícula
- 7. Condiciones ambientales
Siglas
NIR – infrarrojo cercano
NSP – polisacáridos sin almidón
Abbas, R. Z., D. D. Colwell, and J. Gilleard. 2012. Botanicals: An alternative approach for the control of avian coccidiosis. Worlds. Poult. Sci. J. 68:203–215.
Ali, M. 2018. Feed structure and production processes impact on poultry live production. AminoNews. ®:2–19.
Ari, M. M., P. A. Iji, and M. M. Bhuiyan. 2016. Promoting the proliferation of beneficial microbial populations in chickens. Worlds. Poult. Sci. J. 72:785–792.
Berg, R. D. 1999. Bacterial Translocation from the Gastrointestinal Tract.Pages 11–30 in Paul, P.S., Francis, D.H., eds. Springer US, Boston, MA.
Bortoluzzi, C., B. S. Vieira, J. C. de P. Dorigam, A. Menconi, A. Sokale, K. Doranalli, T. J. Applegate, B. Serpa Vieira, J. C. de Paula Dorigam, A. Menconi, A. Sokale, K. Doranalli, and T. J. Applegate. 2019. Bacillus subtilis dsm 32315 supplementation attenuates the effects of clostridium perfringens challenge on the growth performance and intestinal microbiota of broiler chickens. Microorganisms 7:71.
Broom, L. J. 2017. Necrotic enteritis; current knowledge and diet-related mitigation. Worlds. Poult. Sci. J. 73:281–292.
Chapman, H. D. D. 2014. Milestones in avian coccidiosis research: A review. Poult. Sci. 93:501–511.
D’Mello, J. P. F. 2004. Contaminants and toxins in animal feeds. Assess. Qual. Saf. Anim. Feed.:107–128.
Daud, N., N. Hatin, Y. Abba, F. Paan, T. Kyaw, A. Khiang, F. Jesse, K. Mohammed, L. Adamu, and A. Tijjani. 2014. An Outbreak of Colibacillosis in a Broiler Farm. J. Vet. Adv.
De Oliveira, M. J. K., N. K. Sakomura, J. C. De Paula Dorigam, K. Doranalli, L. Soares, and G. D. S. Viana. 2019. Bacillus amyloliquefaciens CECT 5940 alone or in combination with antibiotic growth promoters improves performance in broilers under enteric pathogen challenge. Poult. Sci. 98:4391–4400.
Desin, T. S., W. Köster, and A. A. Potter. 2013. Salmonella vaccines in poultry: past, present and future. Expert Rev. Vaccines 12:87–96.
Dorigam, J. C. de P., K. Doranalli, and N. Yacoubi. 2019. Bacillus amyloliquefaciens CECT 5940 helped overcoming negative effect of heat stress in broiler chickens.in PSA annual meeting 2019.
Ducatelle, R., V. Eeckhaut, F. Haesebrouck, and F. Van Immerseel. 2015. A review on prebiotics and probiotics for the control of dysbiosis: present status and future perspectives. Animal 9:43–48.
Ducatelle, R., E. Goossens, F. De Meyer, V. Eeckhaut, G. Antonissen, F. Haesebrouck, and F. Van Immerseel. 2018. Biomarkers for monitoring intestinal health in poultry : present status and future perspectives. Vet. Res.:1–9.
Dunkley, K. D., T. R. Callaway, V. I. Chalova, J. L. McReynolds, M. E. Hume, C. S. Dunkley, L. F. Kubena, D. J. Nisbet, and S. C. Ricke. 2009. Foodborne Salmonella ecology in the avian gastrointestinal tract. Anaerobe 15:26–35.
EFSA. 2007. Scientific Opinion of the Panel on Biological Hazards (BIOHAZ) - Monitoring of verotoxigenic Escherichia coli (VTEC) and identification of human pathogenic VTEC types. EFSA J. 5:579.
Foley, S. L., R. Nayak, I. B. Hanning, T. J. Johnson, J. Han, and S. C. Ricke. 2011. Population Dynamics of Salmonella enterica Serotypes in Commercial Egg and Poultry Production. Appl. Environ. Microbiol. 77:4273–4279.
Fossum, O., K. Sandstedt, and B. E. E. Engström. 1988. Gizzard erosions as a cause of mortality in white leghorn chickens. Avian Pathol. 17:519–525.
Hawrelak, J. A., and S. P. Myers. 2004. The causes of intestinal dysbiosis: A review. Altern. Med. Rev. 9:180–197.
Honda, K., and D. R. Littman. 2016. The microbiota in adaptive immune homeostasis and disease. Nature.
Immerseel, F. Van, J. De Buck, F. Pasmans, G. Huyghebaert, F. Haesebrouck, and R. Ducatelle. 2004. Clostridium perfringens in poultry: an emerging threat for animal and public health. Avian Pathol. 33:537–549.
Janssens, W. M. M. A. 1971. The influence of feeding on gizzard erosion in broilers. Arch Fur Geflugelkd. 35:137–141.
Kaper, J. B., J. P. Nataro, and H. L. T. Mobley. 2004. Pathogenic Escherichia coli. Nat. Rev. Microbiol.
Khan, T. J., M. N. Hasan, E. I. Azhar, and M. Yasir. 2019. Association of gut dysbiosis with intestinal metabolites in response to antibiotic treatment. Hum. Microbiome J. 11:100054.
Kheravii, S. K., N. K. Morgan, R. A. Swick, M. Choct, and S. B. Wu. 2018. Roles of dietary fibre and ingredient particle size in broiler nutrition. Worlds. Poult. Sci. J. 74:301–316.
Koutsoumanis, K., A. Allende, A. Alvarez-Ordóñez, D. Bolton, S. Bover-Cid, M. Chemaly, A. De Cesare, L. Herman, F. Hilbert, R. Lindqvist, M. Nauta, L. Peixe, G. Ru, M. Simmons, P. Skandamis, E. Suffredini, J. Dewulf, T. Hald, V. Michel, T. Niskanen, A. Ricci, E. Snary, F. Boelaert, W. Messens, and R. Davies. 2019. Salmonella control in poultry flocks and its public health impact. EFSA J. 17.
Lacey, J. A., D. Stanley, A. L. Keyburn, M. Ford, H. Chen, P. Johanesen, D. Lyras, and R. J. Moore. 2018. Clostridium perfringens-mediated necrotic enteritis is not influenced by the pre-existing microbiota but is promoted by large changes in the post-challenge microbiota. Vet. Microbiol. 227:119–126.
Ladero, V., M. Calles-Enriquez, M. Fernandez, and M. A. Alvarez. 2010. Toxicological Effects of Dietary Biogenic Amines. Curr. Nutr. Food Sci. 6:145–156.
Le Roy, C. I., M. J. Woodward, R. J. Ellis, R. M. La Ragione, and S. P. Claus. 2019. Antibiotic treatment triggers gut dysbiosis and modulates metabolism in a chicken model of gastro-intestinal infection. BMC Vet. Res. 15.
Levasseur, C., O. Surel, and D. Kleiber. 2011. Development of Three Risk Assessment Models for Deoxynivalenol and Fumonisins B1 + B2 Contents in Maize Kernel. J. Agric. Sci. Technol. 1:483–494.
Likotrafiti, E., and J. Rhoades. 2016. Probiotics, Prebiotics, Synbiotics, and Foodborne Illness.Pages 469–476 in Probiotics, Prebiotics, and Synbiotics. Elsevier.
Ma, Y. H., G. S. Islam, Y. Wu, P. M. Sabour, J. R. Chambers, Q. Wang, S. X. Y. Wu, and M. W. Griffiths. 2016. Temporal distribution of encapsulated bacteriophages during passage through the chick gastrointestinal tract. Poult. Sci. 95:2911–2920.
Martín, R., S. Miquel, J. Ulmer, P. Langella, and L. G. Bermúdez-Humarán. 2014. Gut ecosystem: how microbes help us. Benef. Microbes 5:219–233.
Menconi, A., A. O. Sokale, S. M. Mendoza, R. Whelan, and K. Doranalli. 2020. Effect of Bacillus subtilis DSM 32315 under different Necrotic Enteritis models in broiler chickens: a meta-analysis of 5 independent research trials. Avian Dis.
Messer, J. S., and E. B. Chang. 2018. Microbial Physiology of the Digestive Tract and Its Role in Inflammatory Bowel Diseases.Pages 795–810 in Physiology of the Gastrointestinal Tract: Sixth Edition. Elsevier.
Miedaner, T., S. Han, B. Kessel, M. Ouzunova, T. Schrag, F. H. Utz, and A. E. Melchinger. 2015. Prediction of deoxynivalenol and zearalenone concentrations in Fusarium graminearum inoculated backcross populations of maize by symptom rating and near-infrared spectroscopy. Plant Breed. 134:529–534.
Mohamed, L., Z. Ge, L. Yuehua, G. Yubin, K. Rachid, O. Mustapha, W. Junwei, and O. Karine. 2018. Virulence traits of avian pathogenic (APEC) and fecal (AFEC) E. coli isolated from broiler chickens in Algeria. Trop. Anim. Health Prod. 50:547–553.
Mohan, V. R. R., P. S. S. Tresina, and E. D. D. Daffodil. 2015. Antinutritional Factors in Legume Seeds: Characteristics and Determination.Pages 211–220 in Encyclopedia of Food and Health. Elsevier.
Osman, A. M. G., A. G. Chittiboyina, and I. A. Khan. 2013. Plant Toxins.Pages 435–451 in Foodborne Infections and Intoxications. Academic Press.
Oviedo-Rondón, E. O. 2019. Holistic view of intestinal health in poultry. Anim. Feed Sci. Technol. 250:1–8.
Scott, K. P., S. W. Gratz, P. O. Sheridan, H. J. Flint, and S. H. Duncan. 2013. The influence of diet on the gut microbiota. Pharmacol. Res. 69:52–60.
Shalaby, A. R. 1996. Significance of biogenic amines to food safety and human health. Food Res. Int. 29:675–690.
Shifrine, M., L. E. Ousterhout, C. R. Grau, and R. H. Vaughn. 1959. Toxicity to Chicks of Histamine Formed During Microbial Spoilage of Tuna. Appl. Microbiol. 7:45 LP – 50.
Singh, P., A. Karimi, K. Devendra, P. W. Waldroup, K. K. Cho, and Y. M. Kwon. 2013. Influence of penicillin on microbial diversity of the cecal microbiota in broiler chickens. Poult. Sci. 92:272–276.
Sokale, A. O., A. Menconi, G. F. Mathis, B. Lumpkins, M. D. Sims, R. A. Whelan, and K. Doranalli. 2019. Effect of Bacillus subtilis DSM 32315 on the intestinal structural integrity and growth performance of broiler chickens under necrotic enteritis challenge. Poult. Sci. 98:5392–5400.
Tellez, G., L. R., and B. M. 2012. Alternative Strategies for Salmonella Control in Poultry. Salmonella - A Danger. Foodborne Pathog. 259-286
The European Parliament and of the Council. 2003. Commission regulation EC No 2160/2003 of 17 November 2003 on the control of Salmonella and other specified food-borne zoonotic agents.
Toor, D., M. K. Wasson, P. Kumar, G. Karthikeyan, N. K. Kaushik, C. Goel, S. Singh, A. Kumar, and H. Prakash. 2019. Dysbiosis disrupts gut immune homeostasis and promotes gastric diseases. Int. J. Mol. Sci. 2432-2446
Tyzzer, E. E. 1929. Coccidiosis in Gallinaceous birds. Am. J. Epidemiol. 10:269–383.
Van Immerseel, F., V. Eeckhaut, R. J. Moore, M. Choct, and R. Ducatelle. 2017. Beneficial microbial signals from alternative feed ingredients: a way to improve sustainability of broiler production? Microb. Biotechnol. 10:1008–1011.
Van Immerseel, F., U. Lyhs, K. Pedersen, and J. F. Prescott. 2016. Recent breakthroughs have unveiled the many knowledge gaps in Clostridium perfringens-associated necrotic enteritis in chickens: the first International Conference on Necrotic Enteritis in Poultry. Avian Pathol. 45:269–270.
Van Immerseel, F., F. De Meyer, V. Eeckhaut, E. Goossens, and R. Ducatelle. 2019. Host and microbial biomarkers for intestinal health and disease in broilers. Aust. Poult. Sci. Symp.:93–98.
Wegener, H. C., T. Hald, D. L. F. Wong, M. Madsen, H. Korsgaard, F. Bager, P. Gerner-Smidt, and K. Mølbak. 2003. Salmonella control programs in Denmark. Emerg. Infect. Dis. 9:774–780.
Whelan, R. A., K. Doranalli, T. Rinttilä, K. Vienola, G. Jurgens, and J. Apajalahti. 2019. The impact of Bacillus subtilis DSM 32315 on the pathology, performance, and intestinal microbiome of broiler chickens in a necrotic enteritis challenge. Poult. Sci. 98:3450–3463.
Wigley, P. 2014. Salmonella enterica in the chicken: How it has helped our understanding of immunology in a non-biomedical model species. Front. Immunol. 5:1–7.
Yang, Y., G. Tellez, J. D. Latorre, P. M. Ray, X. Hernandez, B. M. Hargis, S. C. Ricke, and Y. M. Kwon. 2018. Salmonella Excludes Salmonella in Poultry: Confirming an Old Paradigm Using Conventional and Barcode-Tagging Approaches. Front. Vet. Sci. 5:1–7.
Yun, C. H., H. S. Lillehoj, and E. P. Lillehoj. 2000. Intestinal immune responses to coccidiosis. Dev. Comp. Immunol. 24:303–324.
Zhang-Barber, L., A. K. Turner, and P. A. Barrow. 1999. Vaccination for control of Salmonella in poultry. Vaccine 17:2538–2545.
Zhang, P., T. Yan, X. Wang, S. Kuang, Y. Xiao, W. Lu, and D. Bi. 2017. Probiotic mixture ameliorates heat stress of laying hens by enhancing intestinal barrier function and improving gut microbiota. Ital. J. Anim. Sci. 16:292–300.

.jpg&w=3840&q=75)