simbiosis micorrizica en plántulas de palma
Evaluación del efecto en la simbiosis micorrizica del inóculo mycorrizz sobre distintas dosis de fertilización en plántulas de palma de aceite durante las etapas de pre-vivero y vivero
Todas estas situaciones han generado el planteamiento de estrategias como es el uso de microorganismos benéficos del suelo para estimular el crecimiento vegetal. Esta alternativa ha tomado gran auge en los últimos años porque además de ser una opción ecológica, puede ser usada en forma complementaria con otras estrategias.
Dentro de los microorganismos de mayor uso se destacan los Hongos Micorrízicos Arbusculares (HMA), que son microorganismos del suelo que forman una asociación simbiótica mutualista con aproximadamente un 80% de las plantas terrestres (Vierheilig, 2004). La importancia de ellos en la agricultura se debe a su extenso micelio extra radical que permite mayor zona de exploración del suelo (Requena et al., 2007). Esto proporciona a la planta ventajas como absorción de nutrientes de baja disponibilidad, especialmente fósforo (P) (Requena et al., 2007), aumento de la tolerancia a condiciones de estrés abiótico, mejoramiento de la calidad del suelo, fijación de N2 en leguminosas (Barea et al, 2005) y aumento en la diversidad y productividad de las plantas en un ecosistema determinado (Azcón-Aguilar & Barea, 1997).
La palma de aceite es una planta que forma asociación simbiótica con HMA en su hábitat natural (Sieverding, 1991), sin embargo, es en etapa de pre-vivero y vivero donde han sido reportados resultados favorables de los HMA sobre el crecimiento de la palma de aceite, en intervalos de tiempo cortos y largos, así como en la absorción de nutrientes (Blal et al., 1990; Chu, 1997; Motta & Munévar, 2005). Si bien los HMA hacen parte de la biota nativa de los suelos, las poblaciones de estos son bajas (Motta & Munévar, 2005), o están conformadas por hongos de limitada eficiencia en un determinado cultivo, razón por la cual, se hace determinante la inoculación de las plantas para así promover el establecimiento de la simbiosis y una mayor eficiencia de la misma. Es debido a estos resultados y a que se puede lograr una agricultura sostenible, práctica y económica que impulse el reciclaje nutrientes para mejorar la fertilidad del suelo, lo que convierte a los HMA en una alternativa para contribuir al establecimiento de sistemas de producción sostenible, competitiva y rentable. Por está razón el objetivo de este trabajo de investigación fue evaluar el efecto del inóculo comercial Mycorrizz en plántulas de palma de aceite en etapa de pre-vivero y vivero.
OBJETIVO GENERAL
· Evaluar el efecto del inóculo comercial en plántulas de palma de aceite durante la etapa de Pre-vivero y vivero.
OBJETIVOS ESPECÍFICOS
· Analizar el efecto del inóculo comercial sobre plántulas de palma de aceite bajo diferentes dosis de fertilización química.
· Determinar los efectos de la aplicación del inóculo comercial sobre el crecimiento de las plántulas de palma de aceite en los diferentes tratamientos.
JUSTIFICACIÓN
Entre todos los cultivos oleaginosos que son producidos en Colombia, la palma de aceite es hasta ahora la especie vegetal capaz de producir la mayor cantidad de aceite por unidad de superficie (Revelo, 2002). En el Litoral Atlántico hay registros de producción de 35 toneladas de racimos por hectárea y alrededor del 90% del aceite de palma es destinado para usos alimenticios en Colombia.
La fertilización en palma de aceite, representa en términos generales un 30% de los costos de producción de este cultivo, sin embargo, este proyecto pretende disminuir los costos de producción con el uso de la micorriza como biotecnología, ya que mejora la capacidad de absorción de la planta y más aún, hace más eficiente la fertilización química hasta en un 23%. Además, con un manejo agronómico apropiado se garantiza que un cultivo comercial de palma de aceite alcance una vida productiva de más o menos 25 años.
Por lo tanto, la investigación en la agricultura está enfocada a la búsqueda de metodologías para la producción sostenible de cultivos (altos rendimientos, bajos costos de producción, conservación del ecosistema). Con los simbiontes micorrizicos en los cultivos para producción agrícola, frutales, ornamentales y pasturas, se busca solucionar problemas de índole nutricional para la planta, de sostenibilidad para el suelo y económicos para el agricultor.
La búsqueda de herramientas biotecnológicas que generen un aumento en la productividad, está encaminada en el uso de microorganismos, que de forma simbiótica o libre le confieran beneficios a las plantas. Como alternativa, el uso de HMA ha dado excelentes beneficios a las plantas en los aspectos nutricionales, fitosanitarios y frente a situaciones de estrés biótico y abiótico.
MARCO TEORICO - ANTECEDENTES
La Palma de aceite es una planta tropical perenne, con un ciclo de vida que puede sobrepasar los 100 años y un promedio de vida productiva de 25 a 30 años (Revelo, 2002). La palma aceite es cultivada por su alta producción de aceite con un alto rendimiento de los cultivos, por eso, es preciso la búsqueda de alternativas que reduzcan sus costos de producción y favorezcan la formación de plántulas vigorosas en vivero antes de ser llevadas para campo (CEA & J.E. Austin Associates, 2002).
El tiempo en que la palma de aceite se encuentra en etapa de pre-vivero y vivero es de gran importancia para el desarrollo futuro de la planta, debido a que si no se tienen los cuidados necesarios, como por ejemplo el suministro apropiado de agua, las plantas pueden reducir o hasta
detener su crecimiento (Revelo, 2002).
La Fertilidad del suelo es quizás uno de los factores más importantes, ya que las exigencias iniciales del cultivo tienden a aumentar con el desarrollo y producción, lo cual incide de manera notable en los costos y rentabilidad. La frecuencia de las fertilizaciones dependen de la permeabilidad del suelo y la precipitación, de tal manera que las pérdidas por lixiviación sean reducidas al mínimo (Guerra & Chacón, 2000). Se reconoce que un eficiente empleo de los nutrientes, permite acelerar el crecimiento vegetativo y aumentar la precocidad en la floración.
En cuanto a requerimientos nutricionales, el cultivo de palma de aceite requiere de micronutrientes como boro (B), zinc (Zn), cobre (Cu), hierro (Fe), manganeso (Mn), molibdeno (Mo) y cloro (Cl), vitales para el buen desarrollo de la planta, siendo el boro el más importante debido a que los niveles de este en el suelo son los mas bajos con respecto al resto, además, al ser deficiente afecta el crecimiento de la raíz y se hace escasa la exploración del suelo, lo que tiene como consecuencia la disminución de la extracción de otros micronutrientes y la reducción considerable del crecimiento de la parte aérea y la producción de la planta (Owen, 1993). Los macronutrientes requeridos por la palma de aceite son nitrógeno (N), fósforo (P), potasio (K), calcio (Ca), magnesio (Mg ) y azufre (S). La participación de estos elementos en procesos tales como la fotosíntesis, la síntesis de proteínas o en compuestos energéticos como el ATP, los hace importantes para que la planta pueda cumplir con sus funciones biológicas (Revelo & Africano, 2002).
Las simbiosis mutualistas se caracterizan por una unión íntima entre planta-microorganismo mediada por el reconocimiento entre las dos partes y el intercambio de nutrientes (Sanchez de Praguer, 2007). Una de las asociaciones más importantes en los ecosistemas tropicales, es la que se da entre hongos micorrizicos arbusculares-planta. Las micorrizas arbusculares son estructuras que se forman a partir de la simbiosis entre hongos del suelo y las raíces de aproximadamente un 80% de plantas terrestres y es de carácter importante porque lleva a cabo un mejoramiento nutricional en las plantas, especialmente de fósforo, lo que induce a una mayor capacidad de crecimiento en ellas (Ferrera & Alarcón, 2001).
Chu (1997) y Corley & Tinker (2003) indicaron que la palma de aceite es funcionalmente dependiente de los HMA ya que plántulas de palma micropropagadas, no se desarrollan en suelo estéril si no están colonizadas por este tipo de microorganismos. Dentro de los géneros asociados a las plantaciones de palma de aceite están Glomus (Blal et al., 1990) y Acaulospora, así como el género Gigaspora en Malasia (Nadarajah & Nawawi, 1993).
De igual manera, algunos resultados indican que plantas de palma de aceite micorrizadas podrían tener una mayor resistencia a enfermedades como la pudrición de la estípite producida por Ganoderma boniense (Azzihah, 2004). En situaciones de estrés biológico, los HMA incrementa la resistencia de las plantas al ataque de los patógenos, en especial los que atacan la raíz, cuando ocurre el establecimiento de la simbiosis previo al ataque del patógeno; en el caso de algunas enfermedades que atacan tallos y hojas, causadas por virus, hongos o bacterias, las plantas micorrizadas sufren menos daño que las plantas no micorrizadas (Sánchez de P., 1999).
En Brasil, en etapa de pre-vivero y vivero se han empleado géneros como Scutellospora, Gigaspora y Acaulospora y el género Gigaspora fue el género que presentó los mejores resultados (Chu, 1997). Ya en campo, el número de esporas reportado es bajo por lo que implementar HMA foráneos para aumentar el número de esporas en el suelo y competir con los HMA nativos, podría llevar consigo una mejor efectividad de estos microorganismos sobre las plantas.
MATERIALES Y MÉTODOS
Material Vegetal: El material usado para las pruebas fue el mismo que utiliza la empresa en su vivero (Figura 1), con el fin de establecer el efecto que genere el Inóculo sobre ellas y así poder establecer los beneficios que le reporta la asociación simbiótica.
Estos materiales son:
· Deli x La Me
· Deli x Ghana
Se trabajó con 144 plántulas de Palma de Aceite obtenidas a partir de semilla, las cuales fueron manejadas de acuerdo a las condiciones agronómicas de la empresa, es decir, el manejo de enmiendas, tipo de suelo, fertilización y control de plagas.

Fig. 1. Plántulas de palma de aceite en etapa de vivero, en el vivero de Copalcol en el Municipio de Puerto Wilches, Santander, Vereda El Ocho.
Información General del Producto: Inóculo comercial a base de estructuras de Hongos Micorrizicos Arbusculares en donde se encuentran las esporas en una mezcla de suelo y limo, con raicillas de Brachiaria decumbens (planta Trampa) colonizadas, hifas, micelio externo.
Parámetros de Crecimiento de las Plántulas: Se midieron los siguientes parámetros de crecimiento de cada una de las plántulas muestreadas: número de hojas, altura de la planta, longitud de la raíz, masa seca parte aérea de la planta y masa seca de la raíz. El material vegetal fue secado en estufa a 80ºC por 72 horas y luego pesado para determinar la masa seca.
Porcentaje de Colonización: Antes del secado, una submuestra de la raíz fue tomada con el fin de observar la presencia de estructuras de HMA. La tinción de las raíces se realizó por el método de tinción con Azul de Tripan descrito por Phillips & Hayman (1970).
El porcentaje se determinó utilizando la fórmula:
%C=N° campos positivos x 100
N° campos totales
Esporas: Se tomaron muestras de suelo por unidad experimental, con el fin de aislar las esporas de HMA, siguiendo la metodología de tamizaje y centrifugación con sacarosa descrita por Gerdenman & Nicholson, 1963, con algunas modificaciones. Las esporas fueron contadas mediante el método de cuadrantes de Sieverding (1983).
Época de Inoculación: Se realizó una aplicación del Inóculo comercial, en el momento de la siembra de las semillas para la etapa de pre-vivero. Para la evaluación a partir de la etapa de vivero, el material se transplantó a una bolsa más grande con otra aplicación del producto.
Épocas y Métodos de Evaluación: Se realizaron cuatro muestreos a lo largo del ensayo, teniendo en cuenta una duración de cuatro meses a partir de la siembra de la semilla y 6 meses a partir del transplante para la fase de vivero. Los muestreos fueron realizados a los 90, 180, 240 y 330 días después de la siembra (dds) de la semilla para la variedad Deli x Lame y 90 y 180 dds para la variedad Deli x Ghana.
Diseño Experimental: Se usó un diseño experimental completo al azar con un arreglo de parcelas divididas; en donde se contó con 6 tratamientos así:
· Tratamiento 1: Convencional.
· Tratamiento 2: Convencional + Inóculo.
· Tratamiento 3: Testigo Absoluto.
· Tratamiento 4: Inóculo.
· Tratamiento 5: 50% del Convencional.
· Tratamiento 6: 50% del Convencional + Inóculo.
Se utilizaron cuatro repeticiones cada uno con cuatro unidades experimentales para cada variedad, teniendo así un total de 16 Unidades Experimentales para cada tratamiento.
Número de Plantas por Parcela: En cada uno de los muestreos, se tomaron cuatro plántulas o unidades experimentales de cada tratamiento, para un total de 48 plántulas en cada una de las réplicas, es decir, un total de 144 plántulas para este ensayo.
Análisis Estadístico: Cada muestreo se analizó de forma independiente para cada variedad. Se realizaron pruebas de normalidad y de homogeneidad de varianza a los datos. Posteriormente fue realizada una prueba de comparación de medias T-student. Cuando los datos no pasaron las pruebas de normalidad o de homogeneidad de varianzas, se utilizó la prueba de Mann-Whitney. El análisis estadístico se realizó utilizando el programa Statistic versión 6.0
RESULTADOS
VARIEDAD DELI x LAME
Para el primer muestreo, realizado a los 90 días, se presentaron diferencias significativas entre los tratamientos Convencional + inóculo y Convencional para las variables peso seco radical y porcentaje de colonización. En las dos variables mencionadas anteriormente, el mejor resultado se vio en el tratamiento con inóculo (Tabla 1). Entre los tratamientos Testigo e inóculo se dieron diferencias significativas para la variable número de esporas (Tabla 1). La mayor altura de la planta, la longitud radical más larga y el mayor peso seco radical para esta época, se registraron para el tratamiento Convencional + inóculo. (Tabla 1). En cuanto a las variables microbiológicas, el tratamiento 50% convencional + inóculo presentó el mayor número de esporas aisladas por gramo de suelo seco (58 esporas/g de suelo), mientras que el porcentaje de colonización más alto estuvo en el tratamiento con inóculo comercial (9.75%).
Tabla 1. Efecto del inóculo sobre los parámetros de crecimiento de la palma de aceite variedad Deli x Lame y las variables microbiológicas, a los 90 días después de la siembra.
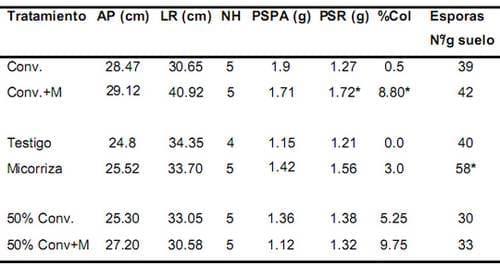
* Los valores con asterisco indican diferencias significativas. Conv.= Convencional, M= Mycorrizz, AP= altura de la planta, LR= longitud radical, NH= número de hojas, PSPA= peso seco parte aérea, PSR= peso seco raíz, %Col= porcentaje de colonización.
A los 180 días las diferencias significativas estuvieron entre los tratamientos Convencional + inóculo y Convencional (Figura 1) y los tratamientos Testigo y inóculo, en ambos casos para la variable peso seco radical (Tabla 2). El mejor resultado se puede observar en los tratamientos con inóculo. No se presentaron diferencias en el número de esporas pero si en el porcentaje de colonización entre los tratamientos 50% convencional (58.23%) y 50% convencional + inóculo (85.61%). Al igual que a los 90 días, no se presentaron diferencias significativas en los parámetros de crecimiento altura de la planta, longitud radical, número de hojas y peso seco parte aérea de la planta, en los seis tratamientos. En el tratamiento Convencional + inóculo se obtuvo la mayor altura de la planta (66.03cm) y el mayor peso seco radical (29.73cm) y de la parte aérea (19.69cm).
La longitud radical fue mayor en el tratamiento Convencional. El tratamiento 50% convencional + inóculo mostró el porcentaje de colonización y el número de esporas, mas alto en este periodo de tiempo evaluado.
Se puede apreciar en este muestreo un aumento en los parámetros de crecimiento evaluados en la planta, para los tratamientos Convencional + inóculo y Convencional, especialmente en el peso seco de la parte aérea de la planta y altura de la planta. El peso seco radical para el tratamiento Convencional + inóculo.
Tabla 2. Efecto del inóculo sobre los parámetros de crecimiento de la palma de aceite variedad Deli x Lame y las variables microbiológicas, a los 180 días después de la siembra.
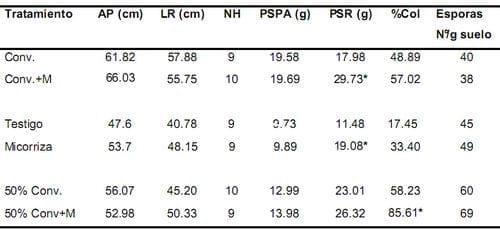
* Los valores con asterisco indican diferencias significativas. Conv.= Convencional, M= Micorriza, AP= altura de la planta, LR= longitud radical, NH= número de hojas, PSPA= peso seco parte aérea, PSR= peso seco raíz, %Col= porcentaje de colonización.

Fig.1 Plántulas de palma de aceite a los 180 dds.
Para los 240 días se observaron diferencias significativas en la altura de la planta entre los tratamientos Convencional+ inóculo y Convencional (Tabla 3). En el porcentaje de colonización, las diferencias estuvieron entre los tratamientos Micorriza y Testigo y entre 50% convencional y 50% Convencional + inóculo. En el número de esporas también se presentaron diferencias significativas entre los dos últimos tratamientos mencionados (Tabla 3). En todos los casos el promedio fue mayor para los tratamientos con inóculo, al ser comparados con sus testigos sin inóculo. Se observó un incremento del peso seco parte aérea y peso radical de la planta con respecto a los 180 días en todos los tratamientos. A su vez, los tratamientos Convencional + inóculo y 50% convencional + inóculo, registraron los valores mas altos de peso seco radical (148.30g y 145g respectivamente). El tratamiento Convencional + inóculo también registró el valor más alto para el peso seco radical de la planta (Tabla 3).
Tabla 3. Efecto del inóculo sobre los parámetros de crecimiento de la palma de aceite variedad Deli x Lame y las variables microbiológicas, a los 240 días después de la siembra.
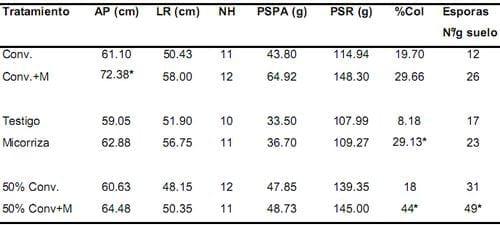
* Los valores con asterisco indican diferencias significativas. Conv.= Convencional, M= Micorriza, AP= altura de la planta, LR= longitud radical, NH= número de hojas, PSPA= peso seco parte aérea, PSR= peso seco raíz, %Col= porcentaje de colonización.
Al final del ensayo (330 días después de la siembra), se presentaron diferencias significativas en la altura de la planta y número de hojas para los tratamientos Convencional + inóculo (Figura 2) y Convencional (Tabla 4). La longitud radical de la planta mostró diferencias significativas entre los tratamientos 50% Convencional y 50% Convencional + inóculo; de la misma forma sucedió con el porcentaje de colonización. Aunque el peso seco parte aérea de la planta fue el mas bajo en este muestreo para los tratamientos Testigo (345.69g) y Micorriza (410.98g), fue aquí donde se presentaron las diferencias significativas. Entre estos dos tratamientos también se presentaron diferencias estadísticas para el porcentaje de colonización (Tabla 3).
Las diferencias estadísticamente significativas encontradas en los tratamientos mencionados anteriormente, favorecieron los tratamientos que contenían el inóculo.
Tabla 4. Efecto del inóculo sobre los parámetros de crecimiento de la palma de aceite variedad Deli x Lame y las variables microbiológicas, a los 330 días después de la siembra.
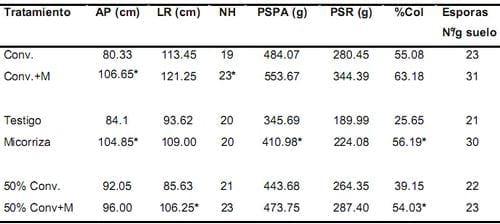
* Los valores con asterisco indican diferencias significativas. Conv.= Convencional, M= Micorriza, AP= altura de la planta, LR= longitud radical, NH= número de hojas, PSPA= peso seco parte aérea, PSR= peso seco raíz, %Col= porcentaje de colonización.

Fig. 2. Plántula de palma de aceite variedad Deli x Lame, 330 dds
VARIEDAD DELI x GHANA
No se presentaron diferencias significativas a los 90 días para las variables evaluadas de esta variedad. A los 180 días las diferencias significativas se presentaron entre los tratamientos Micorriza y Testigo, para la variable longitud radical (Tabla 5).
Tabla 5. Efecto del inóculo sobre los parámetros de crecimiento de la palma de aceite variedad Deli x Ghana y las variables microbiológicas, a los 180 días después de la siembra.
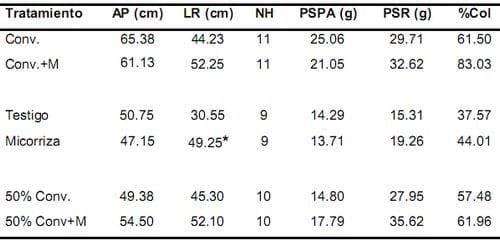
* Los valores con asterisco indican diferencias significativas. Conv.= Convencional, M= Micorriza, AP= altura de la planta, LR= longitud radical, NH= número de hojas, PSPA= peso seco parte aérea, PSR= peso seco raíz, %Col= porcentaje de colonización.
DISCUSIÓN
Respuesta de la Variedad Deli x Lame a la Inoculación con inóculo.
Las plantas de los tratamientos con inóculo se desarrollaron mejor que las plantas no inoculadas. En el caso de la variedad Deli x Lame, se observó una mejor respuesta de la palma de aceite hacia el final del experimento, que en las épocas anteriormente evaluadas. Para las variables peso seco radical y peso seco parte aérea, se observa un aumento considerable a los 240 días con respecto a los 180 días. Ese aumento que se presenta en la masa seca de la planta (parte aérea y raíz) es el reflejo del efecto que tienen los HMA sobre la planta, al absorber el fósforo del suelo y hacerlo disponible para la planta (Silva & Williams, 1992, citados por Chacón & Guerra, 2000). A través del experimento, el tratamiento Convencional + inóculo fue el que se comportó mejor o mostró los mejores resultados en cuanto crecimiento de la planta, lo que indica que la planta, fue más eficiente, aprovechando los nutrientes que le son facilitados por el hongo como N, P, Ca, y Mg (Sanchez de Prager, 1999).
A los 240 días después de la siembra, se dio un aumento del peso seco de la raíz con relación a la parte aérea de la planta. A los 330 días después de la siembra el aumento se dio en el peso seco de la parte aérea de la planta y aunque el peso seco radical también aumentó, no superó el peso seco foliar. Las micorrizas arbusculares además de incrementar la masa seca vegetal, también influyen en la proporción raíz-parte aérea de la planta, por esta razón, esta proporción es mayor en plantas micorrizadas con respecto a las no micorrizadas (Smith, 1980, citado por Barea et al., 1984). El efecto del inóculo sobre el número de hojas solo se dio al final del ensayo, en los muestreos anteriores este parámetro de crecimiento no se vio afectado coincidiendo con lo reportado por Motta y Munevar, 2005, quienes observaron diferencias después de 480 días.
El porcentaje de colonización se incrementó a los 180 días al compararse con los resultados a los 90 días, sin embargo, para los 240 días hubo una disminución en esta variable. Para el final del ensayo, hubo de nuevo un incremento en la colonización.
A los 240 días en la altura de la planta se presentó un aumento del 18.46% del tratamiento Convencional + inóculo con respecto al Convencional. En cuanto a la longitud radical, el peso seco parte aérea y el peso seco raíz se puede apreciar un incremento del 15.01%, 48% y 29% respectivamente, del tratamiento Convencional + inóculo al compararlo con su testigo Convencional. En el tratamiento 50% convencional + inóculo, se observa un aumento del 35% para la altura de la planta, de 4.60% en la longitud radical y de 1.84% y 4.05% en el peso seco, parte aérea y en el peso radical, respectivamente. Entre los tratamientos Micorriza y Testigo el incrementó fue de 6.49% para la altura de la planta, de 9.34% para la longitud radical, de 9.55% en peso seco parte aérea de la planta y de 1.19% peso seco radical. Para todos estos parámetros de crecimiento la mejora estuvo para el tratamiento Micorriza.
A los 330 días se observó en todos los parámetros de crecimiento de la planta una mejoría del 10.43% al 24.67% para el tratamiento Micorriza comparado con el Testigo. Con respecto al tratamiento 50% convencional + inóculo, se registró un aumentó del 4.29% para la altura de la planta, del 24.08% para la longitud radical, de 6.78% para el peso seco parte aérea y de 8.72% para el peso seco radical. El tratamiento Convencional + inóculo mostró un incremento con respecto al tratamiento Convencional del 32.76% para la variable altura de la planta, para la longitud radical el incremento fue de 6.87%, el peso seco radical presentó un aumento de 14.38% y el peso seco parte aérea de 22.80%. El número de hojas presentó un incremento del 21.05% del tratamiento Convencional + inóculo frente el tratamiento Convencional.
Respuesta de la Variedad Deli x Ghana a la Inoculación con inóculo.
Para las plántulas de palma de aceite, variedad Deli x Ghana, la falta de diferencias podría deberse a que 180 días después de la siembra es muy poco tiempo para observar diferencias significativas en plántulas de esta variedad. Sin embargo, el que solo se hayan presentado diferencias entre los tratamientos Micorriza y Testigo, sin ningún tipo de fertilización, para el parámetro de crecimiento longitud radical, muestra el efecto de los hongos micorrizicos arbusculares como estimuladores del crecimiento radical.
Aunque solo se presentaron diferencias significativas en la longitud radical a los 180 días, hubo un aumento también en los demás parámetros de crecimiento de la planta. En el tratamiento Convencional + inóculo hubo un aumento del 18.13% en la longitud radical sobre el tratamiento
Convencional. El tratamiento 50% convencional + inóculo mostró un incremento del 15%. El tratamiento Micorriza presentó un 61.21% de aumento sobre el tratamiento Testigo.
Para la variable altura de la planta el se observó un incremento del 10.37%, para el peso seco radical, el aumento fue de 20.20%. En ambos casos se favoreció el tratamiento 50% convencional + inóculo.
El peso seco radical presentó un aumento de 9.79% para el tratamiento Convencional + inóculo, de 25.80% para el tratamiento Mycorrizz y de 7.79% para el tratamiento 50% convencional + inóculo.
Tanto para la variedad Deli x Lame como para la variedad Deli x Ghana se observó que para algunos de los parámetros de crecimiento, a los 90 y 180 días después de la siembra, los tratamientos sin aplicación del inóculo, presentaron mejor respuesta que los tratamientos con aplicación del inóculo. Esto sucede porque la formación de la simbiosis micorrizica requiere un alto costo (Schroeder e Janos, 2004), no obstante, con el tiempo los beneficios que son aportados por los HMA se empiezan a ver en la planta, explicados por el incremento del área foliar de la planta, elevadas concentraciones de P foliar y un mejoramiento en las relaciones hídricas de las plantas (Sanchez de Prager, 2007).
En condiciones de pre-vivero y vivero, han sido reportados resultados favorables de los HMA sobre el crecimiento de la palma de aceite, (Blal et al., 1990; Chu, 1997; Motta & Munévar, 2005), en regiones que se caracterizan por su producción de aceite de palma, como Malasia y aquí en Suramérica Brasil.
CONCLUSIONES
Variedad Deli x Lame
· La inoculación de la palma de aceite con inóculo, favoreció el crecimiento de las plántulas así como la acumulación de masa seca tanto en la parte aérea de la planta como en la raíz.
· La mejor respuesta de la palma de aceite se observó a los 240 y 330 días después de la siembra, ya en la etapa de vivero, esto posiblemente debido a la condición perenne de esta planta.
· El tratamiento Convencional + Micorriza reportó los mejores resultados en estos dos periodos de tiempo para el desarrollo de la planta.
· La longitud radical en la variedad Deli x Ghana se vio estimulada por el inóculo, cuando no se aplicaron las dos distintas dosis de fertilización. De igual manera el mejor desarrollo radical se dio en las plántulas que fueron inoculadas.
· Estos resultados muestras que el inóculo favoreció el desarrollo de las plántulas de palma de aceite en etapa de vivero, hacia el final del experimento, con fertilización completa y reducida hasta el 50 %.
REFERENCIAS
AZCÓN-AGUILAR, C. & BAREA, JM. Applying mycorrhiza biotechnology to horticulture: significance and potentials. Scientia Horticulturae, 68:1-24, 1997.
AZIZAH, H. Ganoderma versus micorrizas. Palmas, 4: 75-83. 2004
BAREA, JM., AZCÓN-AGUILAR C. & ROLDAN-FAJARDO, B. 1984. Avances recientes en el estudio de la Micorriza V.A. I. formación, función y Efectos en la Nutrición Vegetal. Anales de Edafología y Agrobiología. Tomo 43.
BAREA, J. M., POZO, M. J., AZCÓN, R. & AZCÓN-AGUILAR, C. Microbial co-operation in the rhizosphere. Journal of Experimental Botany, 56(417):1761-1778, 2005.
BLAL, B., MOREL, C., GIANINAZZI-PEARSON, V., FARDEAU, J. C. & GIANINAZZI, S. Influence of vesicular-arbuscular mycorrhizae on phosphate fertilizar efficiency in two tropical acid soils planted with micropropagated oil palm (Elaeis guineensis jacq.). Biology and Fertility of Soils, 9:43-48, 1990.
CHACÓN M. & B. GUERRA. 2000. Tesis de Maestría. Universidad Industrial de Santander. Aislamiento y caracterización de Hongos Formadores de Micorrizas y Rhizobacterias promotoras de crecimiento vegetal, asociadas al cultivo de la mandarina (Citrus reticulata) en el municipio de
Lebrija Santander Colombia.
CHU, EY. Influência dos fungos micorrízicos arbusculares e níveis de adubação do no crescimento inicial de mudas de Dendê. Embrapa. Boletim de Pesquisa, 176: 1-20, 1997.
CORLEY. RH. V & TINKER. PB. 2003. The oil palm. Cuarta edición. Blackwell Science Iowa SA. p. 327-360.
CORPORACIÓN CEA & J.E.AUSTIN ASSOCIATES. Estudio del mercado mundial para aceite de palma africana. Disponível en: http://bogota.usembassy.gov/wwwfad08.pdf, 2002.
GERDEMAN, JW & NICOLSON, TH. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting. Transactions of the british mycological society Vol 46: 235-244. 1963.
FERRERA. R & ALARCÓN, A. 2001. La microbiología del suelo en la agricultura sostenible. Ciencia Ergo Sum Vol 8(2): 175-183.
MOTTA, D. & MUNÉVAR, F. Respuesta de plántulas de palma de aceite a la micorrización. Palmas, 26(3):11-20. 2005.
MUNÉVAR, F. Problemática de los suelos cultivados con palma de aceite en Colombia. Palmas 19. Número especial: 218-228.
NADARAJAH, P & NAWAWI, A. Mycorrhizal status of epiphytes in Malaysian oil palm plantations. Mycorrhiza Vol 4: 21-25. 1993.
OWEN. E. Requerimiento de micronutrimentos para el cultivo de palma de aceite (Elaeis guineensis Jacq.). Palmas Vol 14(4): 9-25. 1993.
PHILLIPS, JM. & HAYMAN, DS. Improved procedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Trans. Br. Mycol. Soc. 55, 158-161. 1970.
REQUENA, N, SERRANO, E., OCÓN, A. & BREUNINGER, M. Plant signals and fungal perceptions during arbuscular mycorrhizal establishment. Phytochemistry, 68:33-40, 2007.
REVELO, M. Generalidades sobre Botánica Morfología y Fisiología. En: Revelo, M. ed. Palmicultura Moderna Volumen I. Sociedad las Palmas Ltda. Bogotá. 2002. p. 9-18.
REVELO, M & AFRICANO, F. Manejo del proceso de fertilización en palma de aceite. Palmicultura Moderna Volumen I. Sociedad las Palmas Ltda. Bogotá, p. 45-72. 2002.
SANCHEZ, M. Endomicorrizas en ecosistemas Colombianos. Universidad Nacional de Colombia. Palmira, p. 95-120. 1999.
SANCHEZ, M. Las Micorrizas: Estrategia compartida para colonizar el suelo. En Sanchez, M. ed. Las endomicorrizas: Expresión bioedáfica de importancia en el trópico. Universidad Nacional de Colombia. Palmira, p. 115-175. 2007.
SCHROEDER, M. S. & JANOS, D. Phosphorus and intraspecific density alter plant responses to arbuscular mycorrhizas. Plant and Soil, 264:335-348, 2004.
SIEVERDING. E. Manual de métodos para la investigación de la micorriza vesiculo-arbuscular en el laboratorio Ciat: 121. 1983. Cali- Colombia.
SIEVERDING, E. Vesicular-arbuscular mycorrhiza management in tropical agrosystems. GTZ, Eschborn, Germany. 1997
Informe suministrado por el Ing. Alexander Corzo, del departamento comercial de la empresa.
Las micorrizas llevan 400 millones de años sobre la Tierra, y son los “abonos naturales” que las plantas han utilizado desde siempre. Pero el uso excesivo de fertilizantes y fitosanitarios, la sobreexplotación de los suelos agrícolas y la desertificación las hacen desaparecer. Por eso hay que recuperarlas, reactivarlas y reintroducirlas para devolver a la planta y al suelo el equilibrio natural que han perdido.
Los propágulos de micorriza son el conjunto de esporas, raíces micorrizadas e hifas que hay en el suelo o en el inoculante micorrícico que añadimos. Se llaman “propágulos” porque de cada uno de ellos se puede “propagar” la micorriza. Por lo tanto, el contenido en Micorriza de un inoculante deberia indicarse e número de propagulos. Un inoculante ideal es el que tiene mayor número de propágulos.
Para que un inoculante sea excelente NO BASTA CON TENER SÓLO ESPORAS; es mejor que tenga una COMBINACIÓN DE LOS TRES TIPOS DE PROPÁGULOS (esporas, raíces, hifas), porque eso potencia la actividad de la micorriza. Si un inoculante dice que tiene, por ejemplo, “200 esporas por ml”, es probablemente porque no contenga ningún otro tipo de propágulos, con lo cual está perdiendo gran capacidad de actuación.


