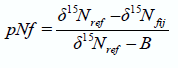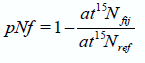INTRODUCCIÓN
La estimación de la fijación biológica de Nitrógeno (FBN) mediante el uso técnicas isotópicas se basa en que, bajo las mismas condiciones de crecimiento, las plantas fijadoras tienen una concentración de 15N inferior a las no fijadoras, y esta diferencia es proporcional a la fracción de N fijado. Esta diferencia puede ser estimada a nivel de abundancia natural (AN) ó a un nivel superior de 15N. Ésta última forma de estimación se denomina técnica de dilución isotópica (TDI) y se basa en el agregado al suelo de una pequeña dosis de fertilizante N enriquecido en 15N, lo cual implica la delimitación de un área y por ende la instalación de un ensayo para la aplicación de éste método (Chalk, 1985). La técnica AN, en cambio, permite estimar FBN de una pastura sin necesidad de instalar previamente un ensayo en el sitio bajo estudio. Ambos métodos requieren que se determine la masa de materia seca de la pradera, su contenido de nitrógeno total y el valor de concentración de 15N. Para el caso de AN, es necesario cuantificar además el fraccionamiento isotópico (valor B) que ocurre durante dicho proceso. En el caso de TDI, en cambio, se asume que los efectos isotópicos son despreciables y por tanto se considera que el valor B es cero.
El valor B de leguminosas se ha estimado usualmente en medios de cultivo inertes, como arena o soluciones hidropónicas, en dónde la única fuente de N es la atmosférica (Ledgard, 1989b; Unkovich et al., 1994). Otra posibilidad es estimar B utilizando como medio de crecimiento un suelo típico de la zona dónde interesa estimar FBN. Esta estimación se puede realizar de varias maneras; una de ellas es utilizar el promedio de los valores más negativos (BMIN) de ?15N de las leguminosas de interés, bajo la asunción de que estas plantas representan los casos en que el N absorbido provino solo de la fijación (Peoples et al., 1997).
Esta metodología fue utilizada por Hansen y Vinther (2001) para estimar la FBN de praderas de trébol blanco (TB) y raigrás que estaban bajo el efecto de pastoreo animal. En estas condiciones de crecimiento, vale decir bajo la influencia de deyección animal, un alto porcentaje de las leguminosas tuvieron valores de ?15N más negativos que el valor B estimado en medio libre de N. Ante la dificultad de no poder utilizar éste método los autores optaron por la metodología BMIN que fue específico para cada sitio experimental. Los valores BMIN de TB fluctuaron entre -2,10 y -2,59 ‰, y se ajustaron dentro del rango de valores ya reportado por otros autores (Riffkin et al., 1999) a partir de plantas de TB inoculadas con cepas de Rhizobium que fueron seleccionadas de nódulos colectados en un amplio rango de tipos de suelos. Otra técnica mas indirecta propuesta por Doughton et al. (1992) es definir B como el valor de ?15N que minimiza la suma de los desvíos al cuadrado entre pNf calculado por AN y TDI (en este trabajo se lo denominó BD). Este valor B fue estimado por Okito et al. (2004) con leguminosas tropicales creciendo en macetas a cielo abierto y comparado con los valores B de las mismas leguminosas pero creciendo en un sustrato mezcla de arena y vermiculita en invernáculo. Los resultados de este estudio revelaron que el valor B estimado en sustrato mezcla fue mas de dos unidades permil mayor que el estimado para la misma combinación cepahospedante creciendo en suelo. Los autores sugirieron que esta diferencia de B entre medios de crecimiento podría ser explicada en parte por diferencias en las condiciones ambientales pero esencialmente por la presencia de cepas nativas de Rhizobium con alta eficiencia de fijación que se encuentran en medio edáfico pero no en medio inerte.
Otra posibilidad aún no evaluada podría ser estimar el valor BMIN en medio edáfico pero con aporte limitado de N, lo cual puede lograrse mediante el agregado de un material con alta relación C/N, que genere un proceso de inmovilización neta de N. El presente trabajo tuvo como objetivo comparar en condiciones de invernáculo y de campo distintas metodologías de estimación del valor B. Estas comparaciones se realizaron contrastando los valores de FBN estimados con éstos valores B con los obtenidos por TDI, el que se consideró cómo método referencia.
MATERIALES Y MÉTODOS
El 30 de agosto de 2007 se instalaron dos experimentos en un establecimiento lechero de la zona sur de Uruguay. En este sitio se había plantado en mayo de 2005 una pradera comercial de festuca, lotus (L) y TB. Uno de los experimentos fue instalado en una zona de la pradera en donde crecían las tres especies originalmente sembradas (Experimento 1.1), mientras que el otro fue instalado en una zona con alta predominancia de TB y donde había prácticamente desaparecido las otras dos especies (Experimento 1.2). Para diferenciar TB de ambos experimentos se denominó TB mezcla (TBM) al del Experimento 1.1 y TB puro (TBP) al del Experimento 1.2. En ambos casos el suelo fue un Typic Argiudoll y el contenido promedio de C y N orgánico así como de abundancia natural de 15N (?15N) fue similar (25,7 y 2,3 gkg-1 y de 8,1‰, respectivamente). El día de instalación de ambos experimentos se aplicó una dosis de 10 kg N ha-1 como urea enriquecida con 10at%15N a microparcelas de 1m2 (Tratamiento TDI). Esta aplicación se efectuó solo una vez, al comienzo del ensayo, en ambos experimentos (1.1 y 1.2). Ese mismo día se realizó un muestreo de plantas en parcelas de 11,5 m2 ubicadas en un área que no había recibido aplicaciones de 15N (Tratamiento AN). El diseño experimental del Experimento 1.1 fue un factorial de dos tratamientos: Método de estimación de FBN (ME-FBN) por Especie, mientras que en el Experimento 1.2 el tratamiento fue ME-FBN. En ambos casos los tratamientos estuvieron dispuestos en parcelas al azar con cuatro repeticiones. Luego de ese primer muestreo, se efectuaron tres cortes más, a los 25, 50 y 88 días.
Se realizaron también en invernáculo dos experimentos maceteros. En uno de los experimentos (Experimento 2.1) se tomó suelo de una zona aledaña al ensayo de campo y se pasó por un tamiz de malla de 1 cm para homogeneizar la muestra y separar el material vegetal grueso. Luego, se ajustó su contenido de humedad a capacidad de campo y se le agregó azúcar (5 g kg -1 suelo seco) para inducir un proceso de inmovilización neta del N mineral. A una porción de suelo se le agregó una dosis de 10kg de N ha-1 como urea enriquecida al 10 at%15N (Tratamiento TDI), mientras que a otra no se le agregó 15N (Tratamiento AN). Las muestras de ambos tratamientos de 15N fueron dispuestas en macetas y sembradas con tres pasturas (las especies forrajeras comerciales existentes en el ensayo de campo), dos puras (una de TBP y otra de festuca) y una mezcla (L, TBM y festuca) con tres repeticiones. El diseño experimental del Experimento 2.1 fue idéntico al de campo, pero con tres repeticiones. Las plantas fueron sometidas a cuatro cortes los días 28/11, 19/12, 15/01, 13/02. En el segundo experimento (Experimento 2.2) se utilizó arena (previamente lavada y posteriormente autoclavada por 60 minutos a 121 ºC) en vez de suelo como medio de crecimiento y se sembró sólo leguminosas puras (L y TBP), a las que se aplicó semanalmente una solución nutritiva libre de Nitrógeno (solución nutritiva JENSEN, pH 6,25). En este experimento las plantas se cortaron a los 60 días post- siembra debido a que éstas presentaron un estrés no identificado. En ambos experimentos de invernáculo las semillas de leguminosas fueron inoculadas con su Rhizobium específico y la fecha de siembra fue el 27/09/07.
A los 10 días post-emergencia se ajustó el número de plantas/maceta a la densidad comercial. Todas las macetas fueron regadas con agua con una frecuencia variable para asegurar que el agua disponible en el medio de crecimiento (suelo ó arena) no fuera limitante. En el laboratorio se realizó la separación botánica de las muestras cosechadas (del ensayo de campo y macetero), discriminando entre las tres especies (L, TB y festuca) y agrupando el resto como malezas. Luego, cada componente de la pastura fue secado por separado en una estufa de aire forzado durante 48 hs. a 65 ºC y molido hasta alcanzar el tamaño granulométrico (consistencia talco) necesario para el análisis de 15N por espectrometría de masa. La concentración de NT y la abundancia natural de 15N de las muestras (conteniendo aproximadamente 35 ug de N) se determinó simultáneamente utilizando el método de combustión Dumas dentro de un sistema que consistió de un analizador elemental Flash EA 112 acoplado a un espectrómetro de masa DeltaPlus (Finnigan MAT, Bremen, Germany).
La estimación de pNf por AN (pNf-AN) se estimó de la siguiente manera (Shearer y Kohl,1986):
dónde ?15ref es el valor isotópico de la planta no fijadora usada como referencia y ?15fij es el valor isotópico de la planta fijadora, mientras que B es el valor isotópico de la planta fijadora creciendo en un medio libre de N. Para la estimación de pNf-TDI, en cambio, se asume que los efectos isotópicos son despreciables y por tanto el valor B es cero, por lo cual la ecuación [1] equivale a:
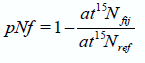
en dónde la concentración isotópica se expresa como at%15N. La planta de referencia utilizada para la estimación de pNf (AN y TDI) fue festuca (Festuca arundinaceae Schreb). El análisis de varianza (ANOVA) de los datos de pNf fue realizado usando el Software de análisis estadístico InfoStat (Di Rienzo et al., 2008). Los valores de B estimados por las distintas metodologías produjeron diferentes valores de pNf. En el ANOVA se compararon estos valores entre sí y con los de TDI, por lo cual el tratamiento ME-FBN tuvo más de dos niveles. La suma de cuadrados de éste tratamiento fue separada en contrastes ortogonales.
RESULTADOS Y DISCUSIÓN
En el Experimento 2.2, los valores de B obtenidos en arena (BAR) fueron -2,02 y -0,90‰ para L y TB, respectivamente. Estos valores se obtuvieron en un solo corte, luego de 60 días de crecimiento. En el Experimento 2.1, los valores BMIN obtenidos en suelo con limitado aporte de N, luego de cuatro cortes y 137 días de crecimiento fueron -1,78, -1,53 y -2,03‰ para L, TBP y TBM, respectivamente. En ambos casos los valores B son el promedio de tres repeticiones. El hecho de que BAR de TB fue menos negativo que BMIN estaría indicando que el fraccionamiento isotópico de la FBN en arena fue menor que en suelo, ya que el valor BAR fue más próximo al valor de la señal isotópica del N2 del aire, el cual por definición es 0‰. Okito et al. (2004) trabajando con leguminosas tropicales también observaron que el fraccionamiento isotópico durante la FBN produjo valores de B más negativos en el medio edáfico que en un medio inerte de arena y vermiculita. Esto en principio sería contrario a lo esperado, ya que el valor más negativo debería de obtenerse en la arena, dónde la fuente de N es sólo atmosférica. Según estos autores, ésta diferencia podría ser explicada por la presencia de cepas nativas de Rhizobium con alta eficiencia de fijación que se encuentran en medio edáfico pero no en medio inerte. Los valores BD de L, TBP y TBM usando datos de los Tratamientos TDI y AN del Experimento 2.1 fueron -1,75, -1,38 y -1,90 ‰, respectivamente. Los valores de BD fueron muy similares a los de BMIN lo que confirmaría que ambas metodologías estiman adecuadamente el fraccionamiento isotópico en medio edáfico.
En los Experimentos de campo (1.1 y 1.2), los valores encontrados de BMIN para L, TBP y TBM fueron de -0,76, 0,05 y -0,92‰, respectivamente y los valores de BD correspondientes fueron - 1,82, -1,42 y -2,05‰. El hecho de que los valores BMIN de campo fueran más positivos que los de invernáculo indicaría que los mismos no serían apropiados para corregir FBN-AN, ya que este valor no representaría sólo el aporte de N de la atmósfera sino también el del suelo. Este resultado se debería a que en el campo existió mayor mineralización neta de N que en el invernáculo, dónde se agregó glucosa al suelo. Los valores BD obtenidos con datos de campo, en cambio, se relacionaron estrechamente con los de invernáculo (r = 0,99; P=0,06), y aunque los primeros tendieron a ser algo más negativos, la diferencia entre ellos no fue estadísticamente significativa cuando se evaluó en términos de pNf (datos no mostrados). En cambio, cuando se estimó pNf usando BMIN si existió diferencia significativa con TDI.
En invernáculo, el ANOVA de pNf reveló que en la mayoría de los casos no existió diferencia significativa entre FBN estimada por TDI y AN corregida por BMIN ó BD. Esta diferencia sólo fue significativa cuando FBN-AN fue corregida por BAR y FBN fue superior a 70%. Este mayor impacto del valor B en la estimación de FBN a valores altos de fijación ha sido reportada previamente por otros investigadores (Unkovich et al., 1994). Como BAR fue superior a los demás valores de B obtenidos en invernáculo, parece razonable asumir que ésta diferencia significativa se debió a que BAR indujo a sobreestimar pNf-AN. Por tanto, los resultados de campo e invernáculo sugieren que sólo los valores de BMIN determinados en invernáculo y los de BD obtenidos en campo ó invernáculo estiman adecuadamente FBN cuando se utiliza AN.
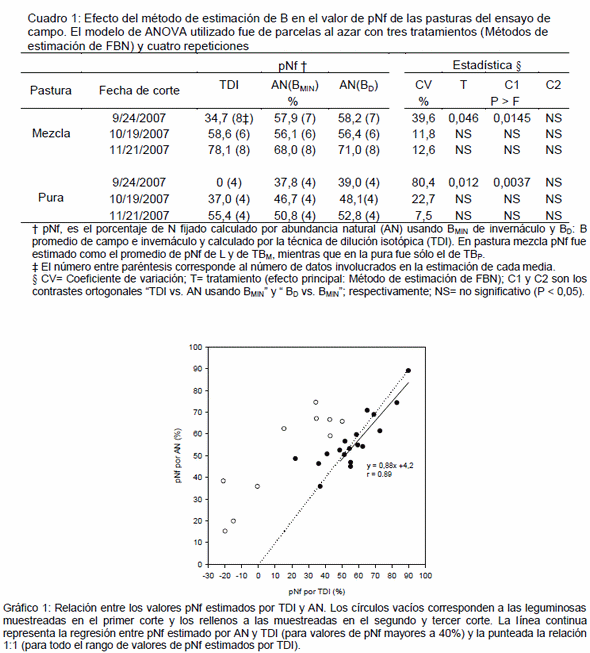
En campo, el ANOVA de pNf de los experimentos 1.1 y 1.2, utilizando BD promedio de campo e invernáculo y BMIN de invernáculo reveló que sólo existió efecto significativo (P<0,05) de ME-FBN en el Corte 1, cuando pNf-TDI fue inferior a 40% (Cuadro 1), pero no resultó clara la superioridad de TDI ó AN para estimar FBN en estas condiciones. Según Unkovich et al., 1994 a bajos valores de pNf el método TDI estimaría mejor FBN que AN, ya que el uso de fertilizante enriquecido con 15N permite detectar diferencias de 15N entre la leguminosa y la referencia. Sin embargo, en este caso ésta diferencia de 15N fue mayor en AN, y los valores estimados de FBN-TDI fueron negativos, lo cual también genera dudas acerca de la precisión de éste método. Además, sólo en este corte la relación entre TDI y AN se alejo de la relación 1:1 (Figura 1). De todas maneras, cabe señalar que en este corte de invierno la producción de materia seca de ambos experimentos fue muy baja (datos no mostrados) y la cantidad de N fijado fue pequeña, por lo cual el error de estimación de FBN por cualquiera de los métodos carece de importancia práctica. Esta estimación resulta relevante en los períodos del año de alta productividad cuando la FBN también es alta y en este caso la estimación por ambos métodos fue similar.
CONCLUSIÓN
En condiciones de alta producción de materia seca la estimación de FBN por TDI ó AN (usando BMIN de invernáculo ó BD de campo ó invernáculo) produjo resultados similares. De todas maneras la estimación de FBN por AN presenta ventajas prácticas ya que es posible estimar la fijación en pasturas comerciales sin realizar previamente un experimento.
BIBLIOGRAFÍA
Doughton, J.A., Vallis, I. & P.G. Saffigna. 1992. An indirect method for estimating 15N isotope fractionation during nitrogen fixation by a legume under field conditions. Plant and soil 144: 23-29.
Hansen, J. P. & F. P. Vinther. 2001. Spatial variability of symbiotic N2 fixation in grass-white clover pastures estimated by the 15N enriched method and the natural 15N abundance method. Plant and Soil 230: 257-266.
Di Rienzo J.A., Casanoves F., Balzarini M.G., Gonzalez L., Tablada M., Robledo C.W. (2008). InfoStat, versión 2008, Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina.
Ledgard, S.F. 1989b. Nutrition, moisture and rhizobial strain influence isotopic fractionation during N2, fixation in pasture legumes .Soil Biol. Biochem.21: 65-68.
Mallarino, A.P., Wedin, W.F., Goyenola, R.S., Perdomo, C.H. & C.P. West. 1990. Legume species and proportion effects on symbiotic dinitrogen fixation in legume –grass mixtures. Agron. J. 82: 785-789.
Peoples M.B., Turner G.L., Shah Z., Aslam M., Ali S., Maskey S., Bhattari S., Afandi F., Schwenke G. & Herridge D. 1997. Evaluation of the 15N natural abundance technique for measuring N2 fxation in experimental plots
and farmers? felds. Pp. 57–75 in „Extending nitrogen fxation research to farmers felds?, ed. by O.P. Rupella, C. Johansen and D.F. Herridge. ICRISAT: Patancheru, India.
Okito, A., Alves, B., Urquiaga, S. & R.M. Boddey. Isotopic fractionation during N2 fixation by four tropical legumes, Soil Biol. and Biochem. 36 (7): 1179-1190.
Riffkin, P.A., Quigley, P.E., Cameron, F.J, Peoples, M.B. and J.E. Thies. 1999b. Factors associated with biological nitrogen fixation in pastures in south-western Victoria. Aust. J. Agric. Res. 50: 261-272.
Unkovich, M.J, Pate, J.S., Sanford, P, & E. Armstrong. 1994. Potential precision of the δ15N natural abundance method in field estimates of nitrogen fixation by crop and pasture legumes in south – west Australia.
Australian Journal of Agricultural Research 45(1): 119 – 132.