Introducción
La glomalina es una glicoproteína termoresistente, insoluble al agua, que forma parte de la fracción de ácido fúlvico de los suelos y es producida por los hongos micorrízicos arbusculares (HMA) en los cuales forma parte de la pared de las hifas y sus esporas, asimismo, posee de 0.8% a 8% de hierro (Wright y Upadhyaya, 1996; Wright y Upadhyaya, 1998; Wright et al., 1998; Wright y Anderson, 2000; Wright, 2000; Rillig, 2004; Driver et al., 2005). Fue descubierta cuando se desarrolló el anticuerpo monoclonal Mab32b11, solo se ha reportado que el phylum Glomeromycota (Géneros: Glomus, Acaulospora, Gigaspora, Scutellospora y Entrophospora) lo produce en cantidades significantes (Wright et al., 1996), por tanto, es la principal fuente de origen en el medio ambiente (Lovelock et al., 2004a).
La glomalina se clasifica como glomalina de fácil extracción (GFE), glomalina de difícil extracción (GDE), estas clasificaciones son operativas, dicho de otra manera, son los métodos de extracción las que delimitan su categorización (Wright y Upadhyaya, 1996).
De manera general variados autores han sugerido que la glomalina puede ser utilizado como un indicador de múltiples factores tales como: indicador de cambios de C en los suelos, de la alteración de la estabilidad de los agregados del suelo (Rillig et al., 2003a; Rillig et al., 2001a).
Lutgen et al. (2003) Señalan que los cambios estacionarios en las cantidades de glomalina son relativamente pequeños en los reservorios de los suelos, indicando que una muestra es más que suficientes para poder medir dichos indicadores, al mismo tiempo, agregan que la glomalina no sirve como indicador de la actividad de los HMA y tampoco con su relación con el largo de las hifas, sin embargo, Wright y Upadhyaya (1999), Lovelock et al. (2004a), Rosier et al. (2008) y Bedini et al. (2009) indican lo contrario, la glomalina si puede servir de indicador de la actividad de los HMA, pero solo teniendo en cuenta si son en condiciones de laboratorio y experimentos controlados (in-vitro, condiciones de invernadero), y si es en campo esto solo aplica en la acumulación a corto plazo.
Al ser los HMA organismos mutualistas obligados, estos dependen de su hospedero para su alimentación y desarrollo, es por ello que en este trabajo se busca caracterizar la producción de GFE y GDE que presentan las especies de gramíneas Bouteloua curtipendula, Bouteloua gracilis y Chloris virgata, las cuales son especies que tienen una función ecológica y económica en los pastizales localizados en la región de los valles del estado de Durango, con el fin de conocer su producción y ver si varían entre si.
Materiales y métodos
Área de estudio
El trabajo se llevó a cabo en la región de los valles del estado de Durango, que son las planicies a 1800 a 2100 msnm localizadas en los municipios de Canatlán, Durango, Guadalupe Victoria, Nombre de Dios, Panuco de Coronado, Vicente Guerrero y Villa Unión.
Sitios de estudio
Se utilizaron los registros históricos del herbario del CIIDIR Durango para determinar la distribución de las especies Bouteloua gracilis, Bouteloua curtipendula y Chloris virgata en la región, de ahí fueron seleccionados 15 sitios de estudio al azar en base a la presencia de las especies analizadas.
Muestreo de suelos
El muestreo de llevo a cabo a partir de la segunda semana de septiembre hasta la primera de octubre de 2015. Se utilizó la NOM-021-SEMARNAT-2000 y se tomaron muestras de suelos cercanas a las raíces de los pastos Bouteloua gracilis, Bouteloua curtipendula y Chloris virgata por triplicado del horizonte A (5-30 cm); cada una de las muestras fueron seleccionadas de manera aleatoria en cada sitio de estudio. Las muestras de suelos fueron secados a la sombra por 72hr, y pasados por un tamiz de 2mm, y almacenados en bolsas de plástico Ziploc® a 4°C hasta su utilización.
Extracción y cuantificación de glomalina
Para la obtención de la glomalina de fácil extracción (GFE) y difícil extracción (GDE) se llevó a cabo con la metodología sugerida por Wright et al., (1998). La GFE se extrajo de 1 g de muestra de suelo, agregando 8 ml de citrato de sodio a 20mM, pH 7.0, a 121°C por 30 min en autoclave, la muestra se centrifugó a 3200 rpm por 25 min y se recuperó el sobrenadante. La GDE se extrae con de 1 g muestra de suelo, más 8 ml de citrato de sodio a 50mM, pH 8.0, a 121°C por 90 min en autoclave, la muestra se centrifugó a 3200 rpm por 25 min y se recupera el sobrenadante, para la GDE se requieren múltiples ciclos extracción hasta que la solución de la muestra tenga un característico color pajizo. Los sobrenadantes se refrigeraron a 4 °C hasta su utilización. Para medir la cantidad de proteína presente en los sobrenadantes se realizó un ensayo de Bradford (Bradford, 1976) con el uso de suero de albumina bovina (BSA) como estándar, la proteína es cuantificada por miligramo de proteína por gramo de suelo (mg g-1).
Resultados y discusión
El Cuadro 1 presenta el sitio y las coordenadas de donde fueron extraídas las muestras, solo dos sitios no mostraron la presencia de C. virgata por lo que se tuvo que ir a sitios alternativos cercanos para poder realizar el muestreo.
Cuadro 1.- Caracterización de los sitios de estudio
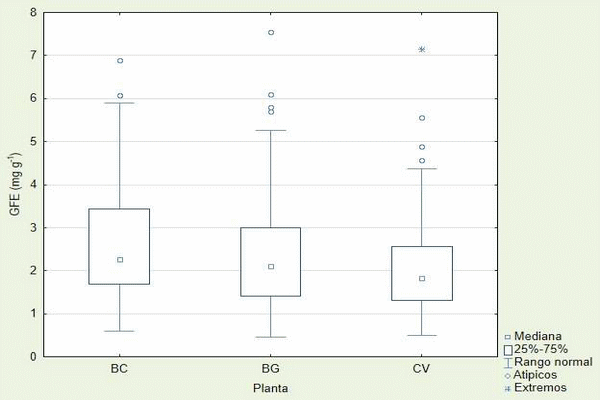
En la Figura 1 se observa la producción de Glomalina de Fácil Extracción (GFE) agrupada por especie de planta en diagramas de caja, se observa que tienen rangos similares entre si, aunque se observa que C. virgata es ligeramente menor a las demás. Existen datos atípicos en todas las especies y uno extremo para en el caso de C. virgata, aunque la presencia de este tipo de datos no es deseable hay que considerar que el total de mediciones son de 117 por plantas, y considerando que las mediciones fueron realizadas en un estudio de campo son tolerables ya que representan menos del 4% del total de las mediciones, además se observa que los valores mínimos son similares entre las especies, los valores máximos observados sin incluir a los datos aberrantes, B. curtipendula tiene un valor cercano a 6 mg de GFE g-1 de suelo, mientras que B. gracilis es cercano a 5 y C. virgata es aproximado a 4.5.
Figura 1.- Diagrama de cajas de la producción de GFE agrupada por especie
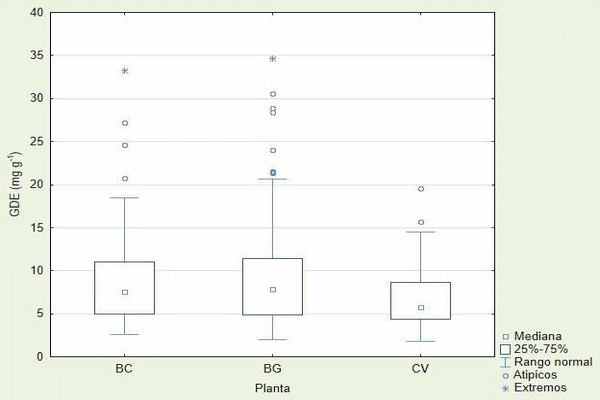
La Figura 2 muestra la producción de Glomalina de Difícil Extracción (GDE) agrupada por especie de gramínea, se observa que el valor minino base por cada especie es similar entre si, y se observa que existe una clara diferencia en el rango y máximo de la producción, donde C. virgata es claramente inferior a B. curtipendula y B. gracilis. La existencia de datos atípicos y extremos es patente en el diagrama de cajas, donde B. gracilis es el que presenta más datos y C. virgata el menor, se tendría la siguiente relación en base a 117 mediciones por cada planta ≈4% de error para B. curtipendula, ≈6% para B. gracilis y ≈2% para C. virgata. Considerando solo el rango normal se observa que B. gracilis tiene un valor máximo ligeramente superior a 20 mg gr-1, B. curtipendula cercano a 19 mg gr-1 y C. virgata ligeramente menor a 15 mg gr-1.
Figura 2.- Diagrama de cajas de la producción de GDE agrupada por especie
El Cuadro 2 nos muestra la media, error estándar y rango de la GFE y GDE agrupado por especie, en él se realizó un ANOVA para visualizar si existen diferencias significativas en la producción entre las especies de gramíneas, se observa que B. curtipendula y C. virgata son diferentes entre si en la producción de GFE, aunque se observa que sus rangos son similares los valores medios son los que determinan esta diferenciación. En cuanto a la GDE se observa con más claridad dos grupos en donde B. curtipendula y B. gracilis son significativamente diferentes a C. virgata, produciendo más GDE. Se observa con más claridad en sus medias y rangos donde C. virgata tiene menor producción.
Cuadro 2.- Medias de GFE y GDE en B. curtipendula, B. Gracilis y C. virgata.

La GFE está relacionada con la glomalina de más reciente producción (Lovelock et al., 2004b; Steinberg y Rillig, 2003), con lo que podemos observar es que, en estos resultados, existe un valor base mínimo independientemente de la especie, sin embargo, las producciones medias y máximas varían entre especies con lo que inferimos que B. curtipendula influye más en la generación de GFE que C. virgata, pero no de B. gracilis, dando así a entender que las especies generan diferentes influencias en las producciones de GFE. Si comparamos estos resultados con las observaciones a nivel ecosistémico en pastizales, agostaderos, estepas mediterránea y matorrales estos van de 0.14 a 3.36 mg gr-1 (Bird et al., 2002; Lutgen et al., 2003; Nichols y Wright, 2005; Rillig et al., 2002; Rillig et al., 2003; Wright y Upadhyaya, 1998), comparando los valores medios observados Cuadro 2 estos entran en el rango que muestran ellos, aunque hay que resaltar que existen valores superiores por las mismas plantas tales como las valores máximos registrados que son de 6.89 a 7.54 mg gr-1.
La GDE por otra parte está relacionada con la acumulación de la glomalina recalcitrante en los suelos (Wright y Upadhyaya, 1998), y es aquí en este caso donde las diferencias entre B. curtipendula, B. gracilis y C. virgata se notan con mayor claridad. Se ve como C. virgata tiene una menor acumulación a comparación de las otras dos, una posible explicación sería el sistema radicular que pueden llegar a desarrollar B. curtipendula y B. gracilis dado que son plantas perenes a comparación de C. virgata que es una planta anual. La glomalina al ser producida por los hongos micorrízicos arbusculares está directamente influenciada por el ciclo de vida de los mismos, al ser organismos que son mutualistas obligados se ven favorecidos al juntarse con especies vegetales que presentan más superficie radicular (Brito et al., 2008). En otros trabajos los valores reportados de GDE han sido con un rango de media de 1.97 a 2.59 mg gr-1 en tierras de cultivo (Wuest et al., 2005), de 2.54 a 6.16 mg gr-1 en los suelos con diferentes vocaciones tales como cultivo o pastizales en los Apalaches (Halvorson y Gonzales, 2006), de 0.40 a 1.70 mg gr-1 en suelos quemados en los bosques boreales (Treseder et al., 2004), de 63.1 a 111.8 mg gr-1 en pastizales con suelos minerales y turba (Schindler et al.,2007), de 3 a 14.1 mg gr-1 (Wright et al., 2000), y en costa rica se observó una media de 6.25 mg gr-1, con un rango de 1.27 a 19.84 mg gr-1 en un bosque tropical (Lovelock et al., 2004b), el cual comparándolo con las especies analizadas en el Cuadro 2 se observa que tienen medias de 6.76, 9.11 y 9.13 mg gr-1 con rangos de 2.61 - 33.27 mg gr-1, 2.03 - 34.68 mg gr-1, 1.77 - 19.57 mg gr-1, siendo especialmente similar a la producción que tuvo la C. virgata, por otra parte las B. curtipendula y B. gracilis obtuvieron valores mayores y rangos más amplios, con lo que nos indica que generan un ambiente adecuado para la acumulación de glomalina, hay que recalcar que la producción en el bosque tropical es generalizado y este estudio solo va enfocado a la producción en el área bajo la influencia de la interacción de la planta con su medio, con lo que el beneficio solo se extenderá hasta donde alcance dicha influencia. Hay que notar que los datos aberrantes pudieron ser producidos debido a la interferencia de la alta cantidad de materia orgánica, compuestos polifenólicos, proteínas hidrofóbicas, complejos polifenol-proteína, la posibilidad de aminoácidos libres, taninos y sustancias húmicas en general (Whiffen et al., 2007; Rosier et al. 2006; Halvorson y González, 2006; Nichols y Wright, 2005; Schindler et al. 2007; Purin y Rillig, 2005; Gillespie et al., 2011). Este tipo de mediciones se han observado con valores de hasta 120 mg gr-1 (Rillig et al., 2001b; Wright et al., 2000) ya que le hizo la medición de GDE en selvas tropicales con alta presencia de materia orgánica, la cual reflejo altos contenidos glomalina.
Concluciones
La producción media de GFE de cada especie está dentro del rango normal a comparación de otros pastizales, hay diferencias entre especie de plantas. B. curtipendula produce más GFE que C. Virgata, además esta última acumula menos GDE que B. curtipendula y B. gracilis. Los valores de GDE caen dentro de la normalidad comparándolos el bosque tropical, aunque el área de influencia solo se limita a la planta y no a todo el ecosistema. Aunque las conclusiones son evidentes en las diferencias, este estudio no puede concluir por que se generan esas discrepancias entre especies, por lo que hace falta la inclusión de variables explicativas a nivel ecosistémico, radicular y molecular para poder entender mejor este fenómeno y así aprovechar las características que ofrece la glomalina a los suelos.
Literatura citada
Bedini, S., Pellegrino, E., Avio, L., Pellegrini, S., Bazzoffi, P., Argese, E. y Giovannetti, M. (2009).
Changes in soil aggregation and glomalin-related soil protein content as affected by the arbuscular mycorrhizal fungal species Glomus mosseae and Glomus intraradices. Soil Biology & Biochemistry. 41(7): 1491-1496. doi: 10.1016/j.soilbio.2009.04.005
Bird, S.B., Herrick, J.E., Wander, M.M. y Wright, S.F. (2002). Spatial heterogeneity of aggregate stability and soil carbon in semi-arid rangeland. Environmental Pollution. 116(3): 445-455. doi: 10.1016/S0269-7491(01)00222-6
Bradford, M.M. (1976). A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72(1-2):248-252. doi: 10.1016/0003-2697(76)90527-3
Brito, I., Goss, M.J., de-Carvalho, M., van-Tuinen, D. y Antunes, P.M. (2008). Agronomic Management of Indigenous Mycorrhizas. En: A. Varma (Ed.) Mycorrhiza (pp. 375-394). Berlin, Alemania: Springer.
Driver, J.D., Holben, W.E. y Rillig, M.C. (2005). Characterization of glomalin as a hyphal wall component of arbuscular mycorrhizal fungi. Soil Biology & Biochemistry. 37(1):101-106. doi: 10.1016/j.soilbio.2004.06.011
Gillespie, A. D., Farrell, R.E., Walley, F.L., Ross, A.R.S., Leinweber, P., Eckhardt, K., Regier, T.Z. y Blyth, R.I.R. (2011). Glomalin-related soil protein contains non-mycorrhizal related heat-stable proteins, lipids and humic materials. Soil Biology & Biochemistry. 43(4):766-777. doi: 10.1016/j.soilbio.2010.12.010
Halvorson, J.J. y González J.M. (2006). Bradford reactive soil protein in Appalachian soils: distribution and response to incubation, extraction reagent. Plant and Soil. 286(1): 339-356. doi: 10.1007/s11104-006-9047-x
Lovelock, C.E., Wright, S.F. y Nichols, K.A. (2004a). Using glomalin as an indicator for arbuscular mycorrhizal hyphal growth: an example from a tropical rain forest soil. Soil Biology & Biochemistry. 36(6): 1009-1012. doi: 10.1016/j.soilbio.2004.02.010
Lovelock, C.E., Wright, S.F., Clark, D.A. y Ruess, R.W. (2004b). Soil stocks of glomalin produced by arbuscular mycorrhizal fungi across a tropical rain forest landscape. Journal of Ecology. 92(2): 278-287. doi: 10.1111/j.0022-0477.2004.00855.x
Lutgen, E.R., Muir-Clairmont, D., Graham, J. y Rillig, M.C. (2003). Seasonality of arbuscular mycorrhizal hyphae and glomalin in western Montana grassland. Plant and Soil. 257(1): 71-83. doi: 10.1023/A:1026224209597
Nichols, K.A. y Wright S.F. (2005). Comparison of glomalin and humic acid in eight native U.S: soils. Soil Science. 170(12):985-997. doi: 10.1097/01.ss.0000198618.06975.3c
Purin, S. y Rillig, M.C. (2007). The arbuscular mycorrhizal fungal protein glomalin: Limitations, progress, and a new hypothesis for its function. Pedobiologia. 51(2):123-130. doi: 10.1016/j.pedobi.2007.03.002
Rillig, M.C. (2004). Arbuscular mycorrhizae, glomalin, and soil aggregation. Can. J. Soil. Sci. 84(4):355-363. doi: 10.4141/S04-003
Rillig, M.C., Ramsey, P.W., Morris, S. y Paul, E.A. (2003). Glomalin, an arbuscular-mycorrhizal fungal soil protein, responds to land-use change. Plant and Soil. 253(2): 293-299. doi: 10.1023/A:1024807820579
Rillig, M.C., Wright, S.F. y Eviner, V.T. (2002). The role of arbuscular mycorrhizal fungi and glomalin in soil aggregation: comparing effects of five plant species. Plant and Soil. 238(2): 325- 333. doi: 10.1023/A:1014483303813
Rillig, M.C., Wright, S.F., Kimball, B.A., Pinter, P.J., Wall, G.W., Ottman, M.J. y Leavitt, S.W. (2001a). Elevated carbon dioxide and irrigation effects on water stable aggregates in a sorghum field: a possible role for arbuscular mycorrhizal fungi. Global Change Biology. 7(3): 333-337. doi: 10.1046/j.1365-2486.2001.00404.x
Rillig, M.C., Wright, S.F., Nichols, K.A., Schimdt W.F. y Torn M.S. (2001b). Large contribution of arbuscular mycorrhizal fungi to soil carbon pools in tropical forest soil. Plant and Soil. 233(2): 167- 177. doi: 10.1023/A:1010364221169
Rosier, C.L., Hoye, A.T. y Rillig, M.C. (2006). Glomalin-related soil protein: Assessment of current detection and quantification tools. Soil Biology & Biochemistry. 38(8): 2205-2211. doi: 10.1016/j.soilbio.2006.01.021
Rosier, C.L., Piotrowski, J.S., Hoye, A.T. y Rillig M.C. (2008). Intraradical protein and glomalin as a tool for quantifying arbuscular mycorrhizal root colonization. Pedobiologia. 52(1): 41-50. doi: 10.1016/j.pedobi.2008.02.002
Schindler, F.V., Mercer, E.J. y Rice J.A. (2007). Chemical characteristics of glomalin-related soil protein (GRSP) extracted from soil of varying organic matter content. Soil Biology & Biochemistry. 39(1): 320-329. doi: 10.1016/j.soilbio.2006.08.017
Steinberg, P.D. y Rillig, M.C. (2003). Differential decomposition of arbuscular mycorrhizal fungal hyphae and glomalin. Soil Biology & Biochemistry. 35(1): 191-194. doi: 10.1016/S0038- 0717(02)00249-3
Treseder, K.K., Mack, M.C. y Cross, A. (2004). Relationships among fires, fungi, and soil dynamics in Alaskan boreal forests. Ecological Applications. 14(6):1826-1838. doi: 10.1890/03-5133
Whiffen, L.K., Midgley, D.V. y McGee, P.A. (2007). Polyphenolic compounds interfere with quantification of protein in soil extracts using the Bradford method. Soil Biology & Biochemistry. 39(2): 691-694. doi: 10.1016/j.soilbio.2006.08.012
Wright, S. F., Upadhyaya, A. y Buyer, J.S. (1998). Comparison of N-linked oligosaccharides of glomalin from arbuscular mycorrhizal fungi and soils by capillary electrophoresis. Soil Biol. Biochem. 30(13): 1853-1857. doi: 10.1016/S0038-0717(98)00047-9
Wright, S.F. (2000). A fluorescent antibody assay for hyphae and glomalin from arbuscular mycorrhizal fungi. Plant and Soil. 226(2): 171-177. doi:10.1023/A:1026428300172
Wright, S.F. y Anderson, R.L. (2000). Aggregate stability and glomalin in alternative crop rotations for the central Great Plains. Biol Fertil Soils. 31(3): 249-253. doi: 10.1007/s003740050653
Wright, S.F. y Upadhyaya, A. (1996). Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi. Soil Science. 161 (9): 575-586. doi: 10.1097/00010694-199609000-00003
Wright, S.F. y Upadhyaya, A. (1998). A survey for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi. Plant and Soil. 198(1):97-107. doi: 10.1023/A:1004347701584
Wright, S.F. y Upadhyaya, A. (1999). Quantification of arbuscular mycorrhizal fungi activity by the glomalin concentration on hyphal traps. Mycorrhiza. 8(5):283-285. doi: 10.1007/s005720050247
Wright, S.F., Franke-Snyder, M., Morton, J.B. y Upadhyaya. (1996). Time-course study and partial characterization of a protein on hyphae of arbuscular mycorrhizal fungi during active colonization of roots. Plant and Soil. 181(2):193-203. doi:10.1007/BF00012053
Wright, S.F., Rillig, M.C., Nichols, K.A. (2000). Glomalin: a soil protein important in carbon sequestration. En proceedings of American chemical society annual meeting symposium. pp.721- 725. Recuperado de: https://web.anl.gov/PCS/acsfuel/preprint%20archive/Files/45_4_WASHINGTON%20DC_08- 00_0721.pdf
Wuest, S.B., Ceasar-TonThat, T.C., Wright, S.F. y Williams, J.D. (2005). Organic matter addition, N and residua burning effects on infiltration, biological, and physical properties of an intensively tilled silt-loam soil. Soil & Tillage Reseach. 84(2): 154-167. doi: 10.1016/j.still.2004.11.008