Introducción
Una dieta a base de trigo entero, además de cumplir una función nutricional reconocida mundialmente, ha demostrado reducir la incidencia de las principales enfermedades humanas tales como la diabetes, enfermedades cardiovasculares y cáncer (Wilcox et al. 2004). Ello sugiere que los componentes de trigo tipo fibra son responsables de los beneficios de protección hacia la salud. Esta observación ha llevado a algunos investigadores a centrarse en los compuestos fenólicos como los agentes causantes de dichos beneficios (Sang et al. 2006).
Los compuestos fenólicos son los principales metabolitos secundarios elaborados por las plantas y comprenden un amplio grupo de compuestos caracterizados por un anillo aromático al que se unen diversos grupos sustituyentes, tales como hidroxilo, carboxilo y metoxilo y frecuentemente otras estructuras cíclicas no aromáticas. Los compuestos fenólicos se diferencian de los lípidos en que son más solubles en agua y menos solubles en solventes orgánicos no polares. Sin embargo, algunos compuestos fenólicos son bastantes solubles en éter, especialmente cuando el pH es lo bastante bajo como para impedir la ionización de cualesquiera de los grupos carboxilos e hidroxilo presentes. Esta propiedad ayuda mucho en la separación de estos compuestos entre sí y de otros compuestos (Salisbury-Ross, 2000). En el trigo se encuentran en forma libre confinado sobre todo en las células aleurónicas o ligado a polisacáridos tipo hemicelulosas solubles (Krygier et al. 1982). Los compuestos fenólicos en el grano de trigo, están representados mayormente por el ácido ferúlico, un derivado del ácido cinámico (Abdel-Aal et al. 2001). El ácido ferúlico forma enlaces cruzados con sacáridos como arabinoxilanos y los ácidos orgánicos de las paredes celulares y se piensa que confiere resistencia contra los insectos (depredadores), patógenos microbianos y acción protectora de la radiación UV (McCallum y Walker 1990; Abdel-Aal et al. 2001).
Muchos de estos compuestos fenólicos presentan fuertes propiedades antioxidantes que desactivan o atrapan los radicales libres donando electrones y por tanto reducen o minimizan el daño oxidativo a las proteínas, el ADN y los lípidos (Salisbury-Ross, 2000). Esta reducción en el daño oxidativo a las células y componentes celulares puede explicar inhibición de enfermedades como el cáncer y enfermedades cardiovasculares, que puede ser causada o agravada una vez que la enfermedad ha progresado por el estrés oxidativo celular (Wilcox et al. 2004).
En el presente trabajo se realizó la extracción y cuantificación de los compuestos fenólicos del trigo en su fracción salvado, donde se hallan en mayor proporción (Zielinsky- Kozlowska, 2000) de una serie de 35 cultivares provistos por la RET 2 MJ. La calidad de los compuestos mencionados, desde el punto de vista saludable, estuvo medida por la actividad antioxidante, una de las principales propiedades de los compuestos fenólicos. La cuantificación de los compuestos fenólicos se hizo a través del reactivo de Folin-Ciocalteu mediante espectrofotometría visible (Singleton, V. et al. 1999). La curva de calibrado se construyó a partir de una solución de acido gálico de concentración conocida y una serie de estándares de la misma sustancia a diferentes concentraciones. Para la medición de la actividad oxidante se empleó una solución de DPPH (1,1-difenil-2-picrilhidracilo) (Beta et al. 2005) previa realización de la curva de calibrado para esta sustancia. Los resultados se procesaron estadísticamente a través del programa INFOSTAT y se dedujeron conclusiones tratando de relacionar el ciclo del cultivo y los grupos de calidad con el contenido en compuestos fenólicos.
Materiales y Métodos
Las 35 muestras de trigo comprenden los cultivares: ACA (303, 304, 305,315 y 601); Baguette (17, 18 y P11); BIOINTA (1002, 2004,3000, 3004 y 3005); BUCK (Mangrullo, Malevo, Meteoro, Ranquel y Taita); INIA Tijereta; KLEIN (Yarará, Capricornio, Carpincho, Gavilán, Guerrero, Pantera y Proteo); LE (2271; 2330, 2333 y 2371); SRM Nogal; THEMIX L; BIOINTA (3003, 1005 Y 1006) . Los reactivos Follin-Ciocalteu solución 2 N, Éter Etílico, Metanol, Etanol y Acetato de Etilo (Ciccarelli, San Lorenzo, Sta. Fe, Argentina); Acido Gálico (Biopack); 2,2-difenil-1- picrilhidracilo (DPPH) (Sigma Aldrich, Co, St. Louis, USA).
Preparación de las muestras y extracción.
Todas las muestras (100 g) fueron acondicionadas a 15 % de humedad y luego molidas usando un molino Agromatic AG modelo ACQ (Agromatic AG, Zurich, Switzerland) siguiendo los Métodos 25-50 (AACC Internacional 2000). De cada muestra se seleccionó la fracción salvado. Todos los ensayos se realizaron por duplicado.
Los FLI fueron extraídos con soluciones alcohólicas de acuerdo a lo sugerido por Adom et al. (2005), con algunas modificaciones a los fines de adaptar el instrumental disponible. En un tubo de centrífuga se pesó 1 g de salvado y se le agregó 10 mL de solución alcohólica (agua en etanol, 80 % v/v). Se agitó 2 min en un agitador de vaivén (Delver MP1011 A, Delver, La Plata, Argentina); se centrifugó a 2.500g por 10 min. Este proceso se repitió dos veces. Se colectaron los sobrenadantes y se evaporaron a temperaturas inferiores a 50 ºC hasta un volumen inferior a 5 mL. Las muestras concentradas fueron llevadas a un volumen final de 10 mL con agua destilada en matraz aforado y guardadas en el refrigerador (5 ºC) hasta el tratamiento posterior.
Los FCO fueron extraídos del residuo anterior siguiendo el método descripto por Krygier et al. (1982) con algunas modificaciones. Se pesó 0,5 g de residuo y se le agregó 20 mL de solución de NaOH 0,2 N. La mezcla fue agitada por espacio de 4 h en un agitador a 2.000 rpm que se mantuvo en un recipiente encerrado a temperatura constante de 20 ºC (VELP Scientifica FTC 90, Velp, Usmate, Italia). Luego fue neutralizado a pH 2 con solución de HCl 2 N y se le agregó 20 mL de éter etílico y se centrifugó a 2500g por 10 min. Se retiró el sobrenadante y al residuo remanente se le agregó 20 mL de acetato de etilo, se centrifugó a 2.000g por 10 min. Ambos sobrenadantes se colectaron y se llevaron a evaporación a temperatura inferior a 50 ºC hasta un volumen inferior a 5 mL. Los concentrados se llevaron a volumen final de 10 mL con agua destilada en matraz aforado y se guardaron en refrigerador (5 ºC) hasta tratamiento posterior.
Determinación del Contenido de Fenólicos
Las concentraciones de FLI y FCO existentes en los extractos fueron determinadas como describe Singleton et al. (1999) con algunas modificaciones. Se midió un volumen de 2,5 mL del extracto, se agregó 2 mL de agua destilada y luego 0,5 mL del reactivo de Folin-Ciocalteu 1 N (dilución del comercial 2N) y 1,5 mL de solución de carbonato de sodio al 20 %. Todo se llevó a volumen de 25 mL y se guardó en la oscuridad por espacio de 2 h, para desarrollo del color azul. Paralelamente se preparó una solución patrón de Acido Gálico (1 mg/mL) y a partir de ella se prepararon los estándares de 0,1; 0,2; 0,4; 0,6 y 0,8 mg/L. Se tomó 1 mL de cada uno de ellos y se agregó 0,5 mL del reactivo de Folin-Ciocalteu y solución de carbonato de sodio como se describió anteriormente y todo se llevó a un volumen de 10 mL. Los estándares así preparados se guardaron en la oscuridad por espacio de 2h y se procedió a trazar la curva de calibrado midiendo la absorbancia de ellos a 765 nm en un espectrofotómetro HACH DR 2800 (Hach Company, Loveland, USA). Con la curva trazada y rectificada se procedió a medir las absorbancias de las muestras para obtener los resultados en μg/g equivalente a Acido Gálico (AGE). Verma et al. (2007) compararon curvas de calibrado trazadas con ácido gálico y ácido ferúlico (el fenólico más abundante en trigos) y no hallaron sustanciales diferencias.
Determinación de la Actividad Antioxidante.
Fue medida usando una solución de DPPH como describe Beta et al. (2005). El DPPH es un radical estable que absorbe a 515 nm pero frente a antioxidantes decrece su estabilidad lo que se refleja en una disminución de su coloración. El ensayo con DPPH es una medida de la capacidad de los compuestos fenólicos para captar el electrón y en ello radica el efecto antioxidante. Estos ensayos también se realizaron por duplicado. Se pesó 0,1 g de salvado y se agregó como extractante 1 mL de metanol. Se mantuvo en agitación por 2 h y se tomó 0,1 mL del extracto que se hizo reaccionar con 3,9 mL de solución metanólica de 23,6 mg/L de DPPH (6 x 10-5 mol/L). A esta mezcla se le midió la absorbancia a 515 nm en un espectrofotómetro HACH DR 2800 y se consideró absorbancia inicial (Ao). Al cabo de 30 min se volvió a medir la absorbancia y se consideró absorbancia 30 (A30). La actividad antioxidante, medida por la decoloración. Los valores obtenidos se informaron como % de actividad oxidante ± desviación estándar obtenidos a partir de la siguiente ecuación:
Resultados y Discusión
Los resultados de la cuantificación de compuestos fenólicos se muestran en la Tabla 1. Los FT fueron obtenidos por suma de los FLI más FCO. De acuerdo a ello puede establecerse que: los FLI oscilaron entre 1.008 ± 94 μg/g y 2.092 ± 54 μg/g, con un promedio de 1.379 ± 33,4 µg/g. Los FCO oscilaron entre 3.278 ±179 μg/g y 6.697± 14 μg/g con un promedio de 4.448 ± 46 µg/g y para FT un promedio 5.826 ± 82 µg/g donde se observa que aproximadamente el 75 % del contenido total de fenólicos constituyen los fenólicos conjugados, resultado que está de acuerdo por lo hallado por otros investigadores que evaluaron la relación FCO/FLI como 68 a 72 % (Verma et al. 2007). La actividad antioxidante varió de 9,87 % a 20,68 % con un promedio de 13,63±0,62 %. Beta et al (2005) y otros investigadores arribaron, empleando el método aquí adoptado, valores promedios de 16 % de AA, resultado totalmente concordante.
La Figura 1 representa un gráfico de barras de la distribución de los FLI, FCO y FT en función de los ciclos de los cultivares. Se observa una mayor proporción de compuestos fenólicos en cultivares de ciclo intermedio corto .La Figura 2 representa un gráfico de barras de la distribución de los FLI, FCO y FT en función de los grupos de calidad industrial fijados por el INASE. De acuerdo a ello se observa una proporción mayor (leve) en los grupos 2 y 3 (de menor contenido proteico). Análisis de regresión lineal entre los FT y la AA señala que existe relación de dependencia entre estas variables (p< 0,05) y un coeficiente de correlación lineal muestral (r) de 0,96 (Di Rienzo et al. 2008).
Tabla 1. Compuestos Fenólicos en la fracción salvado y actividad antioxidante de 35 cultivares pertenecientes a la RET 2 MJ, 2009.
Donde Ciclo: I (intermedio); IC (intermedio corto); IL (intermedio largo); Grupo 1(trigos correctores); 2(trigos panificación fermentación tradicional) y 3 (trigos panificación fermentación rápida). FLI (compuestos fenólicos libres); FCO (compuestos fenólicos conjugados); AA (actividad antioxidante) y DE (desviación estándar).
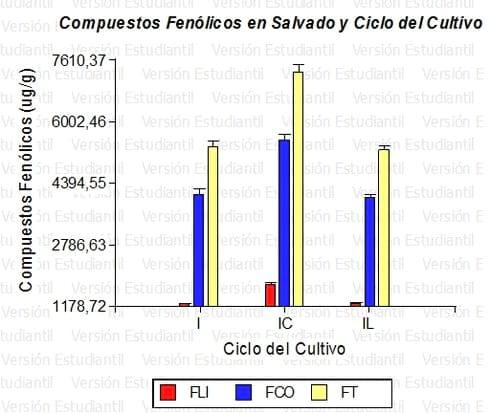
Figura 1. Compuestos fenólicos en salvado y ciclo del cultivo. La altura de las barras representa promedios de los cultivares ensayados en cada ciclo y las líneas truncadas el error estándar (EE). Ciclo: I (intermedio); IC (intermedio corto) e IL (Intermedio largo). (Infostat, 2011).
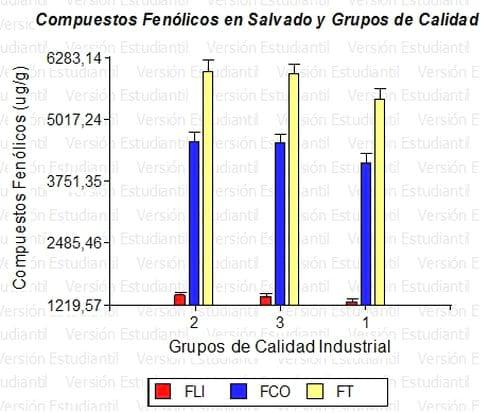
Figura 2. Compuestos fenólicos en salvado y grupos de calidad industrial. La altura de las barras representa promedios de los cultivares ensayados en cada grupo y las líneas truncadas el error estándar (EE).Grupo: 1(corrector); 2 (fermentación tradicional) y 3 (fermentación rápida).
En un análisis de varianza (ANAVA) correspondiente a las variables de la Figura 1 se observa que existe un efecto significativo (p< 0,05) del ciclo del cultivo sobre la proporción de compuestos fenólicos totales. La aplicación de la prueba de Fisher, que produce una DMS = 442, indica que hay diferencias para los cultivares de ciclo IC, bajo esta condición el promedio de FT es 7251,50 µg/g, mientras que para los restantes ciclos (promedios de 5.271,40 µg/g para ciclo IL y 5.349,34 µg/g) no pueden distinguirse estadísticamente el efecto del ciclo sobre los compuestos fenólicos. En un análisis similar, pero remitiendo a la Figura 2, no existe un efecto significativo (p= 0,2835). La aplicación de la prueba de Fisher, conduce a un DMS = 672 y establece que los efectos de los grupos sobre los compuestos fenólicos no son estadísticamente diferentes. En cuanto a la AA, el análisis de regresión muestra una dependencia significativa (p<0,05) entre la AA y los FT con un R2 = 0,92 y una correlación lineal muestral, r = 0,96; el estadístico T = 24, demuestra que esta correlación es estadísticamente significativa ya que resulta ser superior al t crítico de2,73. Cultivares con mayor proporción de FT muestran mayor AA (Di Rienzo et al. 2008).
Conclusiones
Los FLI, FCO y FT en la fracción salvado de 35 cultivares de trigo muestra un contenido en FCO que es aproximadamente el 75 % de los FT con un promedio general de 5.825 ± 82 µg de GAE/g de salvado y diferencias significativas en la medida de FT en los diferentes ciclos de cultivo, atribuyéndose los cultivares de ciclo intermedio corto las mayores proporciones. No hay una marcada significación entre los grupos de cultivares y el contenido en compuestos fenólicos. La AA, con un promedio del 13 % es considerable y está en concordancia con otras investigaciones que arrojaron porcentajes similares medidos en las mismas condiciones (Beta et al 2005) y guarda una proporción positiva con los FT.
Agradecimientos
Al INTA Marcos Juárez y en especial al Ing. Agr. Jorge Fraschina quien desinteresadamente envió las 35 muestras de trigo perfectamente identificadas a los Laboratorios de la UTN San Francisco; al Molino Carlos Boero Romano SAIC de San Francisco (Cba) por su colaboración en la molienda de las muestras; a la Dra Gabriela Pérez de la FCA de la UNC por su apoyo incondicional y al grupo de trabajo conformado por las estudiantes becadas, Vanesa Caporali, Emilia Carrillo y Melisa Panero, de la especialidad ingeniería química, que llevaron a cabo la parte experimental participando en este proyecto.
Bibliografía
- AACC International. 2000. Approved Methods of the American Association of Cereal Chemists, 10th Ed. Method 26-50. The Association: St Paul. MN.
- Abdel-Aal, E. S., Hucl, P., Sosulski, F. W., Graf, R., Gillott, C., and Pietrzak, L. Screening spring wheat for midge resistance in relation to ferulic acid content. J. Agric. Food Chem. 49 (2001) 3559-3566.
- Adom, K. K., Sorrells, M. E., and Liu, R. H. Phytochemicals and antioxidant activity of milled fractions of different wheat varieties. J. Agric. Food Chem. 53 (2005) 2297-2306.
- Beta, T., Nam, S., Dexter, J. E., and Saperstein, H. D. Phenolic content and antioxidant activity of pearled wheat and roller-milled fractions. Cereal Chem. 82 (2005) 390-393.
- Di Rienzo, J; Casanoves, F.; Gonzalez, L.; Tablada, E.; Díaz M.; Robledo, C.; Balzarini, M. 2008. Estadística para las Ciencias Agropecuarias. 7ma Ed. Brujas. Córdoba, Argentina.Di Rienzo, J. A.; Casanoves F., Balzarini M. G., Gonzalez L., Tablada M., Robledo C.W. 2008.
- InfoStat, versión 2008, Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina.
- Krygier, K., Sosulski, F., and Hodge, L. Free, esterified, and insoluble- bound phenolic-acids. Extraction and purification procedure. J. Agric. Food Chem. 30 (1982) 330-334.
- McCallum, J. A., and Walker, J. R. Proanthocyanidins in wheat bran. Cereal Chem. 67 (1997) 282-285.
- Salisbury, F.B and Ross, C, W. 2000. Fisiología de las Plantas 2.Thomson Editores Spain Paraninfo, S.A. Madrid. España. p 486-490.
- Sang, S. M., Ju, J. Y., Lambert, J. D., Lin, Y., Hong, J. G., Bose, M., Wang, S., Bai, N. S., He, K., Reddy, B. S., Ho, C. T., Li, F., and Yang, C. S. Wheat bran oil and its fractions inhibit human colon cancer cell growth and intestinal tumorigenesis in Apc (min/+) mice. J. Agric. Food Chem. 54 (2006) 9792-9797.
- Singleton, V. L., Orthofer, R., and Lamuela-Raventós, R. M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent. Methods Enzymol. 299 (1999) 152-178.
- Verma, B., Hucl, P.and Clubb, R. Phenolic Content and Antioxidant Propertiesof Bran in 51 Wheat Cultivars. Cereal Chem. 85 (2008) 544–549.
- Wilcox, J. K., Ash, S. L., and Catignani, G. L. Antioxidants and prevention of chronic disease. Crit. Rev. Food Sci. Nutr. 44 (2004) 275-295.
- Zielinski, H., Koslowska, H. Antioxidant activity and total phenolics in selected cereal grains and their different morphological fractions. J. Agric. Food Chem. 48 (2000) 2008-2016.