Agregación de ácidos húmicos: efecto del ph y la concentración de calcio
Los ácidos húmicos (AH) son los componentes principales de carbono orgánico en el medio ambiente acuático y en el suelo. Las partículas de AH pueden formar agregados en presencia de cationes y bajo ciertas condiciones de pH. Sin embargo no existen datos concretos acerca de la cinética de estos procesos ni del mecanismo por el cual la agregación de AH tiene lugar en medios acuosos. Los objetivos de este trabajo son: estudiar la cinética de agregación de un AH evaluando el efecto del pH y la presencia de iones Ca2+ y analizar la distribución de partículas de AH durante la reacción de agregación. Para esto se realizaron experimentos cinéticos de agregación en un sistema en “batch”, empleando una solución de AH, bajo condiciones controladas de velocidad de agitación, temperatura, pH y concentración de Ca2+. La concentración de AH en el sobrenadante se cuantificó por espectrofotometría UV-visible. Además se determinó el potencial zeta del AH bajo diversas condiciones experimentales. Los resultados obtenidos revelan que la velocidad de agregación de partículas de AH aumenta con la concentración de iones Ca2+ y con el incremento del pH. La etapa determinante de la velocidad no sería puramente electrostática, sino que la reacción de agregación ocurriría en dos pasos: una unión rápida de Ca2+ a los AH cargados negativamente y una posterior agregación de moléculas de AH unidas al Ca2+. Dicho proceso sería controlado por difusión y contribuirían fracciones de diferente composición química a la formación de agregados.
PALABRAS CLAVE: Ácidos Húmicos, Agregación, Calcio.
2. Medidas de potencial zeta (ZP)
3. Experimentos de agregación
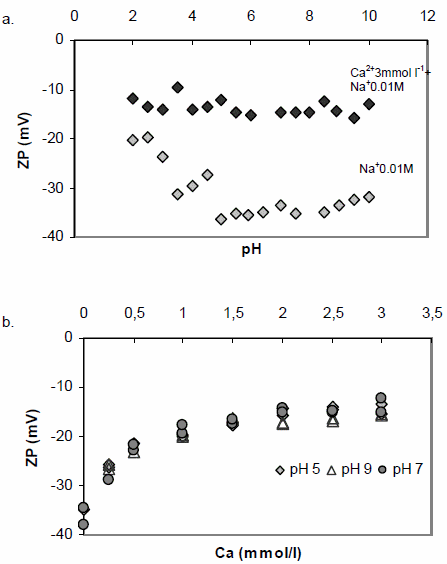
La figura 1b muestra el efecto de la concentración de Ca2+ sobre el ZP del AH a diferentes pH. El ZP decae desde -40 mV a -15 mV entre 0 y 1,5 mmol l-1 de Ca2+, y luego se mantiene aproximadamente constante a concentraciones mayores a 1,5 mmol l-1. No se observan cambios significativos al variar el pH. Los resultados indican que si bien buena parte de los grupos negativamente cargados del AH pueden ser neutralizados por Ca2+, una fracción de ellos permanece sin neutralizar aún a concentración 3 mmol l-1 de Ca2+. Esto es coincidente con los resultados de Majzik y Tombácz (2007), quienes observaron que aún con un exceso de Ca2+ de 5 veces la carga eléctrica del AH el ZP seguía siendo negativo.
Aunque no se muestran aquí, estudios cinéticos indicaron que el agregado de Ca2+ a una solución de AH varía el ZP de manera casi instantánea, lo que permite deducir que la unión de Ca2+ al AH es muy rápida.
La cinética de agregación se evaluó graficando el grado de progreso de la reacción de agregación, α, en función del tiempo. α se define como: α=cA/c0, donde cA es la concentración de AH que se encuentra formando agregados a un tiempo t y c0 es la concentración de AH al inicio de la reacción. Un valor de α=0 ó α=1 indican que 0% o 100% del AH se encuentra formando agregados. Un gráfico α vs. t es llamado curva de agregación. La figura 2a muestra las curvas de agregación del AH a pH 5, obtenidas a diferentes concentraciones de Ca2+. Excepto para el caso de Ca2+ 0,8 mmol l-1, en todos los casos se observa que la agregación aumenta a medida que aumenta el tiempo y se detiene luego de aproximadamente 20 minutos de reacción. La fracción
agregada aumenta a medida que aumenta la concentración de Ca2+, llegando a una agregación casi completa (α aproximadamente 0,9) a concentraciones de Ca2+ de 2,4 mmol l-1 o mayores.
La velocidad de agregación del AH fue cuantificada a partir de la pendiente inicial de las curvas de la figura 2a. Los resultados se indican en la figura 2b, donde se grafica la velocidad de agregación como función de la concentración de Ca2+ a diferentes pH. Se puede observar que la velocidad de agregación es fuertemente dependiente de la concentración de Ca2+.
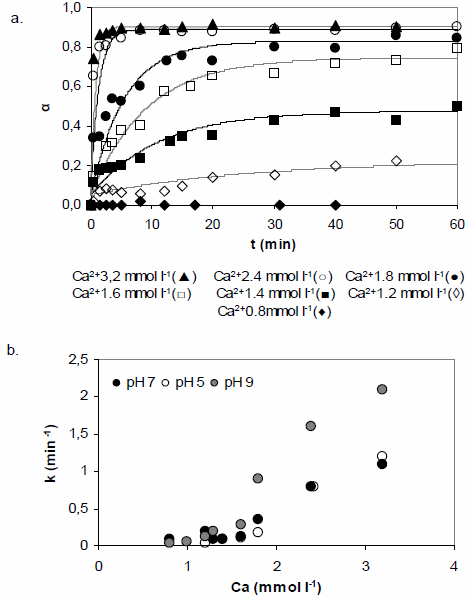
Se observa también que la velocidad de agregación es notablemente mayor a pH 9 que a pH 5 y 7, lo cual podría asociarse al diferente grado de disociación de grupos reactivos del AH en función del pH.
Los resultados mostrados hasta ahora permiten postular un mecanismo de reacción de dos pasos, como se esquematiza a continuación:

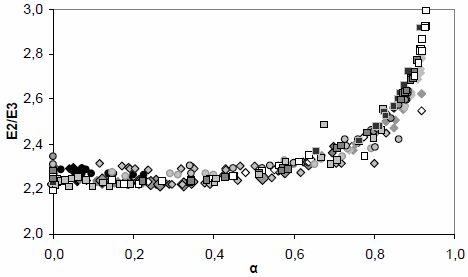
Por lo tanto, si esta relación no varía a medida que ocurre la agregación no habría fraccionamiento de moléculas y los agregados tendrían la misma composición que las especies en solución. Si por el contrario, se observa una variación en la relación E2/E3, los resultados indicarían un fraccionamiento durante la agregación. La figura 3 muestra los datos de relación E2/E3 versus α para todas las concentraciones de Ca2+ y pH estudiados. La relación E2/E3 se mantiene aproximadamente constante hasta valores de α de aproximadamente 0,6, indicando que no hay fraccionamiento en estas condiciones. A mayores valores de α se observa un marcado incremento en la relación, indicando fraccionamiento de especies de AH, quedando en solución aquellas especies menos condesadas. Este hallazgo es coincidente con los resultados de Chilom et al. (2009) quien ha demostrado que los diferentes componentes del AH tienen diferentes contribuciones a la agregación de AH en solución, pero además indica que estos componentes disminuyen gradualmente su grado de aromaticidad durante el transcurso de la reacción.
- Alvarez-Puebla, RA & JJ Garrido. 2005. Effect of pH on the aggregation of a gray humic acid in colloidal and solid states. Chemosphere. 59:659-667.
- Baalousha, M; M Motelika-Heino & P Le Coustumer. 2006. Conformation and size of humic substances: Effects of major cation concentration and type, pH, salinity and residence time. Colloids and Surfaces A: Physicochem. Eng. Aspects. 272:48-55.
- Brigante, M; G Zanini & M Avena. 2009. Effect of pH, anions and cátions on the dissolution kinetics of humic acid particles. Colloids and Surfaces A: Physicochem. Eng. Aspects. 347:180-186.
- Bronick, CJ & R Lal. 2005. Soil structure and management: a review. Geoderma. 124:3-22.
- Chilom, G; AS Bruns & JA Rice. 2009. Aggregation of humic acid in solution: contributions of different fractions. Organic Geochemistry. 40:455-460.
- Majzik, A & E Tombácz. 2007. Interaction between humic acid and montmorillonite in the presence of calcium ions II. Colloidal interactions: charge state, dispersing and/or aggregation of particles in suspension. Organic Geochemistry. 38:1330-1340.
- Swift, RS. 1996. Organic matter characterization. In: Sparks, DL (Ed.). Methods of Soil Analysis. Part 3. Chemical Methods. Pp. 1011–1069. SSSA Book Series: 5. WI, USA.
- Tipping, E. 2002. Cation Binding by Humic Substances. Cambridge University Press, Cambridge. pp422
- Tombácz, E. 1999. Colloidal propierties of humic acid and spontaneous changes of their colloidal state under variable solution conditions. Soil Science. 164(11):814-824.






