
Contenido patrocinado por:
R-Biopharm Latinoamerica S.A.
Inmunoensayo enzimático (Elisa) competitivo para el análisis cuantitativo de ochratoxina A en vinos
Publicado: 16 de agosto de 2010
Por: Javier Ruiz (r-Biopharm Latinoamérica ), Raquel Romano, Sergio Barrionuevo y María Barbeito (Instituto Nacional de Vitivinicultura), Argentina
RESUMEN:
El vino es propenso a la contaminación de ocratoxina a (OTA) por la infección de hongos en las uvas. Los métodos inmunológicos son utilizados para determinar la OTA en diversas matrices. La OTA se extrae mediante purificación en fase sólida con columnas de inmunoafinidad con anticuerpos específicos. Para la cuantificación se utilizó el método de enzimoinmunoensayo (ELISA) competitivo automatizado en muestras de vinos tintos y blancos. El límite de detección obtenido fue de 0,05 µg.L-1 y la recuperación de la OTA a partir de muestras de vino varió desde 94 hasta 98%. Este método de ELISA se contrastó con el método oficial mediante cromatograf ía líquida de alta presión (HPLC) resultando eficiente y eficaz para medir la OTA en el rango lineal de respuesta entre 0,5 µg.L-1 y 4 µg.L-1.
ABSTRACT
The wine is prone to contamination of Ochratoxin A (OTA) for fungal infection in grapes.
Immunological methods are used to determine OTA in various matrices. The OTA is extracted by solid-phase purification of immunoaffinity columns with specific antibodies. For quantification, the method of enzyme immunoassay (ELISA) in samples of compet it ive automated red and white wines. The detection limit obtained was 0.05 μg. L-1 and the recovery of OTA from wine samples ranged from 94-98%. This ELISA method was compared with the official method by high pressure liquid chromatography (HPLC) is efficient and effective to measure the OTA in the linear response range between 0.5 and 4 μg.L μg.L-1.
Introducción y objetivos
El vino es propenso a la contaminación de ocratoxina A (OTA) debido a la infección de hongos en las uvas; existiendo estudios que comprueban una alta correlación entre infecciones de Aspergilus, Botrytis, podredumbre acida, Oidio, Lobesia y las determinaciones de ácido glucónico, glicerol y OTA(1,2).
Los hongos responsables de la producción de OTA son principalmente el Penicillium verrucosum y el Aspergillus ochraceus.
Esta micotoxina en particular posee una marcada nefrotoxicidad, mostrando una hepatotoxicidad y propiedades teratogénicos, arcinogénicas e nmunosupresivas (tiene la capacidad de dañar el riñón, el hígado, el sistema inmunitario y al feto, siendo esto demost rado en animales) (3,4,5,6).
Hay un elevado riesgo para la salud humana a través de las ingestas de alimentos contaminados de origen vegetal, como así también por alimentos de origen animal. La ocratoxina A fue detectada en vinos, bebidas espirituosas, cervezas, cereales, frutas secas, café, etc. además en sangre y riñones de cerdo, en sangre humana y en leche materna. En algunos países se hallan autoras que destacan al vino como la segunda fuente de ingesta de OTA, tras los cereales.
La Comisión Europea f ijo un límite de 2.0 µg.L-1 para OTA en vinos (7,8,9). Esto es importante para considerar la validación de un método cuantitativo que cumpla con los límites de la legislación actual.
Materiales y Métodos
• Estación de Trabajo ChemWell® 2910 (9,10): con modulo de enfriamiento para reactivos y modulo de lavado de policubetas
Marca Awareness Technology
• OchraPrep®(10): columna de purificación en fase sólida por inmunoafinidad para la detección de OTA aprobado por la AOAC para ser usado en HPLC
Art. Nro. P14 Marca R-Biopharm - Rhone Ltd.
• RIDASCREEN® FAST Ochratoxin A(10): kit de enzimoinmunoensayo para el análisis cuantitativo de OTA que usa las columnas OchraPrep
Art. No. R5402 Marca R-Biopharm.
• Accesorio Pack para Columnas de Inmunoafinidad (alternativo)
Art. No. AP01 Marca R-Biopharm - Rhone Ltd.
• Sobres PBS (alternativo)
Art. No. RP202 Marca R-Biopharm.
• Muestras de vinos: contaminados naturalmente y art ificialmente, no contaminadas
• Estándar sólido de Ocratoxina A: se uso para contaminar muestras de vinos
Marca Sigma-Aldrich
Método analítico:
Consiste en dos etapas, la primera es la extracción y purificación de la micotoxina a través de las columnas de inmunoaf inidad que contienen anticuerpos monoclonales específicos para OTA (11). En el caso particular del vino se consiguió optimizar esta etapa utilizando TWEEN 80 en una proporción del 12 % con respecto a la cantidad del vino procesada, según el método aportado por su fabricante más el incremento del volumen de la solución de lavado (se usaron 20 mL de esta solución). De esta forma se eliminan todas las interferencias existentes especialmente en el vino t into (materia colorante).
Segunda etapa, es el método analítico propiamente dicho, cuyo fundamento se basa en una reacción ant ígeno-ant icuerpo. Este ensayo usa ant icuerpos de captura contra anticuerpos anti-ocratoxina A; a ellos se les agrega muestra o estándar mas conjugado ocratoxina A-enzima y anticuerpos anti-ocratoxina A produciendo que la ocratoxina A libre y el conjugado ocratoxina A-enzima compitan para unirse a sit ios específicos del ant icuerpo anti-ocratoxina A (inmunoensayo enzimático competitivo).
Al mismo tiempo, los ant icuerpos anti-ocratoxina A se unen a los anticuerpos de captura inmovilizados sobre la placa. El conjugado ocratoxina A-enzima que no se unió es removido posteriormente en un proceso de lavado. El substrato / cromógeno es agregado e incubado. El conjugado ocratoxin A enzima a través de los anticuerpos, convierte al cromógeno en una substancia azul. La adición de la solución stop provoca un cambio de color de azul a amarillo.
La medición se realiza fotométricamente a 450 nm; la absorción es inversamente proporcional a la concentración de ocratoxina A en la muestra. Para obtener los datos se elaboro la curva de calibración usando el modo de regresión lineal con 4 puntos (ejes: Y=ABS; X=ln(Conc)) más dos controles cuyos valores son 1,50 y 2,50 µg.L-1 respectivamente Fig 1. Se puede ampliar el rango de medición hasta 4,00 µg.L-1 usando el modo de cubic spline; para calcular la curva de calibración se usan 5 puntos más los dos controles Fig. 2
Nota: Los anticuerpo son elaborados por las células plasmáticas en respuesta al estímulo producido por una molécula extraña al organismo llamada antígeno, estos poseen sitios de unión especifico a los cuales se une el anticuerpo adecuado; los anticuerpos monoclonales son anticuerpos de especificidad única sintetizado por un único clon de células plasmáticas, estos anticuerpos son hoy utilizados ampliamente para reactivos de diagnostica e investigación.
Para analizar las muestras y controles se tomaron los siguientes criterios:
El vino es propenso a la contaminación de ocratoxina a (OTA) por la infección de hongos en las uvas. Los métodos inmunológicos son utilizados para determinar la OTA en diversas matrices. La OTA se extrae mediante purificación en fase sólida con columnas de inmunoafinidad con anticuerpos específicos. Para la cuantificación se utilizó el método de enzimoinmunoensayo (ELISA) competitivo automatizado en muestras de vinos tintos y blancos. El límite de detección obtenido fue de 0,05 µg.L-1 y la recuperación de la OTA a partir de muestras de vino varió desde 94 hasta 98%. Este método de ELISA se contrastó con el método oficial mediante cromatograf ía líquida de alta presión (HPLC) resultando eficiente y eficaz para medir la OTA en el rango lineal de respuesta entre 0,5 µg.L-1 y 4 µg.L-1.
ABSTRACT
The wine is prone to contamination of Ochratoxin A (OTA) for fungal infection in grapes.
Immunological methods are used to determine OTA in various matrices. The OTA is extracted by solid-phase purification of immunoaffinity columns with specific antibodies. For quantification, the method of enzyme immunoassay (ELISA) in samples of compet it ive automated red and white wines. The detection limit obtained was 0.05 μg. L-1 and the recovery of OTA from wine samples ranged from 94-98%. This ELISA method was compared with the official method by high pressure liquid chromatography (HPLC) is efficient and effective to measure the OTA in the linear response range between 0.5 and 4 μg.L μg.L-1.
Introducción y objetivos
El vino es propenso a la contaminación de ocratoxina A (OTA) debido a la infección de hongos en las uvas; existiendo estudios que comprueban una alta correlación entre infecciones de Aspergilus, Botrytis, podredumbre acida, Oidio, Lobesia y las determinaciones de ácido glucónico, glicerol y OTA(1,2).
Los hongos responsables de la producción de OTA son principalmente el Penicillium verrucosum y el Aspergillus ochraceus.
Esta micotoxina en particular posee una marcada nefrotoxicidad, mostrando una hepatotoxicidad y propiedades teratogénicos, arcinogénicas e nmunosupresivas (tiene la capacidad de dañar el riñón, el hígado, el sistema inmunitario y al feto, siendo esto demost rado en animales) (3,4,5,6).
Hay un elevado riesgo para la salud humana a través de las ingestas de alimentos contaminados de origen vegetal, como así también por alimentos de origen animal. La ocratoxina A fue detectada en vinos, bebidas espirituosas, cervezas, cereales, frutas secas, café, etc. además en sangre y riñones de cerdo, en sangre humana y en leche materna. En algunos países se hallan autoras que destacan al vino como la segunda fuente de ingesta de OTA, tras los cereales.
La Comisión Europea f ijo un límite de 2.0 µg.L-1 para OTA en vinos (7,8,9). Esto es importante para considerar la validación de un método cuantitativo que cumpla con los límites de la legislación actual.
Materiales y Métodos
• Estación de Trabajo ChemWell® 2910 (9,10): con modulo de enfriamiento para reactivos y modulo de lavado de policubetas
Marca Awareness Technology
• OchraPrep®(10): columna de purificación en fase sólida por inmunoafinidad para la detección de OTA aprobado por la AOAC para ser usado en HPLC
Art. Nro. P14 Marca R-Biopharm - Rhone Ltd.
• RIDASCREEN® FAST Ochratoxin A(10): kit de enzimoinmunoensayo para el análisis cuantitativo de OTA que usa las columnas OchraPrep
Art. No. R5402 Marca R-Biopharm.
• Accesorio Pack para Columnas de Inmunoafinidad (alternativo)
Art. No. AP01 Marca R-Biopharm - Rhone Ltd.
• Sobres PBS (alternativo)
Art. No. RP202 Marca R-Biopharm.
• Muestras de vinos: contaminados naturalmente y art ificialmente, no contaminadas
• Estándar sólido de Ocratoxina A: se uso para contaminar muestras de vinos
Marca Sigma-Aldrich
Método analítico:
Consiste en dos etapas, la primera es la extracción y purificación de la micotoxina a través de las columnas de inmunoaf inidad que contienen anticuerpos monoclonales específicos para OTA (11). En el caso particular del vino se consiguió optimizar esta etapa utilizando TWEEN 80 en una proporción del 12 % con respecto a la cantidad del vino procesada, según el método aportado por su fabricante más el incremento del volumen de la solución de lavado (se usaron 20 mL de esta solución). De esta forma se eliminan todas las interferencias existentes especialmente en el vino t into (materia colorante).
Segunda etapa, es el método analítico propiamente dicho, cuyo fundamento se basa en una reacción ant ígeno-ant icuerpo. Este ensayo usa ant icuerpos de captura contra anticuerpos anti-ocratoxina A; a ellos se les agrega muestra o estándar mas conjugado ocratoxina A-enzima y anticuerpos anti-ocratoxina A produciendo que la ocratoxina A libre y el conjugado ocratoxina A-enzima compitan para unirse a sit ios específicos del ant icuerpo anti-ocratoxina A (inmunoensayo enzimático competitivo).
Al mismo tiempo, los ant icuerpos anti-ocratoxina A se unen a los anticuerpos de captura inmovilizados sobre la placa. El conjugado ocratoxina A-enzima que no se unió es removido posteriormente en un proceso de lavado. El substrato / cromógeno es agregado e incubado. El conjugado ocratoxin A enzima a través de los anticuerpos, convierte al cromógeno en una substancia azul. La adición de la solución stop provoca un cambio de color de azul a amarillo.
La medición se realiza fotométricamente a 450 nm; la absorción es inversamente proporcional a la concentración de ocratoxina A en la muestra. Para obtener los datos se elaboro la curva de calibración usando el modo de regresión lineal con 4 puntos (ejes: Y=ABS; X=ln(Conc)) más dos controles cuyos valores son 1,50 y 2,50 µg.L-1 respectivamente Fig 1. Se puede ampliar el rango de medición hasta 4,00 µg.L-1 usando el modo de cubic spline; para calcular la curva de calibración se usan 5 puntos más los dos controles Fig. 2
Nota: Los anticuerpo son elaborados por las células plasmáticas en respuesta al estímulo producido por una molécula extraña al organismo llamada antígeno, estos poseen sitios de unión especifico a los cuales se une el anticuerpo adecuado; los anticuerpos monoclonales son anticuerpos de especificidad única sintetizado por un único clon de células plasmáticas, estos anticuerpos son hoy utilizados ampliamente para reactivos de diagnostica e investigación.
Para analizar las muestras y controles se tomaron los siguientes criterios:
• Se usaron diferentes horarios, personal, kit de OTA (cantidad 2) y distintas calibr aciones del equipo Cuadro 1.
Los datos obtenidos en primer lugar fueron corroborados con una prueba sencilla realizada en una bodega de la zona donde se utilizo el resto de unos de estos kit de OTA y el mismo estándar para contaminar la muestra; el resto de las variables son distintas (personal, equipamiento, etc.) Cuadro 2.
Resultados
Con los resultados obtenidos del análisis de estándares como control de exactitud y muestras contaminadas (naturalmente y artificialmente), se obtuvieron los siguientes datos en un período de 20 días:
• Precisión: CV% Max es del 13% (en valores bajos = 0,13 µg.L-1) y DS Max es de 0,22 µg.L-1 en valores cr íticos correspondiendo un CV% del 11%
• Exactitud: Diferencia porcentual entre el valor esperado y el obtenido es del 2% al 11%
• Normalmente el método oficial acepta el 25 - 35% en el CV
De acuerdo a los resultados del Cuadro 1 y corroborado en el Cuadro 2 se observa que la recuperación del estándar adicionado a muestras de vinos tintos y blancos varia entre el 94 al 98%. Teniendo el ensayo características principales como: rango de medición lineal entre 0,20 a 3,00 µg.L-1 con un limite de detección de 0,05 µg.L-1, una exactitud menor al 11% y su precisión menor al 13% donde las curvas de calibración poseen una correlación mayor a R2 0,998 Fig. 1.; al obtener los datos bajo la modalidad cubic spline se incrementan los % CV y DS pero siempre dentro de parámetros aceptables Fig. 2.
Los resultados en Cuadro 1 y 2 están expresados en µg.L-1
Cuadro 1. Resultado de controles y muestras
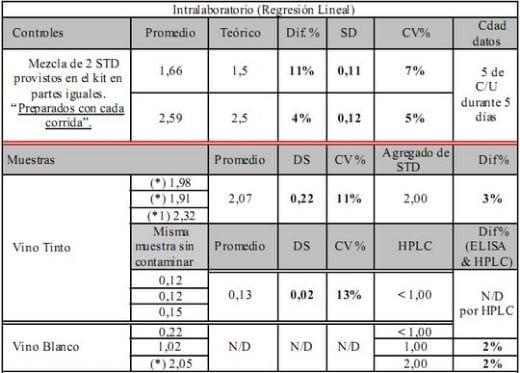
Queda pendiente la prueba de repetibilidad aunque creemos debería dar mejores resultados ya que en esta prueba no hay variaciones en las condiciones analíticas
(*) Muestra contaminada artificialmente
(*1) Posible error de dilución (1/500)
Cuadro 2. Datos obtenidos en circunstancias distintas que corroboran al estudio inicial
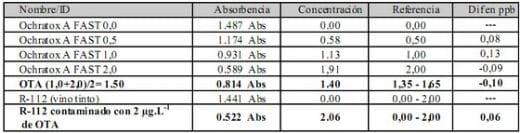
Opciones de curva de calibración según el rango de medición, %CV y DS que se requiera
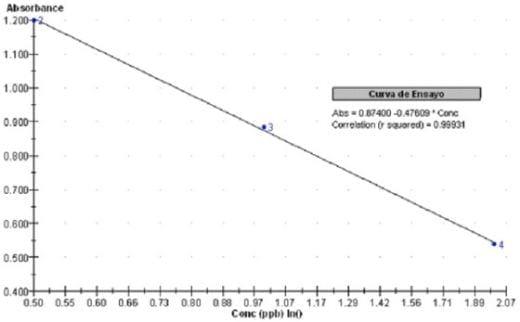
Fig. 1. Curva de calibración
R2 = 0,99931 Ecuación Lineal = Abs=0,874-0,47609*Conc.
Limite de medición bajo 0,20 µg.L-1
Limite de detección 0,05 µg.L-1
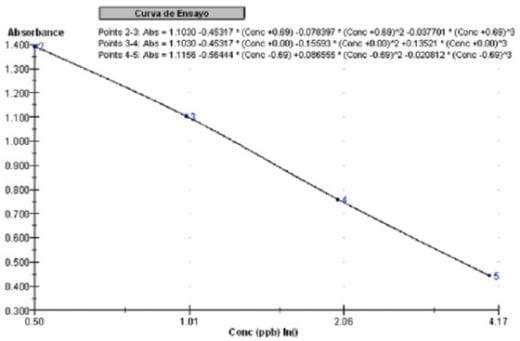
Figura 2. Curva de calibración usando cubic spline
Ctrol 1,50 = 1,63 µg.L-1 ; Ctrol 2,50 = 2,83 µg.L-1
Discusión
Los métodos ELISA (competitivos) son especialmente sensibles y específicos, lo que aseguran resultados confiables y repetitivos en el rango de medición. Con ayuda de la automatización estas ventajas se ven significativamente superadas, ya que podemos hablar de rango de medición lineal con precisión y exactitud; además otorga velocidad de respuesta al laboratorio y baja sus costos, lo que aumenta su eficacia y eficiencia.
Los datos obtenidos en primer lugar fueron corroborados con una prueba sencilla realizada en una bodega de la zona donde se utilizo el resto de unos de estos kit de OTA y el mismo estándar para contaminar la muestra; el resto de las variables son distintas (personal, equipamiento, etc.) Cuadro 2.
Resultados
Con los resultados obtenidos del análisis de estándares como control de exactitud y muestras contaminadas (naturalmente y artificialmente), se obtuvieron los siguientes datos en un período de 20 días:
• Precisión: CV% Max es del 13% (en valores bajos = 0,13 µg.L-1) y DS Max es de 0,22 µg.L-1 en valores cr íticos correspondiendo un CV% del 11%
• Exactitud: Diferencia porcentual entre el valor esperado y el obtenido es del 2% al 11%
• Normalmente el método oficial acepta el 25 - 35% en el CV
De acuerdo a los resultados del Cuadro 1 y corroborado en el Cuadro 2 se observa que la recuperación del estándar adicionado a muestras de vinos tintos y blancos varia entre el 94 al 98%. Teniendo el ensayo características principales como: rango de medición lineal entre 0,20 a 3,00 µg.L-1 con un limite de detección de 0,05 µg.L-1, una exactitud menor al 11% y su precisión menor al 13% donde las curvas de calibración poseen una correlación mayor a R2 0,998 Fig. 1.; al obtener los datos bajo la modalidad cubic spline se incrementan los % CV y DS pero siempre dentro de parámetros aceptables Fig. 2.
Los resultados en Cuadro 1 y 2 están expresados en µg.L-1
Cuadro 1. Resultado de controles y muestras

Queda pendiente la prueba de repetibilidad aunque creemos debería dar mejores resultados ya que en esta prueba no hay variaciones en las condiciones analíticas
(*) Muestra contaminada artificialmente
(*1) Posible error de dilución (1/500)
Cuadro 2. Datos obtenidos en circunstancias distintas que corroboran al estudio inicial

Opciones de curva de calibración según el rango de medición, %CV y DS que se requiera

Fig. 1. Curva de calibración
R2 = 0,99931 Ecuación Lineal = Abs=0,874-0,47609*Conc.
Limite de medición bajo 0,20 µg.L-1
Limite de detección 0,05 µg.L-1

Figura 2. Curva de calibración usando cubic spline
Ctrol 1,50 = 1,63 µg.L-1 ; Ctrol 2,50 = 2,83 µg.L-1
Discusión
Los métodos ELISA (competitivos) son especialmente sensibles y específicos, lo que aseguran resultados confiables y repetitivos en el rango de medición. Con ayuda de la automatización estas ventajas se ven significativamente superadas, ya que podemos hablar de rango de medición lineal con precisión y exactitud; además otorga velocidad de respuesta al laboratorio y baja sus costos, lo que aumenta su eficacia y eficiencia.
Conclusión
Se concluye que debido a el límite de detección obtenido de 0,05 µg.L-1 y siendo la recuperación de la OTA a partir de muestras de vino entre 94 hasta 98%, el método ELISA competitivo automatizado para el análisis de micotoxina ocratoxina A resulta un método simple, pudiendo ser practicado en cualquier laboratorio y cumple ampliamente con las exigencias de la legislación actual.
Se concluye que debido a el límite de detección obtenido de 0,05 µg.L-1 y siendo la recuperación de la OTA a partir de muestras de vino entre 94 hasta 98%, el método ELISA competitivo automatizado para el análisis de micotoxina ocratoxina A resulta un método simple, pudiendo ser practicado en cualquier laboratorio y cumple ampliamente con las exigencias de la legislación actual.
Referencias
1. Battilani, P.; Pietri, A.: «Ochratoxin A in Grapes and Wine». European J Plant Pathol 2002; 108 (8): 639-643.
2. Zimmerli, B. ; Dick, R.: «Ochr atoxin A in table wine and gr ape-juice: occurrence and risk assessment», Food Add Contamin 1996; 13: 655-658.
3. Biro, K., Solti, L., Barna-Vetro, I., Bago, G., Glavits, R., Szabo, E. and Fink-Gremmels, J.2002. Tissue distribution of ochratoxin A as determined by HPLC and ELISA and histopathological effects in chickens. J. Avian Pathol. 31, 141-8.
4. Gareis, M., et al; Z. Lebensm. Unters. Forsch. 186, 114 - 117(1988): Bestimmung von Ochratoxin A in Muttermilch Märt lbauer, E., Terplan, G.; Archiv für Lebensmittelhygiene 39, 133 - 156 (1988): Ein enzymimmunologisches Verfahren zum Nachweis von Ochratoxin A in Schweineserum
5. Bauer, J., et al 2. World Congress Foodborne Infections and Intoxications, Inst. Vet. Med. Robert von Ostertag Institut, Berlin, 907 (1986): Incidence of ochratoxin A in blood serum and kidneys of man and animals
6. Mayura, K. et al; Toxicol. 25, 175 - 185 (1982): Embryocidal, fetotoxic and teratogenic effects of ochratoxin A in rats
7. Commission Directive 98/53/EC, Laying down the sampling methods and the methods of analysis for the official control of the levels for certain contaminants in foodstuffs, Official Journal of the European Communities L201/93
8. Commission Regulation (EC 123/2005) establishing maximum limits for ochratoxin A in a variety of food products
9. COMMISSION REGULATION (EEC) No 2676/90 of 17 September 1990 determining Community methods for the analysis of wines
10. R- Biopharm Rhone Ltd West of Scotland Science Park, Unit 3.06 Kelvin Campus, Maryhill Road, Glas gow, Scot land G20 0SP
11. Krogh, P. B. et al; Acta path. mikrobiol. scand. Sect. B 85, 238 - 240 (1977): Balkan (endemic) nephropathy and foodborne ochratoxin A: Preliminary results of a survey of foodstuffs
Trabajo cientifico R-Biopharm ha presentado un Trabajo Científico en el 33° Congreso de la Viñay el Vino que se celebró en Tbilisi, la capital de Georgia. La Organización Internacional de la Viña y el Vino (O.I.V) fue la que presento este evento entre el 20-25 de Julio de 2010.
Temas relacionados:
Autores:
R-Biopharm Latinoamerica S.A.
Recomendar
Comentar
Compartir
R-Biopharm Latinoamerica S.A.
8 de noviembre de 2011
Buen día Dra. Higashi, agradezco sus amables palabras.
Respecto a sus consultas, entiendo que en principio no es necesario usar columnas de purificación aunque le recomendaría que converse con la gente de La Ensenada (por si hubiera alguna excepción) también ellos tienen nuestras ultimas bibliografías
Saludos
Javier
Recomendar
Responder
Corporación Rico - Rico Pollo
3 de noviembre de 2011
Saludos Dr. Javier Ruiz, feliciaciones por su trabajo de investigacion en el area vitivinicola, pero yo uso los kits para evaluar los granos ,maiz,torta de soya,soya inegral ,subproducto de trigo, que se usan para la elaboracion de alimento para aves y cerdos, me gustarìa saber si para cada uno de estos ingredientes ,hay que usar columnas de adsorcion , tambien si me pudiera facilitar informaciòn acerca de (bibliografia no menor del 2007 que daten acerca del efecto de las micotoxinas en dichos animales. Le agradezco su apoyo,mi proveedor es Productos Alimenticios La Ensenada en Peru.fe de errata quise decir columna de inmunoafinidad.,muchas gracias.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.

