Introducción:
En los últimos años se han realizado numerosos experimentos con diversas sustancias buscando una posible alternativa a los antimicrobianos, sustancias con una eficacia similar pero sin los problemas que hoy en día plantean el uso de antibióticos, que no generen resistencias ni residuos. Entre estas alternativas se encuentra la lisozima, una enzima descubierta por Alexander Fleming en 1922 (Fleming, 1922) cuya acción antibacteriana es realmente eficaz frente a Gram + (en menor medida frente a las negativas) y ya se usa desde hace años en la industria alimentaria.
Este trabajo pretende mostrar la utilidad de la lisozima como prebiótico a través del análisis de diferentes trabajos publicados en los últimos años. Su uso como aditivo en dietas de lechones en transición podría ayudarnos a disminuir el uso de antimicrobianos, siendo una herramienta más a tener en cuenta en esta búsqueda de alternativas, sobre todo en la prevención de enfermedades protagonistas de la etapa de transición de los lechones
Resultados y discusión:
La lisozima o muramidasa es una enzima de 14,4 kilodalton capaz de dañar las células bacterianas catalizando la hidrólisis de las uniones β-1,4 entre los residuos de N-acetilmurámico y N-acetil-D-glucosamina en un peptidoglicano. Esta enzima está presente en secreciones como la saliva, las lágrimas y el moco, en los gránulos citoplasmáticos de neutrófilos polimorfonucleares, en la clara del huevo, en el bazo y los pulmones, leucocitos, así como en plasma, leche y cartílagos.
Fue descubierta por Alexander Fleming en 1922 (Fleming, 1922), quien más tarde, en 1945, en su discurso de aceptación del Premio Nobel de Medicina por el descubrimiento de la penicilina afirmó que esta no era el primer antibiótico que descubrió, sino que el primero había sido la lisozima. La describió como un poderoso fermento antibacteriano con un efecto lítico extraordinario en algunas bacterias y que una suspensión espesa de bacterias podía eliminarse por completo en unos segundos por una fracción de gota de lágrimas humanas o clara de huevo (Imagen 1). También destacó que las bacterias que fueron más fuertemente inhibidas o lisadas por la lisozima no infectaban al hombre.
 Imagen 1: Cultivo de M. lysodeikticus en placa al que se le ha añadido lisozima en el centro, se observa el efecto lítico de la lisozima del que Fleming hablaba en su primer artículo. (Fleming, 1922)
Imagen 1: Cultivo de M. lysodeikticus en placa al que se le ha añadido lisozima en el centro, se observa el efecto lítico de la lisozima del que Fleming hablaba en su primer artículo. (Fleming, 1922) En los primeros experimentos (Fleming, 1922; Fleming & Allison, 1922) se demostró que el moco nasal contenía gran cantidad de lisozima, y más tarde, se observó que, tanto las lágrimas como el esputo, tenía una acción lítica muy potente. Asimismo se descubrieron otros tejidos que contenían lisozimas, y que había diferencias en la velocidad del proceso lítico entre los tejidos. La epidermis, la membrana de revestimiento del tracto respiratorio y especialmente los tejidos conectivos (ya sean fibrosos, grasos o cartilaginosos) contienen grandes cantidades de lisozima. En la sangre está presente en los leucocitos, en el plasma y en el suero.
Como ya dijo Fleming, la mayoría de las bacterias sensibles a la lisozima no son patogénicas, aunque, en algunos casos, la lisozima es la razón principal por la que estos organismos no lleguen a ser patogénicos. La lisozima ejerce una actividad particularmente intensa sobre los principales componentes de la pared celular de la mayoría de las bacterias Gram+, lo que las torna vulnerables a la lisis. Cataliza la hidrólisis de las uniones entre los azúcares (uniones β-1,4 entre los residuos de N-acetilmurámico y N-acetil-D-glucosamina) en el "esqueleto" de disacáridos repetitivos del peptidoglicano, esto conduce a la destrucción casi completa de la pared celular de las bacterias Gram+. El contenido celular que permanece rodeado por la membrana plasmática puede continuar indemne en ausencia de lisis (protoplasto) (Kirby, 2001)
La exposición de las bacterias Gram- a la lisozima, en general, se asocia con un grado de destrucción de la pared celular menor que el observado después de la exposición de bacterias Gram+; en las células Gram- persiste una porción de la membrana externa (Ellison & Giehl, 1991).
La lisozima de la clara de huevo ha demostrado tener actividad antibacteriana contra organismos que hacen peligrar la seguridad alimentaria (Hughey & Johnson, 1987), incluyendo Listeria monocytogenes y ciertas cepas de Clostridium botulinum.
La lisozima es muy atractiva como conservante alimentario, porque es específica para la pared bacteriana e inofensiva para los humanos, aunque nunca se ha usado como antimicrobiano en producción animal como se ha planteado en los experimentos realizados en los últimos años. Desde un punto de vista práctico, la lisozima puede administrarse en forma de granulado en dietas líquidas y sólidas, aunque no se cree que pueda resistir los procesos de fabricación del pienso, por lo que de administrarse debería hacerse mezclándola con el pienso ya fabricado.
Como ya se ha citado, la lisozima es secretada en la leche materna. Sin embargo, en el caso de la cerda su concentración en la leche de esta especie es muy baja (<0.065 µgramos/mL) por lo que no se cree que juegue un papel importante como factor de prevención de infecciones en el caso de los lechones lactantes (Oliver & Wells, 2015).
Efectos sobre el rendimiento nutricional y la morfología intestinal:
La morfología del intestino ha sido típicamente usada como una estimación de la salud intestinal de los cerdos. En el periodo de postdestete el lechón pasa de una dieta líquida muy digestible a sólida, en este momento el tracto gastrointestinal del animal es inmaduro y su microbiota no está adaptaba, y es por ello que en este periodo son más propensos a sufrir una disbiosis, produciéndose diarreas, anorexia, infecciones entéricas… Este cuadro se agrava progresivamente al tener lugar una atrofia del intestino delgado, de las vellosidades y criptas intestinales y una disminución de la absorción intestinal.
Muchos de los estudios realizados en relación a la administración de lisozima han demostrado el efecto beneficioso que produce en la morfología intestinal: muestran unas microvellosidades intestinales más largas que el grupo control y también una disminución de la profundidad de las criptas, tanto en el íleon como en el yeyuno. Estos resultados son similares a los obtenidos en los animales que fueron alimentaos con dietas con antibióticos. (May et al., 2012; Nyachoti et al., 2012)
La mejora de la morfología del intestino delgado es una estrategia de los tratamientos antibióticos para mejorar la capacidad de absorción y, por tanto, mejorar la tasa de crecimiento, aunque, en ocasiones, estos tratamientos puedan llevar a empeorar la disbiosis y agravar la situación. Sin embargo, la lisozima administrada en estos tiene el mismo efecto mejorante de la morfología lo que podría ser de gran utilidad como alternativa a otros tratamientos preventivos.
Por el contrario en algunos de estos estudios, no se observaron cambios en la morfología del íleo (Oliver & Wells, 2013) aunque sí hubo una gran mejoría en el yeyuno: la altura de sus microvellosidades era un 28% mejor que el control (35% en la dieta de antibióticos) y la profundidad de las criptas disminuyó en un 23% respecto a la dieta control (27% en la de antibióticos). (Figura 1)
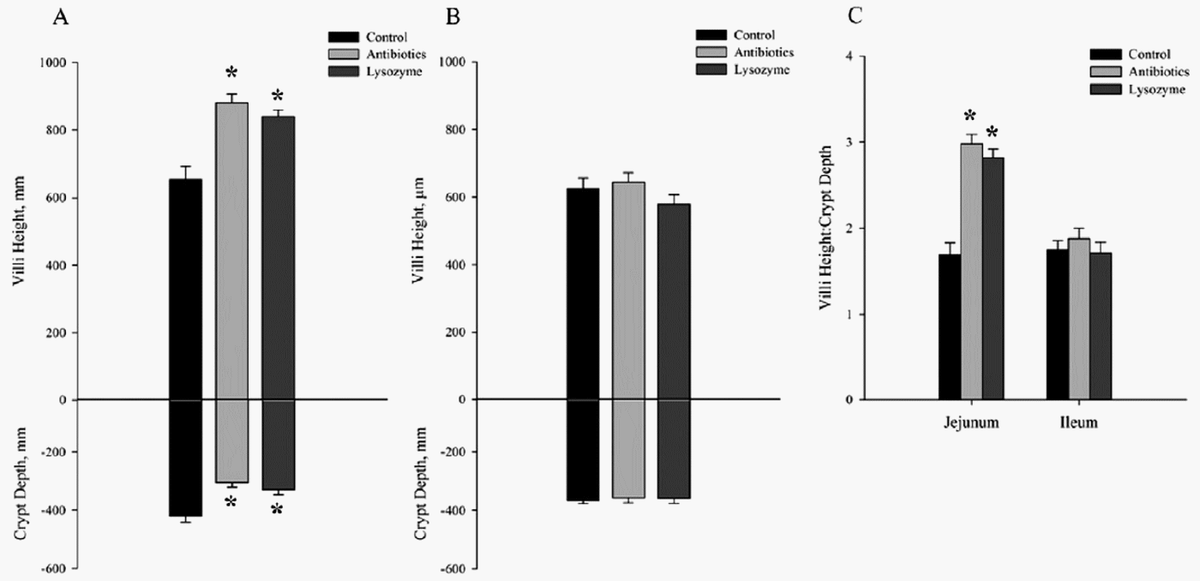 Figura 1: Efecto de los antibióticos o la lisozima en dietas de lechones sobre la altura de las microvellosidades y la profundidad de las criptas en el yeyuno (A) y el íleo (B). También se muestra el radio microvellosidad-criptas (C). (Oliver & Wells, 2013)
Figura 1: Efecto de los antibióticos o la lisozima en dietas de lechones sobre la altura de las microvellosidades y la profundidad de las criptas en el yeyuno (A) y el íleo (B). También se muestra el radio microvellosidad-criptas (C). (Oliver & Wells, 2013)Así como en el anterior estudio sólo se observaron cambios en la morfología del yeyuno, en otro estudio (May et al., 2012) en el que se administró dieta líquida suplementada con antibiótico, lisozima o control sí que se detectaron cambios tanto en íleon como en yeyuno, fundamentalmente un aumento de la altura de las microvellosidades y de la profundidad de las criptas tanto en el íleon como en el yeyuno en ambos grupos suplementados con lisozima y antibióticos, comparados con el grupo control (Figura 2). Esto puede deberse principalmente a la forma física de la dieta, ya que la forma líquida es más digestible y el mayor desgaste de la morfología intestinal se produce cuando se pasa de una dieta líquida a una sólida.
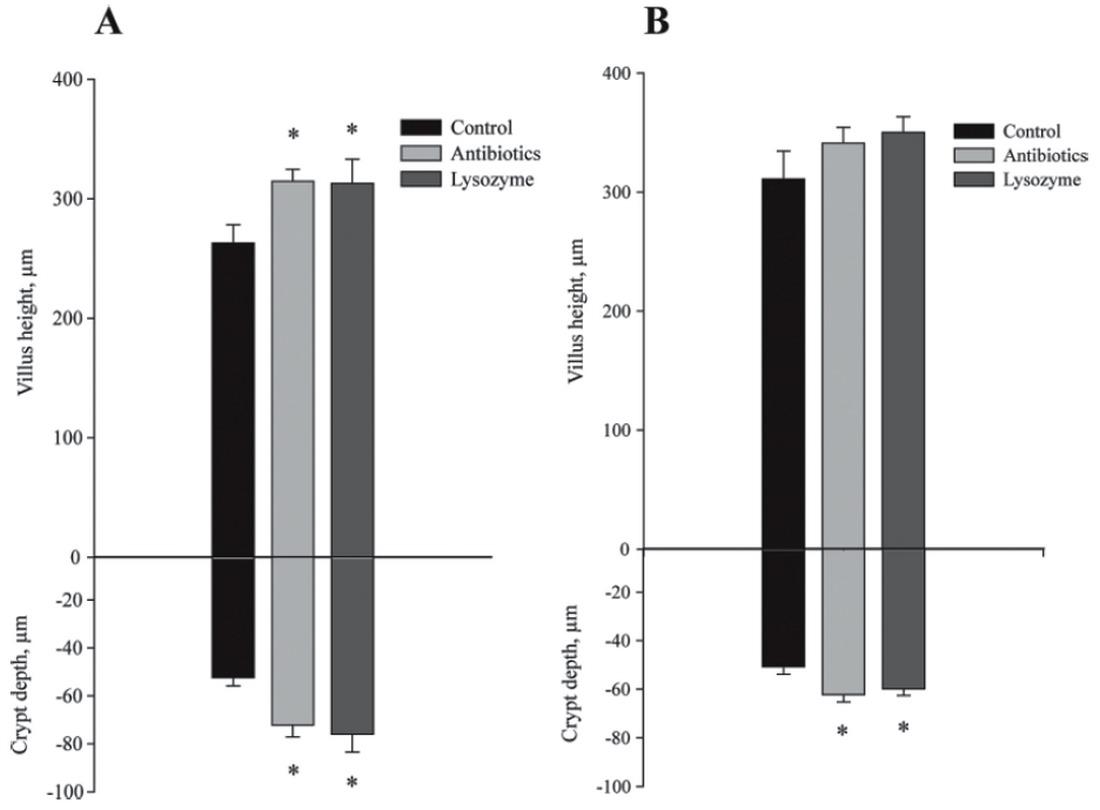 Figura 2: Efecto de las dietas con antibióticos o lisozima sobre la altura de las vellosidades y la profundidad de las criptas en íleo (A) y yeyuno (B). (May et al., 2012)
Figura 2: Efecto de las dietas con antibióticos o lisozima sobre la altura de las vellosidades y la profundidad de las criptas en íleo (A) y yeyuno (B). (May et al., 2012) En cuanto a la mejora del crecimiento debido a la adición de lisozima en la dieta es un hecho que ya quedó demostrado (Oliver & Wells, 2013), que obtuvieron resultados similares a los de la dieta suplementada con antibióticos: se mejoró el índice de conversión en un 7.3% en dietas con lisozima, la eficiencia alimentaria mejoró un 8.3% para ambos grupos, antibiótico y lisozima, respecto al grupo control y tras los 28 días que duró el experimento el ritmo de crecimiento fue mayor en el grupo lisozima y en el de antibióticos.
Efectos sobre la respuesta inmune ante una infección y en la prevención de patologías:
La mayoría de las bacterias sensibles a las lisozimas no son patogénicas (Fleming, 1922; Salton, 1957), aunque en algunos casos, la lisozima es la razón principal por la que estos organismos no lleguen a ser patogénicos. Esta enzima ejerce una actividad particularmente intensa sobre los principales componentes de la pared celular de las bacterias Gram+, lo que las torna vulnerables a la lisis (Fleming, 1922; Kirby, 2001). Cataliza la hidrólisis de las uniones entre los azúcares (uniones β-1,4 entre los residuos de N-acetilmurámico y N-acetil-D-glucosamina) en el "esqueleto" de disacáridos repetitivos del peptidoglicano, lo que conduce a la destrucción casi completa de la pared celular de las bacterias Gram+. Por el contrario, las bacterias Gram- son resistentes a la lisozima, aunque ésta ha demostrado ser efectiva ante este tipo de bacterias cuando actúa junto a lactoferrina (Ellison & Giehl, 1991)
La lisozima ha demostrado en varios estudios ser eficaz: se ha probado que es efectiva frente a varios patógenos, entre los que se incluye E. coli (Ellison & Giehl, 1991). Se realizó un estudio (Nyachoti et al., 2012) para probar que la lisozima suplementada en el agua de bebida de los lechones era un método de prevención efectivo contra la proliferación intestinal de ETEC en lechones cuando éstos consumían una dieta libre de antibióticos y antes de ser infectados intencionalmente con esta bacteria. Se quería probar que su efecto de prevención era parecido al de los lechones en cuya dieta se había incluido antibióticos.
Los resultados indicaron que la lisozima a dosis más bajas prevenía la adherencia de la bacteria a la mucosa intestinal minimizando así el daño asociado, lo que apoya los resultados obtenidos sobre morfología intestinal (Tabla 1). También se determinó la concentración sérica de TNF-α e IL-6 para comprobar si la administración de lisozima mitigaba la respuesta inmunológica asociada a una infección por ETEC, al observarse que la inflamación producida era menor en aquellos individuos que había consumido la enzima en el agua de bebida.
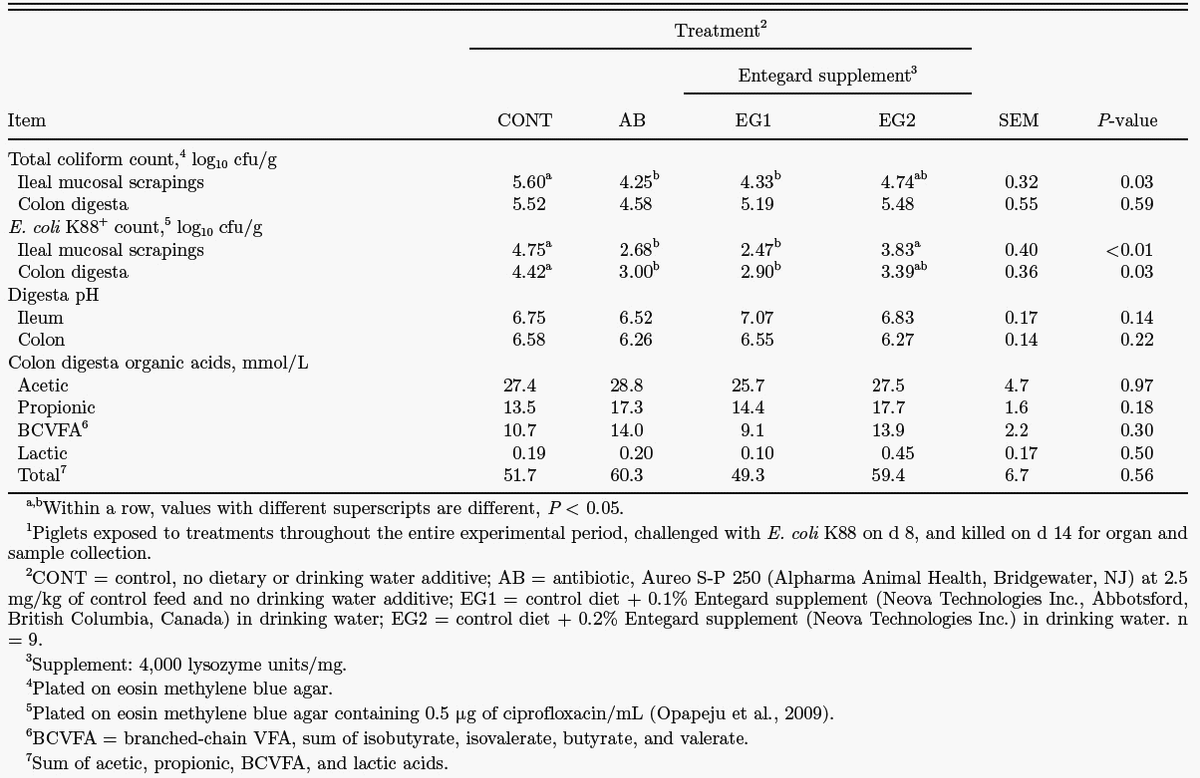 Tabla 1: Efecto de la suplementación con antibióticos y lisozima sobre la actividad microbiana gastrointestinal en lechones infectados con E. coli K88+1. (Nyachoti et al., 2012)
Tabla 1: Efecto de la suplementación con antibióticos y lisozima sobre la actividad microbiana gastrointestinal en lechones infectados con E. coli K88+1. (Nyachoti et al., 2012)Todo ello confirma que la lisozima es capaz de minimizar la infección por
ETEC, así como sus consecuencias sobre el rendimiento de los lechones y la morfología intestinal.
En un estudio reciente (Huang et al., 2018) se probó que la lisozima protegía a lechones neonatos contra ETEC, tanto a los que se infectaba intencionadamente como a los que cohabitaban con ellos, aunque en este estudio se usaron cerdas transgénicas que secretaban lisozima humana en la leche, lo que tiene muchas limitaciones en la práctica. Los resultados obtenidos fueron muy positivos: se redujo la severidad y la duración de la diarrea tanto en los lechones infectados inicialmente como en los que convivían con ellos y se observó un enriquecimiento de probióticos en el intestino de los lechones asociado a este consumo de lisozima. Al igual que en el anterior estudio, también se observó una concentración sérica menor de IL-6 y TNF-alfa los días posteriores a la infección, indicando una respuesta inflamatoria menor frente a la infección en ambos grupos.
Ambos estudios anteriormente citados, prueban de manera convincente los efectos positivos del uso de la lisozima como medida preventiva frente a una infección aguda por ETEC, pero no aclaran su papel potencial frente a una infección de carácter subclínico.
En otro experimento (Oliver et al., 2014) se colocaron a los lechones en dos enfermerías separadas: una de ellas había sido limpiada y desinfectada mientras que la otra se había dejado sin limpiar tras su vaciado. En cada enfermería había tres lotes de igual número de lechones con una dieta control, con una dieta control y antibióticos y con la misma dieta control y lisozima. Cuando los lechones sufren una patología subclínica la eficiencia nutricional disminuye ya que se usan los nutrientes para defenderse ante la agresión y se frena o enlentece el crecimiento. En este experimento se observó que tanto los lechones que consumieron lisozima como los del grupo de antibiótico mejoraron su índice de crecimiento, tanto en el ambiente sucio como en el limpio, y también se disminuyó la severidad de la respuesta inmune.
En un estudio posterior (Wells et al., 2015) diseñado de manera similar al anterior, primero se determinó si los lotes eran positivos o no a determinados patógenos que frecuentemente proliferan en ambientes sucios (por ejemplo, Campylobacter) y luego se observó la reacción que tenían ante los tres diferentes tratamientos administrados. Se observó que tras 28 días, en los lotes tratados con lisozima había un 50% menos animales positivos a Campylobacter spp. respecto a los lotes tratados con antibióticos y control; incluso en estos se observó que a lo largo del experimento la prevalencia de Campylobacter aumentaba de manera significativa. En el caso del lote tratado con antibióticos (clortetraciclina y tiamulina) se piensa que se obtuvieron estos resultados debido a que Campylobacter podría haber desarrollado una cierta resistencia a estas sustancias. También hay otro estudio (May et al., 2012) en el que se administró lisozima granulada en una dieta líquida a lechones de 10 días y se observó si se reducía la diseminación de Campylobacter. Tras dos semanas, en el lote control el 27% de los animales diseminaba Campylobacter, una cifra que se vio muy disminuida en el lote que consumía lisozima (8%) y antibiótico (5%).
Aunque estos estudios demuestran que Campylobacter podría verse afectado en dietas suplementadas con lisozima de manera similar que en el caso de usar antibióticos, se debe destacar que Campylobacter es un Gram- por lo que no cabe esperar que se vea afectado por la lisozima ya que es resistente a su acción (Hughey & Johnson, 1987). Lo más probable es que los resultados observados se deban a cambios en la morfología intestinal y en la microbiota, lo que indirectamente influye en la colonización y diseminación de la bacteria. (May et al., 2012)
Conclusiones:
Actualmente, el sector porcino, al igual que otros sectores de la producción animal, se encuentra bajo presión para reducir o eliminar significativamente el uso de antibióticos debido a la preocupación sobre el desarrollo de resistencias, tanto por parte de los expertos como de la sociedad.
La búsqueda de posibles alternativas es esencial y permitiría mantener la salud y el bienestar animal así como las ventajas económicas que ofrece el uso de antibióticos, pero sin los inconvenientes derivados del mismo. La lisozima es un antimicrobiano natural ya usado en otras facetas de la industria alimentaria, reduce el potencial de diseminación de patógenos y mejora la tasa de crecimiento y la morfología intestinal.
Su posible uso como aditivo en dietas de lechones podría ser de gran utilidad, si bien no sustituiría del todo a los antibióticos, ya que su efecto, aunque similar, no es equiparable. Se espera que en un futuro se realicen más estudios para esclarecer su alcance como herramienta de prevención de patologías gastrointestinales de la etapa de transición de los lechones, que analicen sus efectos tanto directos como indirectos y el efecto dosis-respuesta de su administración.









.jpg&w=3840&q=75)