INTRODUCCIÓN
La inseminación artificial (IA) es ampliamente utilizada por los productores porcinos en todo el mundo, jugando un papel fundamental en la mejora de la producción mundial de cerdos (Sus scrofa domestica). Alrededor de 99% de las IAs en cerdos se realiza con semen refrigeradoentre 15 y 18 °C,que es almacenado por pocos días (d) [7, 25], colocando 3x109 espermatozoides en el cervix dos o tres veces durante el estro, con resultados de fertilidad iguales o superiores a los de apareamiento natural [18]. Bajo este escenario, la producción porcina actual se traduce en empresas altamente competitivas, por lo cual se ven obligadas a incorporar métodos de cría de una mayor eficiencia y rentabilidad, por lo que la productividad aumenta junto con la reducción de costos. En este contexto, se buscan técnicas reproductivas que permitan disminuir el número de espermatozoides requeridos por dosis, por cerda y por cubrición efectiva, sin comprometer la población de espermatozoides competentes que alcanzan el oviducto en el momento de la ovulación, ya que en consecuencia se podría reducir los resultados de tasas de parto y/o tamaño de la camada [18].
En la década de los 70’s se produjo por primera vez con éxito la IA con semen criopreservado (SC) de cerdos, inseminando quirúrgicamente en el oviducto mediante laparotomía (Polgey col., 1970; citado por Hernández y col, 2006 [12]. No obstante,se estima que actualmente se realizan alrededor de 19 millones de inseminaciones artificiales en el mundo, de las cuales el SC participa en menos de 1% [7, 13]. En este orden de ideas, el semen porcino difiere en varios aspectos al compararlo con el de otros animales domésticos, por ejemplo, el verraco produce gran volumen de semen (100-500 mL) y es muy sensible al estrés por frío, siendo la viabilidad de los espermatozoides afectada drásticamente cuando se exponen a temperaturas inferiores a 15°C [11]. Sin embargo, la criopreservación de semen de verraco es considerada útil para la conservación y mejora de los recursos genéticos por largos periodos de tiempo, así como facilitar el transporte de material genético entre países. Además, el SC se utiliza también asociado a otras tecnologías reproductivas, tales como la fertilización in vitro, transferencia de embriones y sexaje de semen [10]. Si bien lo anterior es cierto, también y desafortunadamente, el avance de la criopreservación efectiva de semen porcino es lenta, en parte debido a que el productor de cerdos está muy satisfecho con las tasas de fertilidad y prolificidad del semen refrigerado, siendo estas características las que siguen siendo los principales problemas cuando se utiliza semen criopreservado (SC) de verraco [8]. De tal manera, en condiciones de campo se obtiene todavía baja fertilidad, incluso utilizando SC de verraco con un número de espermatozoides potencialmente aptos para lograr la fecundación y con una movilidad aceptable [13].
En general, la baja fertilidad reportada en la literatura científica del SC de verraco es posiblemente debido a que no se han podido diseñar protocolos de criopreservación que garanticen una fertilidad que supere el 30%, además la prolificidad disminuye 2 a 3 lechones/camada [3, 5]. En referencia a estos hechos, se plantean factores que se asocian a este fallo crítico, esto incluye espermatozoides porcinos con membrana plasmática altamente sensible al cambio de temperatura durante el enfriamiento, congelación y descongelación [26]. De aquí deriva el hecho de que el SC es escasamente utilizado por la industria porcina, siendo su único uso transferir material genético valioso [23]. Sin embargo, grandes esfuerzos se plantea la comunidad científica en aumentar los niveles de utilización comercial de esta biotecnología, con mejora significativa de fertilidad y prolificidad en los rebaños porcinos.
La IA post cervical (IAPC) no se aplica generalmente a cerdas nuliparas debido a que es dificultoso la introducción transcervical de la sonda, no obstante, realizando una buena detección de celo y practicando la IA a cerdas que superen los 140 kg y que al mismo tiempo hayan expresado al menos tres celos previos (experiencias no publicadas) se consigue introducir la sonda hasta el cuerpo del útero sin gran dificultad. Es también un hecho que la cerda de reemplazo expresa intervalos de expresión de celo más cortos que la cerda multípara, lo cual sugiere una predicción más precisa del tiempo de ovulación y por ende se podría alcanzar una mayor tasa de concepción al inseminar con SC. En tal sentido, el presente estudio planteó determinar la tasa de concepción (TC), el número total de lechones nacidos/camada (LNT), el número de lechones nacidos vivos/camada (LNV) en 20 cerdas nulíparas después de aplicar IAPC con SC utilizando dos intervalos entre las inseminaciones (ITEI) en función de la hora de expresión de celo de la cerda (mañana/tarde).
MATERIALES Y MÉTODOS
El experimento se realizó en un sistema de producción de cerdos ubicado en el municipio San Francisco del estado Zulia, Venezuela; en una zona caracterizada agro-ecológicamente como bosque seco tropical. Se utilizaron 20 cerdas nulíparas de raza Duroc alimentadas apropiadamente durante sus fases de crecimiento, desarrollo y reproducción, además de estar sujetas a un programa sanitario que garantizó su desempeño reproductivo óptimo. Las cerdas seleccionadas fueron sometidas estrictamente a un programa de bioestimulacion a partir de los 90 a 100 kg de peso vivo, el cual era realizado 2 veces al día por un operador entrenado. Este proceso era realizado en corrales con capacidad para 15 cerdas, permaneciendo en estimulación hasta alcanzar su capacidad de reproducirse eficientemente, tiempo que generalmente no superaba las 8 semanas (sem) de ocupación del área. Una vez que las cerdas expresaran como mínimo dos celos y que tuviesenla edad y peso promedio al servicio igual o superior a los 230 d y 140 Kg, fueron seleccionadas y trasladadas (con 15 d de antelación al próximo estro) al área de gestación, donde las cerdas eran mantenidas en jaulas individuales. La detección del estro se realizó visualizando la expresión de celo mediante su inmovilización al aplicar presión dorsal en presencia de un verraco recelador.
El protocolo de IA comienza una vez la hembra haya expresado el celo, siendo las cerdas inseminadas dos veces con SC a intervalos variables de 8 horas (h) (8:00 am- 16:00 pm) y 16 h (16:00 pm- 8:00 am) en función de la hora de detección del celo. Esta clasificación se realizó debido a que la cerda nulípara se insemina una vez haya expresado celo, por lo cual, si la expresión del estro ocurría en h de la tarde había que esperar obligatoriamente 16 h para la segunda inseminación, debido a la carencia de personal que pudiera inseminar en horario nocturno, en cambio si la expresión de celo ocurría en la mañana se podría aplicar con toda seguridad el protocolo sugerido de 8 h. Este hecho “natural” propició el agrupamiento de las cerdas en dos grupos con ITEI desbalanceados.
El servicio se realizaba mediante la IAPC de 10 pajuelas de 0,5 mL con 600 x 106 espermatozoides/pajuela, distribuidas en dos IA, la primera dosis estaba constituida por 6 pajuelas y la segunda dosis por las 4 pajuelas restantes.
El SC provenía de dos verracos Pietrain que prestaban servicio en un Centro de Inseminación Porcina ubicado en Bélgica. Para la criopreservación de dosis seminales se descendió la temperatura del semen a 17o C y se centrifugó, eliminando el sobrenadante. Se le añadió el medio de dilución LEY (a base de yema de huevo, lactosa y antibióticos) y se enfrió a 5o C (0,1o C/min), adicionando entonces el diluyente de congelación LEYGO (LEY con 9% de glicerol y 1,5% de EquexStem®). El semen se envasó y se congeló en vapores de nitrógeno y luego se sumergió en nitrógeno líquido [21].
Una vez el SC en Venezuela y previo a la IA, se valoró la calidad de varias pajuelas por cada verraco para determinar la vitalidad espermática (55 a 62%) realizando un extendido con la tinción Eosina-nigrosina y observando en un microscopio óptico (Globe®, LEM 1600, Alemania) con objetivo de inmersión y la motilidad total (35 a 45%) y progresiva (15-20%) mediante el objetivo de 40X del mismo microscopio. Los resultados obtenidos en la valoración del SC se consideraron aceptables según el estándar internacional y se procedió a su utilización.
En la granja, se descongelaron las pajuelas (20 s a 37 °C) en un baño de María (Modelo BAE-6/ # 20234, Raypa® Barcelona, España) para posteriormente ser reconstituidas en una dosis convencional con 40 mL de un diluyente de refrigeración de corta duración (BTS, Kubus®). La dosis fue depositada en el cuerpo del útero mediante un catéter de IAPC (Minitub®), diseñado para tal fin. Semanas más tarde, entre el día 18 y 24 d post IA se confirmó o no la gestación mediante el “test de no retorno” y luego se reconfirmó entre el día 38 y 45 post IA con el mismo método.
Una vez obtenidos todos los datos se realizó un análisis estadístico descriptivo, obteniendo un valor medio para la TC absoluta y en función del ITEI y media ± desviación estándar para los parámetros que cuantifican la prolificidad (LNT/ LNV).
RESULTADOS Y DISCUSIÓN
De las 20 cerdas inseminadas, 16 quedaron gestantes (80%), 15 fueron inseminadas con el protocolo am-pm (8 h) y 5 con el protocolo pm-am (16 h). Tal como se esperaba, la TC mediante el protocolo de ITEI de 16 h fue el menos eficiente y correspondió al 40% (2/5), mientras que el ITEI de 8 h presentó una TC del 93,33% (14/15) (FIG. 1). Los resultados de LNT y LNV por camada correspondieron a 5,75 ± 2,33 y 4,13 ± 2,08, respectivamente, destacando que la mayoría de los lechones presentaron alto peso corporal al nacimiento propiciando partos dificultosos.
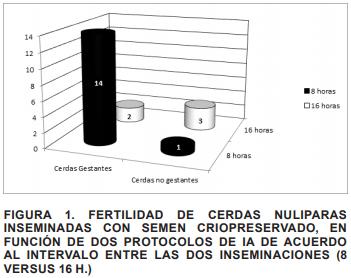
Las cifras más recientes indican que la tasa de parición tras la IA con SC oscila entre el 75-80% [7]. Actualmente, el consenso es que la IA utilizando SC no debe realizarse utilizando la técnica convencional (cervical), sino a través de IAPC [4, 16, 19, 27], tal como fue utilizada en este experimento obteniendo resultados muy favorables, o mediante la técnica intrauterina profunda [4, 16, 19, 27]. También es inobjetable que estos rendimientos (comercialmente competitivos) son alcanzados cuando se realizan dos IA en vez de una [20], enfatizando que el ITEI no debe superar las 8 h, aseveración hecha en función de los resultados obtenidos en este ensayo.
Otro aspecto que debe tenerse en cuenta es el ITEI y la ovulación, ya que hay una ventana de fertilidad más estrecha cuando se utiliza semen porcino congelado-descongelado [28]. Abad y col. [1] no observaron diferencias al realizar la IA entre 2 o 12 h antes de momento establecido para la ovulación. Spencer y col. [20] demostraron que un intervalo más largo entre la IA y la ovulación reduce las tasas de preñez, número de fetos normales y la supervivencia embrionaria.
No obstante, es importante destacar que son muy escasos los datos sobre resultados de fertilidad realizando inseminación peri y post-ovulatoria con SC en cerdas jóvenes con ovulación espontánea. En este sentido, el uso de SC en primerizas sincronizadas ha reportado TP de 60-70% [17], valores ligeramente inferiores a datos reportados en las cerdas cuando se utiliza semen fresco o refrigerado. En una investigación que incluyó la ecografía transcutánea cada 4 h durante el estro como una herramienta para el diagnóstico exacto de la ovulación, inseminaron con SC a un grupo de cerdas jóvenes con un intervalo de tiempo de 4 a 0 h antes de la ovulación y obtuvieron un TC de 88,1%, sin embargo, ésta disminuyó significativamente cuando las cerdas fueron inseminadas con SC más de 4 h antes o 0 a 4 h después de la detección de la ovulación [24]. Por consiguiente, en el presente estudio, la implementación de la técnica IAPC con SC y un ITEI de 8 h en cerdas nulíparas (no siendo una técnica habitual en cerdas jóvenes), arroja resultados de TC comparables a otros reportes para semen refrigerado y semen congelado en cerdas jóvenes con ovulación espontanea [24] y con protocolos de sincronización de celo en cerdas multíparas [15]. En referencia a este estudio y a los resultados favorables obtenidos en lo referente a TC, bien hace pensar que estos valores, consecuencia del ITEI de 8 h propició una renovación de la población espermática más rápida con menos daños subletales, más cercano al momento de la ovulación y con menos recorrido hacia el depósito oviductal.
En lo correspondiente a la baja prolificidad reportada en este estudio, son diversas las referencias bibliográficas que en la actualidad apuntalan a un detrimento de la prolificidad en cerdas multíparas inseminadas con SC, estas referencias mencionan pérdidas de dos a tres lechones en relación a semen refrigerado [3, 5]. A partir de datos disponibles pero aún más escasos de prolificidad en cerdas jóvenes, investigadores como Martin y col. [15], al utilizar un protocolo hormonal de sincronización de celo en cerdas jóvenes obtuvieron 74% de TC y 12,8 LNV por camada para IA con SC, lo cual motivó en su tiempo a seguir investigando sobre este tópico, sin embargo, cuando se aplicaba comercialmente y sin el control estricto de los diseños experimentales requeridos por los ensayos, los resultados no alcanzan los valores estándar requeridos para propiciar su uso comercial. Es importante destacar, el hecho inédito de combinar la técnica de IAPC utilizando SC en cerdas nulíparas sexualmente aptas (cérvix y útero bien desarrollado), sin protocolos hormonales que pudieran incidir directamente sobre la fisiología ovárica de las cerdas como unidad experimental (UP).
Destaca el hecho que la prolificidad (LNT/LNV) obtenida en este estudio con SC en cerdas nulíparas con ovulación espontanea fue considerablemente afectado, puntualizando también que la mayoría de los lechones presentaron alto peso corporal al nacimiento (>2 kg) propiciando partos dificultosos, sin embargo, a manera de justificar estos resultados es importante destacar que las cerdas Duroc primerizas no se consideranaltamente prolíficas, ya que su productividad al parto no supera los 8,5 lechones por camada [29]. En otro estudio donde se experimentó con cerdas nuliparas Duroc que fueron estimuladas hormonalmente e inseminadas con semen refrigerado para determinar su rendimiento lácteo al primer parto, obtuvieron 10 LNT y 9,05 LNV por camada [6]. A sabiendas que los experimentos referenciados donde obtuvieron valores cercanos a los 10 LNT por camada con el uso de SC corresponden a cerdas de líneas genéticas de mayor prolificidad y que en el presente caso, la UP correspondió a cerdas menos prolíficas, se puede afirmar que en este ensayo hubo una disminución de 3 lechones por camada producto de la IA con SC, por lo cual se podría considerar un valor de 5 a 6 lechones por camada como un valor justo y esperado al inseminar con SC cerdas jóvenes Duroc.
Valorando otros aspectos inherentes a la calidad seminal utilizada en este experimento, es importante señalar que la motilidad individual progresiva estaba afectada de manera importante en el SC utilizado, con valores que no superaron en el mejor de los casos el 20%, sin embargo, tomando en cuenta los trabajos realizados en SC por otros investigadores donde se resta importancia a este parámetro, se decidió realizar el experimento. En este sentido, McNamara y Knox [17] valoraron la motilidad espermática de semen porcino congelado-descongelado y lo relacionaron con la TC asociada al momento de la ovulación (24 y 36 h después del inicio del estro) refiriendo que distintos patrones de motilidad espermática no afectaron la tasa de preñez y el tamaño de la camada, sin embargo, si se observó una reducción en el número de fetos concebidos cuando la motilidad estaba comprometida (baja). Yaste [28] expone que estos resultados son muy interesantes porque indican que en IA múltiples, el semen de diferentes calidades podría ser utilizado para ayudar a mejorar la TC y aumentar tamaño de la camada.
Uno de los principales desafíos en el ámbito de la reproducción porcina es el desarrollo de técnicas de IA adecuadas con SC que superen el bajo porcentaje de fertilidad en comparación con semen refrigerado, tanto en términos de TC y con respecto al tamaño de la camada [2, 9]. En este sentido, los adelantos científicos de los últimos años han dado como frutos el aumento o mejora de la posibilidad de que los espermatozoides puedan fecundar ovocitos una vez descongelados y colocados a través de IA en el tracto reproductivo de la cerda. Es de hacer notar que los resultados de fertilidad reportados en este estudio corroboran lo señalado por otros investigadores, de que esta técnica bien puede alcanzar TC similar a las obtenidas bajo implementación de IA con semen refrigerado [4, 7, 14, 18]. Adicionalmente, es importante destacar que los datos obtenidos resultan de una mejora de la calidad espermática post-descongelación asociada en la actualidad a la identificación de diferencias individuales en la criopreservación espermática, que parecen tener origen genético [22], lo que en los últimos años se ha difundido como verracos buenos y malos congeladores [4].
CONCLUSIÓN
Este trabajo confirma que se puede aplicar efectivamente la IAPC en cerdas nulíparas y obtener buenas TC con el uso de SC, sin embargo, el tamaño de la camada (LNT/LNV) se afecta considerablemente, disminuyendo 3 lechones por camada, por lo cual se recomienda la utilización de SC, solo con fines genéticos
AGRADECIMIENTO
Al Consejo de Desarrollo Científico y Humanístico de la Universidad del Zulia (CONDES-LUZ, proyecto CC-0635-13) por registrar esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
[1] ABAD, M.; GARCIA, J.C.; SPRECHER, D.J.; CASSAR, G.; FRIENDSHIP, R.M.; BUHR, M.M.; KIRKWOOD, R.N. Effect of insemination-ovulation interval and addition of seminal plasma on sow fertility to insemination of cryopreserved sperm. Reprod. Domest. Anim. 42: 418-422. 2007.
[2] BATHGATE, R. Functional integrity of sex-sorted, frozen–thawed boar sperm and its potential for artificial insemination. Theriogenol. 70 (8): 1234-1241.2008.
[3] BOLARÍN, A.; ROCA, J.; RODRÍGUEZ-MARTINEZ, H.; HERNÁNDEZ, M.; VÁZQUEZ, J.; MARTINEZ, E. Dissimilarities in sows’ovarian status at the insemination time could explain differences in fertility between farms when frozen–thawed semen is used. Theriogenol. 65 (3): 669-680. 2006.
[4] CASAS, I.;SANCHO, S.; BRIZ, M.; PINART, E.; BUSSALLEU, E.; YESTE, M.; BONET, S. Fertility after postcervical artificial insemination with cryopreserved sperm from boar ejaculates of good and poor freezability. Anim. Reprod. Sci. 118: 69-76. 2010.
[5] CÓRDOVA, A.; PÉREZ, J.; MARTÍN, R.S. Temperatura de descongelación del semen de verraco: capacidad fecundante in vitrode los espermatozoides congelados en pajillas de 5 mL. Visión Técnica. 4 (5): 32-35. 2000.
[6] DAZA, A.; RIOPÉREZ, J.; OVEJERO, I. Lactation performance of Duroc gilts under the single farrowing production system. Span. J. Agric. Res. 3(3): 281-286. 2005.
[7] DIDION, B.; BRAUN, G.; DUGGAN, M. Field fertility of frozen boar semen: A retrospective report comprising over 2600 AI services spanning a four year period. Anim. Reprod. Sci. 137:189-196. 2013.
[8] ERIKSSON, B.M.; PETERSSON, H.; RODRIGUEZMARTINEZ, H. Field fertility with exported boar semen frozen in the new flatpack container. Theriogenol. 58: 1065-1079.2002.
[9] FRASER, L.; STRZEZEK, R.; STRZEZEK, J. Fertilizing capacity of boar semen frozen in an extender supplemented with ostrich egg yolk lipoprotein fractions - a pilot study. Polish J. Vet. Sci. 10 (3): 131-135.2007.
[10] GERRITS, R.; LUNNEY, J.; JOHNSON, L.; PURSEL, V.; KRAELING, R.; ROHRER, G.; DOBRINSKY, J.R. Perspectives for artificial insemination and genomics to improve global swine populations. Theriogenol. 63:283- 299. 2005.
[11] GILMORE, J.; JUNYING, D.; JUN, T.; PETER, A.; CRISTER, J. Osmotic properties of boar spermatozoa and their relevance to cryopreservation. J. Reprod. Fertil. 107:87- 95. 1996.
[12] HERNÁNDEZ, M.; BOLARÍN, A.; GIL, M.A.; ALMIÑANA, C.; CUELLO, C.; PARRILLA, I.; GARCÍA, E.; CABALLERO, I.; SÁNCHEZ-OSORIO, J.; LUCAS, X.; VAZQUEZ, J.M.; MARTÍNEZ, E.A.; ROCA, J. Criopreservación Espermática. En: Biotecnología de la Reproducción Porcina: Manual de Técnicas de Reproducción Asistida en Porcino. Bonet, S.; Martínez, E.; Rodríguez, J.E.; Barrera X. (Eds). 1ra Ed. Universidad de Girona. Pp 185-200. 2006.
[13] JOHNSON, L.A.; WEITZE, K.F.; FISER, P.; MAXWELL, W.M.C. Storage of boar semen. Anim. Reprod. Sci. 62:142-172. 2000.
[14] KNOX, V.; YANTIS, B. The effect of numbers of frozenthawed boar sperm and addition of prostaglandin F2α at insemination on fertility in pigs. Anim. Reprod. Sci. 151 (3- 4): 194-200. 2014.
[15] MARTIN, M.; EDGERTON, S.; WISEMAN, B. Frozen semen: A breeding protocol that results in high fecundity. Swine Health Prod. 8 (6): 275–277. 2000.
[16] MARTINEZ, E.A.; VAZQUEZ, J.M.; ROCA, J.; LUCAS, X.; GIL, M.A.; VAZQUEZ, J.L. Deepintrauterine insemination and embryotransfer in pigs. Reprod. 58: 301–311. 2001.
[17] MCNAMARA, K.; KNOX, R. Effect of using frozen-thawed boar sperm differing in post-thaw motility in the first and second inseminations on pregnancy establishment, litter size, and fetal paternity in relation to time of ovulation1. J. Anim. Sci. 91: 5637-5645.2013.
[18] ROCA, J.; PARRILLA, I.; RODRIGUEZ-MARTINEZ, H.; GIL, M.; CUELLO, C.; VÁZQUEZ, J.; MARTINEZ, E. Approaches Towards Efficient Use of Boar Semen in the Pig Industry Reprod. Domest. Anim. 46 (2): 79–83.2011.]]
[19] RODRÍGUEZ-GIL, J.E.; ESTRADA E. Artificial insemination in boar reproduction. In: Boar Reproduction. Bonet, S., Casas, I., Holt, W.V., Yeste, M (Eds), 1ra Ed. Springer, Berlin, Pp 589–608. 2013.
[20] SPENCER, K.W.; PURDY, P.H.; BLACKBURN, H.D.; SPILLER, S.F.; STEWART, T.S.; KNOX, R.V. Effect of number of motile, frozen-thawed boar sperm and number of fixed-time inseminations on fertility in estrous-synchronized gilts. Anim. Reprod. Sci. 121: 259–266. 2010.
[21] THILMANT, T. Cryopreservation of boar semen in 0.5 mL french straws. 10th Meeting of Artificial Insemination. Brujas, 03/04. Bélgica. 125 pp. 1998.
[22] THURSTON, L.; HOLT, W.; WATSON, P.; HOLT, W. Semen cryopreservation: a genetic explanation for species and individual variation? Cryo-Lett. 23(4): 255-62.2002.
[23] TRIBOUT, T.; CARITEZ, J.; GRUAND, J.; BOUFFAUD, M.; GUILLOUET, P.; BILLON, Y.; PERY, C.; LAVILLE, E.; BIDANEL, J. Estimation of genetic trends in French Large White pigs from 1977 to 1998 for growth and carcass traits using frozen semen. J. Anim. Sci. 88 (9): 2856-2867. 2010.
[24] WABERSKI, D.; WEITZE, K.; GLEUMES, T.; SCHWARZ, M.; WILLMEN, T.; PETZOLDT, R. Effect of time of insemination relative to ovulation on fertility with liquid and frozen boar semen. Theriogenol. 42 (5): 831-40. 1994.
[25] WAGNER, H.; THIBIER, M. World statistics for artificial insemination in small ruminants and swine. Proc 14th International Congress on Animal Reproduction. Estocolmo, 07/02-06 Suecia. 425 pp. 2000.
[26] WATSON, P.F. The causes of reduced fertility with cryopreserved semen. Anim. Reprod. Sci. 60-61: 481-482. 2000.
[27] WONGTAWAN, T.; SARAVIA, F.; WALLGREN, M.; CABALLERO, I.; RODRÍGUEZ-MARTINEZ, H. Fertility after deep intra-uterine artificial insemination of concentrated lowvolume boar semen doses. Theriogenol. 65: 773-787. 2006.
[28] YASTE, M. Recent Advances in Boar Sperm Cryopreservation: State of the Art and Current Perspectives. Reprod. Domest. Anim. 50 (2): 71-79. 2015.
[29] YEN, N.T.; TAI, C.; CHENG, Y.S.; HUANG, M.C. Relative Genetic Effects of Duroc and Taoyuan Breeds on the Economic Traits of Their Hybrids. AJAS. 14(4): 447-454.2001.








.jpg&w=3840&q=75)