Fecundación in Vitro con Semen Congelado en la Especie Porcina
Publicado: 1 de enero de 2002
Por: Joaquín Gadea Mateos, S. Ruiz, P. Coy, R. Romar y I. Campos (Ftad. de Veterinaria. Univ. de Murcia), A. Poto, y B. Peinado (Ctro. Investigación y Desarrollo Agroalimentario) y O. Zubillaga (Asoc. Defensa Sanitaria Cordillera-Sur). España
Se ha estudiado el efecto de la concentración espermática (1, 5 y 10 x 106 espermatozoides/ ml) y de la presencia de las células epiteliales del oviducto porcino (POEC) en un sistema de fecundación in vitro (FIV) utilizando semen congelado. Los resultados muestran que la presencia de células epiteliales tiene un efecto positivo en la penetración de los ovocitos (22,64 vs 11,02; 70,09 vs 47,41 y 89,68 vs 56,88) y que la concentración espermática está directamente relacionada con las tasas de penetración y el número de espermatozoides que penetran cada ovocito (1,54 vs 2,56 vs 3,05; 1,31 vs 1,82 vs 1,92).
Los resultados obtenidos son alentadores pues, por una parte, se consiguen niveles elevados de penetración lo que permite utilizar la FIV como una técnica válida para asegurar y comparar la capacidad fecundante del semen congelado y permiten, por otra parte, conseguir embriones viables a partir de semen congelado en unas proporciones muy interesantes y que varían entre el 10 y el 20 p.100 del total de ovocitos maduros.
Introducción
La fecundación in vitro (FIV) es una técnica que permite el estudio de los procesos que conducen a la penetración del ovocito por un espermatozoide y la formación de un zigoto viable. Del mismo modo puede ser utilizada en la valoración de la capacidad fecundante de los gametos masculinos y es una herramienta que permite la obtención de embriones a partir de gametos de alto valor genético.
La producción de embriones mediante la FIV puede ofrecer una gran ayuda a los programas de mejora y conservación del patrimonio genético, al permitir la utilización de gametos que, de modo natural, serían inviables. Por otro lado, la aplicación de la técnica de criopreservación espermática puede ayudar a la conservación del material genético durante largos periodos de tiempo. En relación con la FIV, la congelación de semen se determina como un instrumento de gran utilidad para el desarrollo de esta técnica ya que permite aprovechar el semen de un determinado animal en repetidas ocasiones para valorar los diferentes factores que afectan al proceso (Rath y Niemann, 1997), y al mismo tiempo la FIV es una herramienta útil para valorar la capacidad fecundante de los espermatozoides (Xu et al., 1996; Gadea, 1997).
Desde los primeros trabajos de Nagai et al. (1988), con resultados negativos al utilizar semen congelado, se ha dado un gran paso hasta nuestros días donde con técnicas de fecundación in vitro con semen congelado se puede obtener un número considerable de embriones viables (Wang et al., 1997; Abeydeera et al., 1997). Sin embargo, hasta el momento en la especie porcina, la fecundación in vitro sigue limitada por la presentación de altas tasas de polispermia. In vivo, la polispermia está controlada en parte por la acción reguladora del oviducto, demostrándose en muchas especies que el istmo actúa como un reservorio de espermatozoides, al adherirse éstos a su epitelio. La unión con estas células ayuda a mantener la viabilidad y capacidad fertilizante y regula el número de espermatozoides que alcanzan el ovocito. Diversos autores han preincubado los espermatozoides con células epiteliales del oviducto en un paso previo a la fecundación in vitro como un método que ha permitido reducir las tasas de polispermia (Nagai y Moor, 1990; Dubuc y Sirard, 1995). Sin embargo, no está totalmente aclarado el efecto de las células epiteliales cuando éstas están presentes en el momento de la fecundación.
El objetivo del presente estudio ha sido evaluar el efecto de las condiciones de cultivo en un sistema de FIV en el ganado porcino empleando diferentes concentraciones de semen congelado y la presencia de células epiteliales del oviducto en el sistema de fecundación.
Material y Métodos
Maduración in Vitro
Los ovocitos fueron obtenidos a partir de ovarios procedentes del sacrificio de cerdas híbridas comerciales de unos 90-100 kg de peso vivo, en el matadero Industrias Fuertes S.A. Una vez obtenidos los ovarios fueron transportados al laboratorio en una solución salina (0,9 p.100 w/v NaCl) con 100 mg/l de kanamicina y 50 mg/l de sulfato de polimixina B atemperada a 37°C en un periodo de tiempo inferior a una hora. Los ovarios seleccionados presentaban folículos de tamaño comprendido entre 3 y 5 mm de diámetro; éstos fueron seccionados con un bisturí para recoger el contenido folicular que se dispuso en placas de petri con PBSDm suplementado con 4 mg/ml de alcohol de polivinilo.
El método de maduración utilizado es el descrito por Yoshida et al. (1992) basado en la utilización del medio Waymouth MB 725/1, suplementado con un 10 p.100 de fluido folicular porcino, 10 p.100 de suero fetal bovino (FCS), 10 UI/ml de PMSG, 10 UI/ml de HCG, 1 µg/ml de 17ß-estradiol y 100 µg/ml de kanamicina. El cultivo se realizó en condiciones estáticas en 3 microgotas de 100 ml por placa cubiertas con aceite de parafina. En cada microgota se dispusieron 20 ovocitos que fueron mantenidos durante 44 horas en un incubador a 38,5ºC, saturado de humedad y con un 5 p.100 de CO2 en aire.
Cultivo de las Célulasepiteliales del Oviductoporcino (POEC)
Los oviductos fueron obtenidos en el matadero a partir de cerdas prepúberes de razas comerciales. Estos fueron trasladados al laboratorio en solución salina con polimixina B y kanamicina a 37ºC, donde fueron disecados y sometidos a una solución de tripsina al 0,25 p.100 en solución tamponada de Hepes (Sigma) a 37° durante 45 min. Tras este tiempo se procedió a la obtención de las células mediante la compresión del oviducto para recoger el contenido de la luz oviductal en medio M199 con un 15 p.
100 de suero fetal bovino (FCS), penicilina y estreptomicina.
Tras la centrifugación, las células epiteliales obtenidas fueron sembradas a una concentración de 750.000 células en placas de petri de 35 mm de diámetro en 2 ml de medio M199 y se pusieron en cultivo en un incubador de CO2 al 5 p.100 y a 39°C. El medio fue renovado cada 48 horas, comprobando el crecimiento normal de la monocapa de células.
Fecundación In Vitro
Se utilizó como medio de fecundación el M199 suplementado (Mattioli et al., 1989). La pajuela de semen, con un volumen de 5 ml y con un total de 5 x 109 espermatozoides, fue descongelada por inmersión en baño a 42°C durante 45 segundos y seguidamente diluida en medio BTS en una proporción 1:20. Tras el equilibrado, las muestras seminales fueron sometidas a una primera centrifugación (50 g x 3 minutos), de la cual se recogió el sobrenadante, de manera que se eliminó el sedimento para desechar partículas extrañas y espermatozoides muertos. Seguidamente se procedió a una segunda centrifugación (1200 g x 3 minutos) de donde se recogió el pellet. Éste se diluyó en el medio de cultivo y se ajustó a una concentración final de 1, 5 y 10 x 106 espermatozoides/ml, añadiendo volúmenes de 100 ml a las placas de petri que contenían 2 ml del medio de fecundación y 20 ovocitos maduros.
Después de 18 h de cultivo en incubador de CO2 al 5 p.100 y a 38,5°C, los ovocitos fueron fijados y teñidos con una solución de lacmoid al 1 p.100 (w/v) y examinados bajo microscopía de contraste de fases a 400x.
Diseño Experimental
En este estudio se analizó el efecto de la concentración espermática (1, 5 y 10x106 espermatozoides/ml) y la presencia o ausencia de las células POEC sobre los resultados de la fecundación in vitro. Para ello se evaluaron los siguientes parámetros: porcentaje de penetración y número de espermatozoides por ovocito penetrado. El estudio se realizó en 3 replicados en días diferentes, siendo posteriormente agrupados.
Análisis estadístico
Los resultados se expresaron como la media ± sem. Éstos fueron analizados mediante un ANOVA de doble vía, considerando como efectos principales la concentración espermática y la presencia o ausencia de células POEC. Los valores porcentuales fueron previamente transformados. Cuando el ANOVA mostró diferencias significativas, los valores obtenidos fueron comparados con un test de Tukey. Se consideraron diferencias estadísticamente significativas cuando p<0,05.
Resultados y Discusión
Los resultados se resumen en la tabla I. El método de maduración in vitro de ovocitos utilizado, basado en el medio Waymouth (Yoshida et al, 1992), permite obtener unos buenos porcentajes de éxito, como se refleja en los resultados obtenidos en el presente estudio. Las tasas de maduración (núcleos en metafase II) obtenidas en este estudio varían para los diferentes grupos experimentales entre el 92,2 y el 100 p.100, con un valor medio de 96,88 p.100. Del mismo modo, la formación del pronúcleo masculino en los ovocitos penetrados alcanza unas buenas proporciones que oscilan en todos los grupos experimentales entre el 62 y el 79 p.100. Este valor depende fundamentalmente del grado de maduración alcanzado por el ovocito y de las características del macho utilizado (Coy et al., en prensa) y no tanto de otras condiciones del cultivo como puede ser el medio utilizado (Wang et al., 1997), la concentración espermática o la presencia de células epiteliales.
En cuanto a las tasas de penetración y al número de espermatozoides por ovocito, ambos parámetros se ven claramente favorecidos por la presencia de las células POEC y por la concentración creciente de espermatozoides, sin embargo la relación no es lineal para la tasa de penetración como lo indica la interacción significativa de los efectos principales.
Otros autores han estudiado la relación entre la concentración espermática y los resultados de la FIV en varias condiciones detrabajo (Coyet al., 1993; Martínez et al., 1993; Xu et al., 1996), de manera que, para cada macho y sistema de fecundación, puede ajustarse la concentración más adecuada al objetivo propuesto (Test de penetración o producción de embriones).
Tabla I.Efecto de la concentración espermática (C) y la presencia de células epiteliales del oviducto porcino (POEC) sobre los resultados de la fecundación in vitro (media ± sem).
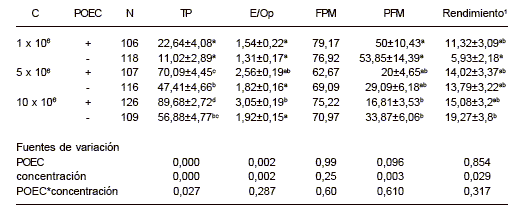
TP: Tasa de Penetración (p.100). E/Op: Esperm/ Ovocito penetrado.
FMP: Formación del pronúcleo masculino del total de ovocitos penetrados ( p.100).
PFM: Pronúcleo femenino y masculino ( p.100). Ovocitos que presentan un pronúcleo femenino y uno masculino del total de penetrados.
1Zigotos viables/ovocitos totales.
a,b,cDiferentes superíndices en la misma columna indican diferencias significativas (p<0,05).
Las células POEC ejercen un efecto favorecedor de la penetración pues probablemente permitan unas condiciones mas fisiológicas, permitiendo la liberación al medio de cultivo de hormonas y factores de crecimiento (Kano et al., 1994). La utilización de estas células en precultivos para la preparación de los espermatozoides ha sido una técnica utilizada para conseguir mayores tasas de monospermia (Nagai y Moor, 1990; Dubuc y Sirard, 1995). Sin embargo, bajo las condiciones experimentales utilizadas en este estudio con elevadas concentraciones de espermatozoides y un largo periodo de cocultivo no se detecta este efecto.
Los resultados son alentadores pues, por una parte, se consiguen niveles muy considerables de penetración lo que permite utilizar la FIV como una técnica válida para asegurar y comparar la capacidad fecundante del semen congelado y por otra parte, permite obtener embriones viables a partir de semen congelado en unas proporciones interesantes. Los resultados varían entre el 10 y el 20 p.100 de los ovocitos utilizados siendo comparables con los obtenidos por Wang et al.,
1997 y Abeydeera et al., 1997. Además es posible modificar otros factores del sistema que permitan reducir la polispermia para poder mejorar la tasa de embriones viables, como son el tiempo de cocultivo y los aditivos.
Bibliografía
Los resultados obtenidos son alentadores pues, por una parte, se consiguen niveles elevados de penetración lo que permite utilizar la FIV como una técnica válida para asegurar y comparar la capacidad fecundante del semen congelado y permiten, por otra parte, conseguir embriones viables a partir de semen congelado en unas proporciones muy interesantes y que varían entre el 10 y el 20 p.100 del total de ovocitos maduros.
Introducción
La fecundación in vitro (FIV) es una técnica que permite el estudio de los procesos que conducen a la penetración del ovocito por un espermatozoide y la formación de un zigoto viable. Del mismo modo puede ser utilizada en la valoración de la capacidad fecundante de los gametos masculinos y es una herramienta que permite la obtención de embriones a partir de gametos de alto valor genético.
La producción de embriones mediante la FIV puede ofrecer una gran ayuda a los programas de mejora y conservación del patrimonio genético, al permitir la utilización de gametos que, de modo natural, serían inviables. Por otro lado, la aplicación de la técnica de criopreservación espermática puede ayudar a la conservación del material genético durante largos periodos de tiempo. En relación con la FIV, la congelación de semen se determina como un instrumento de gran utilidad para el desarrollo de esta técnica ya que permite aprovechar el semen de un determinado animal en repetidas ocasiones para valorar los diferentes factores que afectan al proceso (Rath y Niemann, 1997), y al mismo tiempo la FIV es una herramienta útil para valorar la capacidad fecundante de los espermatozoides (Xu et al., 1996; Gadea, 1997).
Desde los primeros trabajos de Nagai et al. (1988), con resultados negativos al utilizar semen congelado, se ha dado un gran paso hasta nuestros días donde con técnicas de fecundación in vitro con semen congelado se puede obtener un número considerable de embriones viables (Wang et al., 1997; Abeydeera et al., 1997). Sin embargo, hasta el momento en la especie porcina, la fecundación in vitro sigue limitada por la presentación de altas tasas de polispermia. In vivo, la polispermia está controlada en parte por la acción reguladora del oviducto, demostrándose en muchas especies que el istmo actúa como un reservorio de espermatozoides, al adherirse éstos a su epitelio. La unión con estas células ayuda a mantener la viabilidad y capacidad fertilizante y regula el número de espermatozoides que alcanzan el ovocito. Diversos autores han preincubado los espermatozoides con células epiteliales del oviducto en un paso previo a la fecundación in vitro como un método que ha permitido reducir las tasas de polispermia (Nagai y Moor, 1990; Dubuc y Sirard, 1995). Sin embargo, no está totalmente aclarado el efecto de las células epiteliales cuando éstas están presentes en el momento de la fecundación.
El objetivo del presente estudio ha sido evaluar el efecto de las condiciones de cultivo en un sistema de FIV en el ganado porcino empleando diferentes concentraciones de semen congelado y la presencia de células epiteliales del oviducto en el sistema de fecundación.
Material y Métodos
Maduración in Vitro
Los ovocitos fueron obtenidos a partir de ovarios procedentes del sacrificio de cerdas híbridas comerciales de unos 90-100 kg de peso vivo, en el matadero Industrias Fuertes S.A. Una vez obtenidos los ovarios fueron transportados al laboratorio en una solución salina (0,9 p.100 w/v NaCl) con 100 mg/l de kanamicina y 50 mg/l de sulfato de polimixina B atemperada a 37°C en un periodo de tiempo inferior a una hora. Los ovarios seleccionados presentaban folículos de tamaño comprendido entre 3 y 5 mm de diámetro; éstos fueron seccionados con un bisturí para recoger el contenido folicular que se dispuso en placas de petri con PBSDm suplementado con 4 mg/ml de alcohol de polivinilo.
El método de maduración utilizado es el descrito por Yoshida et al. (1992) basado en la utilización del medio Waymouth MB 725/1, suplementado con un 10 p.100 de fluido folicular porcino, 10 p.100 de suero fetal bovino (FCS), 10 UI/ml de PMSG, 10 UI/ml de HCG, 1 µg/ml de 17ß-estradiol y 100 µg/ml de kanamicina. El cultivo se realizó en condiciones estáticas en 3 microgotas de 100 ml por placa cubiertas con aceite de parafina. En cada microgota se dispusieron 20 ovocitos que fueron mantenidos durante 44 horas en un incubador a 38,5ºC, saturado de humedad y con un 5 p.100 de CO2 en aire.
Cultivo de las Célulasepiteliales del Oviductoporcino (POEC)
Los oviductos fueron obtenidos en el matadero a partir de cerdas prepúberes de razas comerciales. Estos fueron trasladados al laboratorio en solución salina con polimixina B y kanamicina a 37ºC, donde fueron disecados y sometidos a una solución de tripsina al 0,25 p.100 en solución tamponada de Hepes (Sigma) a 37° durante 45 min. Tras este tiempo se procedió a la obtención de las células mediante la compresión del oviducto para recoger el contenido de la luz oviductal en medio M199 con un 15 p.
100 de suero fetal bovino (FCS), penicilina y estreptomicina.
Tras la centrifugación, las células epiteliales obtenidas fueron sembradas a una concentración de 750.000 células en placas de petri de 35 mm de diámetro en 2 ml de medio M199 y se pusieron en cultivo en un incubador de CO2 al 5 p.100 y a 39°C. El medio fue renovado cada 48 horas, comprobando el crecimiento normal de la monocapa de células.
Fecundación In Vitro
Se utilizó como medio de fecundación el M199 suplementado (Mattioli et al., 1989). La pajuela de semen, con un volumen de 5 ml y con un total de 5 x 109 espermatozoides, fue descongelada por inmersión en baño a 42°C durante 45 segundos y seguidamente diluida en medio BTS en una proporción 1:20. Tras el equilibrado, las muestras seminales fueron sometidas a una primera centrifugación (50 g x 3 minutos), de la cual se recogió el sobrenadante, de manera que se eliminó el sedimento para desechar partículas extrañas y espermatozoides muertos. Seguidamente se procedió a una segunda centrifugación (1200 g x 3 minutos) de donde se recogió el pellet. Éste se diluyó en el medio de cultivo y se ajustó a una concentración final de 1, 5 y 10 x 106 espermatozoides/ml, añadiendo volúmenes de 100 ml a las placas de petri que contenían 2 ml del medio de fecundación y 20 ovocitos maduros.
Después de 18 h de cultivo en incubador de CO2 al 5 p.100 y a 38,5°C, los ovocitos fueron fijados y teñidos con una solución de lacmoid al 1 p.100 (w/v) y examinados bajo microscopía de contraste de fases a 400x.
Diseño Experimental
En este estudio se analizó el efecto de la concentración espermática (1, 5 y 10x106 espermatozoides/ml) y la presencia o ausencia de las células POEC sobre los resultados de la fecundación in vitro. Para ello se evaluaron los siguientes parámetros: porcentaje de penetración y número de espermatozoides por ovocito penetrado. El estudio se realizó en 3 replicados en días diferentes, siendo posteriormente agrupados.
Análisis estadístico
Los resultados se expresaron como la media ± sem. Éstos fueron analizados mediante un ANOVA de doble vía, considerando como efectos principales la concentración espermática y la presencia o ausencia de células POEC. Los valores porcentuales fueron previamente transformados. Cuando el ANOVA mostró diferencias significativas, los valores obtenidos fueron comparados con un test de Tukey. Se consideraron diferencias estadísticamente significativas cuando p<0,05.
Resultados y Discusión
Los resultados se resumen en la tabla I. El método de maduración in vitro de ovocitos utilizado, basado en el medio Waymouth (Yoshida et al, 1992), permite obtener unos buenos porcentajes de éxito, como se refleja en los resultados obtenidos en el presente estudio. Las tasas de maduración (núcleos en metafase II) obtenidas en este estudio varían para los diferentes grupos experimentales entre el 92,2 y el 100 p.100, con un valor medio de 96,88 p.100. Del mismo modo, la formación del pronúcleo masculino en los ovocitos penetrados alcanza unas buenas proporciones que oscilan en todos los grupos experimentales entre el 62 y el 79 p.100. Este valor depende fundamentalmente del grado de maduración alcanzado por el ovocito y de las características del macho utilizado (Coy et al., en prensa) y no tanto de otras condiciones del cultivo como puede ser el medio utilizado (Wang et al., 1997), la concentración espermática o la presencia de células epiteliales.
En cuanto a las tasas de penetración y al número de espermatozoides por ovocito, ambos parámetros se ven claramente favorecidos por la presencia de las células POEC y por la concentración creciente de espermatozoides, sin embargo la relación no es lineal para la tasa de penetración como lo indica la interacción significativa de los efectos principales.
Otros autores han estudiado la relación entre la concentración espermática y los resultados de la FIV en varias condiciones detrabajo (Coyet al., 1993; Martínez et al., 1993; Xu et al., 1996), de manera que, para cada macho y sistema de fecundación, puede ajustarse la concentración más adecuada al objetivo propuesto (Test de penetración o producción de embriones).
Tabla I.Efecto de la concentración espermática (C) y la presencia de células epiteliales del oviducto porcino (POEC) sobre los resultados de la fecundación in vitro (media ± sem).

TP: Tasa de Penetración (p.100). E/Op: Esperm/ Ovocito penetrado.
FMP: Formación del pronúcleo masculino del total de ovocitos penetrados ( p.100).
PFM: Pronúcleo femenino y masculino ( p.100). Ovocitos que presentan un pronúcleo femenino y uno masculino del total de penetrados.
1Zigotos viables/ovocitos totales.
a,b,cDiferentes superíndices en la misma columna indican diferencias significativas (p<0,05).
Las células POEC ejercen un efecto favorecedor de la penetración pues probablemente permitan unas condiciones mas fisiológicas, permitiendo la liberación al medio de cultivo de hormonas y factores de crecimiento (Kano et al., 1994). La utilización de estas células en precultivos para la preparación de los espermatozoides ha sido una técnica utilizada para conseguir mayores tasas de monospermia (Nagai y Moor, 1990; Dubuc y Sirard, 1995). Sin embargo, bajo las condiciones experimentales utilizadas en este estudio con elevadas concentraciones de espermatozoides y un largo periodo de cocultivo no se detecta este efecto.
Los resultados son alentadores pues, por una parte, se consiguen niveles muy considerables de penetración lo que permite utilizar la FIV como una técnica válida para asegurar y comparar la capacidad fecundante del semen congelado y por otra parte, permite obtener embriones viables a partir de semen congelado en unas proporciones interesantes. Los resultados varían entre el 10 y el 20 p.100 de los ovocitos utilizados siendo comparables con los obtenidos por Wang et al.,
1997 y Abeydeera et al., 1997. Además es posible modificar otros factores del sistema que permitan reducir la polispermia para poder mejorar la tasa de embriones viables, como son el tiempo de cocultivo y los aditivos.
Bibliografía
- Abeydeera L.R. and B.N. Day. 1997. Fertilization and subsequent development in vitro of pig oocytes inseminated in a modified Trisbuffered medium with frozen thawed ejaculated spermatozoa. Biol. Reprod., 57: 729-734.
- Coy, P., E. Martínez, S. Ruiz, J.M. Vázquez, J. Roca and C. Matas. 1993. Sperm concentration influences fertilization and male pronuclear formation in vitro in pigs. Theriogenology, 40:
- Coy, P., S. Ruiz, R. Romar, I. Campos and J. Gadea. Maturation, fertilization and full development of porcine oocytes matured in different systems. Biol. Reprod., (prensa).
- Dubuc, A. and M.A. Sirard. 1995. Effect of coculturing spermatozoa with oviductal cells on the incidence of polyspermy in pig in vitro fertilization. Mol. Reprod. Dev., 41: 360-367.
- Gadea, J. 1997. Predicción de la fertilidad in vivo de los eyaculados de verraco mediante parámetros rutinarios de contrastación seminal, pruebas bioquímicas y el test homólogo de penetración in vitro. Tesis doctoral. Universidad de Murcia.
- Kano, K., T. Miyano and S. Kato. 1994. Effect of oviductal epithelial cells on fertilization of pig oocytes in vitro. Theriogenology, 42: 1061- 1068.
- Martínez, E., J.M. Vázquez, C. Matas, J. Roca, J. Gadea and P. Coy. 1993. Evaluation of boar spermatozoa penetrating capacity using pig oocytes at the germinal vesicle stage.
- Theriogenology, 40: 547-557.
- Mattioli, M., M.L. Bacci, G. Galeati and E. Seren. 1989. Developmental competence of pig oocytes matured and fertilized in vitro. Theriogenology, 31: 1201-1207.
- Nagai, T., T. Takahashi, H. Masuda, Y. Shioya, M. Kuwayama, M. Fukushima, S. Iwasaki and A. Hanada. 1988. In-vitro fertilization of pig oocytes by frozen boar spermatozoa. J. Reprod. Fert., 84: 585-591.
- Nagai, T. and R.M. Moor. 1990. Effect of oviduct cells on the incidence of polyspermy in pig eggs fertilized in vitro. Mol. Reprod. Dev., 26: 377-382.
- Rath, D. and H. Niemann. 1997. In vitro fertilization of porcine oocytes with fresh and frozenthawed ejaculated or frozen-thawed epididymal semen obtained from identical boars. Theriogenology, 47: 785-793.
- Wang, W.H., L.R. Abeydeera, T.C. Cantley and B.N. Day. 1997. Effects of oocyte maturation media on development of pig embryos produced by in vitro fertilization. J. Reprod. Fert., 111: 101-108.
- Xu, X., P.C. Seth, D.S. Harbison, A.P. Cheung and G.R. Foxcroft. 1996. Semen dilution for assessment of boar ejaculate quality in pig IVM and IVF systems. Theriogenology, 46: 1325-1337.
- Yoshida, M., K. Ishigaki and V.G. Pursel. 1992. Effect of maturation media on male pronucleus formation in pig oocytes matured in vitro. Mol. Reprod. Dev., 31: 68-71.
Este trabajo ha sido financiado por la Comisión Interministerial de Ciencia y Tecnología (CICYT). Proyecto AGF96-1069.
Temas relacionados
Autores:
Universidad de Murcia - España
Recomendar
Comentar
Compartir

1 de septiembre de 2005
Necesito saber lo necesario para implementar un centro de inseminación artificial para un proyecto futuro.
Alumnas de medicina veterinaria
ELIZABETH FARIAS Y VERONICA CABRERA
Recomendar
Responder

23 de agosto de 2005
Hola quiero saber cómo puedo hacer una inseminación artificial.
Recomendar
Responder

12 de agosto de 2005
Es posible que exista una relación paracrina entre epitelio y ovocito, que desendana señales para que pueda lograrse la anfimixia.
Recomendar
Responder

15 de junio de 2005
Ojala encuentres algo de lo buscado en esta pagina, checala bien.
hasta pronto
http://www.ansi.okstate.edu/
Recomendar
Responder

13 de junio de 2005
Buenas noches
Estoy muy interesada en la inseminacion en vitro ya que soy estudiante de medicina veterianria y deseo realizar una exposicion sobre este tema, por eso les pido si tienen por enlaces o pag donde pueda obtener fotografias para hacer una exposicion mas acertada.
muchas gracias.
Rosa
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.





