Introducción
La evaluación de los registros reproductivos y de las causas de descarte en reproductoras porcinas es una herramienta imprescindible para aplicar estra-tegias de descarte eficaces y lograr una mayor eficien-cia productiva. Esto se debe al impacto económico y productivo que representan la compra y preparación de nuevas reproductoras (D´Allaire et al., 1987, 1992, 2006; Engblom et al., 2008; Knauer et al., 2007; Sasaki et al., 2010; Vargas et al., 2009).
Para una completa evaluación del descarte en granjas porcinas deben considerarse cuatro aparta-dos:
I. Tasa de descarte anual y tasa de reposición anual
II. Causas de descarte
III. Registros reproductivos
IV. Inspección del aparato genital en frigorífico
El análisis de las tasas y de las causas de descarte nos permite conocer no sólo el modo en que se realiza el descarte dentro del establecimiento sino también poder identificar las causas de descarte que generan mayor impacto. Asimismo, el análisis de registros permite evaluar si el descarte de repro-ductoras se está realizando de manera correcta y, además, medir el impacto económico y productivo que estos representan. Por último, la evaluación del aparato genital (AG) en frigorífico nos permite evaluar si existe asociación entre lesiones del AG y la decisión de descarte (Koketsu et al., 1997a; Rodríguez-Zas et al., 2003; Sasaki et al., 2010). El objetivo del presen-te trabajo fue realizar una revisión de las principales causas de descarte en productores porcinos, de los factores asociados y de las herramientas disponibles para su análisis.
I. Tasa de descarte y reposición anual
Se entiende por tasa de descarte anual (TDA) al porcentaje de hembras descartadas por un esta-blecimiento a lo largo de un año. Los valores de TDA presentados por diferentes autores oscilan entre un 15 y un 85 % (D´Allaire et al.,1987, 1992, 2006; Engblom et al., 2008; Knauer et al., 2007; Sasaki et al., 2010;Vargas et al., 2009).
La tasa de reposición anual (TRA) indica la cantidad de cerdas a reponer a lo largo de un año. En Argentina, esta tasa oscila históricamente entre el 25 % y el 35 %, observándose en los últimos años incrementos que alcanzan valores del 40 % al 50 %. En granjas comerciales el objetivo es alcanzar una TRA que oscile entre el 39 % y el 40 %, en la que lareposición por descarte represente el 35 o el 36 % y la debida a la muerte de reproductoras un 3 % a un 5 % (Dial et al., 1992; D´Allaire et al., 1999; Muirhead, 1976; PIC Latinoamérica, 2015).
Ambas tasas pueden ser calculadas sobre el total de cerdas productivas del establecimiento o bien sobre el inventario promedio de reproductoras (IPR). El IPR es la cantidad de hembras que son servidas en el establecimiento a lo largo del periodo que se desea evaluar (generalmente mensual o anual). Es importante incluir dentro del IPR a las cerdas nulíparas descarta-das, para no generar un sesgo en los resultados. La comparación de la TDA y la TRA entre los diferentes establecimientos suele ser difícil de evaluar debido a que existen diferencias en las instalaciones, en el ma-nejo y en la calidad de operarios, entre otros factores (D´Allaire et al., 1987, 1992, 2006; Knauer et al., 2007).
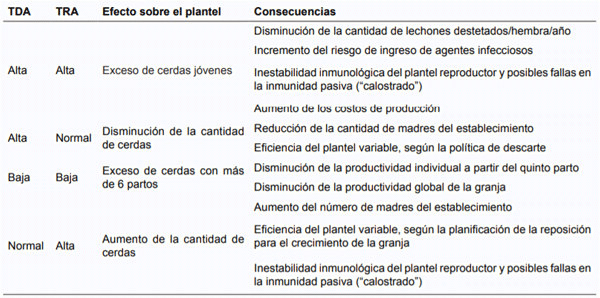
Se sugiere que la TDA y la TRA deben estar equilibradas entre sí y con valores que oscilen entre un 35 % y un 40 %. De esta manera se logra man-tener constante el inventario de reproductoras para conseguir la estabilidad reproductiva e inmunológica del plantel, con mayor probabilidad de maximizar la productividad de la granja. Las consecuencias del desequilibro entre las tasas se presentan en la tabla 1. Hay dos condiciones en las que la falta de equilibrio es aceptada, en granjas que están en periodo de ex-pansión y en aquellas que se encuentran reduciendo la cantidad de cerdas productivas (D´Allaire et al., 1992, 2006; Koketsu et al., 1997a; Sasaki et al., 2010).
II. Causas de descarte
Las causas de descarte en hembras porcinas pueden agruparse en categorías; esto facilita su estu-dio y permite realizar comparaciones entre diferentes establecimientos. El conocimiento de dichas causas es útil para determinar la ocurrencia de cada una y detectar problemas (D´Allaire et al., 1987, 1999; Sa-saki et al., 2010).
Estas causas suelen dividirse en descartes re-productivos (DR) y descartes no reproductivos (DNR). Los DR representan del 3 % al 42 % de los descartes. Incluyen problemas de fertilidad (retorno al celo re-gular o irregular, control de preñez negativo), falta de celo, abortos y descarga vulvar. Dentro de los DNR se incluyen: edad avanzada, sobrepeso, trastornos del aparato locomotor, alteraciones de la glándula mama-ria y baja productividad (poca cantidad de lechones nacidos vivos y destetados). Estos representan entre el 58 % y el 97 % de los descartes (D´Allaire et al., 1987; Engblom et al., 2007; Heinonen et al., 1998; Koketsu et al., 1997a; Tummaruk et al., 2009; Sasaki et al., 2010; Vestergaard et al., 2006).
El descarte puede realizarse en forma pro-gramada y no programada. Las causas de descarte programado son: baja productividad, edad avanzada y sobrepeso. Los descartes programados son planifi-cados por el productor, permiten organizar la reposi-ción y, en consecuencia, no se produce un aumento significativo de los días no productivos (DNP) . Los descartes no programados incluyen trastornos loco-motores y fallas reproductivas. Estos descartes son los de mayor impacto económico y productivo, dado que en algunos casos no se cuenta con suficientes hembras de reemplazo, lo que lleva a retener hembras en las que estaría indicado el descarte. Esta situación, representa un mayor riesgo de fracaso reproductivo, menor productividad y aumento de los DNP (D´Allaire et al., 1999).
Tabla 1. Consecuencias sobre la productividad de la relación tasa de descarte anual/tasa de reposición anual (TDA/TRA).
II.a. Descarte reproductivo
Problemas de fertilidad
Los problemas de fertilidad están dentro de las causas más comunes de DR y se caracterizan por un fallo en la concepción o en el mantenimiento de la preñez. Ante la presentación de un problema, el desafío para el productor o asesor está en lograr de-tectar las causas que generaron dicha falla. El primer paso es tener en cuenta la cantidad de partos de las cerdas afectadas, el ambiente, la nutrición y el ma-nejo reproductivo. Luego debe aplicarse el siguiente enfoque sistemático: 1. Determinar si los retornos al celo son regulares o irregulares. 2. Determinar si la falla está relacionada con una causa infecciosa o no infecciosa. 3. Establecer si la causa está relacionada con la hembra, el macho o el error humano. 4. Evaluar minuciosamente la rutina de servicio. De este modo podremos clasificar de manera correcta dichas fallas y aplicar las medidas apropiadas (Kirkwood et al., 2012; Koketsu et al., 1997a).
La aparición de un retorno al celo regular o irregular depende del momento en que se produce la muerte embrionaria en relación al reconocimiento materno de la preñez (RM). Dicho reconocimiento está mediado por la producción de estrógenos fe-tales, la que comienza el día 12 de gestación y se completa hacia el día 18 (Almond et al., 2006; First & Staigmiller 1973; Kirkwood et al., 2012; Rutter & Russo, 2002). Si no hubo concepción o si se produce una muerte embrionaria que deja viables menos de cuatro embriones antes del RM la cerda retornará al celo a los 21±3 días, lo que se denomina retorno regular. Cuando los embriones mueren luego del RM, los cuerpos lúteos se mantendrán activos por más tiempo, dando como resultado un retorno a intervalo irregular, observándose conducta de celo entre los 25 y 39 días postservicio (Rutter & Russo, 2002). El conocimiento de este concepto es útil en el momento de evaluar las causas de retorno, ya que los retornos regulares generalmente están asociados con causas no infecciosas, tales como: fallas en los padrillos, semen, técnica y momento de inseminación, clima e instalaciones, estrés durante el primer tercio de la gestación, quemaduras por sol en sistemas a campo, intoxicación con zearalenona, entre otros. Por otra parte, los retornos irregulares generalmente están asociados con causas infecciosas (Almond et al., 2006), siendo las más comunes en Argentina la par-vovirosis, la enfermedad de Aujeszky, la brucelosis y la leptospirosis.
Falta de celo
La falta de celo es una de las causas de elimi-nación más comunes en cerdas de menos de 2 partos.
El principal signo asociado es el anestro, es decir, la falta de manifestación externa de celo. El mismo puede ser fisiológico (durante la gestación y la lactancia) o patológico (Safranski & Cox 2007; Soede et al., 2011). A partir de estudios ultrasonográficos y de inspección del aparato genital en frigorífico, se pudo determinar que el anestro patológico se encuentra relacionado, en la mayoría de los casos, con la inactividad de los ovarios (Almond et al., 2007; Knauer et al., 2007; Rodríguez et al., 2008).
La falta de celo se manifiesta productivamente con un retraso o falta de pubertad en cerdas nulíparas y un aumento del intervalo destete-celo o falta del celo posdestete en cerdas primíparas y pluríparas (Almond et al., 2007; Koketsu et al., 1997a). Hay estudios que indican que las cerdas con intervalo destete-celo de más de 30 días presentan un riesgo mayor de descarte que las cerdas con un intervalo menor a 4 días. Es de gran importancia realizar un examen clínico-reproductivo individual y poblacional con el fin de determinar si la falta de celo se debe a un anestro real o a problemas en la detección del mismo por parte de los operarios (Serenius & Stalder 2006). En relación con la edad, el riesgo de descar-te por anestro es mayor para las cerdas nulíparas que para las cerdas adultas (D´Allaire et al., 1987; Tummaruk et al., 2006). Son varios los factores que influyen en la presentación de anestro en la cerda.
Dentro de los más frecuentes pueden enumerarse: la época del año, la presencia de quistes ováricos, un bajo nivel de consumo de alimento en la lactancia, la duración de la misma, una baja condición corporal y el estado sanitario (Koketsu et al., 1997a, 1997b; Vargas et al., 2009).
Aborto
El aborto representa un bajo porcentaje de los DR, del 1 % a 4 % (D´Allaire et al., 1987, 2006). Es necesario realizar un correcto diagnóstico de la causa de aborto para tomar la decisión de descar-te. Las causas de aborto pueden ser infecciosas o no infecciosas; dentro de las últimas se incluyen: trauma, afecciones del aparato locomotor, tóxicos, variaciones climáticas y estrés. El diagnóstico de las mismas se basa en la anamnesis, la historia reproductiva y los signos clínicos (Tubbs, 2007).
Como causas de aborto infeccioso en la especie porcina se incluyen agentes bacterianos y virales; dentro de los primeros, Brucella suis, di-ferentes serovariedades de Leptospira interrogans y Erysipelothrix rhusiopathiae son los involucradoscon mayor frecuencia.Los agentes virales más frecuentes son: virus del síndrome respiratorio y re-productivo porcino, virus de la peste porcina clásica (exóticos en Argentina), virus de la Enfermedad de Aujeszky, parvovirus porcino, circovirus porcino tipo 2 y virus de influenza porcina (SENASA, 2013, 2016; Straw et al., 2006; Torremorrell, 2007).
Descarga vulvar
En la cerda, las descargas vulvares (DV) pueden ser normales o anormales. Dentro de las DV normales encontramos la observada durante el celo, que es una secreción escasa, serosa, trans-parente y filante y las descargas puerperales que son sanguinolentas (de Winter et al., 1995). Las DV anormales son generalmente más abundantes y pueden ser serosas, purulentas, hemorrágicas o combinaciones de ellas.
Las descargas purulentas son el principal signo clínico de endometritis y se presentan con mayor frecuencia durante el posparto o en el pe-riodo postservicio. Esto se debe a que el útero, en estos periodos, se encuentra bajo la influencia de la progesterona (P4) que induce inmunosupresión en el endometrio, lo que predispone a infecciones (Almond et al., 2006).
Durante los primeros días posparto los niveles de P4 se mantienen elevados y permiten la prolifera-ción de los microorganismos presentes en el tracto genitourinario y/o predisponen a infecciones de ori-gen ambiental. Es por esto que una higiene deficiente de las salas de maternidad aumenta el riesgo de presentación de endometritis y DV en este periodo (Almond et al., 2007; Carabin et al., 1995; Dalin et al., 2004; Fangman & Carlson Shannon, 2007). Laendometritis postservicio está relacionada con la higiene de la vulva, del prepucio de los padrillos y de los elementos de inseminación artificial. El momento en que se realiza la inseminación artificial puede influir en la presentación de infecciones uterinas. Las cerdas que son inseminadas hacia el final del estro tienen mayor riesgo de presentar endometritis; esto se relaciona con una disminución de las con-centraciones plasmáticas de estradiol (E2) y con un aumento de P4 luego de la ovulación. Resumiendo, una higiene deficiente en el momento del servicio y/o una inseminación tardía incrementan el riesgo de presentación de endometritis y DV (Almond et al., 2006; Carabin et al., 1996; de Winter et al., 1995).
De todos modos, para que una reproductora sea descartada por este motivo debe presentar algu-na falla reproductiva, siendo la repetición insidiosa de celo el principal signo clínico asociado. Si se presenta un exceso de descarte por esta causa se deben eva-luar las condiciones de higiene y desinfección en el momento de la inseminación artificial y de asistencia durante el parto (Carabin et al., 1995; Fangman & Carlson Shannon, 2007; Tummaruk et al., 2009).
Baja productividad
Las cerdas son incluidas dentro de esta cate-goría cuando su nivel de producción se encuentra por debajo de lo esperado en relación con la edad de la misma. Dentro de las razones de descarte se incluyen: tamaño de camada reducido, baja cantidad de lecho-nes destetados y bajo peso (al nacer o al destete). La baja productividad (BP) representa entre el 4 % y 21 % de los descartes. Esta variación depende de los objetivos productivos de cada establecimiento y de otros factores (D´Allaire et al., 1987, 2006).
La BP puede estar asociada a varios factores, tales como la edad, la alimentación de las cerdas, la genética, el manejo del semen, los servicios y los protocolos de IA, entre otros (Soede et al., 1995). Las deficiencias alimentarias, especialmente durante la lactancia y el periodo posdestete, son los problemas observados con mayor frecuencia (Hoving et al., 2010; Knox et al., 2002; Tsakmakidis et al., 2010). Du-rante estos periodos, un balance energético negativo produce una disminución de la actividad folicular, de la tasa de ovulación, de la viabilidad embrionaria y, en consecuencia, del tamaño de la camada (Hoving et al., 2010). Es necesario tener en cuenta el papelde los machos dentro de las causas de BP, ya que la calidad seminal podría estar relacionada con la viabilidad embrionaria (Knox et al., 2002; Tsakmakidis et al., 2010).
II.b. Descarte no reproductivo Edad avanzada
La edad avanzada representa entre el 3 % y 33 % del total de los descartes. En algunos casos, la edad avanzada está relacionada con una disminución de la productividad (la cual es esperable a partir de séptimo u octavo parto) o con sobrepeso que dificulta el manejo y la contención de las hembras, sobre todo en sistemas de gestación y lactancia en jaula individual (D´Allaire et al., 1987, 2006).
Trastornos del aparato locomotor
Los trastornos del aparato locomotor (TAL) son, junto con las fallas reproductivas, las causas de descarte prematuro más frecuentes en producción porcina (Engblom et al., 2007; Serenius & Stalder, 2006). El impacto económico que estos representan se atribuye a que las cerdas con TAL generalmente son descartadas antes de su cuarto parto, no pudiendo alcanzar su pico productivo. Estos descartes prema-turos se traducen en una menor cantidad de camadas por cerda por año y menor cantidad de lechones des-tetados por hembra por año, aumentando los costos por lechón destetado (Anil et al., 2005; D´Allaire et al., 1987; Dewey et al., 1993).
Los factores que predisponen a la aparición de TAL son: la genética, las condiciones de alojamiento, el bajo consumo de alimento y/o deficiencias nutricio-nales, la falta de ejercicio y los pisos no enrejillados y/o demasiado duros (Anil et al., 2005; D´Allaire et al., 1987; Oliviero et al., 2010) . Algunos autores indican que las cerdas alojadas en gestaciones grupales pre-sentan mayor riesgo de desarrollar lesiones de origen traumático, artritis y, en consecuencia, cojera, pero un menor riesgo de presentar lesiones en las pezuñas, tales como lesiones de la línea blanca o fracturas de muralla (Calderón Díaz et al., 2014; Heinonen et al., 1998; Schenck et al., 2008).
El signo clínico asociado a los TAL es la claudicación o la imposibilidad para desplazarse y mantenerse en pie. Es importante determinar el tipo de afección presente y su causa para lograr disminuir la cantidad de cerdas descartadas por este motivo. Las afecciones del aparato locomotor más comunes son: ruptura o reblandecimiento de pezuñas, lesiones traumáticas, osteocondrosis, fracturas, osteomalacia y artritis infecciosas o de origen mecánico (Dewey et al., 1993). En relación con los factores genéticos,se ha descripto que las cerdas hiperprolíficas son más susceptibles a presentar osteomalacia, debido a que muchas veces no logran reponer las pérdidas de minerales que ocurren durante la lactancia (Anil et al., 2005).
Alteraciones de la glándula mamaria
Las alteraciones de la glándula mamaria (AGM) representan entre el 1 % y el 36 % de los descartes. Este amplio rango puede deberse a diferencias en los sistemas de producción, principalmente entre gestaciones individuales y grupales. En estos últimos se registran mayor cantidad de AGM, especialmente procesos inflamatorios, tales como las mastitis y los abscesos mamarios (Heinonen et al., 1998; Kirkwood et al., 2012). Las AGM pueden dividirse en dos grupos:alteración de la producción láctea y procesos infla-matorios. Ambos suelen estar asociados al síndrome de agalaxia o hipogalaxia posparto. Los procesos inflamatorios, que incluyen cuadros de mastitis clínica y subclínica, son de etiología multifactorial y están influenciados por diversos factores predisponentes (Klopfenstein et al., 2006).
En cerdas con mastitis clínica se observa tem-peratura rectal mayor a 40 °C, anorexia, constipación, tumefacción, enrojecimiento y dolor a la palpación de las mamas, presencia de secreción purulenta a través de los pezones y, en casos crónicos, endurecimiento de las mamas con pérdida del tejido glandular. En las camadas de cerdas con AGM se observa una disminución del aumento diario de peso y aumento de la mortalidad de lechones asociada a la inanición e infecciones sistémicas (Fangman & Carlson Shannon, 2007; Klopfenstein et al., 2006).
III. Registros reproductivos
Como se expresó anteriormente, un exhaustivo análisis de registros relacionados con el descarte y re-posición nos permite: supervisar cómo se realizan los mismos, aumentar la longevidad de las reproductoras, disminuir el descarte de cerdas jóvenes, aumentar la productividad/cerda/año, disminuir los DNP y reducir los costos relacionados con el descarte y la reposición (Koketsu, 2005; Rodríguez-Zas et al., 2003).
En un establecimiento, la longevidad de las cerdas se encuentra íntimamente relacionada con la cantidad de lechones producidos durante su vida productiva y con los costos y los riesgos de la intro-ducción de nuevas reproductoras al establecimiento (Deen, 2003a; Serenius & Stalder, 2006). En produc-ción porcina se considera que no es económicamente beneficioso descartar una elevada cantidad de cerdas antes de su cuarto parto. Esto se relaciona con un aumento en los costos de reposición debido a la me-nor cantidad de lechones producidos y al descenso del porcentaje de parición asociados a una elevada cantidad de cerdas jóvenes (D´Allaire et al., 2006).
Los principales registros a evaluar para mejorar las políticas de descarte y reposición son los siguientes (Deen, 2003b):
1. La distribución de partos en el plantel reproductor
2. Los días no productivos (DNP)
3. El tiempo de permanencia en la granja o edad al descarte (herdlife)
III.a. Distribución de partos en el plantel reproductor
La distribución de partos en el plantel reproduc-tor es el primer dato que debe analizarse, dado que permite evaluar rápidamente las políticas de descarte y reposición y el posible impacto de dichas prácticas. Es un tema complejo y variable, ya que la distribución dentro de cada granja se relaciona con la tasa de con-cepción, edad de las cerdas al descarte, tamaño de camada y consumo de alimento, entre otros factores. Esto hace que la distribución óptima pueda variar de un establecimiento a otro (Dhuyvetter, 2000; D´Allaire et al., 2006).
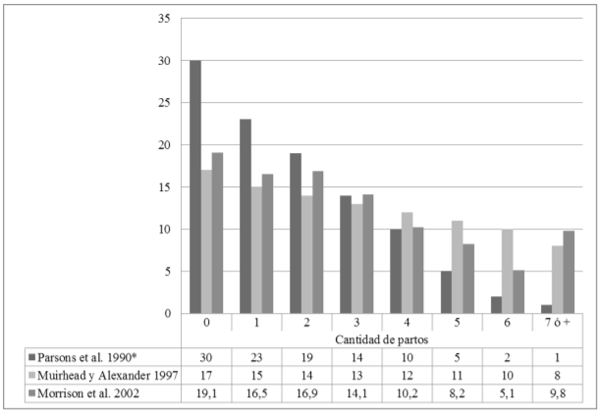
Las recomendaciones para una distribución óptima son variables y las propuestas por algunos au-tores se muestran en la Figura 1. D´Allaire et al (2006) consideran que, para obtener una madurez óptima del plantel reproductor, es necesario que el 90 % de las cerdas nulíparas servidas alcancen el primer parto y el 90 % de las cerdas de primer parto alcancen el segundo. Spörke (2009) sostiene que la distribución óptima se logra cuando más del 52 % de los partos de la granja son de cerdas de entre 3 y 6 partos.
En lo que coinciden la mayoría de los auto-res es que, para lograr un plantel equilibrado, la distribución de partos debe tener forma de pirámide escalonada descendente hacia la derecha, como puede observarse en la figura 1, con una reducción porcentual entre parto y parto de 10 % a 15 %. Esta distribución “modelo” deberá adaptarse a los costos y disponibilidad de reposición, la habilidad de los operarios y la situación de mercado para obtener el mayor beneficio económico posible (Dhuyvetter, 2000; D´Allaire et al., 2006; Morrison et al., 2002; Muirhead & Alexander, 2001).
III.b. Días no productivos
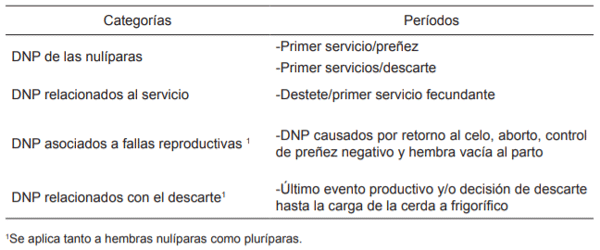
El análisis de los DNP de una cerda es un paso indispensable para tomar la decisión de descarte, ya que refleja el costo económico y el productivo de la misma. Se define como DNP a los días en los que la cerda se encuentra vacía y no está en lactancia. Para maximizar los resultados del análisis, los DNP pueden ser divididos en categorías basadas en los diferentes periodos de la vida productiva de una cerda, como se muestra en la tabla 2. La identificación de cada una de estas categorías permite obtener información más precisa de cada cerda y tomar una decisión de descarte justificada, sobre la base de sus resultados productivos y económicos (Koketsu, 2005).
Las hembras descartadas por fallas reproducti-vas presentan una mayor cantidad de DNP relaciona-dos al descarte, especialmente las cerdas de menos de tres partos, contrariamente a lo que ocurre con los descartes programados (Anil et al., 2005; Engblom et al., 2007). La falla más común en el análisis de este registro es no contabilizar los DNP relacionados con el descarte de cerdas nulíparas (Deen, 2003b; D´Allaire et al., 2006).
III.c. Tiempo de permanencia en la granja o edad al descarte (herdlife)
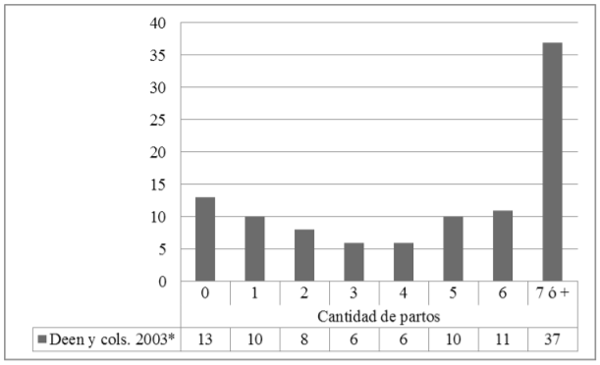
El índice de longevidad o herdlife (HL) indica el tiempo de permanencia de las cerdas en la granja. Puede expresarse de dos maneras: la cantidad de partos al momento del descarte o la cantidad de días transcurridos desde la entrada de una cerda hasta su descarte. El HL permite relacionar las causas de descarte con la edad de las reproductoras, dato de gran importancia para lograr una mejor eficiencia de descarte (Engblom et al., 2007). No es conveniente analizar solamente el valor promedio de HL, dado que el mismo puede estar influenciado por valores extremos. Cuando se trabaja con datos de paridad, debería confeccionarse un gráfico similar al utilizado para el análisis de la distribución de partos. Como se observa en la figura 2, la distribución de partos al descarte debe ser inversa a la distribución del plantel en producción, siendo que la mayoría de los descartes se concentren en las cerdas de 6, 7 y 8 partos (Deen, 2003a). Como referencia, valores promedio de HL entre 4 y 5 partos son considerados aceptables (D´Allaire et al., 2006).
Figura 1. Recomendaciones de distribución óptima de partos según diferentes au-tores (valores expresados en porcentaje).
La importancia económica del análisis de longevidad en una granja radica en que si una cerda es descartada antes de su cuarta parición solamente se alcanzan a recuperar los costos de compra o preparación de la misma (Rodríguez-Zas et al., 2003). Del mismo modo, las cerdas con valores bajos de HL generan menor cantidad de lechones producidos por año y una mayor cantidad de DNP (Engblom et al., 2007). Por este motivo, es aconsejable que las tasas y causas de descarte de las cerdas con menos de 3 partos sean analizadas de manera diferenciada, con el objetivo de instaurar medidas de manejo que permitan disminuir el riesgo de descarte prematuro (D´Allaire et al., 1987; Deen, 2003a).
Para mejorar la longevidad dentro del plantel, antes de decidir el descarte de hembras jóvenes debería realizarse un examen clínico individual, con-siderando: la historia clínico-reproductiva, los costos de reposición y preparación y las pérdidas potenciales de las camadas no producidas. Estas últimas deben calcularse sobre la base de los objetivos planteados en cada establecimiento. Por ejemplo, si se establece como objetivo que cada reproductora produzca, al menos, seis camadas y se descarta una hembra luego de su segundo parto, dentro de los costos de ese descarte deberían contemplarse los ingresos que no se perciben de esas cuatro camadas potenciales no producidas (Deen, 2003b).
Tabla 2. Categorías de días no productivos (DNP).
Figura 2. Distribución de partos al descarte (valores expresados en porcentaje). *Adaptado de Deen 2003a
IV. Inspección del aparato genital en planta de faena
En la cerda, el abordaje por vía rectal de los órganos reproductivos es dificultoso, por lo que la inspección clínica particular del aparato genital (AG) se limita a la exploración de los genitales externos. Esta situación hace que sea difícil, por un lado, tomar una decisión de descarte objetiva y, por el otro, en el caso de los DR, conocer los factores que desencadenaron la falla reproductiva (Almond et al., 2007; Safranski & Cox, 2007; Straw & Meuten, 1992).
En este sentido, la inspección del AG en planta de faena brinda información complementaria para mejorar el criterio de descarte, debido a que podemos evaluar la decisión de descarte basados en la presen-cia o ausencia de lesiones. Si hay lesiones, debemos relacionarlas con la historia clínica y los registros para determinar si las mismas explican el descarte. Por el contrario, si las cerdas de DR no presentan lesiones podremos realizar un análisis retrospectivo para de-terminar si dicho descarte estuvo asociado a otros factores como ser: problemas de manejo o gestión, nutrición o ambiente, entre otros (Almond et al., 2007; D´Allaire et al., 1992; Heinonen et al., 1998; Knauer et al., 2007).
En numerosos estudios realizados a partir de muestras obtenidas en planta de faena se describe que entre el 15 y el 49 % de las hembras descartadas presentan alguna alteración del AG. Las lesiones halladas varían de un estudio a otro, destacándose la presencia de ovarios inactivos (8-25 %), quistes ováricos (6-20 %) y alteraciones uterinas (1-22 %) (Heinonen et al., 1998; Karvelienė & Riškevičienė, 2009; Knauer et al., 2007; Rodríguez et al., 2008; Tummaruk et al., 2009). A continuación se hace una breve revisión de cada una.
Ovarios inactivos
Los ovarios inactivos son aquellos que presen-tan estructuras foliculares de un diámetro menor a 4 o 5 mm, con ausencia de cuerpos lúteos y albicans (Almond et al., 2007; Knauer et al., 2007; Rodríguez et al., 2008). La inactividad ovárica está relacionada, en muchos casos, con una nutrición deficiente de la cerda nulípara previa a la pubertad o de la cerda primípara y plurípara durante la lactancia (Knauer et al., 2007; Koketsu et al., 1997a; Vargas et al., 2009; Zak et al., 1998).
La evaluación de la actividad ovárica permite estimar los descartes por falta de celo. Cuando la mis-ma está asociada con ovarios inactivos debe remitirse a la granja y evaluar los posibles factores asociados (principalmente ambiente y nutrición). Por otro lado, pueden existir hembras descartadas por falta de celo y que presenten los ovarios activos; esto se relacio-naría con fallas en la estimulación y/o detección de celo (Barrales et al., 2014).
Quistes ováricos
Los quistes ováricos (QOv) son aquellos que se forman por una falla en la ovulación o en la luteólisis (Cianciolo & Mohr, 2007). El tamaño y la cantidad de quistes presentes en cada ovario son variables, pu-diendo ser grandes o pequeños, múltiples o simples y uni o bilaterales. En estudios realizados mediante ultrasonografía de tipo B (USG-B), la prevalencia de QOv varió entre el 2 % y el 30 % en el animal vivo (Cianciolo & Mohr, 2007), mientras que en estudios rea-lizados en planta de faena fue de 7 % a 13 % (Barrales et al., 2014; D´Allaire et al., 2006; Engblom et al., 2008;Heinonen et al., 1998; Knauer et al., 2007; Rodríguez et al., 2008; Tummaruk et al., 2009).
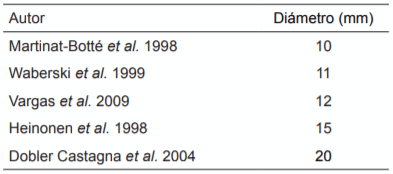
Se considera QOv a toda aquella estructura que supere el diámetro normal de un folículo o un cuerpo lúteo. El diámetro a partir del cual se considera a una estructura quística es muy variable según los diferen-tes autores (Tabla 3).
El efecto de los QOv sobre la fisiología repro-ductiva es diferente según el tipo de quiste presente. En general, los quistes simples y de gran tamaño sufren grados variables de luteinización y secretan P4, pudiendo producir una inhibición del eje hipotálamo-hipófisis-gónada que se expresa en falta de celo o anestro patológico. Por el contrario, los quistes múltiples y de tamaño pequeño son secretores de estradiol (E2), por lo que podrían producir retorno de celo a intervalo irregular o ninfomanía (Almond et al, 2006, 2007).
En el estudio realizado por Vargas et al (2009) se observó que cerdas nulíparas con QOv presentaron 7,6 veces más probabilidades de repetir celo en su primer servicio. Estos resultados son similares a los presentados por Dobler Castagna et al (2004) para cerdas primíparas y pluríparas, quienes reportan que el 50% de las cerdas conQOv presentó algún tipo de falla reproductiva.
Los QOv son fáciles de identificar mediante USG-B. En las imágenes ecográficas, dentro de los diagnósticos diferenciales se deben incluir: la preñez temprana, la ovulación retardada, los quistes parao-váricos y los cuerpos hemorrágicos (Dobler Castagna et al., 2004). Entre el 60 % y el 75 % de los quistes sonobservables mediante USG-B durante 15 días desde el momento de su formación. Es así que el seguimiento de la dinámica de los QOv es una rutina útil para la aplicación de tratamientos hormonales o para decidir el descarte en caso de que el quiste persista (Dobler Castagna et al., 2004; Cianciolo & Mohr, 2007).
Tabla 3. Diámetro a partir del cual se considera quiste a una estructura ovárica según diferentes autores.
De todos modos, debe considerarse que un quiste ovárico simple raramente afecta la fertilidad o el ciclo estral. Algunos autores afirman que las cer-das deben presentar, al menos, entre 5 y 10 quistes luteinizados de gran tamaño (50 mm de diámetro) para que se produzca el anestro. Para determinar si un QOv está afectando el desempeño reproductivo de una cerda es necesario relacionar varios factores, como por ejemplo, la signología clínica, los registros reproductivos, la cantidad y tamaño de los QOv y de las estructuras normales presentes en el ovario y las concentraciones séricas de hormonas sexuales (Ebbert et al., 1993; Cianciolo & Mohr, 2007; Martinat-Botté et al., 1998; Waberski et al., 1999).
Endometritis
Los procesos inflamatorios del útero se cla-sifican según la capa de la pared uterina que se encuentre afectada. El endometrio es el afectado con más frecuencia y su inflamación se define como endometritis (Cianciolo, 2007).El diagnóstico de esta afección se basa en la evaluación clínica, el estudio anatomopatológico y la evaluación mediante USG-B. El principal signo clínico asociado a esta afección suele ser la descarga vulvar purulenta.
En la inspección en planta de faena, en los ca-sos de endometritis clínica, se observa el endometrio de color rojo oscuro con marcado edema y congestión y, en la mayoría de los casos, una colecta purulenta (Almond et al., 2007; Tummaruk et al., 2009). Es importante destacar que el aspecto macroscópico del endometrio varía según el predomino de las hormonas sexuales (P4 y E2); por esta razón se hace necesario relacionar la etapa del ciclo estral con los hallazgos, para evitar confundir procesos fisiológicos con inflamatorios (Almond et al., 2007; Karvelienė & Riškevičienė, 2009; Tummaruk et al., 2009). Las colectas en la luz uterina varían en cantidad y tipo, pudiendo hallarse desde pequeños flóculos de pus hasta colectas purulentas de gran volumen (Almond et al., 2007). Los microorganismos aislados con ma-yor frecuencia son Escherichia coli, Staphylococcus spp., Streptococcus spp., Actinomyces pyogenes, Enterococcus spp. y Pasteurella multocida. Cabe destacar que, en muchas ocasiones, pueden ob-servarse colectas purulentas en la luz uterina sin lesiones endometriales (de Winter et al.,1995). La mayor parte de las endometritis suelen ser causadas por infecciones ascendentes de origen ambiental. Es por esto que, si se detecta un aumento en la ocu-rrencia en planta de faena, está indicado evaluar las condiciones de higiene, tal como se mencionó para el descarte por DV (Almond et al., 2006; de Winter et al., 1995; Rodríguez et al., 2008).
La observación de las endometritis suele ser difícil mediante USG -B, debido a que la ecogenicidad de la pared varía a lo largo del ciclo. En los casos de endometritis detectables mediante USG-B, se observa la luz del útero anecoica y, en su interior, algunos puntos hiperecóicos que aparecen y des-aparecen. Estas últimas imágenes son compatibles con la presencia de colecta purulenta en la luz del útero. Sin embargo, en la práctica, estas imágenes no siempre se interpretan de manera correcta, dado que se necesita entrenamiento y experiencia por parte del operador (Almond et al., 2006; Kauffold et al., 2004, 2010).
Discusión y conclusiones
El aumento de los costos de producción en los últimos años, en especial los relacionados a la alimentación y los recursos humanos, hizo necesario implementar medidas con el objetivo de aumentar la eficiencia económica y productiva. En este sentido, incrementar la longevidad de las reproductoras es una de las más importantes ya que se amortizan los costos de compra y/o preparación de una cerda y se incrementa la cantidad de lechones destetados por madre por año, aumentando la rentabilidad global de la explotación.
Los descartes reproductivos y por problemas lo-comotores son la principal causa de descarte prematuro y no programado en cerdas, hecho que se mantiene constante en los trabajos publicados. Por este motivo, la estrategia dentro de la granja debería estar dirigida a disminuir la cantidad y el impacto de los mismos.
Un exhaustivo análisis de registros es el primer paso para mejorar la tasa de retención de hembras en la granja. La amplia difusión, en los últimos años, de programas informáticos de gestión permitió obtener mayor cantidad y calidad de información para conocer cuáles son los factores que influyen sobre la longevi-dad de las cerdas. De todos modos, las limitaciones que presenta el examen clínico reproductivo en la hembra porcina hace necesaria la aplicación de he-rramientas que permitan dar un enfoque más objetivo a las políticas y decisiones de descarte reproductivo. Este hecho tiene particular importancia para las cerdas de menos de tres partos, por el impacto económico que significa el descarte prematuro de hembras, si se tiene en cuenta que no se logra un flujo positivo de ingresos para la granja si no alcanzan su cuarto parto. El análisis de registros reproductivos individuales y poblacionales, sumado a un examen ecográfico repro-ductivo y/o a la inspección del aparato genital en planta de faena aportaría objetividad a estas decisiones.
Conflicto de intereses
Todos los autores declaran que no existe con-flicto de intereses, relaciones financieras, personales o de otro tipo con personas u organizaciones que pudieran afectar al presente trabajo.








.jpg&w=3840&q=75)