Determinación de la concentración de zn en ovarios de cerdas prepúberes
Publicado: 16 de diciembre de 2015
Por: Rosales B, Zarate J, López M., Flores J. (Medicina Veterinaria y Zootecnia. UAM-X), Yasmin De Loera Ortega, Jesús Guevara González, Adelfa Del Carmen García Contreras (FES-Cuatitlàn). Mexico
Introducción
El ambiente, la alimentación, los errores en el manejo y cuidado de los animales ejercen a menudo un efecto negativo sobre la eficiencia reproductiva porcina. Esto se manifiesta principalmente en desórdenes reproductivos en hembras y machos. En el caso de las hembras el anestro (ausencia de síntomas de celo), subestro (celo silente), ciclos anovulatorios y cambios patológicos en los ovarios como los quistes foliculares y luteales (Mahan, 1990) son comunes, aunque difícilmente son identificados debido a la localización intra-abdominal de los ovarios. Tomando en cuenta lo anterior se hace pertinente identificar la morfología de las estructuras sexuales internas y en su caso el papel que juegan los minerales incluidos en las dietas, ya que estos representan parte de los nutrientes esenciales, que se encuentran aproximadamente en un 5% del peso vivo del animal (Brem et al., 2003). Dentro de los microminerales el Zn es hoy en día señalado por diversos autores (Regalla y Lyons, 2005; Yamasaki et al., 2007; Murakami e Hirano, 2008) como de gran importancia. Desde el punto de vista fisiológico interviene en el almacenamiento y liberación de insulina; confiere integridad a la membrana celular; actúa en procesos de maduración sexual y en la reproducción; participa en actividades de sensibilidad olfativa y gustativa; es un activo componente de la función tiroidea y de los procesos de coagulación sanguínea, actúa como co-factor de por lo menos 200 enzimas incluyendo anhidrasa carbónica y es activo previsor del estrés oxidativo (Zn superóxido dismutasa ; ZnSOD) y conforma a la metalotioneínas (MT) quien captura superóxidos y radicales hidroxilo (Ménézo et al., 2011; Haase et al., 2008), además de ser crucial para la respuesta inmunitaria (García, 2010).
En el caso de las hembras prepúberes, estas suelen ser alimentadas con dietas para cerdos en etapa de crecimiento, lo que permite asumir un consumo de proteína suficiente para que desarrollen su musculatura, y su aparato óseo, sin incrementar el nivel de grasa corporal por arriba de los 22 mm en la posición P2 (García et al., 2012). Sin embargo, la formula mineral utilizada para estas hembras frecuentemente es la misma que para los cerdos que van a ser llevados a matadero.
En el caso de las hembras prepúberes, estas suelen ser alimentadas con dietas para cerdos en etapa de crecimiento, lo que permite asumir un consumo de proteína suficiente para que desarrollen su musculatura, y su aparato óseo, sin incrementar el nivel de grasa corporal por arriba de los 22 mm en la posición P2 (García et al., 2012). Sin embargo, la formula mineral utilizada para estas hembras frecuentemente es la misma que para los cerdos que van a ser llevados a matadero.
El objetivo de este trabajo fue determinar la cantidad de Zn que contienen los ovarios de cerdas prepúberes y la relación que tiene esta con los diferentes estadios de folículos.
Material y Métodos
Los ovarios fueron obtenidos de hembras prepúberes, sacrificadas en rastro. Los ovarios fueron transportados en solución salina fisiológica al 0.9%, a una temperatura de 30-35°C hasta su llegada al laboratorio de Imagenología (LABIMA) en la UAM-X, en un tiempo no mayor a tres horas (Barati et al., 2008; Fernández et al., 2010), posteriormente los ovarios fueron colocados en cajas de Petri, para identificar y contar los folículos, los cuales fueron clasificados en tres niveles: Primarios, Secundarios y Terciarios, de inmediato se transfirieron a un crisol previamente pesado (balanza analítica, KERN) para la obtención del peso de cada ovario en base húmeda (BH), paso seguido sometidos durante 24 horas a una temperatura constante de 80°C en una estufa marca EELISA®, con ellos e obtuvo el peso en base seca (BS). Los ovarios en BS fueron sometidos a una digestión con ácido nítrico (HNO3) y ácido clorhídrico (HCl) suprapur, siguiendo la técnica del Programa de Control de Calidad y Desarrollo de Laboratorios (1995). Previo a la lectura de la concentración de Zn en las muestras digeridas de ovario, se realizó una calibración del equipo de espectrofotometría de absorción atómica (SpectrAA 220).
Análisis estadístico
Se utilizó un análisis de paquete estadístico SAS (Statistical Analysis Systems), para la interpretación de los resultados, utilizando una prueba de Tukey para la comparación de medias, y aplicando un nivel de significancia de P<0.05 para señalar como diferentes a los tratamientos utilizados.
Resultados
Los resultados obtenidos en la presente investigación mostraron que el peso medio de los ovarios de cerdas prepúberes sacrificadas en rastro es variable (P=0.0001), siendo la media de 2.96 g en base húmeda, (EEM=0.21), pero encontrando valores que van desde 0.85 hasta 4.99 g. En estos ovarios se observó variabilidad (P=0.0001) en el número de folículos, ya que los valores tuvieron un intervalo de 19 a 100 folículos, con una media de 49.25 folículos totales (EEM=0.32) (Gráfica 1).
Al realizar la clasificación de los folículos, se observó que existía un número significativamente (P=0.0001) mayor de folículos primarios (FP) (X= 23.64 FP), comparativamente con los folículos secundarios (X=25.68 FS) y terciarios (X=9.82 FT). También se observó que en la medida que se aumenta el peso de los ovarios el número de folículos aumenta (P=0.001), pero solo los FP y FS, ya que los FT se mantienen en número. En cuanto a la variable de concentración de Zn (P=0.450) en los ovarios, se identificó que la concentración de este mineral era de X=0.227 ppm en base seca (EEM=0.036) (Grafico 2). Es importante señalar las diferencias en peso mostradas en los ovarios y folículos, esto no afectó la concentración de Zn en el estroma ovárico.
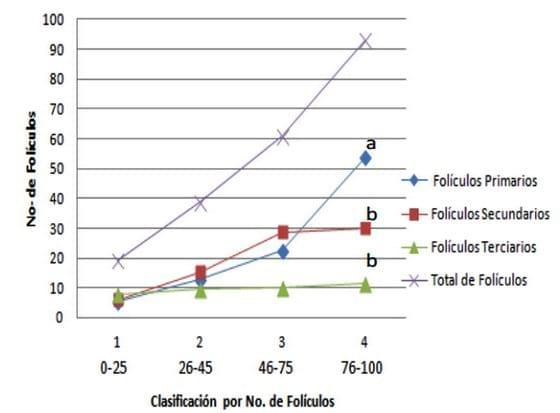
Gráfica 1. Clasificación de Folículos por estadios en base al peso ovárico en base húmedo.
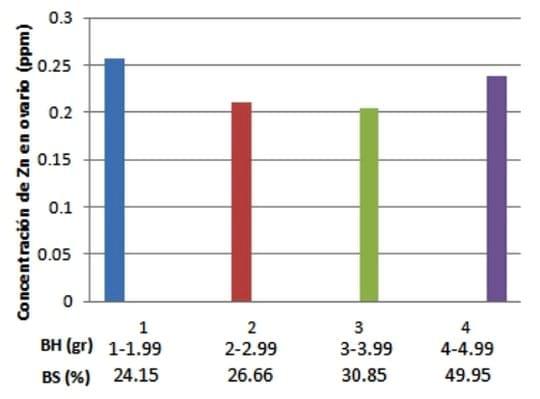
Gráfica 2. Concentración de Zn (ppm) y peso del ovario en base seca (BS).
Discusión
Los autores Domingo y Medel, describieron en (2002) que una cerda púber en la etapa de proestro contienen 50 folículos en sus ovarios, lo cual es similar a lo encontrado en los ovarios de las hembras de rastro utilizadas en este estudio (59.14 folículos), sin embargo el autor no menciona los tipos de folículos (primarios, secundarios y terciarios). En tanto que el peso de los ovarios encontrado en este estudio mostró ser de 2.96 g, lo cual se asemeja a los obtenidos en un estudio con hembras primerizas de línea materna (YL) (2-2.9 g) (Martín, 2000). Sin embargo, valores de hasta 4 g han sido reportados, lo cual coincide con este estudio que mostró un 35% de los ovarios entre 3 y 3.99 g. En cuanto a los niveles de Zn se ha observado que el nivel no varía en el estroma ovárico, pero un estudio realizado por Parra et al. (2014) demostró que existen diferentes cantidades en el líquido folicular. Por su parte Kaswan et al. (1995) demostró que un nivel bajo de Zn puede producir atresia folicular, una baja ovulación y degeneración de las células de la granulosa, así como la reducción de la producción de estrógeno. De la misma manera en cabras con una inclusión deficiente de Zn con 15ppm mostraron folículos atrésicos, mientras que cabras alimentadas con una inclusión de 65 ppm no mostraron ninguna anormalidad, lo cual indica que este mineral es necesario para el funcionamiento normal del epitelio germinal del ovario (Aruna, 1985).
Conclusión
El peso de los ovarios en cerdas prepúberes es distinto, pero la concentración de Zn no mostró ser diferente, aunque es recomendable aumentar el tamaño de muestra.
Referencias
- Aruna, C y Arora, S (1985). Ganadería Producción Ciencia, 12(1);69-77
- Barati et al (2008). Elservier.767-772.
- Brem et al (2003).Revista Veterinaria. 14(1):11-13.
- Domingo, K y Medel, P (2002). FEDNA.
- Fernández et al (2010). Rev. Salud Animal. 32(2):78-83.
- García CA. 2010.UCM : 5-7
- García et al (2012). Revista Complutense de Ciencias Veterinarias. 6(1):21-50.
- Haase et al (2008). Experimental Gerontology 43: 394–408.
- Kaswan S, and Bedwal, R. (1995). Indian Journal of Experimental Biology. 33(7):469-479.
- Mahan, D. (1990). J ANIM SCI, 68: 573-582.
- Martín et al. (2010). VII Simpósio Internacional de Reproducao e Inseminacao Artificial em Suinos. Foz do Iguacú.
- Ménézo et al (2011).Reproductive BioMedicine 22, 647-652.
- Murakami, M and Hirano T. (2008). Cancer Sci. 99(8):1515-1522.
- Parra et al (2014). Reunión Nacional de Innovación Acuícola y Pesquera 1.
- Regalla, L. and Lyons T. (2005). Molecular Biology of Metal Homeostasis and Detoxification. 14:37-58.
- Yamasaki et al (2007). Journal of Cell Biology. 177:637-645.
Contenido del evento:
Temas relacionados:
Autores:
Universidad Autónoma Metropolitana - UAM (México)
Universidad Autónoma Metropolitana - UAM (México)
UNAM - Universidad Nacional Autónoma de México
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.






.jpg&w=3840&q=75)