Micosis y Micotoxicosis en Pollos. La Influencia de Ciertos Factores Nutricionales (Parte II)
Publicado: 5 de mayo de 2004
Por: Alberto Gimeno
Consultor Técnico de SPECIAL NUTRIENTS, INC., 1394 Coral Way, Miami, Florida, 33145 USA.
María Ligia Martins
Laboratorio Nacional de Investigação Veterinaria, Estrada de Benfica 701, 1500 Lisboa, Portugal
Consultor Técnico de SPECIAL NUTRIENTS, INC., 1394 Coral Way, Miami, Florida, 33145 USA.
María Ligia Martins
Laboratorio Nacional de Investigação Veterinaria, Estrada de Benfica 701, 1500 Lisboa, Portugal
Notas: Este artículo es una revisión del ya publicado en www.mycotoxin.com con el titulo “Problemas de Micosis y Micotoxicosis en Pollos."
Este articulo esta dividido en dos partes, la primera parte ( Parte I ), publicada anteriormente, trata de los problemas más significativos de micosis en pollos, tales como: aspergilosis, mucormicosis intestinal y candidiasis o muget. Son descritas las sintomatologías, lesiones y los posibles tratamientos para estas micosis. Seguidamente son tratados problemas de micotoxicosis producidos por aflatoxina B1 y ocratoxina A. La influencia de ciertos factores nutricionales está también descrita.
La segunda parte ( Parte II ), aquí publicada, trata de los problemas de micotoxicosis producidos por toxina T-2 y diacetoxiscirpenol. Se describen también, otras micotoxicosis de mucha menos importancia para los pollos y producidas por las micotoxinas citrinina, vomitoxina o deoxinivalenol, zearalenona, rubratoxinas y fumonisinas. Finalmente se exponen toda una serie de sinergismos y asociaciones de algunas micotoxinas.
2.3.- TOXINAS TRICOTECENAS
2.3.- TOXINAS TRICOTECENAS
Producidas esencialmente por Fusarium tricinctum, F.nivale, F.roseum, F.graminearum, F.solani, F.oxysporum, F.lateritium, F.sporotrichioides, F.rigidiusculum, F.episphaeria y F.poae. Otros mohos también pueden producir toxinas tricotecenas, a saber, Cephalosporium crotocigenum, Myrotecium verrucaria, Stachybotrys atra, Calonectria nivalis, Trichoderma viride, Tricotecium roseum y Gibberella saubinetti. Existen 40 derivados de tricotecenos, sin embargo solo 4 son importantes por el momento, a saber: toxina T?2, diacetoxiscirpenol, vomitoxina o deoxinivalenol y nivalenol (75-78).
Los tricotecenos reciben este nombre por poseer el esqueleto tetracíclico, 12,13-epoxitricotec-9-eno.
Las toxinas tricotecenas pueden encontrarse como contaminantes naturales en los Cereales ( maíz y subproductos, cebada, sorgo, avena, trigo y subproductos, arroz, centeno y mijo) (77, 78, 79).
El principal síndrome que provocan es el gastroentérico, los sistemas y órganos afectados son, el sistema digestivo, nervioso, circulatorio y la piel. Es característico de la vomitoxina el provocar vómitos y rechazo del alimento (75-78, 80-82).
Para más detalles, podemos citar las características toxicológicas generales de estas micotoxinas, a saber (75-78, 80-82):
1.- Vómitos, taquicardia, diarrea, pérdida de la atención.
2.- Hemorragias, edemas, necrosis de los tejidos cutáneos.
3.- Hemorragias de la mucosa epitelial del estómago e intestino.
4.- Destrucción de tejidos hematopoyeticos.
5.- Disminución de los glóbulos blancos y plaquetas circulantes.
6.- Meninges hemorrágicas (cerebro).
7.- Alteración del sistema nervioso.
8.- Rechazo del alimento.
9.- Lesiones necróticas en diferentes partes de la boca.
10.- Degeneración patológica de las células de la médula ósea, nódulos linfáticos,
e intestino.
2.- Hemorragias, edemas, necrosis de los tejidos cutáneos.
3.- Hemorragias de la mucosa epitelial del estómago e intestino.
4.- Destrucción de tejidos hematopoyeticos.
5.- Disminución de los glóbulos blancos y plaquetas circulantes.
6.- Meninges hemorrágicas (cerebro).
7.- Alteración del sistema nervioso.
8.- Rechazo del alimento.
9.- Lesiones necróticas en diferentes partes de la boca.
10.- Degeneración patológica de las células de la médula ósea, nódulos linfáticos,
e intestino.
Las toxinas tricotecenas tienen una potente actividad inmunosupresiva (28).
2.3.1.- CASOS DE TOXICIDAD EN POLLOS
2.3.1.- CASOS DE TOXICIDAD EN POLLOS
2.3.1.1.- LD50

La LD50 esta expresada en mg/Kg de peso vivo.

La LD50 esta expresada en mg/Kg de peso vivo.
La administración de las micotoxinas fue por vía oral.
Las muertes ocurrieron dentro de las 48 horas después de la administración (dosis única).
En la toxicidad aguda de la toxina T-2, parece ser que la mayor edad del pollito no ayuda a que éste sea mas resistente.
2.3.1.2.- Casos generales.
1.- En pollitos broiler que consumieron desde 1 a 63 días de edad, pienso contaminado con, 0,2; 0,4; 2 y 4 ppm de toxina T-2, no fueron encontrados síntomas de problemas digestivos, no hubo hemorragias ni cambios patológicos en la médula ósea, hígado, riñón y corazón (84).
Con 4 ppm de toxina T-2, disminuyó la ganancia de peso vivo y el consumo de pienso. Con 0,4 ppm de toxina T-2 se desarrollaron lesiones en la boca. Los niveles en suero de la transaminasa glutamico oxalacetica, transaminasa glutamico piruvica, deshidrogenasa láctica y fosfoquinasa creatinica no fueron diferentes comparados con los valores del control.
Hubo una disminución de los niveles de ácido úrico y colesterol en suero, no hubo cambios hematologicos.
Con 4 ppm de toxina T-2, disminuyó la ganancia de peso vivo y el consumo de pienso. Con 0,4 ppm de toxina T-2 se desarrollaron lesiones en la boca. Los niveles en suero de la transaminasa glutamico oxalacetica, transaminasa glutamico piruvica, deshidrogenasa láctica y fosfoquinasa creatinica no fueron diferentes comparados con los valores del control.
Hubo una disminución de los niveles de ácido úrico y colesterol en suero, no hubo cambios hematologicos.
Los autores (84) concluyen que pollitos que consumieran durante 21 días, pienso contaminado con 1 ppm de toxina T-2 sufrirían una reducción en la ganancia de peso vivo, semejante a la que sufrirían si consumieran la dieta con 0,4 ppm de toxina T-2 durante 49-63 días.
2.- Piensos con 1, 2, 4, 8 y 16 ppm de toxina T-2 fueron suministrados durante 3 semanas a pollitos broiler de 1 día de vida, los resultados fueron los siguientes (85).
Para 4, 8 y 16 ppm de toxina T-2, hubo una reducción significativa de la tasa de crecimiento, en cambio los índices de conversión no se vieron afectados. Los pesos relativos del bazo y páncreas aumentaron. Para contaminaciones de 8 y 16 ppm de toxina T-2 hubo una reducción del peso de la bolsa de Fabricio, en cambio el peso del hígado no fue afectado. Acido úrico y glucosa en plasma, hemoglobina, seroproteinas,colesterol y lípidos totales no fueron afectados, comparados con el control.
2.3.1.3.- Efectos en la mortalidad, aumento de peso vivo y consumos de pienso.
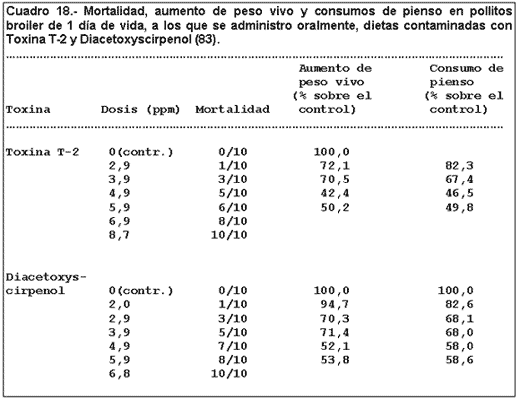
La prueba duró 7 días y se hicieron grupos de 10 aves.
La ganancia de peso vivo y el consumo de pienso fueron para los pollitos sobrevivientes durante los 7 días que duró la prueba.
Para 4, 8 y 16 ppm de toxina T-2, hubo una reducción significativa de la tasa de crecimiento, en cambio los índices de conversión no se vieron afectados. Los pesos relativos del bazo y páncreas aumentaron. Para contaminaciones de 8 y 16 ppm de toxina T-2 hubo una reducción del peso de la bolsa de Fabricio, en cambio el peso del hígado no fue afectado. Acido úrico y glucosa en plasma, hemoglobina, seroproteinas,colesterol y lípidos totales no fueron afectados, comparados con el control.
2.3.1.3.- Efectos en la mortalidad, aumento de peso vivo y consumos de pienso.

La prueba duró 7 días y se hicieron grupos de 10 aves.
La ganancia de peso vivo y el consumo de pienso fueron para los pollitos sobrevivientes durante los 7 días que duró la prueba.
Se observó un incremento de la mortalidad, así como una significativa reducción de la ganancia de peso vivo y consumo de pienso, en consonancia con el aumento de la concentración de micotoxina.
2.3.1.4.- Niveles de toxina T-2 en la dieta que no afectan a ciertos parámetros.

2.3.1.5.-Hematomas en hígado

El consumo de pienso con estas contaminaciones de toxina T-2, fue de 1 a 21 días de edad.

2.3.1.5.-Hematomas en hígado

El consumo de pienso con estas contaminaciones de toxina T-2, fue de 1 a 21 días de edad.
2.3.1.6.- Variación de parámetros sanguíneos.
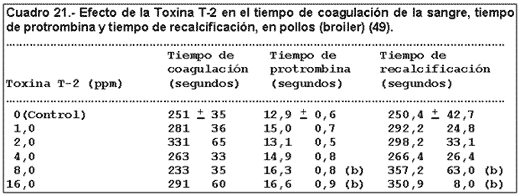
La prueba fue iniciada en pollitos de 1 día de vida y el final de la prueba fue después de 3 semanas. Los valores expuestos en el cuadro 21 son los valores medios obtenidos al cabo de las 3 semanas.

La prueba fue iniciada en pollitos de 1 día de vida y el final de la prueba fue después de 3 semanas. Los valores expuestos en el cuadro 21 son los valores medios obtenidos al cabo de las 3 semanas.
(b): esto valores son significativamente diferentes respecto a los valores del control (P menor que 0,05).
Podemos ver que para contaminaciones de 8 y 16 ppm, el tiempo de protrombina y tiempo de recalcificación, varían significativamente con respecto al control.
El tiempo de coagulación no se ve afectado significativamente por ninguna de las concentraciones de toxina T-2.
2.3.1.7.- Lesiones en la boca y disturbios neurológicos.
El tiempo de coagulación no se ve afectado significativamente por ninguna de las concentraciones de toxina T-2.
2.3.1.7.- Lesiones en la boca y disturbios neurológicos.
1.- Dietas contaminadas con 1 a 16 ppm de toxina T-2 que fueron suministradas a pollitos de 1 día de vida durante 7 días, causaron lesiones en el paladar y la lengua (86). El tamaño de las lesiones aumentó cuando el consumo de pienso contaminado se prolongo por 3 semanas. Algunos pollitos no pudieron ni cerrar la boca y comían con gran dificultad.
Los exámenes de las lesiones por métodos histopatologicos, revelaron una intensa inflamación de los tejidos y necrosis locales. Las zonas externas de las lesiones eran fibrinosas y blandas, mientras que en las zonas internas habían infiltraciones de leucocitos granulares. En las zonas erosionadas había un gran número de bacterias tipo “coccus” dispersas a lo largo del tejido afectado.
Estos autores (86) nos dicen, que la producción de lesiones orales graves, es el efecto primario de la toxina T-2 en pollos y esto es muy importante visto que dificulta significativamente la capacidad de ingestión del pienso por parte del ave.
Con concentraciones de 4, 8 y 16 ppm de toxina T-2, hubo disturbios neurológicos graves, los cuales retardaron extraordinariamente el crecimiento, estas mismas concentraciones alteraron el plumaje cuando los consumos se prolongan hasta las 3 semanas.
2.3.1.8.- Residuos de micotoxina en musculo.
2.3.1.8.- Residuos de micotoxina en musculo.
1.- Los autores (84) nos dicen que, pollos pesando 1,4 Kg de peso vivo y con un consumo medio diario de 100 gr de pienso conteniendo 2 ppm de toxina T-2, podrían acumular como máximo unos residuos de toxina en musculo de aproximadamente 1,9 mcg/100 gr de musculo. Probablemente esta concentración no coloca en peligro la salud humana.
MICOTOXINAS DE MENOR IMPORTANCIA PARA LOS POLLOS POR SER TOXICAS EN CONCENTRACIONES MUY ELEVADAS
MICOTOXINAS DE MENOR IMPORTANCIA PARA LOS POLLOS POR SER TOXICAS EN CONCENTRACIONES MUY ELEVADAS
2.4.- CITRININA
Producida esencialmente por el Penicillum citrinum, P.viridicatum, P.citreoviride y P.expansum, sin embargo, 14 especies de Penicillium y 3 especies de Aspergillus son responsables por la producción de la citrinina. Penicillium viridicatum parece ser uno de los principales productores de citrinina en cereales (87).
Especies de Penicillium viridicatum y P.palitans producen citrinina junto con ocratoxina A (87).
La citrinina puede encontrarse como contaminante natural en cereales, ensilados y frutas para humanos (esencialmente en peras y manzanas) (87,88).
El principal síndrome que la citrinina produce, es el nefrotóxico y el órgano afectado es el riñón. La citrinina no es carcinogenética, sin embargo, puede favorecer el cáncer renal que puede ser producido por la existencia de otros potentes carcinogenéticos (87). Algunos signos clínicos en la micotoxicosis de la citrinina en animales, son: salivación, lagrimeo, miosis, descarga nasal, vómitos, hiperemia de los oídos y membrana mucosa (87).
Las alteraciones clinicopatologicas que esta micotoxina provoca en el riñón, son: poliúria, proteinúria, creatinúria, glucosúria, enzimúria y aumento de nitrógeno úreico en sangre (87).
Las alteraciones clinicopatologicas que esta micotoxina provoca en el riñón, son: poliúria, proteinúria, creatinúria, glucosúria, enzimúria y aumento de nitrógeno úreico en sangre (87).
La citrinina es inmunosupresiva (28)
2.4.1.- CASOS DE TOXICIDAD EN POLLOS.
2.4.1.- CASOS DE TOXICIDAD EN POLLOS.
2.4.1.1.- Casos generales.
1.- Piensos con 62,5; 125, 250 y 500 ppm de citrinina fueron dados a pollitos broiler desde su nacimiento hasta 3 semanas de edad (87). Para 500 ppm de citrinina, la ganancia de peso vivo se vio reducida y para todas las concentraciones de citrinina experimentadas hubo un aumento del tamaño del riñón. Para 250 y 500 ppm de citrinina, hubo un incremento en el consumo de agua y aparecieron heces líquidas. En las concentraciones anteriormente citadas, la citrinina no afectó a: la seroproteína, glucosa, colesterol, ácido úrico y concentraciones de sodio y potasio. Para la dieta con 500 ppm de citrinina hubo un 30% de incremento en el tamaño del riñón, comparando con los resultados del grupo control.
2.- Piensos conteniendo de 30 a 260 ppm de citrinina, fueron administrados a pollitos broiler (87). Para concentraciones de 33 a 65 ppm no hubo problemas de mayor importancia y para el resto de las contaminaciones, una lentitud de crecimiento, incremento en el consumo de agua y aparición de heces líquidas, fueron síntomas observados en los animales. En necropsias efectuadas en pollitos que consumieron pienso con 130 y 260 ppm de citrinina, fue observado un aumento del tamaño del hígado, riñones pálidos y hemorragias en el intestino delgado.
2.5.- VOMITOXINA (DEOXINIVALENOL)
Esta micotoxina forma parte de las toxinas tricotecenas y ya fue presentada anteriormente.
2.5.1.- CASOS DE TOXICIDAD EN POLLOS.
2.5.1.1.- Casos generales.
1.- Pollitos machos (gallitos) de 6 días de vida fueron alimentados con pienso que contenía maíz contaminado con vomitoxina de forma tal que el alimento compuesto en cuestión quedaba contaminado con una concentración de vomitoxina de 50 ppm (89, 90).
Las aves ingirieron este alimento durante 6 días y no se notaron efectos negativos, ni en el crecimiento ni en el consumo de pienso. Solo fueron observadas alguna erosiones en la boca (89, 90).
Las aves ingirieron este alimento durante 6 días y no se notaron efectos negativos, ni en el crecimiento ni en el consumo de pienso. Solo fueron observadas alguna erosiones en la boca (89, 90).
Una dieta contaminada con 15 ppm de vomitoxina fue suministrada al mismo tipo de aves, durante 6 semanas y no fue notado ningún trastorno en los pollitos (89).
2.6.- ZEARALENONA (F-2)
2.6.- ZEARALENONA (F-2)
La zearalenona es producida esencialmente por Fusarium roseum, F.tricinctum, F.roseum “Culmorum”, F.roseum “Equiseti”, F.roseum “Gibbosum”, F.roseum “Graminearum”, F.oxysporum y F.moniliforme ( 12, 91-94).
El F.roseum es el que produce zearalenona en mayor concentración (3000-15000 ppm) mientras que el F.moniliforme, sintetiza pequeñas cantidades (1-19 ppm) (12, 94).
Existen unos 16 derivados de la zearalenona de los cuales el más importante es la zearalenona y después el zearalenol.
La zearalenona puede encontrase como contaminante natural en, maíz y subproductos, cebada, trigo, avena, sorgo, semilla de sésamo, heno y ensilados (12, 91-94).
El principal síndrome de la zearalenona es el estrogénico (12, 91).
2.6.1.- CASOS DE PROBLEMAS EN POLLOS.
2.6.1.- CASOS DE PROBLEMAS EN POLLOS.
2.6.1.1.- LD50
La LD50 de zearalenona (administración oral, dosis única) en pollitos es de: superior a 15000 mg/Kg peso vivo (91, 95).
2.6.1.2.- Casos generales
2.6.1.2.- Casos generales
1.- Pollitos que consumieron durante 4 días un alimento contaminado con 300 ppm de zearalenona, tuvieron un incremento de peso en la bolsa de Fabricio y un considerable aumento de quistes en el tracto genital (91).
Resultados semejantes fueron obtenidos con dietas contaminadas con 500-600 ppm de zearalenona procedente de cereales infectados con Fusarium (91).
2.- Piensos con 1, 10 y 30 ppm de zearalenona procedente de maíz infectado con Fusarium y pienso contaminado con 30 ppm de zearalenona pura, fueron dados durante 7-8 semanas a pollitos broiler (96).
Cada tratamiento estaba formado por 8 aves y los ensayos se efectuaron por duplicado.
Ninguna de estas concentraciones de zearalenona produjo problemas. El aumento de peso vivo y el índice de conversión fue igual para todas las concentraciones de contaminación.
2.7.- RUBRATOXINAS
2.7.- RUBRATOXINAS
Las rubratoxinas son producidas esencialmente por el Penicillium rubrum y el P.purpurogenum (97).
La más importante es la rubratoxina B y después la rubratoxina A.
Las rubratoxinas pueden encontrase como contaminantes naturales en los cereales (maíz esencialmente) y legumbres (97).
Las rubratoxinas pueden encontrase como contaminantes naturales en los cereales (maíz esencialmente) y legumbres (97).
Los problemas que pueden producir son: una gran congestión (muchas veces con hemorragias) de hígado, riñón, glándulas suprarrenales, pulmón, bazo, tracto gastrointestinal y congestión vascular en los tejidos subcutáneos y hemorragias en víscera abdominal (97).
La rubratoxina B es inmunosupresiva (28)
2.7.1.- CASOS DE TOXICIDAD EN POLLOS.
2.7.1.- CASOS DE TOXICIDAD EN POLLOS.
2.7.1.1.- LD50
La LD50 (vía de administración oral) en pollitos broiler de 1 día de vida, es de 83,2 mg/Kg de peso vivo (98).
2.7.1.2.- Casos generales
1.- Una dosis en pienso correspondiente a 500 ppm de rubratoxina B que fue dada a pollitos broiler durante 3 semanas, no provocó ninguna disminución del peso vivo, sin embargo una concentración de 1000 ppm de rubratoxina B, causó una hipertrofia del hígado y una atrofia de la bolsa de Fabricio (98).
Vemos aquí también que los pollitos son afectados con concentraciones muy elevadas de la toxina.
2.8.- FUMONISINAS
2.8.- FUMONISINAS
Las fumonisinas son producidas esencialmente por Fusarium moniliforme. Existen 6 tipos de fumonisinas, la B1, B2, B3, B4, A1 y A2 (99,100,101). Sin embargo, las que suelen encontrase con más frecuencia y las más importantes son la fumonisina B1 (FB1) y la fumonisina B2 (FB2).
La FB1 y FB2 pueden encontrase como contaminantes naturales, en los cereales (preferencialmente en el maíz y subproductos del maíz) (99-101).
Los principal sindromes que producen son: neurotóxicos (leucoencefalomelacia), nefrotóxicos, edema pulmonar y cerebral, hepatotóxicos y lesiones cardiacas. Los órganos afectados son: el cerebro, pulmón, hígado, riñón y corazón (99-101).
En las aves, las contaminaciones con fumonisinas tienen que ser elevadas para producir algún efecto tóxico, sin embargo, aún no hay suficientes estudios que definan exactamente esta situación en avicultura.
El descubrimiento de estas micotoxinas es relativamente reciente y se están realizando muchos estudios a nivel de toxicidad y a nivel de control.
2.8.1.- CASOS DE TOXICIDAD EN POLLOS.
2.8.1.- CASOS DE TOXICIDAD EN POLLOS.
2.8.1.1.- Casos generales.
1.- Los autores (102) efectuaron un estudio del efecto de las fumonisinas en pollitos y su repercusión en la ganancia de peso vivo, así como las modificaciones químicas del suero sanguíneo en las aves afectadas.
Se hicieron tres experiencias, a saber: pollitos de 2 días de vida fueron alimentados con una dieta que contenía FB1 pura en una concentración de 10 ppm, las aves ingirieron el alimento contaminado durante 6 días.
Algunos pollitos fueron necropsiados al cabo de 6 días y otros fueron dejados 5 semanas en recuperación (consumo de alimento no contaminado) y posteriormente necropsiados.
Las otras dos experiencias realizadas fueron también en pollitos de 2 días de vida a los que se les suministró un pienso starter que contenía un cultivo de Fusarium moniliforme, el cual tenia FB1 de forma que en uno de los grupos la contaminación del pienso era de 30 ppm de FB1 y en el otro de 300 ppm. El primer pienso con 30 ppm de FB1 fue suministrado durante 2 semanas y el segundo pienso con 300 ppm de FB1 lo fue durante 8 días.
Comparando con los grupos control, los pollitos intoxicados presentaron diarrea, disminución del peso vivo y de los pesos absolutos del hígado, bazo y bolsa de Fabricio, hubo un aumento en el peso relativo del hígado (% - peso hígado/peso vivo) y del bazo (% - peso bazo/peso vivo). Los trigliceridos, niveles de ácido úrico y la actívidad de la fosfatasa alcalina, disminuyeron, mientras que los niveles de gamma-glutamil transferasa, aspartanoamino transferasa, deshidrogenasa láctica, creatinquinasa y colesterol aumentaron.
Todos estos efectos tóxicos fueron observados para todas las concentraciones de contaminación con FB1 estudiados en las tres experiencias.
Con las dietas contaminadas con 10 y 300 ppm de FB1, las diarreas aparecieron al tercer día y en la dieta contaminada con 30 ppm aparecieron al 6º día.
Consideramos muy interesante la lectura de este articulo, así como de algunas referencias bibliográficas que en él se citan y en las que se pueden encontrar más datos sobre el efecto de estas micotoxinas en los pollos.
2.- Dietas conteniendo 0; 1,02; 2,04; 3,06; 4,08; 5,10; 6,12 y 7,14% de material de cultivo con fumonisina suplieron al pienso unas contaminaciones de 0, 75, 150, 225, 300, 375, 450 y 525 mg de FB1/Kg de dieta (103).
2.- Dietas conteniendo 0; 1,02; 2,04; 3,06; 4,08; 5,10; 6,12 y 7,14% de material de cultivo con fumonisina suplieron al pienso unas contaminaciones de 0, 75, 150, 225, 300, 375, 450 y 525 mg de FB1/Kg de dieta (103).
Estas dietas fueron suministradas a pollitos broiler de 1 día de vida y la duración del suministro fue de 21 días. Cada tratamiento tenía 4 replicas de 6 pollitos cada una.
En los pollitos que comieron dietas con 450 y 525 ppm de FB1, hubo una disminución del consumo de pienso y de la ganancia de peso vivo, los pesos del riñón e hígado aumentaron. Las tasas de sphinganina libre y de sphinganina:sphingosina, aumentaron en comparación con el control. Fueron observadas lesiones histólogicas en el hígado de los pollitos que comieron dietas conteniendo 225 ppm de FB1 o mayores.
Dietas conteniendo 75 ppm de FB1 afectaron fisiológicamente a los pollitos, aumentando las tasas de sphinganina libre y de sphinganina:sphingosina. La inhibición de la síntesis de los sphingolipidos es hipotéticamente el mecanismo de acción de la FB1. Dietas con 75 ppm de FB1, pueden ser tóxicas para pollitos.
2.9.- SINERGISMOS Y ASOCIACIONES DE ALGUNAS MICOTOXINAS.
2.9.- SINERGISMOS Y ASOCIACIONES DE ALGUNAS MICOTOXINAS.
2.9.1.- AFLATOXINA B1 + PATULINA.
1.- Pollitos de 1 día de vida que consumieron durante 4 semanas un pienso contaminado con 0,100 ppm de aflatoxina B1 + 0,100 ppm de patulina sufrieron una disminución de la ganancia de peso vivo y una mortalidad significativa (104).
2.9.2.- VOMITOXINA , AFLATOXINA B1, VOMITOXINA + AFLATOXINA B1.
2.9.2.- VOMITOXINA , AFLATOXINA B1, VOMITOXINA + AFLATOXINA B1.
1.- Pollitos Hubbard recién nacidos que consumieron piensos contaminados con, 16 ppm de vomitoxina (contaminación individual), 2,5 ppm de aflatoxina B1(contaminación individual), 16 ppm de vomitoxina +2,5 ppm de aflatoxina B1(contaminación conjunta), durante 3 semanas, tuvieron los siguientes problemas (105).
La contaminación individual con aflatoxina disminuyo la ganancia de peso vivo e incremento el peso relativo del bazo, hígado y riñones, hubo hiperlipemia hepática y los niveles de proteína, albúmina y fósforo en el suero disminuyeron al igual que la actividad de la deshidrogenasa láctica.
La contaminación individual con vomitoxina provocó una reducción de la tasa de crecimiento, aumento del índice de conversión e incremento del peso relativo de la molleja, anemia y disminución de la actividad de la deshidrogenasa láctica y de los triglicérido en el suero.
La contaminación conjunta provoca los mismos problemas que anteriormente citamos pero con una mayor gravedad sin embargo parece ser que esta mayor gravedad no fue lo suficientemente significativa como para poder decir que la combinación de las dos micotoxinas represente una toxicidad sinérgica.
2.9.3.- TOXINA T-2, AFLATOXINA B1, TOXINA T-2 + AFLATOXINA B1.
La contaminación individual con aflatoxina disminuyo la ganancia de peso vivo e incremento el peso relativo del bazo, hígado y riñones, hubo hiperlipemia hepática y los niveles de proteína, albúmina y fósforo en el suero disminuyeron al igual que la actividad de la deshidrogenasa láctica.
La contaminación individual con vomitoxina provocó una reducción de la tasa de crecimiento, aumento del índice de conversión e incremento del peso relativo de la molleja, anemia y disminución de la actividad de la deshidrogenasa láctica y de los triglicérido en el suero.
La contaminación conjunta provoca los mismos problemas que anteriormente citamos pero con una mayor gravedad sin embargo parece ser que esta mayor gravedad no fue lo suficientemente significativa como para poder decir que la combinación de las dos micotoxinas represente una toxicidad sinérgica.
2.9.3.- TOXINA T-2, AFLATOXINA B1, TOXINA T-2 + AFLATOXINA B1.
1.- Pollitos Hubbard de 1 día de vida que estuvieron a consumir piensos contaminados con, 4 ppm de toxina T-2 (contaminación individual), 2,5 ppm de aflatoxina B1 (contaminación individual, 4 ppm de toxina T-2 + 2,5 ppm de aflatoxina B1 (contaminación conjunta), durante 3 semanas, tuvieron los siguientes problemas (106).
La contaminación solo con toxina T-2 provoco lesiones orales, disminución de los niveles de proteína, albúmina, potasio y magnesio en el suero, hubo una disminución de la actividad de ciertas enzimas en el suero.
La contaminación solo con aflatoxina B1 provoco una reducción en la ganancia de peso vivo y alteraciones en los niveles de proteína, albúmina, glucosa, colesterol, calcio y magnesio en el suero y ciertas enzimas. Hubo un aumento del peso relativo del hígado, riñones, bazo, páncreas, proventriculo y corazón.
La contaminación con las dos micotoxinas, agrava substancialmente todos los trastornos anteriormente mencionados.
2.9.4.- TOXINA T-2, OCRATOXINA A, TOXINA T-2 + OCRATOXINA A.
La contaminación solo con toxina T-2 provoco lesiones orales, disminución de los niveles de proteína, albúmina, potasio y magnesio en el suero, hubo una disminución de la actividad de ciertas enzimas en el suero.
La contaminación solo con aflatoxina B1 provoco una reducción en la ganancia de peso vivo y alteraciones en los niveles de proteína, albúmina, glucosa, colesterol, calcio y magnesio en el suero y ciertas enzimas. Hubo un aumento del peso relativo del hígado, riñones, bazo, páncreas, proventriculo y corazón.
La contaminación con las dos micotoxinas, agrava substancialmente todos los trastornos anteriormente mencionados.
2.9.4.- TOXINA T-2, OCRATOXINA A, TOXINA T-2 + OCRATOXINA A.
1.- Pollitos de 1 día de vida que estuvieron a consumir pensos contaminados con, 4 ppm de toxina T-2 (contaminación individual), 2 ppm de ocratoxina A (contaminación individual), 4 ppm de toxina T-2 + 2 ppm de ocratoxina A (contaminacion conjunta), durante 3 semanas, tuvieron los siguientes problemas (107).
Con las contaminaciones con ocratoxina A y con la suma de las dos micotoxinas hubo una reducción de la eficacia nutricional del pienso. La contaminación solo con ocratoxina A provoco un aumento significativo del peso relativo del hígado, riñones, molleja y páncreas.
La contaminación con las dos micotoxinas aumento los efectos antes mencionados y redujo la ganancia de peso vivo y los niveles de proteína, la actividad de la deshidrogenasa láctica en el suero también se vio disminuida. La interacción entre estas dos micotoxinas, provoco una elevación en los niveles de triglicéridos en el suero y una disminución de la actividad de la gamma glutamil transferasa y calcio en el suero.
2.9.5.- TOXINA T-2, VOMITOXINA, TOXINA T-2 + VOMITOXINA.
La contaminación con las dos micotoxinas aumento los efectos antes mencionados y redujo la ganancia de peso vivo y los niveles de proteína, la actividad de la deshidrogenasa láctica en el suero también se vio disminuida. La interacción entre estas dos micotoxinas, provoco una elevación en los niveles de triglicéridos en el suero y una disminución de la actividad de la gamma glutamil transferasa y calcio en el suero.
2.9.5.- TOXINA T-2, VOMITOXINA, TOXINA T-2 + VOMITOXINA.
1.- Pollitos de 1 día de vida que consumieron piensos contaminados con, 4 ppm de toxina T-2 (contaminación individual), 16 ppm de vomitoxina (contaminación individual), 4 ppm de toxina T-2 + 16 ppm de vomitoxina (contaminación conjunta), durante 3 semanas, tuvieron los siguientes problemas (108).
La contaminación con las dos micotoxinas provoco una reducción de la ganancia de peso vivo y del peso vivo final, sin embargo esta situación no fue prácticamente significativa cuando se utilizaron las dos contaminaciones por separado. Los problemas de lesiones orales que aparecieron con la contaminación solo con aflatoxina T-2, estuvieron incrementados con la contaminación múltiple.
Otros parámetros que prácticamente permanecieron inalterados con el uso de las contaminaciones por separado, fueron gravemente afectados cuando se utilizo la contaminación con las dos micotoxinas.
2.9.6.- DIACETOXYSCIRPENOL, OCRATOXINA A, DIACETOXYSCIRPENOL + OCRATOXINA A.
La contaminación con las dos micotoxinas provoco una reducción de la ganancia de peso vivo y del peso vivo final, sin embargo esta situación no fue prácticamente significativa cuando se utilizaron las dos contaminaciones por separado. Los problemas de lesiones orales que aparecieron con la contaminación solo con aflatoxina T-2, estuvieron incrementados con la contaminación múltiple.
Otros parámetros que prácticamente permanecieron inalterados con el uso de las contaminaciones por separado, fueron gravemente afectados cuando se utilizo la contaminación con las dos micotoxinas.
2.9.6.- DIACETOXYSCIRPENOL, OCRATOXINA A, DIACETOXYSCIRPENOL + OCRATOXINA A.
1.- Pollitos de 1 día de vida que consumieron piensos contaminados con, 6 ppm de diacetoxyscirpenol (contaminación individual), 2 ppm de ocratoxina A (contaminación individual), 6 ppm de diacetoxyscirpenol + 2 ppm de ocratoxina A (contaminación conjunta), durante 19 días, tuvieron los siguientes problemas (109).
Todas las contaminaciones provocaron una disminución del peso vivo. En la contaminación solo con diacetoxyscirpenol y en la contaminación múltiple hubo una reducción de la eficacia nutricional del pienso.
La contaminación múltiple provoco un incremento del peso relativo del hígado y molleja y disminuyo la concentración de la proteína total y de la hemoglobina en el suero.
El 90% de los pollitos presentaron lesiones orales para todas las contaminaciones.
2.9.7.- FUMONISINA B1, TOXINA T-2, VOMITOXINA, FUMONISINA B1 + TOXINA T-2, FUMONISINA B1 + VOMITOXINA.
Todas las contaminaciones provocaron una disminución del peso vivo. En la contaminación solo con diacetoxyscirpenol y en la contaminación múltiple hubo una reducción de la eficacia nutricional del pienso.
La contaminación múltiple provoco un incremento del peso relativo del hígado y molleja y disminuyo la concentración de la proteína total y de la hemoglobina en el suero.
El 90% de los pollitos presentaron lesiones orales para todas las contaminaciones.
2.9.7.- FUMONISINA B1, TOXINA T-2, VOMITOXINA, FUMONISINA B1 + TOXINA T-2, FUMONISINA B1 + VOMITOXINA.
1.- Pollitos recién nacidos que consumieron piensos contaminados con, 300 ppm de fumonisina B1 (contaminación individual), 5 ppm de toxina T-2 (contaminación individual), 15 ppm de vomitoxina (contaminación individual), 300 ppm de fumonisina B1 + 5 ppm de toxina T-2 (contaminación conjunta), 300 ppm de fumonisina + 15 ppm de vomitoxina (contaminación conjunta), durante 19-21 días, tuvieron los siguientes problemas (110).
La ganancia de peso vivo se vio reducida en 18 a 20% para la contaminación solo con fumonisina B1, 18% para la de toxina T-2, 2% para la de vomitoxina, 32% para la combinación de fumonisina B1 y toxina T-2 y 19% para la combinación de fumonisina B1 y vomitoxina. La eficacia nutricional del pienso fue afectada preferentemente por la dieta con fumonisina B1, independientemente si existían o no las otras micotoxinas.
La mortalidad fue de un 15% para la contaminación conjunta con fumonisina B1 y toxina T-2. Los pesos relativos del hígado y riñones al igual que los niveles de colesterol en el suero, fueron aumentados en especial por la dieta con fumonisina B1, independientemente si existían o no las otras micotoxinas.
El incremento de los niveles de actividad de ciertas enzimas fue provocado por la dieta con solo fumonisina B1 y por las dietas con la combinación de esta micotoxina con la toxina T-2 o con la vomitoxina.
2.9.8.- STERIGMATOCISTINA + AFLATOXINA B1.
La ganancia de peso vivo se vio reducida en 18 a 20% para la contaminación solo con fumonisina B1, 18% para la de toxina T-2, 2% para la de vomitoxina, 32% para la combinación de fumonisina B1 y toxina T-2 y 19% para la combinación de fumonisina B1 y vomitoxina. La eficacia nutricional del pienso fue afectada preferentemente por la dieta con fumonisina B1, independientemente si existían o no las otras micotoxinas.
La mortalidad fue de un 15% para la contaminación conjunta con fumonisina B1 y toxina T-2. Los pesos relativos del hígado y riñones al igual que los niveles de colesterol en el suero, fueron aumentados en especial por la dieta con fumonisina B1, independientemente si existían o no las otras micotoxinas.
El incremento de los niveles de actividad de ciertas enzimas fue provocado por la dieta con solo fumonisina B1 y por las dietas con la combinación de esta micotoxina con la toxina T-2 o con la vomitoxina.
2.9.8.- STERIGMATOCISTINA + AFLATOXINA B1.
1.- Pollitos de 1 día de vida consumieron un pienso contaminado con, 350 ppb de esterigmatocistina + 100 ppb de aflatoxina B1, durante 4 semanas, tuvieron los siguientes problemas (111).
Disminución del peso vivo, índice de conversión deficiente y mortalidad.
Disminución del peso vivo, índice de conversión deficiente y mortalidad.
Nota: Después de las 4 semanas de consumir el alimento contaminado con micotoxinas, los pollos consumieron alimento no contaminado durante más 4 semanas.
2.9.9.- ACIDO PENICILLICO + AFLATOXINA B1.
2.9.9.- ACIDO PENICILLICO + AFLATOXINA B1.
1.- Pollitos de 1 día de vida que consumieron un pienso contaminado con, 0,850 ppm de ácido penicillico + 0,100 ppm de aflatoxina B1, durante 4 semanas, tuvieron los siguientes problemas (111).
Disminución del peso vivo, índice de conversión deficiente y mortalidad.
Disminución del peso vivo, índice de conversión deficiente y mortalidad.
Nota: Después de las 4 semanas de consumir el alimento contaminado con micotoxinas, los pollos consumieron alimento no contaminado durante más 4 semanas.
2.9.10.- OCRATOXINA A y DIACETOXYSCIRPENOL.
2.9.10.- OCRATOXINA A y DIACETOXYSCIRPENOL.
1.- En pollitos de 1 día de vida fueron suministradas dietas que contenían 2 ppm de ocratoxina A y 6 ppm de diacetoxyscirpenol, en combinación y separadamente, durante 19 días (112).
Los pesos de los pollitos decrecieron para todas las dietas. Hubo una significativa interacción antagonista entre ocratoxina A y diacetoxyscirpenol para ácido úrico y colesterol.
El índice de conversión empeoró con la dieta contaminada con 6 ppm de diacetoxyscirpenol y con la dieta en que estaban las dos micotoxinas. Con esta misma dieta, los pesos del hígado y riñón aumentaron y las lesiones en la boca fueron altamente significativas en un 90% de los pollos para la dieta conteniendo solo diacetoxyscirpenol y para la dieta en que estaban las dos micotoxinas.
2.10.- MAS SINERGISMOS.
Los pesos de los pollitos decrecieron para todas las dietas. Hubo una significativa interacción antagonista entre ocratoxina A y diacetoxyscirpenol para ácido úrico y colesterol.
El índice de conversión empeoró con la dieta contaminada con 6 ppm de diacetoxyscirpenol y con la dieta en que estaban las dos micotoxinas. Con esta misma dieta, los pesos del hígado y riñón aumentaron y las lesiones en la boca fueron altamente significativas en un 90% de los pollos para la dieta conteniendo solo diacetoxyscirpenol y para la dieta en que estaban las dos micotoxinas.
2.10.- MAS SINERGISMOS.
1.- Solo nos limitaremos a mencionar que existen numerosas referencias bibliográficas de la revista Poultry Science donde se describen mas estudios efectuados en pollos, sobre efectos sinérgicos de asociaciones tales como : citrinina y ocratoxina A., toxina T-2 y diacetoxyscirpenol., aflatoxina B1 y ocratoxina A., aflatoxina B1 y toxina T-2., aflatoxina B1 y vomitoxina ., toxina T-2 y ácido ciclopiazonico., aflatoxina B1 y ácido ciclopiazonico.
BIBLIOGRAFIA
BIBLIOGRAFIA
(1) Bains,B.S. (1979) A manual of Poultry Diseases - Ediciones Roche (F.Hoffmann - La Roche&Co. Limited Company), Basle, Switzerland, pp. 172-174.
(2) Faublee,V., and Boller,M. (1975) Rec.Med.Vet., 151, 8/9, 481-489.
(3) Serie de Publicaciones Científicas Reveex,S.A (1980), Reus, Tarragona, España, Volumen II, Tomo1, pp.34?50.
(4) Publicaciones Científicas Reveex S.A (1982) Micosis y Micotoxicosis en Avicultura, Vol II, nº 1, pp.45-48.
(5) Borrell,J.V., Gimeno,A., Martins, M.L.(1982) Serie de Publicaciones Cientificas Reveex S.A, Reus, Tarragona, España y Reveex Brasil, Sao Paulo, Brasil. Symposium de Micologia y Micotoxicologia, Brasil, 16 a 31 Octubre, pp. 1-200
(6) Jose A.Castello Llobet y Vicenç Sole Gondolbeu (1986) Manual Practico de Avicultura - Real Escuela Oficial y Superior de Avicultura - 2ª Edicion, pp.202-211.
(7) Bains,B.S. (1979) A manual of Poultry Diseases – Ediciones Roche (F.Hoffmann – La Roche&Co. Limited Company), Basle, Switzerland, pp. 175-176.
(8) George T.Edds (1979) "Aflatoxins" in Conference on Mycotoxins in Animal Feeds and Grains Related to Animal Health. W.Shimoda (Ed.). PB?300 300. Sponsored by: Bureau of Veterinary Medicine. Food and Drug Administration, June 8, report FDA/BVM-79/139. Rockville, Maryland (USA), pp.80?164.
(9) Carnaghan,R., Hartley,R., and O´ Kelly,J. (1963) Nature 200, 1101.
(10) Uraguchi,K., and Yamazaki,M. (1978) Toxicology - Biochemistry and Pathology of Mycotoxins.
(11) Tandon,H.D., and Tandon,B.N. (1981) International Symposium and Workshop on Mycotoxins, September 6-16, Cairo, Dokki, Egypt., Proceedings Book (1983) pp.271-276.
(12) Mirocha,C.J.(1977) XV Symposium Científico; Sección Española de la Asociación Mundial de Avicultura Científica (WPSA), Barcelona (España), 29 de Noviembre a 1 de Diciembre, pp.9?44.
(13) Stoloff,L. (1976) “Occurrence of Mycotoxins in Foods and Feeds” in Mycotoxins and Other Fungal Related Food Problems, J.V.Rodricks (Ed.), American Chemical Society, Washington,D.C., pp.23-50.
(14) Butler,W.H. (1974) “Aflatoxin” in Mycotoxins, I.F.H. Purchase (Ed.), Elsevier Press, Amsterdam, The Netherlands, p.10.
(15) Rodricks,J.V., and Stoloff,L. (1977) “Aflatoxin Residues from Contaminated Feed in Edible Tissues of Food-Producing Animals” in Mycotoxins in Human and Animal Health, J.V.Rodricks, C.W.Hesseltine, and M.A.Mehlman (Eds.), Pathotox Publishers, Inc, Park Forest South,IL, pp.67-79.
(16) Stoloff, L. (1977) “Aflatoxins-An Overview” in Mycotoxins in Human and Animal Health, J.V.Rodricks, C.W.Hesseltine, and M.A.Mehlman (Eds.), Pathotox Publishers, Inc, Park Forest South,IL, pp.7-28.
(17) Guerge,J., and Ramirez,C. (1977) Ann.Nutr.Alim., 31, 485-488.
(18) Boutrif,E., Jemmali,M., Campbell,A.D., and Pholand,A.E. (1977) Ann.Nutr.Alim., 31, 415-424.
(19) Bainton,J., and Jones,B.D. (1977). Ann.Nutr.Alim., 31, 415-424.
(20) Juszkiewicz,T., and Piskorska - Pliszczynska,J. (1977) Ann.Nutr.Alim., 31, 489-493.
(21) Patterson,D.S.P., Roberts,B.A., Shreeve,B.J., Wrathall,A.E., and Gitter,M. (1977) Ann. Nutr.Alim., 31, 643-650.
(22) Walbeek Van. (1973) Microbial Food-Borne Infections and Intoxications, April 1973, pp.78-87.
(23) Neelakantan,S., Theymoli,B., Indira,J., and Balasaraswathi,R. (1981) International Symposium and Workshop on Mycotoxins, September 6-16, Cairo, Dokki, Egypt., Proceedings Book (1983), pp.417-422.
(24) Masimango,N.T., and Kalengayi,M.M.R. (1981) International Symposium and Workshop on Mycotoxins, September 6-16, Cairo, Dokki, Egypt., Proceedings Book (1983), pp.431-435.
(25) Van Egmond,H.P., Paulsch,W.E., Sizoo,E.A., and Schuller,P.L. (1982) International IUPAC Symposium on Mycotoxins and Phycotoxins, Vienna, Austria, Sept. 1-3, pp. 72-75 (Proceedings Book).
(26) Fremy,J.M., Cariou,T., and Bonnet,C. (1982) International IUPAC Symposium on Mycotoxins and Phycotoxins, Vienna, Austria, Sept. 1-3, pp. 80-83 (Proceedings Book).
(27) Wyatt,R.D.(1977) XV Symposium Cientifico Sección Española de la Asociación Mundial de Avicultura Científica (WPSA), Barcelona, España, 29 de Noviembre a 1 de Diciembre, pp.45?51.
(28) Sharma,R.P.(1993) J.Dairy Sci., 76(3): 892-897
(29) Wogan,G.N. (1966) Bacteriol. Rev. 30, 460-470 and Wogan,G.N. (1969) Prog. Exptl. Tumor Res. 11, 134-162.
(30) George T.Edds (1979) “Aflatoxins” in Conference on Mycotoxins in Animal Feeds and Grains Related to Animal Health, W.Shimoda (Ed.) PB-300 300. Sponsored by: Bureau of Veterinary Medicine, Food and Drug Administration, June 8, Rokville, Maryland (USA), pp.138-145.
(31) Smith,J.W., and Hamilton,P.B. (1970) Poultry Science, 49, 207-215.
(32) Lanza, GM., Washburn,K.W., and Wyatt,R.D. (1980) Poultry Science, 59(2): 282-288
(33) Asplin, F.D., and Carnaghan,R.B.A. (1961) Vet.Rec., 73, 1215.
(34) Allcroft,R., Mycotoxins in Foodstuffs by Wogan,G.N. (1965) MIT Press, pp. 154-160.
(35) Doerr,J.A., Huff,W.E., Wabeck,C.J., Chaloupka,G.W., May,J.D., and Merkley,J.W (1983) Poultry Science, 62(10): 1971-1977.
(36) Cottier et al. (1968) Highlights Agr. Res., 15,7.
(37) Huff,W.E., Kubena, L.F., Harvey,R.B., Corrier,D.E., and Mollenhauer,H.H. (1986) Poultry Science, 65(10): 1891-1899.
(38) (a) Smith,F.W., and Hamilton,P.B. (Departments of Poultry Science. Received for publication, October 19, 1970), The effect of dietary modifications on aflatoxins in the broiler chicken. (b) Hamilton,P.B. (1978) Symposium Kemin - Xanco, Barcelona (España) 29 de Mayo y Madrid (España) 30 de Mayo, pp.1-23.
(39) Smith,T.K. (1982) Fed.Proc., 41(11), pp.2828-2832.
(40) Patel,J.M. (1974) Biochem. Pharmacol., 23, pp.1467-1477.
(41) Pont,J.G., Jordana,J.AJ., Campanera,J.M.P., Arroyo,R. “El problema de la Contamina- ción Fungica en la Industria de Piensos”. División Zootecnica, Lucta,S.A., editado por Lucta,S.A., pp.16-18.
(42) Bryden,W.L. (1977) Brit.J.Nutr., 41, pp.529-540.
(43) Smith,J.W. (1970) Poultry Science, 49, pp.207-215.
(44) Hamilton,P.B. (1976) Feedstuffs, 48 (12), pp.22-23.
(45) Doerr,J.A. (1976) Toxicol. Appl. Pharmacol., 35, pp.437-446.
(46) Hagler,W.M. (1982) Dev.Ind.Microbiol., 23, pp.257-256.
(47) Patel,J.M. (1974) Biochem.Pharmacol., 23, pp.1467-1477.
(48) Patel,J.M. (1974) Biochem.Pharmacol., 23, pp.1467-1477.
(49) Doerr,J.A., Huff,W.E., Tung,H.T., Wyatt,R.D., and Hamilton,P.B. (1974) Poultry Science, 53, 1728-1734.
(50) Fernandez,A., Maria Teresa Verde., Gascon,M., Ramos,J., Gomez,J., Luco,D.F., and Chavez,G. (1994) Avian Pathology, 23,37-47.
(51) Vohara,P. (1978) Aflatoxicosis in Poultry. California Agriculture, University of California, 385. Univ, Berkley, CA 94720 (Extension Release).
(52) Rodricks J.V., and Stoloff,L. (1977) “Aflatoxin Residues from Contaminated Feed in Edible Tissues of Food-Producing Animals” in Mycotoxins in Human and Animal Health. Edited by : Joseph V.Rodricks, Clifford H.Hesseltine and Myron A.Melhman. Pathotox Publishers, INC . Park Forest South Illinois., pp.75-76.
(53) Edds,G.T., Nair,K.P.C., and Simpson,C.F. (1973) Am.J.Vet.Res., 34, 819-826.
(54) Galikeev,K.L., Raipor,O.R., and Manysheva,R.A (1968) Byall.Eksp.Biol.Med., 65, 88-90.
(55) Edds,G.T., Nair,K.P.C., and Simpson,C.F. (1976) Am.J.Vet.Res., 37, 65-68.
(56) Pier,A.C., Richard,J.L., and Thurston,J.R. (1978) Interactions of Mycotoxins in Animal Production, Washington:National Academy of Sciences., pp.56-66.
(57) Hamilton,P.B., and Harris,J.R. (1971) Poultry Science, 50, 906-912.
(58) Huff,W.E. (1980) Poultry Science, 59(10): 2213-2215.
(59) Carlton,W.W., and Krogh,P. (1979) “Ochratoxins” in Conference on Mycotoxins in Animal Feeds and Grains Related to Animal Health. W.Shimoda (Ed.). PB-300 300. Sponsored by Bureu of Veterinary Medicine. Food and Drug Administration. Rockville,MD, June 8, report FDA/BVM-79/139, pp.165-287.
(60) Chapman,W.B., Cooper,S.J., Norton,D.M., Williams,A.R., and Jarvis,B. (1981) International Symposium and Workshop on Mycotoxins, September 6-16, Cairo, Dokki, Egypt. Proceedings Book (1983), pp.363-378.
(61) Krogh,P. (1977) “Ochratoxins” in Mycotoxins in Human and Animal Health. Edited by : Joseph V. Rodricks, Clifford H.Hesseltine and Myron A.Melhman. Pathotox Publishers, INC. Park Forest South Illinois., pp.488-506.
(62) Pepeljnjak,S., and Blazevic,N. (1982) V International IUPAC Symposium on Mycotoxins and Phycotoxins, Vienna, Austria, Sept.1-3, pp.102-105 (Proceedins book).
(63) Harwing,J. (1974)”Ochratoxin and Related Metabolites” in Mycotoxins. I.F.H.Purchase (Ed.). Elsevier, Amsterdam, The Netherlands, pp.361-362.
(64) Huff,W.W., Wyatt,R.D., and Hamilton,P.B. (1975) Appl.Microbiol., 30,48-51.
(65) Krogh,P., Elling,F., Hald,B., Jylling,B., Petersen,V.E., Shadhauge,E., and Svendsen,C.K. (1976) Acta Path.Microbiol.Scand.A., 84,215-221.
(66) (a) Hamilton,P.B., Huff,W.E., Harris,J.R., and Wyatt,R.D. (1977) Amer. Microbiol. Soc .Ann.Meeting, p.248. (b) Hamilton,P.B., Huff,W.E., Harris,J.R. (1977) Poultry Science, 56, 1719.
(67) Tucker,T.L., and Hamilton,P.B. (1971) Poultry Science, 50, 1637.
(68) Huff,W.W., Wyatt,R.D., Tucker,T.L., and Hamilton,P.B. (1974) Poultry Science,53, 1585-1591.
(69) Huff,W.E., and Hamilton,P.B. (1975) Poultry Science, 54, 1659-1662.
(70) Chang,C.F., Huff,W.E., and Hamilton,P.B.(1979) Poultry Science, 58, 55-558.
(71) Dwivedi,P., Burns,R.B., and Maxwell,M.H. (1984) Res.Vet.Sci., 36, 104-116.
(72) Huff,W.E., Chang,C.F., Warren,M.F., and Hamilton,P.B. (1979) Appl.Environ.Microbiol., 37,601-604.
(73) Huff,W.E., Doerr,J.A., Hamilton,P.B., Hamann,D.D., Peterson,R.E., and Ciegler,A. (1980) Appl.Environ.Microbiol, 40, 102-107.
(74) Abramson,D., Mills,J.T., and Boycott,B.R. (1983) Can.J.Comp.Med., 47, 23-26.
(75) Smalley,E.B., and Strong,F.M. (1974) in Mycotoxins. I.F.H. Purchase (Ed.). Elsevier Scientific Publishing Co., Amsterdam, The Netherlands, pp..198-228.
(76) Ueno,Y. (1977) “Trichothecenes: Overview Address” in Mycotoxins in Human and Animal Health. J.V Rodricks, C.W.Hesseltine, M.A. Melhman (Eds.). Pathotox Publishers, Inc, Park Forest South,IL., pp. 187-207.
(77) Mirocha,C.J. (1979) “Trichotecene Toxins Produced by Fusarium” in Conference on Mycotoxins in Animal Feeds and Grains Related to Animal Health. W.Shimoda (Ed.). PB-300 300. Food and Drug Administration, Rockville,MD,June8, report FDA/BVM-79/139, pp.288-373.
(78) Bamburg,J.R. (1976) “Chemical and Biochemical Studies of the Trichothecene Mycotoxins” in Mycotoxins and Other Fungal Related Food Problems. J.V.Rodricks (Ed.). American Chemical Society, Washington, DC, pp.144-162.
(79) Pathre,S.V., and Mirocha,C.J. (1977) “Assay Methods for Trichothecenes and Review of Their Natural Occurrence” in Mycotoxins in Human and Animal Health. J.V Rodricks, C.W.Hesseltine, M.A. Melhman (Eds.). Pathotox Publishers, Inc, Park Forest South,IL., pp. 229-253.
(80) Ohtsubo,K., and Saito,M. (1977) “Chronic Effects of Trichothecene Toxins” in Mycotoxins in Human and Animal Health. J.V Rodricks, C.W.Hesseltine, M.A. Melhman (Eds.). Pathotox Publishers, Inc, Park Forest South,IL., pp. 254-262.
(81) Sato,N., and Ueno,Y. (1977) “Comparative Toxicities of Trichothecenes” in Mycotoxins in Human and Animal Health. J.V Rodricks, C.W.Hesseltine, M.A. Melhman (Eds.). Pathotox Publishers, Inc, Park Forest South,IL., pp. 294-307.
(82) Betina,V. (1989) “Trichothecenes” in Mycotoxins, Chemical, Biological and Environmental Aspects. Elsevier Science Publishing Company,Inc., New York, USA., Vol.9, pp. 193-238.
(83) Mirocha,C.J. (1979) “Trichotecene Toxins Produced by Fusarium” in Conference on Mycotoxins in Animal Feeds and Grains Related to Animal Health. W.Shimoda (Ed.). PB-300 300. Food and Drug Administration, Rockville,MD,June8, report FDA/BVM-79/139, pp.288-373.
(84) Chi,M.S., Mirocha,C.J., Kurtz,H.J., Weaver,G., Bates,F., and Shimoda,W. (1977) Poultry Science, 56, 306-313 and 628-637.
(85) Wyatt,R.D., Hamilton,P.B., and Burmeister,H.R.(1973) Poultry Science, 52,1853- 1859.
(86) Wyatt,R.D., Hamilton, P.B., and Burmeister,H.R. (1972) Appl.Microbiol., 24, 251-257.
(87) Carlton,W.W. (1980) “Penicillic acid, Citrinin and Xanthomeguin Quinone Metabolites” in Conference on Mycotoxins in Animal Feeds and Grain Related to Animal Health, W.Shimoda (Ed.), PB 80?221773. Food and Drug Administration, Rockville,MD, June 13, report FDA/BVM?80/132, pp.233?345.
(88) Gimeno,A., and Martins,M.L. (1983) J.Assoc.Off.Anal.Chem., 66, 85-91.
(89) Romer,T.R. (1983) Feedstuffs. April 11, pp.30-31.
(90) Halloran,H.R. (1983) Feedstuffs. May 2, p.18.
(91) Christensen,C.M. (1979) “Zearalenone” in Conference on Mycotoxins in Animal Feeds and Grains Related to Animal Health. W.Shimoda (Ed.). Sponsored by Bureau of Veterinary Medicine. Food and Drug Administration, Rockville, Maryland,USA, PB-300 300, Jun 8, pp.1-79.
(92) Mirocha,C.J., Pathre,S.V., and Christensen,C.M. (1977) “Zearalenone” in Mycotoxins in Human and Animal Health. J.V Rodricks, C.W.Hesseltine, M.A. Melhman (Eds.). Pathotox Publishers, Inc, Park Forest South,IL., pp. 345-416.
(93) Betina,V. (1989) “Zearalenone” in Mycotoxins, Chemical, Biological and Enviromental Aspects. Elsevier Science Publishing Company,Inc (Amsterdam, Oxford, New York, Tokyo), Vol.9, pp.271-284.
(94) Mirocha,C.J., and Christensen,C.M. (1974) “Oestrogenic Mycotoxins Synthesized by Fusarium” in Mycotoxins. I.F.H. Purchase (Ed.). Elsevier Scientific Publishing Company, pp.129-148.
(95) Mirocha,C.J., Weaver,G., Whitmore,H.L., Allen,N., Pathre,S.V., Robison,T.S., Bates,F., and Kurtz,H. (1978) “Pharmacological and Toxicological Studies on Zearalenone in food producing animals” in Quaterly Report IV. Contract No. 233-77-7211. FDA.
(96) Bacon,C.W., and Marks,H.L. (1976) Poultry Science, 55, 1531-1535.
(97) Wilson,B.J., and Harbison, R.D. (1973) J.Amer.Vet.Med.Assoc. 163, 1274-1276.
(98) Wyatt,R.D., and Hamilton,P.B. (1972) Poultry Science, 51, 1383-1387.
(99) Marasas,W.F.O. (1995) Natural Toxins. Vol 3, No.4, pp.193-198.
(100) Visconti,A., Boenke,A., Bruno Doko,M., Solfrizzo,M., and Pascale,M. (1995) Natural Toxins. Vol 3, No. 4, pp.269-274.
(101) Prelusky,D.B., Rotter,B.A., and Rotter,R.G. (1974) “Toxicology of Mycotoxins” in Mycotoxins In Grain. J.D.Miller and H.L. Trenholm (Eds.) Eagan Press, St.Paul, Minnesota, USA. pp.376-379.
(102) Espada,Y., Gopegui,R.R., Cuadradas,C., and Cabañes,F.J. (1994) Avian Diseases, 38,454-460.
(103) Weibking,T.S., Ledoux,D.R., Bermudez,A.J., Turk,J.R., and Rottinghaus,G.E. (1993) Poultry Science, 72, 456-466
(104) Abdelhamid,A.M., and Dorra, T.M. (1993) Arch.Tierernahr., 44(1): 29-40.
(105) Huff, W.E., Kubena, L.F., Harvey, R.B., Hagler, W.M Jr., Swanson, S.P., Phillips, T.D., and Creger,C.R. (1986) Poultry Science, 65(7): 1291-1298.
(106) Huff,W.E., Harvey, R.B., Kubena,L.F., and Rottinghaus, G.E. (1988) Poultry Science, 67(10): 1418-1423.
(107) Kubena, L.F., Harvey, R.B., Huff, W.E., Corrier, D.E., Philips, T.D., and Rottinghaus, G.E. (1989) Poultry Science, 68(7): 867-872.
(108) Kubena,L.F., Huff,W.E., Harvey,R.B., Phillips,T.D., and Rottinghaus,G.E. (1989) Poultry Science, 68(5): 622-626.
(109) Kubena,L.F., Harvey,R.B., Edrington,T.S., and Rottinghaus,G.E. (1994) Poultry Science, 73(3): 408-415.
(110) Kubena,L.F., Edrington,T.S., Harvey,R.B., Buckley,S.A., Phillips,T.D.,Rottinghaus,G.E., and Casper. (1997) Poultry Science, 76(9): 1239-1247.
(111) Abdelhamid,A.M., and Dorra,T.M. (1993) Arch.Tierernahr., 44(1):29-40.
(112) Kubena,L.F., Harvey,R.B., and Edrington,T.S. (1994) Poultry Science, 73, 408-415.
(113) Lanza, G.M.; Washburn, R.W.; Wyatt, R.D. (1980). Poultry Science, 59: 282-288.
.
Temas relacionados
Autores:
Alberto Gimeno
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación
30 de mayo de 2006
¿Cuáles serían los principales diagnósticos diferenciales para las lesiones orales en los pollos?




