El empleo de los antibióticos promotores del crecimiento (APC), como aditivo en la alimentación animal desde hace más de 50 años, ha mostrado la posibilidad de generar microorganismos resistentes a este tipo de antibióticos (1). En 2006, se prohibieron en la comunidad europea y se estudian alternativas a los APC(2).
En la alimentación de las aves se utilizan cereales y otros granos, los cuales se pueden contaminar con hongos. Los del genero Aspergillus; algunas especies producen compuestos heterocíclicos denominadas aflatoxinas cuyos efectos biológicos sobre los organismos pueden ser carcinogénicos, mutagénicos y teratogénicos. Estos efectos son influidos por variaciones de especie, sexo, edad, estado nutricional, efectos con otros químicos, dosis y el período de exposición(3,4).
El problema que producen es hepatotóxico, pudiendo provocar también problemas renales (3). Su efecto citotóxico se debe por la peroxidación de lípidos; las aflatoxinas también inhiben la síntesis de DNA y RNA, producen transversiones de guanina por timina, e inducen la separación de DNA, que se traduce en mutaciones y formación de tumores (efectos carcinogénicos, mutagénicos y teratogénicos) (5). Se ha encontrado un efecto en la reducción la síntesis de vitamina K y un efecto inmunodepresor (6).
Para evitar el efecto nocivo de las aflatoxinas, se debe evitar su producción por parte del hongo, la destoxificación de alimento y bodegas contaminados y por último, la inhibición de la absorción de aflatoxinas en el tracto digestivo(3).
Las paredes celulares de levaduras de Saccharomyces cerevisiae (PCL) pueden ser una alternativa a los APC(7).
Los oligosacáridos (8) de las PCL de Saccharomyces cerevisiae en su mayoría son β-glucanos y mananooligosacáridos (MOS). El porcentaje de oligosacáridos presentes en las PCL es del 85 al 90 % siendo el 10 o el 15 % restante proteínas. Estudios con la suplementación de PCL(9,10,11), fracciones purificadas de estas en dietas para pollos y pavos mejoraron los parámetros productivos (11,12).
Los mecanismos específicos de acción no han sido determinados, pero se detectó un efecto positivo sobre integridad intestinal (13) exclusión de patógenos e inmunoestimulación contra infecciones por Salmonella (14,15). En un estudio, se demostró la capacidad de los MOS para secuestrar aflatoxina B1 (AFB1) reduciendo su absorción gastrointestinal (16). Por otra parte, la administración de β-glucanos en modelos murinos demostraron efecto positivo y adyuvante en la respuesta inmune (17-21).
Su uso en dietas para perros, aumentó la actividad de los neutrófilos en respuesta a la vacunación (22). Con estos antecedentes se planteó el presente estudio, para evaluar la adición de PCL en dietas con base en sorgo-soya, con y sin un contaminante, para pollos de engorda en su comportamiento productivo y respuesta inmunológica.
MATERIALES Y MÉTODOS
Se realizaron 2 experimentos; todos los procedimientos de manejo que involucraron a las aves cumplieron con los requisitos señalados por el Comité Institucional para el cuidado y uso de los animales experimentales (CICUAE FMVZUNAM con base en la Norma Oficial Mexicana NOM-062-ZOO-1999). La temperatura de crianza fue disminuida gradualmente iniciando con 32 ºC, hasta llegar a 21 ºC en el día 28 de edad. Las dietas empleadas en los tratamientos fueron a base de sorgo-soya. El agua y el alimento se proporcionaron a libre acceso.
Experimento 1
Se realizó con 432 pollitos mixtos (50 y 50 % de cada sexo) Ross 308, de 1 día de edad, los cuales se alojaron de manera aleatoria en 12 pisos con cama de viruta de madera. Se empleó un diseño completamente al azar de cuatro tratamientos, con tres réplicas de 36 pollos cada una. Tratamiento 1, dieta testigo (iniciación y finalización) sin promotores de crecimiento; Tratamiento 2, como 1 + PCL (Safmannan.Lesaffre Feed Additives) 0.05 %; Tratamiento 3, como 1 + APC (Bacitracina cinc 30 ppm); y Tratamiento 4, como 1 + 0.05 % PCL y 30 ppm de APC (Cuadro 1).
Experimento 2
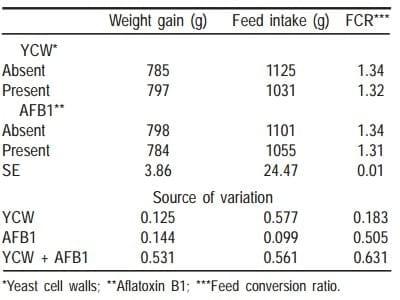
Se emplearon 144 pollitos mixtos (50 y 50 % de cada sexo) Ross 308, de 1 dia de edad, los cuales se alojaron de manera aleatoria en baterías de ambiente controlado Petersime. Se empleó un diseño completamente al azar, con arreglo factorial 2 x 2, con sies réplicas de seis pollos cada una. Un factor fue con y sin la adición de 0.05 % PCL a la dieta testigo de iniciación (Cuadro 1) y el otro factor con y sin la contaminación de 400 mg/t de AFBI.
Las aflatoxinas se obtuvieron por contaminación natural de maíz, con Aspergillus flavus link; el cual produce aflatoxinas B1 y B2. El material cuantificado en aflatoxina B1 fue donado por la unidad de investigación en granos y semillas de la Facultad de Estudios Superiores Cuautitlán de la Universidad Nacional Autónoma de México.
Las aves y el alimento se pesaron, para obtener datos de la ganancia de peso, el consumo de alimento e índice de conversión. Los datos obtenidos fueron de 0 a 21 días y de 0 a 49 días de edad, si había un efecto.
Respuesta inmune humoral. Para conocer si existía efecto inmunoestimulante de PCL a nivel sistémico, se realizó una vacunación simultánea, por vía ocular virus vivo y vía subcutánea, virus inactivado con el virus de la enfermedad Newcastle. A los diez días de edad en el Exp 1, se tomaron muestras de sangre a los días 7 y 14 días post-vacunación (cinco muestras/réplica). Para el Exp 2, las muestras se tomaron los días 4 y 11 días post-vacunación (9 muestras/tratamiento), se obtuvieron los sueros y se congelaron a -20 ºC, para posteriormente determinar títulos de anticuerpos séricos específicos para el virus de Newcastle con la prueba de Inhibición de la hemoaglutinación.
IgA traqueal
Con hisopos estériles, se tomaron muestras en el Exp 2 de exudados traqueales, el día 21 de edad (cinco muestras/ tratamiento), que se colocaron en tubos con PBS estéril y se centrifugaron a 1,200 xg, se tomó el sobrenadante y se congeló a -20 ºC para su posterior evaluación con la prueba de ELISA.
IgA intestinal
En el Exp 1, se sacrificaron por dislocación cervical 10 pollos por tratamiento, se tomaron 10 cm de duodeno, posteriormente se realizaron lavados con 10 ml de PBS frío y estéril, pasando tres veces el PBS en la fracción del lumen intestinal, se recolectó y se centrifugó a 1,200 xg; se tomó el sobrenadante y se congeló a -20 ºC para su posterior evaluación con la prueba de ELISA.
ELISA
Las placas de 96 pozos de fondo plano se cubrieron con IgA (Chicken IgA ELISA1 Quantitation Kit Bethyl Laboratories Inc PO Box 850 Montgomery TX 77356) de pollo previamente reconstituida en buffer de carbonatos (0.05M pH 9.6) toda la noche a 4 ºC. Se lavaron tres veces con PBS adicionado de Tween-20 al 0.05 %, Se añadió solución de bloqueo PBS leche descremada al 0.5 %, Sacarosa 0.2 %, se lavaron y se depositaron las muestras de los lavados intestinales y traqueales y se incubaron 1 h a 37 ºC. Posteriormente se retiraron y se lavaron cinco veces con PBS Tween-20 al 0.05 %.
Se añadió el conjugado HRP (goat anti-chicken IgA-HRP de Bethyl Laboratorios Inc.) incubándose, y nuevamente se realizaron cinco lavados, para añadir el sustrato ABTS (2,2'-azino-bis(3-ethylbenzthiazoline-6-sulphonic acid), con el que se incubó durante 20 min, la reacción se detuvo con la adición de solución de paro (H2 SO4 2M) se realizó la lectura de la absorbancia 405 nm en un espectrofotómetro Beckton Dickenson.
Respuesta inmune celular
Hipersensibilidad cutánea basofílica. La evaluación se llevó a cabo en ambos experimentos, el día 14 de edad mediante una prueba de hipersensibilidad tardía (23), como respuesta a la inoculación intradérmica en la membrana interdigital de las falanges 3 y 4 de la extremidad inferior derecha, empleándose 2 pollos/ réplica, 12/tratamiento, con Phitoheamaglutinina (PHA-A Sigma-Aldrich, Inc) a una concentración de 0.1 mg/0.1 ml. En la membrana interdigital de la pata izquierda, se realizó el mismo procedimiento utilizando solución salina estéril (0.1 ml) como testigo. A las 24 h pos-inoculación, se determinó el grosor de la membrana interdigital con un vernier digital.
Hematología
Se tomaron muestras de sangre con s-monovette EDTA (Sarstedt AG & Co) de las venas radiales de tres pollos por réplica /tratamiento los días 21, 35 y 49 (Exp 1). Se realizó el conteo leucocitario diferencial en frotis sanguíneos teñidos con Wright,
Las cuentas totales se determinaron indirectamente por el cálculo de los porcentajes de la célula y de cuentas totales (24).
Histología
En el Exp 1, se sacrificaron 10 de pollos de cada tratamiento a los 21 días de edad, se tomaron muestras de tejido intestinal de 2 cm de longitud, posteriores al divertículo Meckel, se fijaron en formalina buferada al 10 %, para posteriormente ser procesados, montados en portaobjetos y teñidos con hematoxilina-eosina (Sigma Aldrich) conforme al método de rutina convencional (25), para su posterior observación y evaluación mediante microscopía óptica. Se midió en micras (µ) la longitud y el grosor de las vellosidades intestinales.
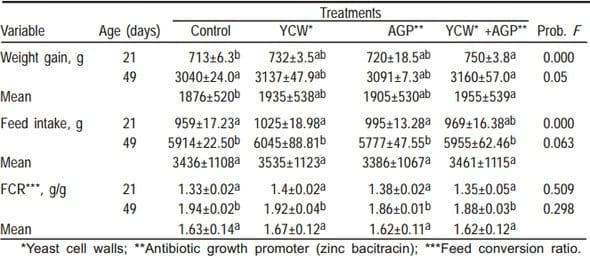
Cuadro 2. Efecto de la adición paredes celulares de levadura y Bacitracina cinc en dietas de pollos de engorda de 0 a 21 y 0 a 49 días de edad (Exp. 1)
Análisis estadístico
Los resultados obtenidos de las variables en estudio, se analizaron estadísticamente mediante análisis de varianza conforme al diseño experimental empleado.
Las variables productivas así como el índice hematológico del Exp 1, se analizaron mediante un diseño completamente al azar con mediciones repetidas según el procedimiento GLM del paquete estadístico SAS(26). Cabe mencionar también, que
los títulos de anticuerpos en ambos experimentos, se sometieron a una transformación logarítmica base 2.
RESULTADOS
Experimento 1
Los resultados de las variables productivas, se muestran en el Cuadro 2. Se puede apreciar que la ganancia de peso, (P<0.05), mejoró con la adición de PCL, APC y la suplementación conjunta de PCL y APC. Para consumo de alimento y conversión alimenticia, no se detectaron diferencias entre los tratamientos (P>0.05).
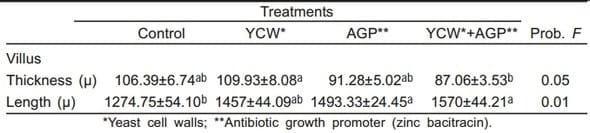
La inclusión de PCL y APC en la dieta de los pollos incrementó la longitud de las vellosidades intestinales, siendo mayor este efecto con la adición conjunta (P<0.01); sin embargo, el grosor de las vellosidades (P<0.05) disminuyó con la suplementación de ambos promotores (Cuadro 3).
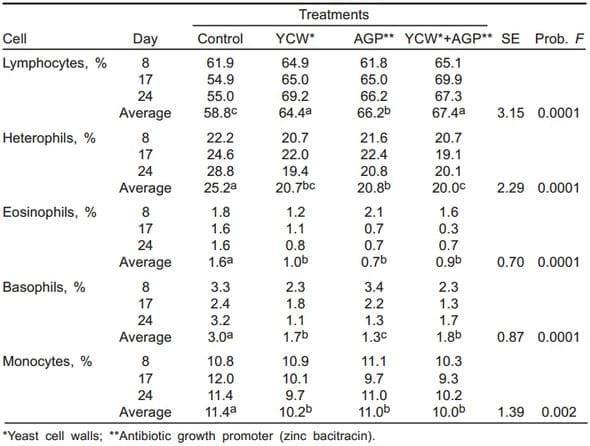
El perfil hematológico mostró diferencias significativas entre tratamientos (P<0.01) en linfocitos, heterófilos, eosinófilos, basófilos y monocitos (Cuadro 4). Se observa en general que los linfocitos aumentaron al adicionar los promotores de crecimiento en la dieta; sin embargo, el porcentaje de heterófilos, eosinófilos, basófilos y monocitos disminuyó (P<0.01) con la suplementación de PCL Y APC.
Cuadro 3. Grosor y longitud de las vellosidades intestinales en duodeno de pollos suplementados con paredes celulares de levadura y bacitracina cinc (Exp. 1)
Cuadro 4. Indices hematológicos en pollos de engorda con paredes celulares de levadura y bacitracina cinc (Exp. 1)
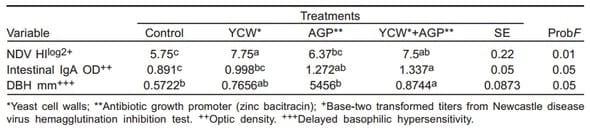
La respuesta inmune humoral sistémica que aparece en el Cuadro 5, mostró que los títulos de anticuerpos séricos contra el virus de la enfermedad de Newcastle, en los tratamientos con PCL y APC+PCL fueron mayores (P<0.05).
La respuesta inmune humoral local, cuantificando la concentración de IgA intestinal; fue mayor (P<0.05) en los tratamientos con PCL+APC. Para la respuesta celular evaluada con la prueba de hipersensibilidad tardía basofílica, se encontró un aumento en el grosor interdigital (P<0.05) en los pollos suplementados con PCL+APC.
Cuadro 5. Respuesta inmune humoral y celular en dietas de pollo de engorda con paredes celulares de levadura y bacitracina cinc (Exp. 1)
Experimento 2
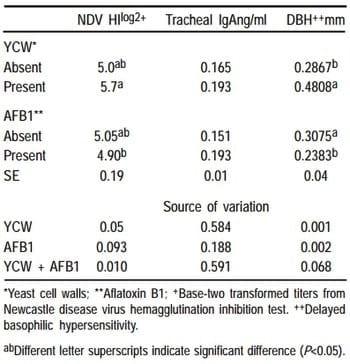
En el Cuadro 6, se aprecia que no se encontró diferencia (P>0.05) entre factores, para ganancia de peso, consumo de alimento y conversión alimenticia.
En el Cuadro 7, a los 11 días postvacunación (21 dias de edad), se nota que los títulos de anticuerpos fueron mayores (P<0.05) para la adición de PCL.
En la evaluación de IgA traqueal no se encontró diferencia entre los factores, ni efecto de interacción.
Para la respuesta celular evaluada con la prueba de hipersensibilidad tardía basofílica, aumentó el grosor interdigital (P<0.05) en los pollos por la adición de PCL, y hubo disminución con el factor aflatoxina (P<0.01).
En el perfil hematológico, se mostró un efecto de interacción (P<0.05) PCL x AFB1 en los leucocitos, linfocitos y heterófilos (Cuadro 8). Se aprecia que los leucocitos aumentaron con la suplementación de PCL, siendo mayor el porcentaje con la dieta sin contaminar, y los heterófilos disminuyeron con todas las dietas excepto el testigo.
La población de linfocitos se incrementó con la adición de PCL; sin embargo en los pollos con las dietas contaminadas con AFB1 no se notó un efecto significativo.
DISCUSIÓN
La tendencia mundial hacia la eliminación de antibióticos promotores del crecimiento (APC) en los alimentos balanceados, ha originado una búsqueda de alternativas con beneficios similares a los APC. Las PCL de Saccharomyces cerevisiae adicionadas en dietas sorgo-soya al 0.05% mejoraron la ganancia de peso de los pollos (P<0.05) a los 49 días de edad, de manera similar a la bacitracina, este efecto promotor del crecimiento concuerda con lo encontrado por algunos autores (9)
.
Este efecto promotor del crecimiento fue potenciado cuando se administraron de manera simultánea PCL y el antibiótico. Además, los resultados de este estudio confirman lo reportado por algunos autores (10,13), quienes señalan que varios promotores nutricionales influyen en la función del intestino, ya que las PCL de Saccharomyces cerevisiae favorecieron la longitud de las vellosidades intestinales, ejerciendo un efecto positivo en el tamaño (P<0.01), esto a su vez pudiera favorecer la superficie de absorción de nutrientes.
Los resultados del comportamiento productivo en el Exp 2, no se afectaron con la inclusión de AFB1 (400 µg/kg). Experimentalmente niveles 500 µg/kg durante tres semanas no causan reducción en el peso de los pollos (27) ; se ha observado reducción en el peso de las aves, con este nivel cuando se consume durante cuatro semanas (28) . Díaz et al (29), proponen que la aflatoxicosis en aves puede generar un efecto de hormesis, fenómeno toxicológico que se caracteriza por estimular a dosis bajas e inhibir a dosis altas, la respuesta en los parámetros productivos.
Cuadro 7. Efectos mayores de la inclusión paredes celulares de levadura en la respuesta inmune humoral y celular (Exp.2)
La respuesta a la vacunación para evaluar funciones inmunes efectoras, como anticuerpos específicos para la enfermedad de Newcastle, indicó, que la adición de PCL incrementó el título de anticuerpos.
Esto concuerda con lo publicado con algunos investigadores(30), quienes utilizaron una fracción purificada de PCL (mananoligosacáridos) y mostraron un aumento significativo en el título de anticuerpos en las reproductoras; así como, en la progenie.
Cuadro 8. Perfiles hematológicos mayores en pollos alimentados con dietas adicionadas con paredes celulares de levadura y aflatoxina B1 (Exp. 2)
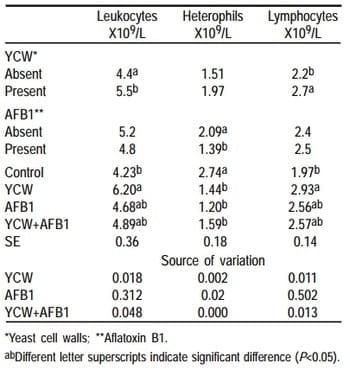
Los hemogramas del Exp 1 indicaron un aumento de los linfocitos, lo que pudiera indicar que las PCL favorecieron el aumento de esta población celular, implicada de forma importante en la respuesta inmune. En los hemogramas del Exp 2, hubo cambios sólo en las poblaciones de leucocitos, heterófilos y linfocitos. Los pollos con aflatoxinas disminuyeron el porcentaje de leucocitos, neutrófilos y linfocitos en comparación con el tratamiento testigo provocando un estado de inmunodepresión (31), esto puede deberse a lo descrito por Celik et al (32), quienes demostraron que en la inmunodepresión que inducen las aflatoxinas no sólo se deprimen las funciones celulares, sino también se disminuye el número de linfocitos T en sangre periférica y en tejidos linfoides. La dosis inmunotóxica de las aflatoxinas fue relativamente más baja, que las dosis necesarias para producir un decremento en el peso (32)
.
Esto pudiera explicar que en el Exp 2 no se encontró efecto en los parámetros productivos, pero en el caso de las variables inmunológicas sí se encontró un efecto inmunodepresor por parte de la aflatoxina B1.
La respuesta inmune celular mostró que la adición en la dieta PCL, aumentó la respuesta celular evaluada por la prueba de hipersensibilidad cutánea basofílica; una posible explicación podría ser por la estructura química de las PCL, determinadas en su mayoría por azúcares, que funcionan como ligando de receptores de tipo lectinas, descritos en poblaciones celulares de linaje linfoide. Por otro lado se ha descrito la presencia de los receptores tipo Toll (33,34) presentes en diferentes células; que reconocen patrones moleculares asociados a patógenos, (PAMP‘s) iniciando con la respuesta inmune innata.
Se ha determinado, que los azúcares de tipo mananos y el zymosan; presentes en Saccharomyces cerevisiae estimulan TLR-4 y TLR-2 y TLR-6 respectivamente, lo que posteriormente desarrolla respuestas inmune específicas. Por estas implicaciones las PCL de Saccharomyces cerevisiae, se pueden considerar como estimulantes del sistema inmune, y promotoras del crecimiento al ser adicionadas en dietas sorgo + soya de pollos de engorda, por lo que resultan una alternativa al uso de antibióticos promotores del crecimiento como la bacitracina cinc.
AGRADECIMIENTOS
Los autores agradecen al Dr. Juan Carlos del Rio (FESC de la UNAM) por la donación del maíz con AFB1 para la realización de este trabajo. Al MVZ Miguel Angel Valadez (CEIEPA-FMVZ/UNAM) por su apoyo técnico en la realización de este trabajo.
LITERATURA CITADA
1. Jones FT, Ricke SC. Observations on the history of the Development of antimicrobials and their use in poultry feeds. Poult Sci 2003;82:613-617.
2. Patterson JA, Burkholder KM. Application of prebiotics and probiotics in poultry production. Poult Sci 2003;82:627-631.
3. Mishra HN, Das C. A review on biological control and metabolism of aflatoxin. Crit Rev Food Sci Nutr 2006;43:145- 264.
4. Ellis WO, Smith JP, Simpson BK, Oldham JH. Aflatoxins in food: occurrence, biosynthesis, effects on organisms, detection, and methods of control. Review. Crit Rev Food Sci Nutr 1991;30:403-39.
5. Hussein SH, Brasel JM. Toxicity, metabolism and impact of mycotoxins on humans and animals. Toxicology 2001;167:101- 134.
6. Bababunmi EA, Thabrew I, Bassir O, Aflatoxin induced coagulopathy in different nutritionally classified animal species. World Rev Nutr Diet 1997;34:161-181.
7. Weststrate JA, Van Poppel G, Verschuren PM. Functional foods, trends and future. Br J Nutr 2002;88:233-235.
8. Swennen K, Courtin MC, Delcour JA. Non-digestible oligosaccharides with probiotic properties. Crit Rev Food Sci Nutr 2006;46:459-469.
9. Arce MJ, Avila GE, López CC, García EA, García GF. Efecto de paredes celulares (Sacharomyces cerevisiae) en el alimento de pollo de engorda sobre los parámetros productivos. Tec Pecu Mex 2005;43:155-162.
10. Solis SF, Donoghue AM, Farnell MB, Huff GR, Huff WE, Donoghue DJ. Gastrointestinal maturation is accelerated in turkey poults supplemented with a mannan-oligosaccharide yeast extrac (Alphamune). Poult Sci 2007;86:921-930.
11. Zhang AW, Lee BD, Lee SK, Lee KW, An GH, Song KB, Lee CH. Effects of yeast (Saccharomyces cerevisiae) cell components on growth performance, meat quality, and ileal mucosa development of broiler chick. Poul Sci 2005;84:1015-1021.
12. Chae BJ, Lohakare JD, Moon WK, Lee SL, Park YH, Hahn TW. Effects of supplementation of beta-glucan on the growth performance and immunity in broilers. Res Vet Sci 2006;80:291- 298.
13. Arce MJ, Ávila GE, López CC. Comportamiento productivo y cambios morfológicos en vellosidades intestinales del pollo de engorda a 21 días de edad con el uso de paredes celulares de Sacharomyces cerevisiae. Vet Méx 2008;39:223-228.
14. Guo Y, Ali RA, Qureshi MA. The influence of â-glucan on immune responses in broiler chicks. Immunophar Immunotox 2003;25:461-472.
15. Spring P, Wenk C, Dawson KA, Newman KE. The effects of dietary mannanoligosaccharides on cecal parameters and the concentrations of enteric bacteria in the ceca of salmonella challenged broiler chicks. Poult Sci 2000;79:201-211.
16. Yiannikouris A, Andre G, Poughon L, Francois J, Dussap CG, Jeminet G, Bertin G, Jouany JP. Chemical and conformational study of the interactions involved in micotoxin complexation with β-D-Glucans. Biomacromolecules 2006;7:1147-1155.
17. Suzuki Y, Adachi Y, Ohno N. Th1/Th2 Balancing immunomodulating activity of gel forming (1-3) B-glucans from fungi. Biol Pharma Bull 2001;24:811-819.
18. Tsukada C, Yokoyama H, Miyaji C, Ishimoto Y, Kawamura H, Abo T. Immunomodulation of intraepithelial lymphocytes in the intestine by oral administration of b-glucan. Cell Immunol 2003;221:1-5.
19. Zhongeum P, Otaka K, Maoka T, Hidaka K. Structure of â-glucan oligomer from Laminarium and It´s effect on Human Monocytes to inhibit the proliferation of U937 cells. Biosci Biotech Biochem 2005;69:553-558.
20. Harada T, Kawaminami H, Miura NN, Adachi Y, Nakajima M, Yadome T, Ohno N. Mechanism of enhanced hematopoietic response by soluble â-glucano SCG in cyclophosphamide-treated mice. Microbiol Immnumol 2006;50:687-700.
21. Hida S, Miura NN, Adachi Y, Nakajima M, Ohno N. â-glucano derived from zymosan acts as an adjuvant for collagen-induced arthritis. Microbiol Immunol 2006;50:453-461.
22. Swanson KS, Grieshop CM, Flickinger EA, Healy HP, Dawson KA, Merchen NR, Fahey GC. Effect of supplemental fructooligosaccharides plus manna oligosaccharides on immune function and ileal and fecal microbial populations in adults dogs. Arch Tierenahr 2002;56:309-318.
23. Corrier DE, DeLoach JR. Evaluation of cell – mediated, cutaneous basophilic hypersensitivity in young chickens by an interdigital skin test. Poult Sci 1990;69:403-408.
24. Campbell TA. Avian hematology and cytology. 2nd ed. Iowa State University Press/Ames, 1995.
25. Luna, LG. Manual of histological staining methods of Armed Forces Institute of Pathology, 3rd ed. American Registry of Pathology. New York: McGraw-Hill; 1968.
26. SAS.SAS User’s Guide:Statics, (version 6 ed.) Cary NC, USA:SAS Inst Inc, 1995.
27. Tejada CIZ, Avila GE, Causaubon HMT, Cervantes ORA, Vásquez PC, Hernández BEM, Moreno ME. Biodetoxification of aflatoxina contaminated chick feed. Poult Sci 2008;87:1569-1576.
28. Kubena LF, Harvey RB, Huff WE, Elissalde MH, Yersin AG, Phiplips TD, Rottinghaus. Efficacy of hydrated sodium calcium aluminosilicate to reduce the toxicity of aflatoxin and diacetoxyscirperol. Poult Sci 1993;72:51-59.
29. Diaz GJ, Calabrese E, Blain R. Aflatoxicosis in chickens (Gallus gallus): an example of hormesis?. Poult Sci 2008;87:727-732.
30. Shashidhara RG, Devegowda G. Effect of dietary mananoligosaccharide on breeder production traits and immunity. Poult Sci 2003;82:1319-1325.
31. Mitchell EB, Johns J. Avian hematology and related disorders. Vet Clin Exot Anim 2008;11:501-522.
32. Celik I, Oguz H, Demet O, Donmez HH, Boydak M, Sur E. Efficacy of polypyrrolidone in reducing yhe immunotoxicity of aflatoxin in growing broilers. Br Poult Sci 2000;41:430-439.
33. Roeder A, Kirschning CJ, Rupec RA, Schaller M, Weindl G, Korting HC. Toll-like receptors as key mediators in innate antifungal immunity. Rev Med Mycol 2004;42:485-498.
34. Akira S. TLR signaling. Curr Top Microbiol Immunol 2006;311:1-16.