INTRODUCCIÓN
La actividad de la enzima lactoperoxidasa (LPO) en leche tratadas con aditivos antimicrobianos debe registrar variaciones, ya que su estructura, es muy inestable. Cuando se rompen los enlaces o puentes disulfuro se inhibe la actividad enzimática, también por condiciones adversas de pH por debajo de su pH óptimo 6.8 (Mansson Rahenthulla et al., 1988). En la preservación de la leche en ausencia de refrigeración el único aditivo permitido es el peróxido de hidrógeno H2O2. (FAO, 1957), (CFR, 1984), (IFD, 1988), (FAO&FEPALE, 2012) el cual puede ser adicionado en concentraciones de 100 a 800 ppm que corresponden a una concentración en un rango de 2,9 a 23,5 mM de H2O2.
Excesos de peróxido de hidrógeno pueden reaccionar con HOSCN/OSCN para generar productos que más citotóxicos que peróxido de hidrógeno mismo. Por otra parte el peróxido de hidrógeno es altamente tóxico para las células animales. Sin embargo, niveles de 100 uM o menos de peróxido de hidrógeno más la presencia de LPO y Tiocianato (SCN) protegen las células de los mamíferos de toxicidad (Pruit y Kamau, 1991). La descomposición del Peróxido de hidrógeno en leche sucede en presencia de la enzima catalasa, componente normal de la leche, la cual cataliza la descomposición del Peróxido de hidrógeno a oxigeno activo y agua; mientras que la LPO necesita un donador de hidrógeno o compuesto oxidable para descomponer el Peróxido de hidrógeno (Shahani, 1966), (Robinson, 1991), Web y Alford, 1974); (Pütter, 1974), (Reiter 1985), (Pruitt and Kamau 1991)
Los datos reportados por el uso del peróxido de hidrógeno en la leche son: Sabor metálico transitorio hasta que se descompone totalmente; inactivación del ácido fólico, pérdida parcial del ácido pirúvico, pérdida de metionina, tirosina, triptófano y cisteína/cistina y finalmente acelera el deterioro oxidativo de la leche, bajando la calidad de los productos lácteos, (Thaer y Lakshmaiah, 1992), (Bracho 2013), Bracho, 2017). La velocidad de la destrucción del peróxido de hidrógeno (agua oxigenada) en la leche cruda es alta al inicio y luego tiende a decrecer, estando en relación inversa con la concentración inicial de agua oxigenada (López, 1986). Su destrucción depende de la concentración inicial, de la temperatura (pasteurización) y de la actividad de las enzimas: catalasa y peroxidasa (Bracho, 2013), (Arias et al., 2010).
La adición de formaldehido a la leche está basada en su efecto bactericida, pero, se observa una exacerbación de la acidez titulable debido a que el formaldehido reacciona con los grupos amino primario y los grupos amino y guanidil, exceptuando los enlaces peptídicos (Bajaj y Rai, 1993), y con el grupo guanidino de los residuos de arginina (Horne y Parker, 1982), pudiendo actuar como inhibidor de los sistemas enzimáticos.
METODOLOGÍA
Por un período de ocho semanas, se tomaron muestras del tanque de enfriamiento, una vez finalizado el ordeño de las vacas Holstein de una Estación Experimental de la Facultad de Ciencias Veterinarias, UCV. Maracay, Venezuela.
Una vez en el laboratorio las muestras se sometieron a todas las determinaciones que se especifican más adelante, antes y después de la adición de aditivos antimicrobianos en diferentes concentraciones: peróxido de hidrógeno 0,06%; 0,045% y 0,03%, y formaldehido 0,5%; 0,25% y 0,10%, antes y después de pasteurizar.
Determinación de acidez titulable. Método COVENIN 658-1982.
Determinación de pH y Temperatura. Métodos instrumentales. pH meter portátil MI 8314 con termómetro incorporado de (Hanna Instruments), para el control de factores condición estricta del Método de Pütter (1974).
Detección de peroxidasa. Método Cualitativo. Ensayo de Arnold Modificado ( López-Alcaide, 1986).
Determinación del Volumen de actividad de la LPO. Método cuantitativo. (Pütter, 1974) y los Principios de Análisis Enzimáticos de Bergmeyer (1965).
Pasteurización de la leche. Método de baja temperatura “Holder” mediante proceso discontinuo a 60-63º C/30 minuto.
Análisis estadístico
Para estudiar el efecto de los aditivos antimicrobianos formaldehido y peróxido de hidrógeno, en la leche refrigerada sin pasteurizar y pasteurizada, sobre las variables acidez y volumen de actividad enzimática, se utilizó un diseño experimental de bloques completos al azar con parcelas divididas (Martínez, 1988). En este existen tratamientos y repeticiones para tratamiento; a su vez cada parcela básica se subdividió en subparcelas y, sobre estas se colocaron tratamientos (diferentes concentraciones de antimicrobianos). Este arreglo resultó útil al agrupar en una parcela principal el tratamiento de la leche con antimicrobianos y pasteurización y en parcelas secundarias las diferentes concentraciones de peróxido de hidrógeno y formaldehido asociadas o no a la pasteurización, para las variables acidez y actividad enzimática. Las variables pH y temperatura son controladas estrictamente por el métodos de determinación enzimática y así descartar su efecto. Se usó una microcomputadora con el paquete Statistix 4.0 (1985-1992).
RESULTADOS Y DISCUSIÓN
Actividad enzimática de la LPO en leche bovina tratada con aditivos antimicrobianos.
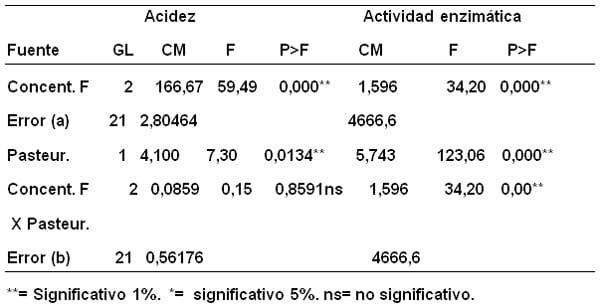
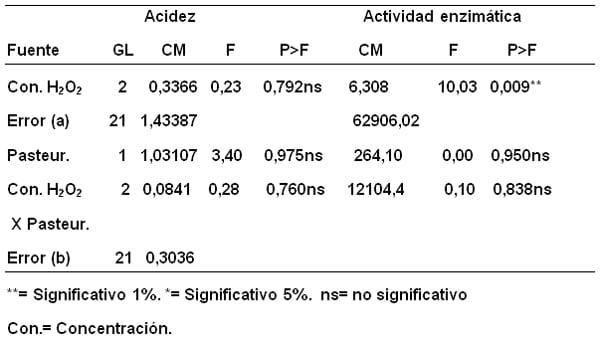
En la Tabla 1 se puede ver el resumen del análisis de varianzas de las variables acidez y actividad enzimática agrupadas en promedios, las cuales resultaron muy significativas, es decir, la adición de antimicrobianos afectan los valores de ambas variables en la leche cruda. La pasteurización también es muy significativa al 1% para la acidez y significativa para actividad enzimática, demostrándose que el proceso de pasteurización utilizado (60-63º C/30 min.) modifica el comportamiento de las variables en discusión. También es muy significativa (al 1%) la asociación antimicrobiano-pasteurización para la variable acidez pero, no significativa al 1% para la actividad enzimática, lo que demuestra que la acidez depende del antimicrobiano adicionado y de si es sometido a pasteurización o no, indicando que la temperatura de pasteurización potencian las reacciones de la leche adicionada de antimicrobianos.
Tabla 1. Análisis de varianza de las variables acidez (mL de NaOH 0,1N/100L) y actividad enzimática U/L de muestras de leche con adición de antimicrobianos antes y después de pasteurizar.
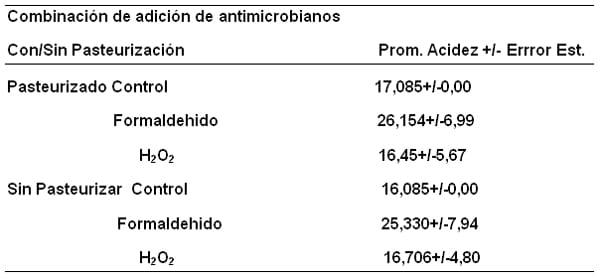
Los análisis de varianza discutidos condujeron a profundizar en el análisis, para lo cual se aplicaron pruebas posteriores como la determinación de las medias y el error estándar de la variable acidez de las muestras de leche, para la interacción detectada: adición de antimicrobianos (formaldehido, peróxido de hidrógeno con el sometimiento a procesos de pasteurización o no y sus respectivos controles (Tabla 2), donde se puede ver el comportamiento promedio de la acidez titulable expresado como (mL de NaOH 0,1 N/ 100ml de leche) de los controles y su error estándar, el cual varia muy poco (16,085+/-0,00) antes y después de pasteurizar y, (17,85+/-0,00) pasteurizado; muy diferente a la media de la acidez de la leche adicionada de formaldehido que resultó muy alta (25,33+/- 7,95) sin pasteurizar y 26,16+/-6,99) pasteurizada.
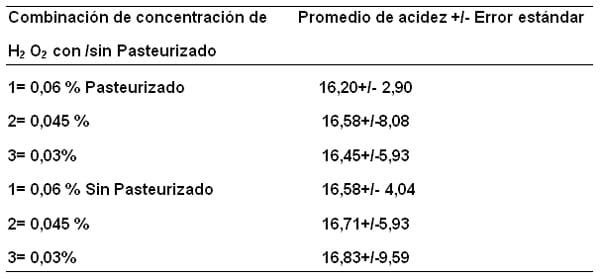
Tabla 2. Medias de la variable acidez (mL de NaOH 0,1N/100 mL de muestra de leche para la interacción detectada adición de antimicrobianos: formaldehido y peróxido de hidrógeno (H2O2) Con/ Sin Pasteurización.
La media de la acidez de la leche adicionada de peróxido de hidrógeno es muy similar a la del control (16,71+4,80) sin pasteurizar y 16,45 +5,68) pasteurizada, demostrando que el peróxido de hidrógeno no afecta la acidez.
Es importante discutir que el Comité venezolano de Normas Industriales (COVENIN), en la Norma Leche Cruda 903-93 (R) y Leche Pasteurizada 978-93 (R), establecen un valor mínimo de acidez titulable de 15 y máximo de 19 expresado como mL. de NaOH 1N/100mL de leche (Bracho 2013), pero, la adición de formaldehido incrementa la acidez debido a que reacciona con los grupos amino primarios y con los grupos guanidil tal como lo señalaron (Bajaj y Rai, 1983).
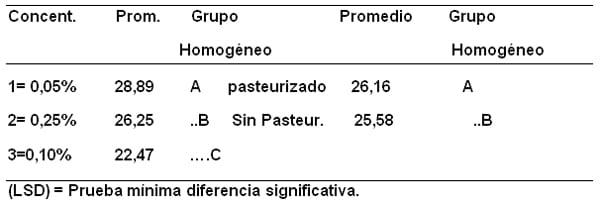
Posteriormente también se realizó la comparación de medias mediante la prueba de la mínima diferencia significativa (LSD), para la interacción actividad enzimática por pasteurización y por la adición de antimicrobianos: formaldehido y peróxido de hidrógeno y, en la Tabla 3 se puede observar la formación de grupos con promedios diferentes por ejemplo, la pasteurización señalada disminuye la actividad enzimática.
Tabla 3. Comparación de medias (LSD) para la diferencia significativa detectada en las interacciones: variables actividad enzimática (U/L) de las muestras de leche por Con/Sin pasteurización y por adición de antimicrobianos: peróxido de hidrógeno (H2O2) y formaldehido.
Por otro lado la actividad enzimática del control es alta con respecto a la actividad enzimática cuando se adicionó peróxido de hidrógeno pero, el descenso que experimenta su valor promedio con la adición de formaldehido es violento y coincidente con lo reportado por Fabre et al., (1962), Horne y Parker (1982) y Bracho (2017), quienes sostienen que el formaldehido tiene efecto inhibitorio sobre los sistemas enzimáticos.
Adición de formaldehido
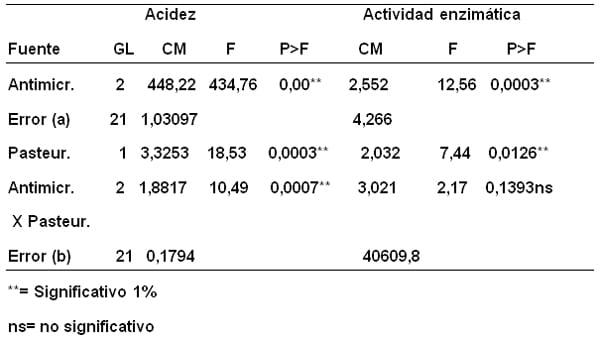
El análisis de varianza de las variables acidez y actividad enzimática de la leche bovina adicionada con tres concentraciones de formaldehido: (1= 0,25%; 2= 0,25% y 3= 0,10%), antes y después de pasteurizar (Tabla 4), resultó muy significativa (P>F 0,000) el efecto de las concentraciones de formaldehido para ambas variables lo cual se evidenció también en el análisis de la parcela principal, fortaleciendo el argumento que el formol produce cambios fuertes en la acidez de la leche y disminuye la actividad enzimática; potenciando esta acción cuando se somete a la temperatura de pasteurización.
Tabla 4. Análisis de varianza de las variables acidez (mL de NaOH 0,1N/100L) y actividad enzimática U/L de muestras de leche con adición de concentraciones de formaldehido: 1= 0,5%; 2= 0,25 % y 3= 0,10% antes y después de pasteurizar.
Concent.F= Concentración de formaldehido.
La combinación concentraciones de formaldehido por pasteurización es no significativa para la acidez pero, muy significativa para la actividad enzimática, lo que demuestra que los valores de actividad enzimática varían más abruptamente en presencia del formaldehido.
La aplicación de pruebas posteriores se realizó comparando las medias (LSD) para la diferencia significativa detectada en las interacciones acidez de las muestras de leche por adición de la concentraciones de formaldehido indicadas antes y después de pasteurizar y se presenta en la Tabla 5. Tal como se observó en el análisis de la parcela principal, acidez es muy elevada, e inclusive para las tres concentraciones se sale de los límites establecidos en las Normas venezolanas e internacionales para leche cruda y pasteurizada, conformando tres grupos diferentes uno de otro con los valores promedios de la acidez de la leche.
Tabla 5. Comparación de medias (LSD) para la diferencia significativa detectada de las interacciones: variable acidez (mL de NaOH 0,1N/100L) de muestras de leche por adición de concentraciones de formaldehido1= 0,5%; 2= 0,25 % y 3= 0,10% con/sin pasteurización.
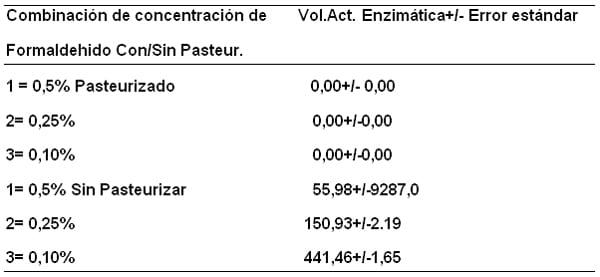
Por otra parte el efecto de pasteurizar o no sobre los valores promedio de acidez de la leche con adición de formaldehido, hace dos grupos diferentes: pasteurizado y sin pasteurizar 26,26 y 25,58 mL NaOH 0,1N/100mL de leche respectivamente. También se hicieron las medias de actividad enzimática para las muestras de leche en la interacción detectada: adición de formaldehido en las concentraciones indicadas con y sin pasteurización y se puede observar en la Tabla 6, que el volumen de actividad enzimática con las diferentes concentraciones de formaldehido antes de pasteurizar fueron: 58,98; 158,93 y 441,46 U/L respectivamente pero, al pasteurizar desaparece por completo.
Tabla 6. Medias de la variable volumen de actividad enzimática (U/L) de muestras de leche para la interacción detectada: adición de formaldehido en concentración de 1= 0,5%; 2= 0,25 % y 3= 0,10% con/sin pasteurización.
Esto tiene una explicación química y bioquímica y se le atribuye a una desnaturalización por agente químico (formaldehido a 37%), asociado a la temperatura de pasteurización (60-63º C/30 min.) El formaldehido causa alteración de la estabilidad proteica ya que está constituido por metales de transición como el hierro y metales pesados, así como , residuos de ignición y al reaccionar con la leche, en presencia de calor, desestabiliza la proteína, cambia el pH, modificándose la estructura conformacional la enzima LPO inactivándola completamente.
Adición de peróxido de hidrógeno
El análisis de varianza de la acidez y la actividad enzimática de la leche bovina con adición de tres concentraciones de peróxido de hidrógeno: (1= 0,06%; 2= 0,045% y 3= 0,03%) antes y después de pasteurizar, se resume en la Tabla 7. Dicho análisis resultó no significativo para la variable acidez en lo que respecta a concentración de peróxido de hidrógeno, pasteurización y la combinación de ambas fuentes de variación, lo cual demostró que no hay modificación de la acidez al ensayar los procesos indicados.
Tabla 7. Análisis de varianza de las variables acidez (mL de NaOH 0,1N/100L) y actividad enzimática U/L de muestras de leche con adición de tres concentraciones de peróxido de hidrógeno H2O2 (1 = 0,06%; 2 = 0,045% y 3 = 0,03%) antes y después de pasteurizar.
Esto se comprobó al determinar las medias de la variable acidez en la combinación adición de concentraciones de peróxido de hidrógeno con y sin pasteurización (Tabla 8). Observándose valores muy parecidos y no existe interacción.
Tabla 8. Medias de la variable acidez (mL de NaOH 0,1N/100L) de muestras de leche en la combinación de adición de peróxido de hidrógeno H2O2 en concentraciones (1 = 0,06%; 2 = 0,045% y 3 = 0,03%) con y sin pasteurización.
Sobre la actividad enzimática se observa que hay diferencia significativa al 1% para la fuente de variación concentración de peróxido de hidrógeno, lo que deja ver que las diferentes concentraciones no tiene el mismo efecto aun cuando la pasteurización y la combinación concentración de antimicrobiano y pasteurización, no son significativas y no causan variaciones mayores.
Se realizó prueba posterior de comparación de medias (LSD) a la variable actividad enzimática con las diferentes concentraciones de peróxido de hidrógeno y se presentan en la Tabla 9, donde se aprecia la formación de dos grupos de medias con idéntica letra, las cuales son similares al 5%; es decir, las concentraciones 0,03%y 0.045% dan valores promedios de actividad enzimática relativamente altos 675,57 y 524,40 U/L. respectivamente y la concentración 0,06% reportó un valor más bajo 281,96 U/L. Se puede decir que el peróxido de hidrógeno a las concentraciones usadas no produce daño sobre la estructura química y bioquímica de la enzima LPO, así como también puede darse prioridad al uso de concentraciones de peróxido de hidrogeno que han dado valores de actividad enzimática más altos y consistentes, ya que la acidez se mantiene en el mínimo establecido en las normativas nacionales e internacionales
.
CONCLUSIONES
El peróxido de hidrógeno H2O2 en las concentraciones usadas en este trabajo son excelentes para conservar la leche sin que se eleve la acidez y sin que se produzcan cambios químicos y bioquímicos en la estructura conformacional de la proteína, por lo cual son estables los valores de concentración de volumen de actividad de la LPO. Se puede aseverar que concentraciones por debajo de 0,06%, son más eficientes de acuerdo con estos resultados.
El uso de formaldehido en las concentraciones: 0,5 %; 0,25% y 0,10% tienen un efecto marcado sobre la acidez de la leche, elevando su valor por encima de lo establecido en la normativa venezolana e internacional vigente como materia prima para la industria. Por otra parte ejerce un marcado efecto negativo sobre el volumen de actividad enzimática de la LPO de la leche cruda y, cuando la leche adicionada de formaldehido se somete a pasteurización lenta (60-63 º C), se anula por completo la actividad enzimática.
Tanto por el efecto sobre la acidez, como sobre el volumen de actividad enzimática resulta contraproducente el uso del formaldehido como aditivo antimicrobiano con fines de preservación de la leche para uso industrial, ya que en principio la elevación de la acidez, origina el rechazo al no cumplir con las normas industriales de calidad.
REFERENCIAS
Arias, Y. Salas, E. Romero, R. (2010). Efecto del peróxido de hidrógeno en la calidad fisicoquímica de la leche cruda de vaca. Rev.Unell.Cienc.Tec. (volumen especial). 52 -57 pp.
Bajaj, V.W. and Rai, T, 1993. Effect of formalin on comparative efficiency of protein and lactose estimation. Indian J.Sci 46.1: 21-25.
Bracho, H. (2013). “Ciencia y tecnología de la leche, Composición y características” 2da Edición. Editorial Académica Española. (EAE) Publishing. Madrid. MoreBook. 124 PP.
Bracho H. 2017. Industrialización de la Leche. Productos y subproductos lácteos. Tercera Edición Editorial De La Parra, KDP-Amazon ISBN 978-990-12-9269-2. USA. 200p.
C.F.R. 1984. Code of Federal Regulations Food and Drugs, 21 CFR 170.3. US Government Printing Office, Washington, D.C.
Comisión Venezolana de Normas industriales. (Covenin). 1979. Norma 1315. Alimento determinación de pH. Ministerio de fomento. Caracas, Venezuela.
Comisión Venezolana de normas industriales. (Covenin). 1993. Norma 903 Leche cruda. Ministerio de fomento. Caracas, Venezuela.
Comisión Venezolana de normas industriales. (Covenin). 1997. Norma 658. Leche y sus derivados determinación de acidez titulable. Ministerio de Fomento. Caracas, Venezuela.
Fabre , R. ; Truhaut, R. ; Granier-Doyeuux, M. 1962. Compendio de toxicología. Tomo I Ediciones Biblioteca UCV-Caracas. Pp. 328-331.
F.A.O. 1957. . Report on the meeting of experts on the use of hydrogen peroxide and other preservatives in milk, Rome, Doc. 57/11/8655.
FAO & FEPALE. 2012. (Organización de las Naciones Unidas para la Agricultura y la Alimentación y Federación Panamericana de la Leche). Situación de la Lechería en América Latina y el Caribe en 2011.
Horne, D.S. & Parker T. 1982 Factors affecting the ethanol stability of bovine milk. Effect of chemical modification of milk protein Dairy Sci. 49: 449-497.
Observatorio de la Cadena Lechera. 2012. Oficina regional de la FAO para América Latina y el Caribe. División de Producción y Sanidad animal.
I.D.F. 1988. Código de práctica para preservación de leche fresca a través del Sistema Lactoperoxidasa. Boletín del Diario Federación Internacional de la Leche. No. 234: 3-5.
Kamau, D.; Doores, S. and Pruitt, K. 1990. Antibacterial activity of the Lactoperoxidase System against Listeria monocitogenes and Staphylococcus aureus in milk. Journal Food Protection; 53: 1010A-1014. U.S.A.
López-Alcaide N. 1986. Persistencia del agua oxigenada en leche cruda y eficacia de algunos métodos usados para su detección. Trabajo de Ascenso. Facultad de Ciencias Veterinarias UCV. Maracay, Venezuela 62 p.
Manson-Rahemtulla, B; Rahemtulla, F ; Baldone, D; Pruitt, K.M; Hierpe, A.1988. Purification and characterization of human salivary peroxidase, Biochemistry, 27,233-9.
Martinez, G. A. 1988. Diseño Experimental, Métodos y Elementos de Teoría Editorial Trilla, S.A. de C.U. México.
Observatorio de la Cadena Lechera. 2012. Oficina regional de la FAO para América Latina y el Caribe. División de Producción y Sanidad Animal.
Pruitt, K.M. and Kamau, D.N. 1991. The lactoperoxidase system of bovine and human milk. In oxidative enzymes in food. Edited by Robinson, D.S. and Skim N.A.M Elsevier Science Publishers LTD Crown house Linton Road. Barking, Essex JG11 JU, Engalnd.
Putter, J. 1974. Peroxidase. In Methods of analysis enzymatic. Vol. Two, Second Edition. Edited by Hans Ulrich Bergmeyer. Academic Press. Inc.
Reiter, B. 1985. The lactoperoxidase system of bovine in the Lactoperoxidase. System Ed. K. M. Pruitt and Tenovuo, J. O. Marcel Dekker, New York; 60: 123-141.
Robinson, D.S. 1991. Peroxidases and catalases in food. Chapter 1. In oxidative enzymes in food. Edited by Robinson and Skin N.A.M: Elsevier Sciences Publishers LTD. pp. 1-47.
Shahanni, K.M; 1966. Milk Enzymes: Their role and significance. Dairy sci 49 (8): 907-920.
STATISTIX Versión 4.0 (C) 1985-1992) Analytical Software.
Taher, M.Y; Lakshmaiah, N.1992. Folic acid stability in hydrogen peroxide-potassium thiocyanate treated milk. Food Chemistry 44: 343-347.
Webb, B; Johnson, A; Alford, J. 1974. Fundamentals of Dairy Chemistry. Two ed. Ed. Avi Westport U.S.A.