INTRODUCCIÓN
Al realizar procedimientos de diagnóstico microbiológico, la toma correcta de muestra de leche de vacas durante la lactancia es necesaria para el aislamiento e identificación de los agentes patógenos causantes de mastitis en los hatos lecheros. Este procedimiento de diagnóstico se lleva a cabo a partir de muestras al realizar la prueba de California, la cual es determinante en el monitoreo del grado de infección en las vacas y los patógenos presentes en el hato relacionados con la ocurrencia de la mastitis en las distintas etapas de producción.
La calidad de las muestras tomadas para cualquier procedimiento de diagnóstico es extremadamente importante, sin embargo, la calidad de las muestras para el diagnóstico de la mastitis es en muchos aspectos más crítica que la de muchas otras enfermedades. Una técnica aséptica en la recolección de muestras para cultivo bacteriano es una necesidad absoluta. No sólo hay organismos que son contaminantes, sino que también estos mismos organismos tienen el potencial de causar la enfermedad. Las muestras contaminadas conducen a diagnósticos erróneos, aumento del trabajo, la confusión y la frustración por lo que se debe de llevar a cabo una toma correcta de las muestras para obtener buenos resultados (Waldner, 2004).
El objetivo del presente artículo consistió en describir el procedimiento que se debe seguir para llevar a cabo la toma correcta de muestras de leche para su procesamiento en el laboratorio y los pasos que se deben seguir para realizar adecuadamente la prueba de California para diagnóstico de mastitis.
TOMA DE MUESTRAS
El aislamiento de agentes patógenos de mastitis u otros microorganismos a partir de muestras tomadas de la glándula mamaria en forma aséptica, no indica necesariamente que estos provengan de una infección intramamaria; así como la falta de aislamiento no indica la ausencia de una infección intramamaria. La glándula mamaria sana es estéril, pero como no es posible obtener condiciones de esterilidad dentro de la sala de ordeño u otros lugares que se dispongan para realizar el muestreo, la leche obtenida manualmente de una glándula sana contendrá casi siempre contaminantes del canal del pezón, lesiones del pezón, piel de la ubre o de las manos de quien realiza el muestreo (Calvinho, 2001).
Partiendo de la premisa que no es posible contar con un ambiente estéril, el objetivo será utilizar métodos de muestreo asépticos que eviten contaminación que podría interferir con el diagnóstico de infecciones intramamarias. El grado de contaminación obtenido al realizar un cultivo de leche es generalmente una medida de la idoneidad en la toma de muestras.
Sin embargo, el número de organismos contaminantes detectados no depende solamente del cuidado en la toma de las muestras, sino también del volumen de leche examinado y del método de análisis utilizado (Calvinho, 2001).
¿Qué tipo de muestras debemos tomar y porqué?
Al trabajar con hatos con problemas de mastitis, es necesario conocer cuáles son los patógenos de la glándula mamaria predominantes. Para este fin pueden tomarse muestras de los cuartos, generalmente con mastitis clínicas o leche de los cuatro cuartos de una vaca de un porcentaje de las vacas. En algunos casos puntuales en los que se establezcan programas de control especiales; planes de segregación, terapia blitz contra S. agalactiae, puede realizarse el muestreo de todas las vacas en ordeño.
Materiales para la toma de muestras
Tubos estériles con tapa a rosca o desechables con tapón a presión. Normalmente se utilizan tubos de 15 a 25 ml de capacidad debido a la facilidad para manipular los mismos. Sin embargo, se pueden utilizar viales o tubos de menor capacidad (Sudhan y Sharma, 2010). Tubos de vidrio o plástico estériles pueden obtenerse en laboratorios dedicados al procesamiento de muestras de leche.
En caso de que se desee utilizar material de vidrio propio, se debe limpiar cuidadosamente y esterilizar en autoclave a 121°C por 15 minutos con las tapas ligeramente flojas. Las mismas deberán ajustarse luego de la esterilización. Se recomienda colocar cinta testigo o similar a cada tubo para posibilitar la identificación de cada muestra utilizando bolígrafo o marcador permanente. Esta práctica es preferible a escribir directamente sobre el tubo de vidrio ya que facilita el lavado del material en el laboratorio. Es conveniente identificar los tubos cuando están secos antes del muestreo. Los viales de plástico se pueden identificar con marcador permanente. Los tubos deberán posteriormente ubicarse en gradillas adecuadas para su manipuleo y almacenamiento.
Momento de la toma de muestras
Las muestras para cultivo bacteriológico pueden ser tomadas antes o después del ordeño, así como en el intervalo entre ordeños. La toma de muestras ya sea pre o postordeño no presenta diferencias respecto de la posibilidad de aislamiento de organismos patógenos, aunque se considera que la especificidad aumenta en el muestreo post ordeño. Sin embargo, si se desea practicar en forma concomitante un recuento de células somáticas (RCS), se debe tener en cuenta que en la leche post-ordeño los valores de células somáticas son mayores a los obtenidos en la leche pre-ordeño. El momento elegido dependerá entonces del objetivo del muestreo, así como de las condiciones de manejo de cada establecimiento.
Datos anamnésicos
Antes de llevar a cabo la recolección de las muestras de leche, se debe incluir información sobre el tipo de muestra (de cuarto, compuesta), así como datos sobre la vaca: identificación, número de lactancia, tiempo de lactancia, tratamientos antibióticos (Calvinho, 2001).
PROCEDIMIENTO PARA LA RECOLECCIÓN DE MUESTRAS DE LECHE
Procedimientos estrictamente asépticos deben utilizarse en la recolección de muestras de leche, con el fin de evitar la contaminación con la gran cantidad de microorganismos presentes en la piel de los flancos de la vaca, la ubre y los pezones, en las manos de las personas que toman las muestras y en el medio ambiente de la granja. Los siguientes procedimientos ayudan a reducir la contaminación durante la recogida de la muestra.
1. Etiquetar los viales o tubos
Etiquetar los viales o tubos de vidrio o plástico antes de realizar el muestreo con la fecha de recolección, nombre de la granja, identificación de la vaca, cuarto, con un marcador indeleble.
2. Limpieza y secado de los pezones
Se pueden obtener muestras de leche adecuadas si la piel de la ubre y especialmente la de los pezones está limpia y seca. Con la mano o con una toalla de papel desechable seca, quitar la suciedad suelta, el material de la cama, el pelo de la glándula y de los pezones.
No se recomienda lavar la ubre si está limpia y seca de los pezones. Solamente que los pezones estén sucios, deben lavarse con agua y una toalla de papel desechable y eventualmente con una solución antiséptica. Una vez lavados, estos deben ser secados con otra toalla desechable. En algunos casos, se sumergen los pezones en una solución antiséptica eficaz o presellador, que se deja actuar por 20 a 30 segundos antes de higienizar los pezones con una toalla desechable (Bewley y Harmon, 2010; Wolter et al., 2004; Bedolla et al., 2013).
3. Despuntar
Desechar los primeros 2 o 3 chorros de leche del pezón y observar la leche y la glándula para detectar signos de mastitis clínica. Anotar todas las observaciones de los signos clínicos (Bewley y Harmon, 2010; Bedolla et al., 2013; Nova Scotia, s/f.).
4. Frotar con alcohol la punta de los pezones
La punta de cada pezón se debe frotar vigorosamente con un algodón o una toalla desechable humedecida en alcohol etílico o isopropílico al 70% durante 10 a 20 segundos; utilizando un trozo de algodón o toalla de papel desechable para cada pezón a muestrear. Este procedimiento debe realizarse hasta notar que la punta del pezón esté visiblemente limpia (Bewley y Harmon, 2010). Dependiendo de la suciedad; en algunos casos se deberá usar más de un trozo de algodón o toalla de papel desechable por pezón.
Se deben comenzar a desinfectar en primer término los pezones de la ubre más alejados, es decir, los del lado opuesto del operador, finalizando por los más cercanos al mismo. El alcohol al 70% es el antiséptico ideal para tal efecto ya que se evapora rápidamente y no deja residuos en la muestra de leche que podrían inhibir el desarrollo bacteriano en el laboratorio (Nova Scotia, s/f.; Bedolla et al., 2013).
5. Recolección de la muestra
Para recolectar las muestras de leche de cuartos individuales y disminuir la contaminación involuntaria de los pezones durante la toma, se debe de comenzar con la recolección de las muestras de los pezones más cercanos al operador, finalizando con los más alejados. Es decir, en orden inverso al de la limpieza.
Para la toma de la muestra, se debe retirar primero la tapa del tubo o vial, colocando ésta hacia abajo, evitando tocar con los dedos la superficie interna de la misma. Enseguida se deberán eliminar los primeros dos o tres chorros de leche y se mantendrá el tubo en posición oblicua (aproximadamente en ángulo de 45°) sin permitir que la boca del tubo de la muestra entre en contacto con la punta del pezón. El pezón se llevará asimismo a una posición oblicua y se dirigirá el chorro de leche dentro del tubo. Al ubicar tubos y pezones en esta posición se minimiza la posibilidad de contaminación por partículas que se desprendieran de la piel de la ubre. La celeridad en el procedimiento también disminuye la posibilidad de contaminación (Bewley y Harmon, 2010; Sudhan y Sharma, 2010).
Una vez que se colecta la muestra, se debe colocar inmediatamente de manera correcta la tapa del tubo o vial.
Los tubos o viales de la muestra no deben ser llenados más de 3/4 de su capacidad. Muestras de gran volumen no se requieren ya que aumentan el riesgo de contaminación. Dos a tres ml de leche es generalmente un tamaño de muestra suficiente para los análisis bacteriológicos (Bewley y Harmon, 2010: Sudhan y Sharma, 2010; Bedolla et al., 2013).
Recolección de muestras compuestas
Para recolectar una muestra compuesta de leche de los cuatro cuartos de la ubre de una vaca en el mismo tubo, el procedimiento de higiene previa es similar. Luego se deben recolectar cantidades aproximadamente similares de cada uno de los cuartos en el tubo. Para ello, se comenzará la recolección de las muestras de los pezones del lado de la ubre más cercanos al operador (Waldner, s/f.).
Conservación y transportación de las muestras al laboratorio
Luego de la recolección de las muestras y ubicación de los tubos en gradillas, las mismas deben mantenerse en conservación a aproximadamente 5°C. Las muestras deben remitirse al laboratorio para su cultivo preferiblemente dentro de las 24 hs de extraídas (Sudhan y Sharma, 2010). En casos en que por la distancia o dificultades en el transporte no puedan remitirse dentro de las siguientes 24 hs, es necesario mantenerlas refrigeradas o congeladas a -20°C por un breve tiempo (Bewley y Harmon, 2010). La refrigeración a 4°C por una semana no afecta ostensiblemente la capacidad de aislamiento de la mayoría de las especies de estafilococos y estreptococos. Sin embargo, la refrigeración o congelación puede disminuir la posibilidad de aislamiento de otros microorganismos como Nocardia spp. y Escherichia coli, dependiendo del tiempo de almacenamiento. Asimismo, debe tenerse en cuenta que las muestras que han sido congeladas no pueden usarse para conteo de células somáticas (Calvinho, 2001; Wolter et al., 2004).
MUESTREO DE LECHE DE TANQUE
El número de muestras a tomar puede ser variable. En algunos casos muestras múltiples recolectadas varios días seguidos arrojan resultados más confiables que una muestra individual. Hay microorganismos como el S. aureus que presentan variaciones diarias en el índice de eliminación. En casos como este, las variaciones pueden superarse tomando muestras por tres o cuatro días consecutivos o en semanas consecutivas.
La leche del tanque debe estar homogeneizada en el momento de la toma de la muestra, lo cual se logra con el funcionamiento de los agitadores mecánicos existentes en los tanques. Un buen momento para obtener la muestra es inmediatamente después del ordeño ya que la agitación durante el proceso de enfriado produce una homogeneización adecuada.
La muestra debe tomarse con materiales estériles: frascos desechables, pipetas de inseminación artificial acopladas por medio de un tubo de goma a una jeringa, etc. En casos particulares en los que no sea posible contar con material estéril se puede higienizar cuidadosamente el muestreador de acero inoxidable, luego sumergirlo en alcohol de 96% dejando un pequeño volumen en su interior y posteriormente flamearlo. El muestreador así tratado deberá ser utilizado inmediatamente luego del flameado. No se recomienda tomar muestras del grifo de salida de los tanques ya que esta área normalmente tiene un alto contenido de bacterias.
La muestra tomada con el muestreador o con pipeta debe ser transferida inmediatamente a un recipiente estéril, manteniéndola refrigerada hasta su procesamiento dentro de las 24 hs. Asimismo, cuando se realizan muestreos seriados es posible congelar las muestras a -20°C y mantenerlas de esta forma hasta por cuatro semanas antes de su envío al laboratorio. En caso que la muestra se congele, no se podrá practicar el recuento de células somáticas (Calvinho, s/f.).
PRUEBA DE CALIFORNIA PARA MASTITIS (CMT)
La Prueba de California para Mastitis (CMT, por sus siglas en inglés) ha sido empleada durante décadas y sigue siendo la prueba más utilizada a nivel de campo para el diagnóstico de mastitis en el ganado bovino lechero (Morresey, 1999; Radostits et al., 2000; Medina y Montaldo, 2003; Erskine, 2001; Bedolla, 2004).
Es una prueba sencilla que es útil para detectar la mastitis subclínica por valorar groseramente el recuento de células de la leche. No proporciona un resultado numérico, sino más bien una indicación de si el recuento es elevado o bajo, por lo que todo resultado por encima de una reacción vestigial se considera sospechoso (Blowey y Edmonson, 1995; Bedolla, 2004).
Pasos a seguir para la realización de la Prueba de California para Mastitis
- Se desecha la leche del preordeño.
- Se ordeñan uno o dos chorros de leche de cada cuarto en cada una de las placas de la paleta.
- Se inclina la paleta de modo que se desecha la mayor parte de esta leche.
- Se añade a la leche un volumen igual de reactivo.
- Se mezcla el reactivo y se examina en cuanto a la presencia de una reacción de gelificación. Antes de continuar con la vaca siguiente se debe enjuagar la placa.
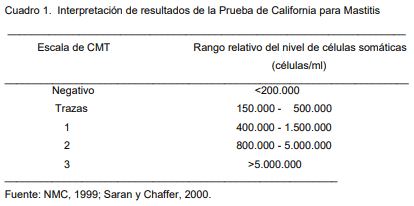
Los resultados pueden interpretarse en cinco clases: desde el resultado negativo en el que la leche y el reactivo siguen siendo acuosos, hasta el recuento de células más elevado en el que la mezcla de la leche y el reactivo casi se solidifica. Esto se determina en relación a la reacción de gelificación (Cuadro 1) (Pérez, 1986; Blowey y Edmonson, 1995; Bedolla, 2004).
La prueba consiste en el agregado de un detergente a la leche, el alquil-aril sulfonato de sodio, causando la liberación del ADN de los leucocitos presentes en la ubre y este se convierte en combinación con agentes proteicos de la leche en una gelatina (Smith 1990; Saran y Chaffer, 2000; Medina y Montaldo, 2003). A mayor presencia de células se libera una mayor concentración de ADN, por lo tanto, mayor será la formación de la gelatina, traduciéndose en nuestra lectura e interpretación del resultado como el grado más elevado de inflamación (Smith 1990; Saran y Chaffer, 2000; Medina y Montaldo, 2003).
Es decir, permite determinar la respuesta inflamatoria con base en la viscosidad del gel que se forma al mezclar el reactivo (púrpura de bromocresol) con la misma cantidad de leche en una paleta con cuatro pozos independientes permitiendo evaluar cada cuarto independientemente (Smith, 1990; Saran y Chaffer, 2000; Medina y Montaldo, 2003).
Desafortunadamente esta prueba es muy subjetiva y tiene que hacerse al lado de la vaca durante el ordeño (lo que interfiere con el manejo del ordeño) (Pérez, 1986).
La Prueba de California es un método de diagnóstico que posee una sensibilidad del 97% y una especificidad del 93%. Sus ventajas principales son:
- Es una técnica muy sensible y se puede utilizar tanto en una muestra de cuartos, como una muestra del tanque enfriador. En una muestra de tanque, los resultados de grado 2 y 3, indican un alto porcentaje de vacas infectadas.
- El material extraño no interfiere con la prueba (pelo u otro material).
- La prueba es simple y no requiere de equipo costoso.
- La paleta es fácil de limpiar después de cada uso (Báez, 2002).
A pesar de sus ventajas, la técnica presenta los siguientes inconvenientes:
- Los resultados pueden ser interpretados de forma variable, entre los individuos que realicen la prueba, por lo que resulta necesario uniformizar el criterio de casos positivos y su categorización en grados.
- Pueden presentarse falsos positivos en leche de animales con menos de diez días de paridos o en vacas próximas a secarse.
- La mastitis clínica aguda da resultados negativos, debido a la destrucción de los leucocitos por las toxinas provenientes de los microorganismos presentes (Báez, 2002).
CONCLUSIÓN
El diagnóstico e identificación de los agentes patógenos causantes de mastitis en las diferentes etapas de producción del hato lechero realizado mediante procedimientos bacteriológicos requiere de una correcta toma de muestras de leche en forma compuesta de los cuatro cuartos de la glándula mamaria de la vaca o de manera individual. Dicho muestreo es recomendable efectuarlo al momento de realizar la prueba de California y así determinar el estado de salud que guarda la glándula mamaria.