Efecto de factores genéticos y ambientales sobre el recuento de células somáticas en ganado lechero de Costa Rica
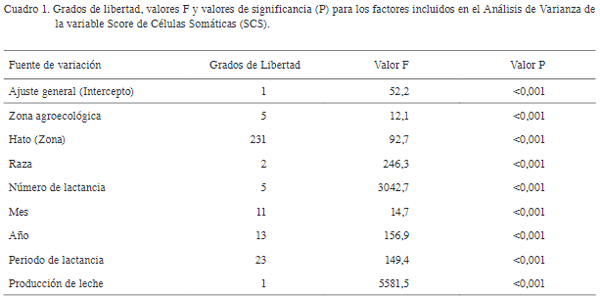
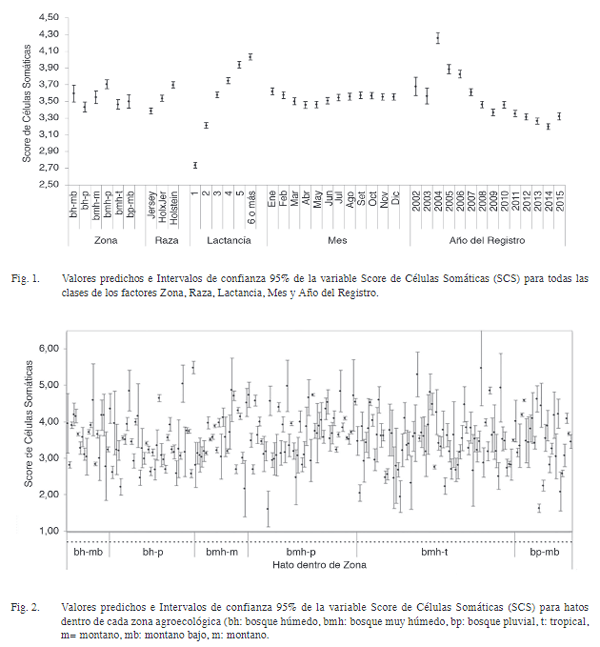
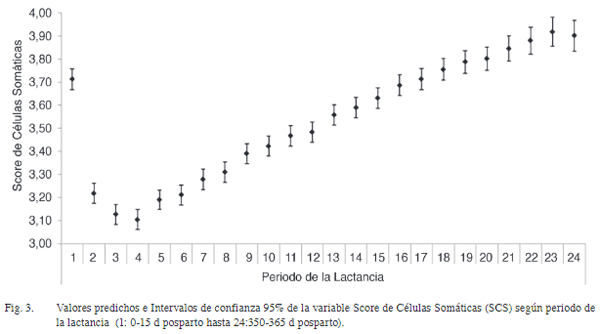
El estudio evaluó el efecto de factores genéticos y ambientales sobre el Score de Célu-las Somáticas [SCS= log2 (RCS/100 000)+3] en ganado lechero de Costa Rica. Se analizaron 198 685 registros diarios, provenientes de 43 535 lactancias, 23 749 vacas lecheras, 237 hatos y 3 grupos raciales. Se utilizó un modelo animal mixto para evaluar efectos fijos de zona, hato dentro de zona, raza, número de lactancia, mes/ año de registro, periodo de lactancia y la cova-riable de producción de leche diaria; también para efectos aleatorios de ambiente permanente, hato×semental y vaca. Se calcularon la heredabi-lidad (h 2) y repetibilidad (r) para el Recuento de Células Somáticas (SCS), así como los valores de cría (BLUP) y confiabilidad para los individuos en la población. El promedio de SCS fue 3,30 (DE=1,87) todos los efectos fijos, significati-vos. Entre zonas, SCS varió desde 3,4 (bh-p) a 3,7 (bmh-p). Para hatos dentro de zona, el SCS osciló entre 1,6 y 5,5. El SCS aumentó desde 2,7 en primera lactancia hasta 4,0 para lactancias ≥6. El SCS fue mayor en Enero (3,6) y menor en Abril (3,4). Se observó un patrón descendente no lineal en SCS desde el 2004 (4,3) hasta el 2015 (3,3) y un patrón no lineal de SCS a lo largo de la lactancia, que inició en 3,7 para disminuir hasta 3,1 al día 60 posparto, mientras que aumentó 3,9 al día 365. Se detectó una reducción de 0,051 en SCS por cada aumento de 1 kg en producción diaria de leche. Los valores de h 2 y r fueron 0,08 (DE=0,008) y 0,33 (DE=0,004), respectivamente. La confiabilidad de los BLUP en vacas y toros fue de 0,40 (DE=0,16) y 0,44 (DE=0,20), res-pectivamente. Estos resultados son útiles para un mejor control de SCS a nivel de hato, basado en el manejo preventivo de grupos más propensos, la optimización del descarte y la selección de sementales.
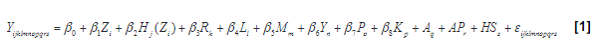
- Yijklmnopq: SCS, Score de Células Somáticas.
- β0: intercepto.
- β1Zi: efecto fijo para la i-ésima zona agroecológica (Clases: bosque húmedo montano/premontano, bosque muy húmedo tropical/premontano/montano y bosque pluvial montano); según la clasificación establecida por Holdridge (1987).
- β2Hj(Zi): efecto fijo para la j-ésimo hato, anidado dentro de zona agroecológica (Clases: Hatos 1 hasta 237).
- β3Rk: efecto fijo para la k-ésima raza (Clases: Holstein, Jersey, Holstein×Jersey).
- β4Ll: efecto fijo para el l-ésimo número de lactancia (Clases: 1 hasta >=6).
- β5Mm: efecto fijo para el m-ésimo mes del registro (Clases: Enero hasta Diciembre).
- β6Yn: efecto fijo para el n-ésimo año del registro (Clases: 2002 hasta el 2015).
- β7Po: efecto fijo para el o-ésimo periodo de lactancia (Clases: Periodos de 15,2 días desde 1 hasta >=24).
- β8Kp: efecto fijo de para la p- ésima cova-riable de producción de leche (kg) del día del registro.
- aq: efecto aleatorio del q-ésimo animal,ligado a la genealogía. El archivo de genea-logías estuvo constituido por un total de 36 588 animales distribuidos en 18 gene-raciones. Los padres desconocidos fueron asignados a una sola población base.
- apr: efecto aleatorio del r-ésimo ambientepermanente. Cuantifica efectos ambienta-les que pueden influenciar el rendimiento de un animal de por vida.
- hss: efecto aleatorio de la r-ésima clasehato-semental. Cuantifica las posibles diferencias entre progenies de un mismo semental nacidas en distintos hatos.
- εijklmnopqr: error aleatorio.
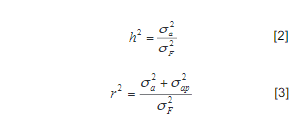
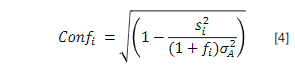

Al-Seaf, A; Keown, JF; Van Vleck, LD. 2007. Estimates of correlations among yield traits and somatic cell score with different models to adjust for bovine somatotropin effects on Holstein dairy cows. Genetics and Molecular Research 6(1):67-78.
Atakan, KOÇ. 2008. A Study of Somatic Cell Counts in the Milk of Holstein-Friesian Cows Managed in Mediterranean Climatic Conditions. Turkish Journal Veterinary Animal Science 32(1):13-18.
Berry, DP; Lee, JM; Macdonald, KA; Stafford, K; Matthews, L; Roche, JR. 2007. Associations among body condition score, body weight, somatic cell count, and clinical mastitis in seasonally calving dairy cattle. J. Dairy Sci. 90(2):637-648.
Blowey, RW; Edmondson, P. 2010. Mastitis Control in Dairy Herds. 2 ed. CAB International, Oxfordshire, UK. 266 p.
Carlén, E; Strandberg, E; Roth, A. 2004. Genetic Parameters for Clinical Mastitis, Somatic Cell Score, and Production in the First Three Lactations of Swedish Holstein Cows. J. Dairy Sci. 87(9):3062–3070.
CDN(CanadianDairyNetwork,CA).2014.MastitisResistance Selection: Now a Reality! (en línea). Guelph, Canada. Consultado 11 set. 2015. Disponible en https://www. google.com/url?sa=t&rct=j&q=&esrc=s&source= web&cd= 1&ved=0CCIQFjAAahUKEwiGwfe7nO_ HAhUGjg0KHWxsCow&url=https%3A%2F%2 Fwww.cdn.ca%2Fdocument.php%3Fid%3D356& usg=AFQjCNHWzFlZKBdDhBdrx1yj-uy0A2p-hA&bvm=bv.102537793,d.eXY&cad=rja
Costa, C; Freitas, A; Cobuci, J; Thompson, G; Carvalheira, J; Silva, M; Valloto, A. 2010. Genetic Parameters for Test Day Somatic Cell Count in Brazilian Holstein Cattle. Proceedings of the 9 th World Congress on Genetics Applied to Livestock Production. Leipzig, Alemania. p. 1-31.
De Haas, Y; Barkema, HW; Veerkamp, RF. 2002. The Effect of Pathogen-Specific Clinical Mastitis on the Lactation Curve for Somatic Cell Count. J. Dairy Sci. 85(5):1314-1323.
Detilleux, J; Leroy, P; Volckaert, D. 1997. Alternative use of somatic cell counts in genetic selection for mastitis resistance. Proceedings of the international workshop on genetic improvement of functional traits in cattle health. Uppsala, Sweden. p. 34-44.
Foss. 2015. Fossomatic™ FC (en línea). Hilrode, Denmark. Consultado 28 may. 2015. Disponible en http://www. foss.dk/industry-solution/products/fossomatic-fc/
García, AD. 2004. Células somáticas y alto recuento bacteriano. ¿Cómo controlarlo? (en línea). Consultado 5 jul. 2011. South Dakota, USA. Disponible en http:// pubstorage.sdstate.edu/AgBio_Publications/articles/ ExEx4031-S.pdf
Gilmour, AR; Cullins, BR; Welham, SJ; Thompson, R. 1998. ASREML user´s manual. New South Wales Agriculture, Orange Agricultural Institute, Orange, NSW, Australia. p. 104.
Haile-Mariam, M; Goddard, ME; Bowman, PJ. 2001. Estimates of Genetic Parameters for Daily Somatic Cell Count of Australian Dairy Cattle. J. Dairy Sci. 84(5):1255-1264.
Harmon, RJ. 2001. Somatic cell counts: a primer. Reno, Nevada, Estados Unidos. 40th Annual Meeting, National Mastitis Council. 6 p.
Harville, DA. 1977. Maximum Likelihood Approaches to Variance Component Estimation and to Related Problems. J. Am. Stat. Assoc. 72(358):320-338.
Hogeveen, H. 2005. Mastitis in Dairy Production: Current Knowledge and Future Solutions. The Netherlands, Wageningen Academic Pub. 744 p.
Holdridge, L. 1987. Ecologia basada en zonas de vida. Traducido por Humberto Jimenez Saa. San Jose, Costa Rica. IICA. 216 p.
INTERBULL (International Bull Evaluation Service, SE). 2015. International Bull Evaluation Service Official Website (en línea). Uppsala, Sweden. Consultado 9 set. 2015. Disponible en http://www.interbull.org/ index
Jamrozik, J; Koeck, A; Miglior, F; Kistemaker, GJ; Schenkel, FS; Kelton, DF; Van Doormaal, BJ. 2013. Genetic and Genomic Evaluation of Mastitis Resistance in Canada. Nantes, France. INTERBULL Bulletin (47):43-51.
Lévesque, P. 2004. Menos mastitis, mejor leche. Québec, Canada, Institut de Technologie Agroalimetaire. 96 p.
McParland, S; O’Brien, B; McCarthy, J. 2013. The association between herd- and cow- level factors and somatic cell count of Irish dairy cows. Irish J. Agr. Food Res. 52(2):151-158.
Miglior, F; Koeck, A; Jamrozik, J; Schenkel, FS; Kelton, DF; Kistemaker, GJ; Van Doormaal, BJ. 2014. Index for Mastitis Resistance and Use of BHBA for Evaluation of Health Traits in Canadian Holsteins. Berlin, Germany. INTERBULL Bulletin (48):73-78.
Mitev, JE; Gergovska, ZHI; Miteva, TCHM. 2012. Effect of teat end hyperkeratosis on milk somatic cell counts in Bulgarian Black- and-White dairy cattle. Bulgarian J. Agric. Sci. 18(3):451-454.
Mrode, RA; Swanson, GJT. 1996. Genetic and statistical properties of somatic cell count and its suitability as an indirect means of reducing the incidence of mastitis in dairy cattle. Anim. Breed. Abs. 64:847-857.
Neijenhuis, F; Mein, GA; Britt, JS; Reinemann, DJ; Hillerton, JE; Farnsworth, R; Baines, JR; Hemling, T; Ohnstad, I; Cook, N; Morgan, WF; Timms, L. 2001. Evaluation of bovine teat condition in commercial dairy herds: 4. Relationship between teat-end callosity or hyperkeratosis and mastitis. (disco compacto) National Mastitis Council. 2th International Symposium on Mastitis and Milk Quality. Vancouver, BC, Canada. 1 disco compacto, 8 mm.
NMC (National Mastitis Council, USA). 2016. Recommended mastitis control program-International version (en línea). Wisconsin, USA. Consultado 30 ago. 2016. Disponible en https://www.nmconline.org/docs/ NMCchecklistInt.pdf
Noordhuizen, JPTM; Buurman, J. 1984. Veterinary automated management and production control program for dairy farms (VAMPP). The application of MUMPS for data processing. Vet. Q. 6(2):66-72.
Pérez, E; Baayen, MT; Capella, E; Barkema, H. 1989. Development of a livestock information system for Costa Rica. In Kuil, H; Palin, RW; Huhn. JE (eds.). Livestock Production and Diseases in the Tropics. Proc. IV Internl. Conf. Inst. Trop. Vet. Med. Utrecht, The Netherlands. p. 221-224.
Prendiville, R; Pierce, KM; Buckley, F. 2010. A comparison between Holstein-Friesian and Jersey dairy cows and their F1 cross with regard to milk yield, somatic cell score, mastitis, and milking characteristics under grazing conditions. J. Dairy Sci. 93(6):2741-2750.
Rodriguez-Zas, SL; Gianola, D; Shook, GE. 2000. An Approximate Bayesian Analysis of Somatic Cell Score Curves in Holsteins. Acta Agric. Scand., Sect. A, Animal Sci. 50(4):291-299.
Ruegg, PL; Pantoja, JCF. 2013. Understanding and using somatic cell counts to improve milk quality. Irish J. Agric. Food Res. 52(2):101-117.
Rupp, R; Boicchard, D. 2003. Genetics of resistance to mastitis in dairy cattle. Vet. Res. 34(5):671-688.
Schutz, MM. 1994. Genetic Evaluation of Somatic Cell Scores for United States Dairy Cattle. J Dairy Sci. 77(7):2113-2129.
Sewalem, A; Miglior, F; Kistemaker, GJ; Van Doormaal, BJ. 2006. Analysis of the Relationship Between Somatic Cell Score and Functional Longevity in Canadian Dairy Cattle. J. Dairy Sci. 89(9):3609-3614.
Sharma, N; Singh, NK; Bhadwal, MS. 2011. Relationship of Somatic Cell Count and Mastitis: An Overview. Asian-Aust. J. Anim. Sci. 24(3):429-438.
Shook, G. 2001. Breeding, selection and somatic cell counts: Where are we today? (en línea). Wisconsin, USA. Consultado 15 mar. 2015. Disponible en http://www. nmconline.org/articles/GenSCS.pdf
Shook, GE. 1993. Genetic improvement of mastitis through selection on somatic cell count. Vet. Clin. North Am. Food Anim. Pract. 9(3):563-581.
USDA (Department of Agriculture, USA). 2007. Dairy 2007 Part I: Reference of Dairy Cattle Health and Management Practices in the United States, 2007 (en línea). Colorado, USA. Consultado 15 mar. 2015. Disponible en http://www.aphis.usda.gov/animal_health/nahms/dairy/downloads/dairy07/ Dairy07_dr_PartI.pdf
Vallimont, JE; Dechow, CD; Sattler, CG; Clay, JS. 2009. Heritability estimates associated with alternative definitions of mastitis and correlations with somatic cell score and yield. J. Dairy Sci. 92(7):3402-3410.
Vargas Bejarano, R. 2008. La calidad de la leche en Costa Rica. La Cooperativa de Productores de Leche Dos Pinos: Un caso de éxito. In Barbosa, SBP; Batista, AMV; Monardes, H (eds.). Congresso Brasileiro de Qualidade do Leite. CCS Gráfica e Editora (3, 2008, Recife, Brasil). Recife, Brasil. p. 241-250.
Zhao, F; Guo, G; Wang, Y; Guo, X; Zhang, Y; Du, L. 2015. Genetic parameters for somatic cell score and production traits in the first three lactations of Chinese Holstein cow. J. Integr. Agric. 14(1):125-130.







