INTRODUCCIÓN
Las garrapatas son parásitos que se alimentan de sangre de animales vertebrados. De las tres familias existentes, se han identificado en el mundo 19 géneros y más de 800 especies, correspondiendo 636, a la familia Ixodidae (Soulsby, 1988). Para América se han identificado 170 especies, de las cuales 48 pertenecen al género Ixodidae spp., y en Guatemala, se han identificado 13 especies de las cuales Boophilus microplus y Amblyoma cajennense, son las de mayor importancia económica para la ganadería, ya que además del daño que provocan, transmiten enfermedades de importancia económica, como la anaplasmosis y piroplasmosis bovina (Prodesa, 1988). Las garrapatas se han logrado adaptar a una gran variedad de hábitats y además posen una distribución cosmopolita. Los hospederos parasitados por garrapatas presentan una variedad considerable, desde las asociadas a un hospedero en particular, como el caso del Boophilus spp. con los bovinos, hasta aquellas con un amplio rango de hospederos como Amblyoma cajennense con mamíferos, aves, batracios, roedores y reptiles (Prodesa, 1988).
El uso de garrapaticidas de origen químico, así como la falta de alternativas en el mercado llevan a que sea necesario desarrollar opciones que sean efectivas en el control de las garrapatas, que no contaminen los productos de la explotación bovina y que a la vez sean inocuas al medio ambiente. Los hongos entomopatógenos tienen gran potencial como agentes controladores, constituyendo un grupo con más de 750 especies, diseminados en el medio ambiente y provocando infecciones fungosas a poblaciones de artrópodos (Pucheta et al., 2006). López y Hans (2001) mencionan que entre los géneros más importantes de hongos entomopaógenos se encuentran: Metarhizium spp., Beauveria spp., Aschersonia spp., Entomophthora spp., Zoophthora spp., Erynia spp., Eryniopsis spp., Akanthomyces spp., Fusarium spp., Hirsutella spp., Hymenostilbe spp., Paecelomyces spp., y Verticillium spp., mientras que para la FAO (2003) los géneros de importancia son Metarhizium spp., Beauveria spp., Paecilomyces spp., Verticillium spp., Rhizopus spp. y Fusarium spp. Como respuesta a lo anterior se evaluó eficiencia y efectividad de cuatro cepas del hongo Metarhizium anisopliae (Metschinkoff) como una alternativa de bajo costo e inocua al ambiente, como control para garrapata Boophilus spp., en condiciones in vitro, en su fase de vida libre e in situ, en su etapa parasitaria en bovinos.
MATERIALES Y MÉTODOS
La investigación se llevó a cabo en el Centro Universitario de Oriente (CUNORI) localizado en el municipio de Chiquimula, Guatemala (12° 47’ 58’’ N y 89° 31’ 05’’ O) a 320 m de altitud. El municipio se ubica en la zona de vida de bosque seco subtropical con una temperatura mínima de 19 °C, una máxima de 42 °C y precipitación promedio de 850 mm anuales (Cruz, 1982).
Desarrollo experimental
Se determinó in vitro la efectividad de cuatro cepas del hongo Metarhizium spp. sobre larvas (L1) de garrapatas del género Boophilus spp. obtenidas a partir de la incubación en laboratorio para ser inoculadas con una solución estandarizada del hongo en suspensión. En una segunda fase se evaluó con terneros estabulados utilizados como hospederos para el desarrollo de las larvas sembradas en campos delimitados por cámaras instaladas en los mismos, donde se efectuó la aplicación del hongo de las cepas que resultaron más efectivas durante la fase in vitro.
Manejo in vitro
Se recolectó, identificó, cultivó y reprodujo garrapatas del género Boophilus spp, con el propósito de obtener una población homogénea para la aplicación de las cepas de Metarhizium spp. La recolección de las hembras repletas o teleóginas, se llevó a cabo en fincas con ganado de doble propósito del municipio de Chiquimula, provenientes de bovinos parasitados; las garrapatas colectadas fueron identificadas y trasladadas posteriormente a una cámara de incubación construida para ese fin, a una temperatura entre 27 °C y 30 °C con humedad relativa promedio de 85%, para que las garrapatas repletas finalizaran su ciclo de vida dentro de frascos de vidrio con papel absorbente en el fondo, hasta llegar la oviposición la cual se produjo entre el segundo y quinto día posterior a la introducción de las teleóginas en la cámara de incubación.
Al finalizar la oviposición se retiraron los cadáveres de las hembras repletas y se continuó con el proceso de espera de la eclosión de las larvas (L1), periodo que duró entre 14 y 16 días. Un día después de iniciada la eclosión de las larvas se procedió a cerrar la boca de los frascos con papel filtro y adhesivo a base de silicón para evitar el escape de las larvas de sus frascos. Las larvas estuvieron en ambiente de 85% y 100% de humedad relativa y se esperó un periodo de entre 14-18 días para obtener un mejor desarrollo de las larvas antes de la inoculación, con soluciones de las cuatro cepas del hongo a prueba.
Manejo del hongoMetarhizium spp.
Las cuatro cepas iniciales provinieron de laboratorios comerciales, como el del Ingenio La Unión y el CENGICAÑA que proporcionaron las cepas PLH y CH 93-3, respectivamente; y el del Agrícola El Sol, que aportó las cepas AESCHS y AESGC. Para llevar a cabo la inoculación de las larvas (L1) de las garrapatas con el hongo, las cepas fueron estandarizadas mediante reproducción y multiplicación.
La unidad experimental fue formada por frascos de vidrio, conteniendo no menos de 1,100 larvas de garrapatas del género Boophilus spp., eclosionadas de los huevos de dos teleóginas, colocadas en un frasco de vidrio para el desarrollo controlado de su ciclo evolutivo, dispuestos dentro de una cámara de incubación con ambiente controlado. Se utilizó un diseño completamente al azar con seis tratamientos y 10 repeticiones, cuyos tratamientos correspondieron a las cuatro cepas del hongo en estudio, un grupo testigo a base de Amitraz y un placebo. El modelo lineal utilizado en la prueba in vitro fue: Yij = μ + θ1 + Σ(a) + τj + θτij + Σij donde: Yij = variable respuesta. μ = efecto de la media poblacional. θi = efecto del período de incubación del hongo sobre la L1 de la garrapata. Σ(a) = error asociado a los periodos de incubación. τj = efecto de las cepas evaluadas. θτij = efecto de la interacción entre el periodo de incubación y las cepas. Σij = error experimental asociado a las unidades experimentales. Los tratamientos evaluados fueron T1 = Amitraz, T2 = Placebo, T3 = PLH, T4 = CH 93- 3, T5 = Cepa A.S.G.C y T6 = Cepa A.E.S.CH.S.
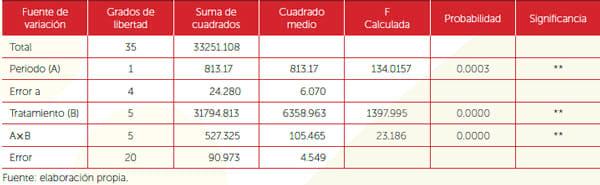
En las pruebas in vitro se efectuaron conteos a las 48 y 96 horas después de la aplicación de los tratamientos sobre las larvas de garrapatas para evaluar el periodo de incubación del hongo. Posteriormente se obtuvieron los porcentajes de larvas muertas de cada uno de los tratamientos evaluados en relación con el número total de larvas; estos porcentajes fueron transformados mediante el arcoseno de la raíz cuadrada de la proporción. Los conteos se hicieron con el estereoscopio a 40X y para determinar el crecimiento de micelio en fase de desarrollo sobre las larvas de garrapata con microscopio a 10X. Los porcentajes de las larvas de garrapata (L1) muertas de cada uno de los periodos de incubación transformados mediante el arcoseno de la raíz cuadrada de la proporción fueron sometidos a un análisis de varianza y las diferencias estadísticas entre los factores y su interacción fueron analizadas con el procedimiento de comparación de medias mediante la prueba Tukey, con un nivel de 0.05 de significancia.
Evaluación in vivo
Se adquirieron ocho bovinos, jóvenes encastados con peso promedio de 195 kg vivo, que fueron estabulados individualmente y alimentados con forraje verde picado ad libitum, durante el tiempo que duró el experimento. Previo a la fase de experimentación se aplicó un periodo de adaptación de los animales que incluyó aplicación de vacunas (Ántrax, Pierna Negra y Edema Maligno) vía parenteral y desparasitante oral a base de Albendazole (12 mg kg-1). Para mantener libre de garrapatas a los bovinos se aplicó Amitraz mediante aspersión en dosis de 2 ml L-1 de agua, tres semanas antes del experimento.
Cámaras de tela sobre los bovinos
Para la siembra de larvas se elaboraron 32 cámaras de tela de 20 centímetros de diámetro cada una, adheridas con pegamento de contacto en las regiones escapular y fosa paralumbar en ambos flancos de los animales, numeradas del uno al cuatro, iniciando por el lado izquierdo anterior, y en cuyo interior se llevó a cabo la siembra de las larvas de garrapata en fase de vida libre (L1) que parasitaron al bovino huésped, desarrollándose hasta la fase de teleógina o hembra repleta. En total se efectuaron dos siembras con un intervalo de 48 horas en las cámaras instaladas sobre los bovinos. Una vez ya colocadas en los bovinos, se inició el proceso de siembra y desarrollo de las larvas de garrapatas dentro de las cámaras. Para tal efecto se realizaron dos siembras, agregando a cada cámara las larvas nacidas de dos teleoginas adultas, cuya producción promedio se estimó en al menos 1,700 larvas por garrapata adulta. Se efectuaron dos eventos de siembra con intervalos de tres días entre sí (Figura 1).
Figura 1. A: Aplicación de larva (l1) de Bophillus spp., en bovinos. B: Terneros sometidos a la prueba de respuesta animal. C: Frascos conteniendo l1 de Bophillus spp., 4000 por unidad. D: Huevos de larva (l1) invadidos por el micelio de Metarhizium anisopliae.
Manejo del Hongo Metarhizium anisopliae
Para llevar a cabo las aplicaciones en la prueba de campo, previamente se seleccionaron dos cepas del hongo M. anisopliae, las cuales mostraron mejores resultados en la prueba in vitro y fueron sometidas a un proceso de revigorización a través de repetir fases de multiplicación y desarrollo para la aplicación en la prueba in vivo. La unidad experimental fue constituida por una cámara de tela de forma circular de 20 centímetros de diámetro adherida a la piel de los terneros que sirvieron de huéspedes para la siembra de no menos de 7,000 larvas de garrapata del género Boophilus spp, colocadas en dos siembras. Los tratamientos fueron las dos cepas del hongo que resultaron más efectivas en la fase in vitro, un tratamiento testigo a base de un garrapaticida y un placebo con materia inerte (T1=Amitraz, T2=Placebo, T3=PLH, T4=CH 93-3, respectivamente).
Diseño experimental y análisis de datos
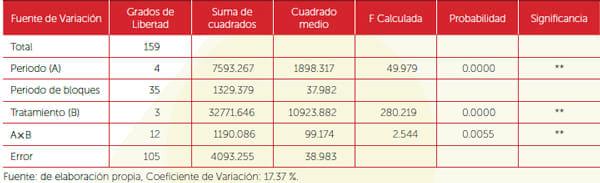
Se utilizó el diseño de bloques completamente al azar, con cuatro tratamientos y ocho repeticiones, con el modelo: Yij = μ + θi + θi(βj) + τk + θτijk + Σijk; donde: Yij = variable respuesta. μ = efecto de la media poblacional. θi = efecto del período de incubación del hongo sobre la garrapata en su fase parásita. θi(βj) = efecto anidado de los periodos de incubación dentro de las repeticiones. τk = efecto de las cepas evaluadas. θτijk = efecto de la interacción entre el periodo de incubación y las cepas. Σijk = error experimental asociado a las unidades experimentales. Se efectuó un conteo de garrapatas al momento del aparecimiento de las primeras teleologías previo a la aplicación; posteriormente se efectuaron conteos diarios de garrapatas vivas y muertas por cámara/ tratamiento durante, 24, 48, 72, 96 y 120 horas con el fin de evaluar el periodo de incubación del hongo y su efecto en los diferentes periodos. Finalmente se obtuvieron porcentajes totales de garrapatas vivas y muertas de cada tratamiento, transformados mediante el arcoseno de la raíz cuadrada de la proporción, y fueron sometidos a un análisis de varianza y comparación de medias (prueba Tukey) a 0.05 de significancia.
Variables
Porcentaje de efectividad en la prueba in vitro
Se determinó efectuando el conteo del total de larvas dentro de cada unidad experimental y estableciendo el número de larvas de garrapata del género Boophilus que mostraron infestación del hongo manifestado mediante crecimiento de micelio, desarrollo de conidios y penetración de la cutícula; esto con el apoyo de estereoscopio y microscopio.
Porcentaje de efectividad en la prueba in vivo y de eficiencia
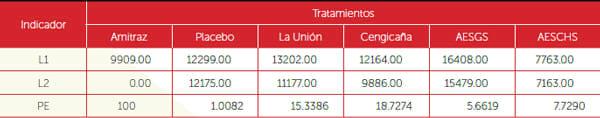
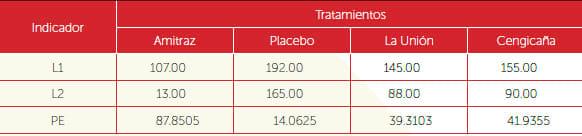
Se determinó efectuando un conteo previo a la aplicación de los tratamientos y luego cada 24 horas por cinco días para establecer el número de garrapatas adultas muertas y vivas que aún se hospedaban en cada cámara. El porcentaje de eficiencia de los productos obtenidos se determinó usando la fórmula: PE = L1 - L2/L1, donde: PE = Porcentaje de eficiencia. L1 = Número de garrapatas antes de la aplicación. L2 = Número de garrapatas vivas post aplicación por cada lectura.
Características cualitativas
Éstas se determinaron mediante pruebas documentales de los efectos del hongo, principalmente durante la esporulación sobre la garrapata. Para verificar la infección del hongo sobre las garrapatas en la prueba in vivo se efectuó un muestreo de 10 garrapatas muertas por tratamiento, colocadas sobre cámaras húmedas para establecer si se realizaba desarrollo del micelio y posterior esporulación del hongo, a partir de lo cual se realizaron cortes histológicos que identificaron los daños ocasionados por el hongo sobre la cutícula de la garrapata.
RESULTADOS Y DISCUSIÓN
Porcentaje de efectividad en la prueba in vitro
La prueba in vitro realizada para determinar la efectividad del M. anisopliae, en la L1 de garrapatas del género Boophilus spp, mostró que los tratamientos tuvieron diferencias altamente significativas en la efectividad para el control de larvas del garrapata en estado de vida libre (CV = 8.82%). El comportamiento de los seis tratamientos aplicados en la prueba in vitro y su efectividad con respecto a los dos conteos llevados a cabo evidenciaron un incremento lineal de larvas muertas infectadas con respecto al incremento en el periodo de conteo, con porcentajes de 17.60% para la cepa proveniente de la Unión, 19.10 para la cepa de CENGICAÑA; 5.50 para la cepa AESGC y 7.30 para la cepa AESCHS, a las 96 horas post-aplicación. La Figura 2 muestra la diferencia entre tratamientos y entre las cuatro cepas sometidas a la prueba, de las cuales La Unión y CENGICAÑA fueron relevantes.
En un experimento llevado a cabo para determinar la efectividad de 12 cepas de M. anisopliae sobre hembras repletas de garrapatas del género Boophilus spp., Guedes- Frazon (2000) encontró que seis de las cepas ocasionaron ente 20 y 50% de infección a las teleóginas, entre el cuarto y el séptimo día post-aplicación de una suspensión de conidios a 106 y 105 conidios ml-1. Moreno et al. (2001) evaluaron a M. anisopliae, B. bassiana y Verticillium lecanii sobre teleoginas de Boophilus microplus, donde M. anisoplie generó inhibición de 87% a concentración de 109 conidiosporas ml-1. Posada y Lecuona (2009) evaluaron la efectividad de 259 aislados de B. bassiana obtenidos del suelo, de garrapatas muertas y de colección fúngica para el control de B. microplus, registrando que la CL50 para 98 de los aislados más virulentos fue de 1 X 107 y 1,15 X 107 conidios ml-1. Fernández- Ruvalcaba et al. (2005) evaluaron la efectividad in vitro de M. anisopliae a diferentes concentraciones en cepas de B. microplus resistente y sensible a organofosforados, hallando que una concentración de 108 esporas X ml-1 genera 100% de mortalidad a los 20 días postinfección. De igual manera, hubo reducción de los parámetros reproductivos con variación en las diferentes concentraciones (Cuadro 1).
Figura 2. Garrapatas del género Boophilus spp. infectadas de Metarhizium anisopliae (Metschinkoff) y en pleno desarrollo de la fase de colonización (producción de conidios). Efecto de las hifas de hongo Metarhizium anisopliae, (Metschinkoff) sobre la cutícula de garrapatas adultas (corte histológico de la cutícula), CUNORI.
Cuadro 1. Análisis de varianza de la prueba in vitro para determinar la efectividad de seis tratamientos en el control de L1 de garrapatas del género Boophilus spp.
Cuadro 2. Efectividad de cuatro tratamientos en el control de garrapatas (Boophilus spp.), fase parásita en bovinos estabulados.
Porcentaje de efectividad en la prueba in vivo
En la prueba in vivo realizada para determinar la efectividad de M. anisopliae en garrapatas del género Boophilus spp., en su fase parásita sobre huéspedes bovinos estabulados, se observó que los tratamientos mostraron diferencias altamente significativas en la efectividad (Cuadro 2). Es de hacer notar que el efecto placebo no fue la aplicación de dicho tratamiento, sino por el efecto animal de librarse de las garrapatas. Sin embargo, el comportamiento de las cepas del hongo M. anisopliae evaluadas con respecto a su efectividad en los diferentes conteos efectuados post-aplicación demostraron que ambas aumentan de forma lineal, haciéndose más notorio a partir de las 72 horas. Además, se muestra la interacción existente entre las dos cepas de M. anisopliae revigorizadas con respecto al periodo postaplicación, evidenciando una efectividad creciente en el tiempo, principalmente en la cepa proveniente de CENGICAÑA. En un experimento llevado a cabo para evaluar la posibilidad de incrementar la capacidad infectiva de dos cepas de M. anisopliae sobre hembras repletas de garrapatas Boophilus microplus, Guedez-Frazon (2000) observó que después de infectar artificialmente teleóginas y a partir de ellas elaborar el inóculo para un segundo pasaje (proceso de revigorización), dos días después de la aplicación se presentó un porcentaje de efectividad de 84%, contrastando con 1.8% obtenido de las mismas cepas en la primera aplicación. En los trabajos realizados en animales, las variaciones en la efectividad de las cepas se pueden relacionar directamente con los factores climáticos y el lugar de procedencia de las cepas, ya que existen algunas que presentan una mayor tolerancia a altas temperatura y exposición a rayos UV (Fernández y Bittencourt, 2008; Biduchka et al., 2001), así como al microambiente del animal, como la temperatura de la piel, ya que se ha demostrado que al incrementarse la temperatura por encima de 34 °C, la germinación del hongo empieza a reducirse (Polar et al., 2008).
Porcentaje de eficiencia
En función de los resultados se observa que las cepas La Unión y CENGICAÑA fueron las que mejor eficiencia mostraron en la evaluación in vitro y a partir de éstos se seleccionaron para ser evaluadas en la prueba in vivo o de campo. Los resultados mostrados en los Cuadros 3 y 4 evidencian el nivel de eficiencia de las cepas La Unión y CENGICAÑA, con porcentajes de 45% y 48% de lo registrado por el testigo a base de Amitraz.
Cuadro 3. Porcentaje de eficiencia (PE) de seis tratamientos evaluados in vitro, con base en sumatoria de conteos.
Cuadro 4. Porcentaje de eficiencia (PE) de cuatro tratamientos evaluados in vivo con base en sumatoria de conteos.
Características cualitativas
En el efecto del M. anisopliae sobre la cutícula de la garrapata se observó una invasión de las hifas penetrando las membranas, rompiendo la continuidad del tejido; sin embargo, no se debe olvidar el efecto enzimático del hongo que a través de una histólisis favorece la penetración de las hifas y la degeneración hialina, que posiblemente sea de tipo extracelular por la precipitación de proteínas plasmáticas de los organelos que se han escapado de la pared celular de las garrapatas, ocurriendo la muerte por un proceso de consunción en la garrapata.
CONCLUSIONES
Las cuatro cepas del hongo M. anisopliae evaluadas en la prueba in vitro para el control de garrapatas en estado de larva (L1) presentaron crecimiento de micelio sobre larvas de garrapatas del género Boophilus spp. En la prueba in vitro existieron diferencias altamente significativas entre las cuatro cepas del hongo y el control químico sobre la mortalidad de garrapatas en estado de larva (L1); las cepas del hongo La Unión y CENGICAÑA evaluadas in vitro fueron las de mayor mortalidad sobre garrapatas en estado de larva (L1) y en la prueba in vivo incrementaron su efectividad en el control de garrapatas del género Boophilus spp. en su fase parásita, registrando hasta 50% de efectividad respecto al mostrado por Amitraz.
LITERATURA CITADA
Bidochka M.J, Kamp A.M,, Lavender T.M,, Dekoning J, and De Croos J.N.A. 2001 Habitat association in two genetic groups of the insect athogenic fungus Metarhizium anisopliae: Uncovering crypt species? Applied Environmental Microbiology; 67:1335- 1342.
CENGICAÑA. 1998 Manejo integrado de la chinche salivosa en caña de azúcar. Guatemala. COMIP, (Comité de Manejo Integrado de Plagas GT). 33 p.
CENGICAÑA (Centro Guatemalteco de Investigación y Capacitación de la Caña de Azúcar Gt). 2002. Informe anual 2001–2002. Guatemala 58p.
Cruz S., J.R. De La. 1982. Clasificación de zonas de vida de Guatemala a nivel de reconocimiento basado en el sistema Holdridge. Guatemala, Dirección General de Servicios agrícolas. 42 p.
Fernandez E.D., Bittencourt V.R.E.P. 2008 Entomopathogenic fungi against South American tick species. Experimental Applied Acarology 46:71-93.
Fernández-Ruvalcaba M., Zhioua E., García-Vázquez Z. 2005 Infectividad de Metarhizium anisopliae en contra de cepas de garrapata Boophilus microplus sensible y resistente a los organofosforados. Técnica Pecuaria en México, v. 43, n. 3, p. 433-440.
FAO. 2003 Resistencia a los antiparasitarios: estado actual con énfasis en América Latina. Roma: Dirección de producción y sanidad animal de la FAO. p. 33-35.
Guedez-Frazon A.P. 2000. In vitro assesment of Metarhizium anisopliae isolates to control the cattle tick Boophilus microplus (en linea) Brazil, Vetrinary Parasitology, ELSEVIER 105 p. Consultado 10 de junio 2012 disponible en: www.elsevier.com/locate/vetpar 39
López-Llorca l.V., Hans-Börje J. 2001. Biodiversidad del suelo: control biológico de nematodos fitopatógenos por hongos nematófagos. Cuaderno de Biodiversidad, v. 3, n. 6, p. 12–15, Disponible en: <http://www.ua.es/es/informacion/ biodiversidad cuadbiod06.pdf>. Acceso en: junio 2012.
Moreno R., Hernández F., Benavides E.; Cotes A.M.; Romero A., Gómez E. I. García L.P. 2001 Evaluación in vitro de Metarhizium anisopliae, Beauveria bassiana y Verticillium lecanii para el control de la garrapata Boophilus microplus Canestrini (Mestastigmata: Ixodidae). In: CONGRESO SOCIEDAD COLOMBIANA DE ENTOMOLOGÍA, 28., 8-10 de agosto 2001, Pereira. Resúmenes. Bogotá: SOCOLEN.
Posada J.B., Lecuona R.E. 2009 Selection of native isolates of Beauveria bassiana (Ascomycetes: Clavicipitaceae) for the microbial control of Rhipicephalus (Boophilus) microplus (Acari: Ixodidae). Journal of Medical Entomology, v. 46, n. 2, p. 284-291, http://dx.doi.org/10.1603/033.046.0213
PRODESA. 1988. Resumen del estudio y proyecto de control de garrapatas en Guatemala, Guatemala. p. 26.
Polar P., Moore D., Kairo M., Ramsubhag A. 2008 Topically applied myco-acaricides for the control of cattle ticks: overcoming the challenges. Exp Applied Acarology 46:119-148.
Puchera-Díaz M., Flores Macías A., Rodríguez-Navarro S., De La Torre M. 2006 Mecanismo de acción de los hongos entomopatógenos. INCI, v. 31, n. 12, p. 856-860.
Soulsby E.J.L. 1988. Parasitología y enfermedades parasitarias en los animales domésticos. 7 ed. México, Editorial Interamericana. 823 p.