Comparación de tres pruebas diagnósticas para el aborto por rinotraqueitis infecciosa bovina en hatos lecheros
Publicado: 19 de agosto de 2006
Por: Alfa Bracho Cárdenas - Carlos J. Jaramillo Arango - José Juan Martínez Maya - Juan Antonio Montaño Hirose - Arturo Olguín y Bernal
Resumen
El presente trabajo compara la sensibilidad (Se), especificidad (Es), valor predictivo positivo (VP(+)) y valor predictivo negativo (VP(-)) de las pruebas de inmunoperoxidasa (IP) e inmunofluorescencia (IF) para el diagnóstico de abortos causados por rinotraqueítis infecciosa bovina, así como la concordancia de los resultados con los de seroneutralización (SN) en las madres de dichos fetos, tomando como prueba estándar de diagnóstico el aislamiento viral (AV). Se evaluaron 49 fetos abortados, obtenidos a lo largo de un año. A cada uno se le tomaron muestras de hígado, bazo, riñón y pulmón; de las madres se obtuvieron tres muestras de suero, con intervalo de un mes, obteniendo la primera a partir del aborto. Las muestras se tomaron en el Complejo Agropecuario e Industrial de Tizayuca (CAIT), en Tizayuca, Hidalgo, México; las técnicas diagnósticas se realizaron en el Centro Nacional de Servicios de Diagnóstico en Salud Animal (CENASA) conforme lo establecido en el mismo centro y por la Organización Mundial de Sanidad Animal (OIE). Se obtuvieron 29 aislamientos virales de IBR del total de las muestras. La prueba de IP tuvo una Se de 96.7% y Es de 20%, VP(+) de 64.4% y VP(-) de 80%. La prueba de IF tuvo una Se de 24.1% y una Es de 70%, un VP(+) de 53.8% y VP(-) de 38.9%. La concordancia para ambas pruebas fue mala. Respecto del órgano, la muestra de hígado y riñón fueron las mejores para diagnóstico de IBR por IF e IP, respectivamente. La concordancia para SN, IF e IP con respecto al AV no fue significativa (P > 0.05).
Palabras clave: IBR, DIAGNÓSTICO, ABORTOS,PRUEBAS DIAGNÓSTICAS.
Introducción
Un agente viral asociado a brotes de enfermedades respiratorias del bovino esel Herpes Bovis 1 (BHV-1) de la familia Herpesviridae que ocasiona la rinotraqueítisinfecciosa bovina (IBR). Según el análisis genómico y tipoantigénicos, el BHV-1 se divide en BHV-1.1 y BHV-1.2, que, a su vez, sesubdivide en subtipo BVH-1.2a y BHV-1.2b.1 Las manifestaciones clínicasy curso de la enfermedad dependen del sitio anatómico de la infección,la edad y el estado inmunológico del portador,2,3 produciendo desde uncuadro clínico respiratorio (rinotraqueítis, conjuntivitis), genital(vaginitis, epididimitis, orquitis y aborto), enteritis y hasta enfermedad sistémica.1,2
La enfermedad tiene un periodo de incubación de 21 días, en promedio.4Cuando la infección ocurre en forma subclínica,1 aquéllase caracteriza por la interrupción de la gestación, lo cual sucedeen 25% al 50% de las vacas gestantes; si la infección se establece tempranamenteen la gestación puede provocar reabsorción embrionaria, pero sila muerte ocurre en los dos primeros trimestres de la gestación (cuando éstaes dependiente del cuerpo lúteo por progesterona) el intervalo entre lamuerte fetal, la luteolisis y la expulsión es suficiente para la autolisisfetal. Generalmente el aborto ocurre en el tercer tercio de la gestación,en un tiempo no mayor a tres semanas en el que el feto está autolizado.1,2,5,6
La prevalencia en hatos depende de factores como el estado inmunitario de lamadre, el periodo de la gestación en que ocurra la infección osi se manifiesta ésta, del tropismo y la virulencia del agente.1
En muestras enviadas al Centro Nacional en Servicios de Diagnóstico enSalud Animal, entre enero de 1992 a febrero de 1996, se obtuvo una frecuenciade positivos de 56.53% en 18 estados de la República mexicana.
La transmisión del virus se realiza a través de las secrecionesrespiratorias, oculares o del aparato reproductor, como el semen, implante deembriones y las operaciones obstétricas.7
El virus puede mantenerse latente en los rebaños, por la presencia debovinos portadores de cepas de campo que se reactivan ocasionalmente bajo diversosestímulos con la consecuente replicación viral a travésde los tractos respiratorio y reproductor, lo cual favorece la transmisióna los animales susceptibles. Esta situación hace que la IBR sea una enfermedadde gran difusión y de muy difícil control.5,7,8
Desde un enfoque económico, la importancia de la IBR aúnno ha sido evaluada completamente, pero se calcula que en diez años seremueve 18% del hato por enfermedades infecciosas, de las cuales es relevanteel aborto.9 La IBR es una enfermedad enzoótica de notificaciónobligatoria en México por su efecto significativo en la producciónpecuaria. Además, pertenece al grupo B del Código ZoosanitarioInternacional por su importancia estratégica para las acciones desalud animal en cada país.4,10
En México, la IBR es una de las enfermedades infecciosas de gran importanciaen los hatos lecheros, pues en la mayoría de los animales la enfermedadtranscurre en forma subclínica; tiene como principal característicael aborto y como consecuencia la pérdida de la cría y la lactancia,afectando los parámetros reproductivos y productivos e incrementando notablementelas pérdidas económicas.
Las técnicas comunes para el diagnóstico de IBR son: seroneutralización,fijación del complemento, ELISA, neutralización viral, aislamientoviral, inmunofluorescencia e inmunohistoquímica.1, 11
La prueba de sueroneutralización tiene como propósito buscar anticuerposneutralizantes en el suero de los animales. Si se utiliza la incubaciónconvencional del virus de 1 hora a 37ºC, la prueba presenta una sensibilidadde 89.2% y especificidad cercana a 100%. Sin embargo, si los reactivos se incubandurante 24 h, es posible aumentar la sensibilidad a 94.4%, pero la especificidaddisminuye a 93.2%.12 Una limitante de esta prueba es que sólo es certeraen hatos donde no se vacuna.1
La prueba de inmunofluorescencia se utiliza para identificar antígenoso anticuerpos en material fresco (riñón y glándulas adrenales)1,13-15La prueba indirecta es más sensible, pero no lo suficiente para justificarsu uso, ya que es más demorada.15,16 En el examen directo de seccionescongeladas de riñón fetal, la prueba tiene especificidad superiora 90% y sensibilidad de 67%.15,16
Para la técnica de inmunoperoxidasa se realizan impresiones en láminasportaobjetos a partir de los tejidos sospechosos. Estos últimosse incubancon anticuerpos contra el virus de IBR conjugados con una enzima, generalmenteperoxidasa de rábano picante. Después de lavada, la impresiónes tratada con el sustrato de la enzima y un cromógeno cuyos productosprovocan una reacción coloreada directamente proporcional a la cantidadde antígeno presente en la muestra.17,18 Según Smith et al.,17esta prueba tiene sensibilidad de 94%.
Esta técnica tiene dos ventajas para el diagnóstico; una es queno se necesitan microscopios equipados para la observación con luz ultravioletay otra es que pueden fijarse directamente los cultivos celulares infectados enlas mismas microplacas utilizadas para el aislamiento viral.
Otra prueba diagnóstica es el aislamiento viral, que tiene por inconvenientessu lentitud, ya que tarda al menos una semana; requiere de equipo, material ypersonal especializados. Si las muestras no se trabajan inmediatamente o sonalmacenadas, deben congelarse a -70°C. Cultivos de células en monocapa,homólogas o primarias se incuban a 37°C y se observan diariamentepara comprobar la aparición de efecto citopático, este efecto debevalorarse en comparación con cultivos no inoculados llamados testigosnegativos, en especial en casos de virus que precisan periodos de incubaciónsuperiores a una semana.10,19,20
Algunos autores mencionan que el diagnóstico en abortos sólo seconfirma por examen de tejido fetal.1 Aunque los diferentes aislamientos viralesobtenidos de distintas formas clínicas de la enfermedad difieren en suafinidad por los distintos órganos, resultan serológicamente idénticos.16
A nivel oficial, para diagnóstico de IBR se debe utilizar la pruebade seroneutralización, que ha sido aceptada internacionalmente como pruebade referencia.10,20
Como consecuencia de lo anterior es necesario una prueba alternativa de equivalentevalor o mejor especificidad, sensibilidad y más rápida para detectarapropiadamente a los animales y fetos infectados en las condiciones existentesen campo.
Material y métodos
El estudio se llevó a cabo en el Complejo Agropecuario e Industrial deTizayuca (CAIT), en Tizayuca, Hidalgo, México, mediante un muestreo noprobabilístico por conveniencia en el que se evaluaron los fetos abortadosobtenidos mediante la notificación de los encargados o dueños,o ambos, de los establos al laboratorio de patología del CAIT, y los suerosde las vacas y vaquillas progenitoras de aquéllos a lo largo del peridode estudio.
A los fetos obtenidos se les realizó la necropsia conforme a lo descritopor Aluja,21 disecando: hígado, bazo, riñón y pulmón,de cada uno se obtuvieron aproximadamente 2 cm³, que se colocaron en frascosde vidrio estériles identificados y mantenidos en congelación a-4ºC durante uno a dos días hasta su traslado al Centro Nacionalen Servicios de Diagnóstico en Salud Animal (CENASA), donde se analizaron.
El día en que cada vaca abortó, se le tomaron 10 ml de sangre mediante punciónen la vena coccígea. El suero se clarificó por centrifugacióna 1875 g durante 15 minutos y se colocó en viales estériles;este proceso se repitió a los 30 y 60 días después del aborto.Las muestras se conservaron en congelación a -4?C hasta su análisis.
Análisis de los órganos
A cada muestra de órgano se le realizaron pruebas de: aislamiento viral(AV), inmunoperoxidasa en placa (IPP), inmunoperoxidasa directa (IP) e inmunofluorescenciadirecta (IF).
Para el diagnóstico por AV se realizó un macerado con aproximadamente0.5 g de cada órgano (2 g en total) en 18 ml de MEM (medio esencial mínimo),conteniendo 0.2 ml de bicarbonato al 2%. Se filtró en una membrana de0.45 µm, la técnica se realizó según la OIE.18,19
Se utilizaron las líneas celulares MDBK y PK15 inoculándose cincobotellas de 5 ml por línea celular y por muestra; las botellas se observarondiariamente durante cinco días para detectar efecto citopático.Si no hubo efecto durante esos días se realizaron de tres a cinco pasespor muestra de feto; simultáneamente se realizó IPP en placa de96 pozos para evidenciar que el aislamiento viral fuera IBR.
Las técnicas de IP e IF se llevaron a cabo según lo recomendadopor la OIE y la FAO,19,20 las cuales consistieron básicamente en: Se cortó ymontó una muestra de órgano (hígado, bazo, riñóny pulmón) de aproximadamente 1 cm2 con gelatina y se congeló enun criostato para realizar tres cortes de 3-5 mm de espesor, los cuales se colocaronen un portaobjetos (laminilla), y se fijaron con acetona al 30% en congelacióndurante 10 minutos.El presente trabajo compara la sensibilidad (Se), especificidad (Es), valor predictivo positivo (VP(+)) y valor predictivo negativo (VP(-)) de las pruebas de inmunoperoxidasa (IP) e inmunofluorescencia (IF) para el diagnóstico de abortos causados por rinotraqueítis infecciosa bovina, así como la concordancia de los resultados con los de seroneutralización (SN) en las madres de dichos fetos, tomando como prueba estándar de diagnóstico el aislamiento viral (AV). Se evaluaron 49 fetos abortados, obtenidos a lo largo de un año. A cada uno se le tomaron muestras de hígado, bazo, riñón y pulmón; de las madres se obtuvieron tres muestras de suero, con intervalo de un mes, obteniendo la primera a partir del aborto. Las muestras se tomaron en el Complejo Agropecuario e Industrial de Tizayuca (CAIT), en Tizayuca, Hidalgo, México; las técnicas diagnósticas se realizaron en el Centro Nacional de Servicios de Diagnóstico en Salud Animal (CENASA) conforme lo establecido en el mismo centro y por la Organización Mundial de Sanidad Animal (OIE). Se obtuvieron 29 aislamientos virales de IBR del total de las muestras. La prueba de IP tuvo una Se de 96.7% y Es de 20%, VP(+) de 64.4% y VP(-) de 80%. La prueba de IF tuvo una Se de 24.1% y una Es de 70%, un VP(+) de 53.8% y VP(-) de 38.9%. La concordancia para ambas pruebas fue mala. Respecto del órgano, la muestra de hígado y riñón fueron las mejores para diagnóstico de IBR por IF e IP, respectivamente. La concordancia para SN, IF e IP con respecto al AV no fue significativa (P > 0.05).
Palabras clave: IBR, DIAGNÓSTICO, ABORTOS,PRUEBAS DIAGNÓSTICAS.
Introducción
Un agente viral asociado a brotes de enfermedades respiratorias del bovino esel Herpes Bovis 1 (BHV-1) de la familia Herpesviridae que ocasiona la rinotraqueítisinfecciosa bovina (IBR). Según el análisis genómico y tipoantigénicos, el BHV-1 se divide en BHV-1.1 y BHV-1.2, que, a su vez, sesubdivide en subtipo BVH-1.2a y BHV-1.2b.1 Las manifestaciones clínicasy curso de la enfermedad dependen del sitio anatómico de la infección,la edad y el estado inmunológico del portador,2,3 produciendo desde uncuadro clínico respiratorio (rinotraqueítis, conjuntivitis), genital(vaginitis, epididimitis, orquitis y aborto), enteritis y hasta enfermedad sistémica.1,2
La enfermedad tiene un periodo de incubación de 21 días, en promedio.4Cuando la infección ocurre en forma subclínica,1 aquéllase caracteriza por la interrupción de la gestación, lo cual sucedeen 25% al 50% de las vacas gestantes; si la infección se establece tempranamenteen la gestación puede provocar reabsorción embrionaria, pero sila muerte ocurre en los dos primeros trimestres de la gestación (cuando éstaes dependiente del cuerpo lúteo por progesterona) el intervalo entre lamuerte fetal, la luteolisis y la expulsión es suficiente para la autolisisfetal. Generalmente el aborto ocurre en el tercer tercio de la gestación,en un tiempo no mayor a tres semanas en el que el feto está autolizado.1,2,5,6
La prevalencia en hatos depende de factores como el estado inmunitario de lamadre, el periodo de la gestación en que ocurra la infección osi se manifiesta ésta, del tropismo y la virulencia del agente.1
En muestras enviadas al Centro Nacional en Servicios de Diagnóstico enSalud Animal, entre enero de 1992 a febrero de 1996, se obtuvo una frecuenciade positivos de 56.53% en 18 estados de la República mexicana.
La transmisión del virus se realiza a través de las secrecionesrespiratorias, oculares o del aparato reproductor, como el semen, implante deembriones y las operaciones obstétricas.7
El virus puede mantenerse latente en los rebaños, por la presencia debovinos portadores de cepas de campo que se reactivan ocasionalmente bajo diversosestímulos con la consecuente replicación viral a travésde los tractos respiratorio y reproductor, lo cual favorece la transmisióna los animales susceptibles. Esta situación hace que la IBR sea una enfermedadde gran difusión y de muy difícil control.5,7,8
Desde un enfoque económico, la importancia de la IBR aúnno ha sido evaluada completamente, pero se calcula que en diez años seremueve 18% del hato por enfermedades infecciosas, de las cuales es relevanteel aborto.9 La IBR es una enfermedad enzoótica de notificaciónobligatoria en México por su efecto significativo en la producciónpecuaria. Además, pertenece al grupo B del Código ZoosanitarioInternacional por su importancia estratégica para las acciones desalud animal en cada país.4,10
En México, la IBR es una de las enfermedades infecciosas de gran importanciaen los hatos lecheros, pues en la mayoría de los animales la enfermedadtranscurre en forma subclínica; tiene como principal característicael aborto y como consecuencia la pérdida de la cría y la lactancia,afectando los parámetros reproductivos y productivos e incrementando notablementelas pérdidas económicas.
Las técnicas comunes para el diagnóstico de IBR son: seroneutralización,fijación del complemento, ELISA, neutralización viral, aislamientoviral, inmunofluorescencia e inmunohistoquímica.1, 11
La prueba de sueroneutralización tiene como propósito buscar anticuerposneutralizantes en el suero de los animales. Si se utiliza la incubaciónconvencional del virus de 1 hora a 37ºC, la prueba presenta una sensibilidadde 89.2% y especificidad cercana a 100%. Sin embargo, si los reactivos se incubandurante 24 h, es posible aumentar la sensibilidad a 94.4%, pero la especificidaddisminuye a 93.2%.12 Una limitante de esta prueba es que sólo es certeraen hatos donde no se vacuna.1
La prueba de inmunofluorescencia se utiliza para identificar antígenoso anticuerpos en material fresco (riñón y glándulas adrenales)1,13-15La prueba indirecta es más sensible, pero no lo suficiente para justificarsu uso, ya que es más demorada.15,16 En el examen directo de seccionescongeladas de riñón fetal, la prueba tiene especificidad superiora 90% y sensibilidad de 67%.15,16
Para la técnica de inmunoperoxidasa se realizan impresiones en láminasportaobjetos a partir de los tejidos sospechosos. Estos últimosse incubancon anticuerpos contra el virus de IBR conjugados con una enzima, generalmenteperoxidasa de rábano picante. Después de lavada, la impresiónes tratada con el sustrato de la enzima y un cromógeno cuyos productosprovocan una reacción coloreada directamente proporcional a la cantidadde antígeno presente en la muestra.17,18 Según Smith et al.,17esta prueba tiene sensibilidad de 94%.
Esta técnica tiene dos ventajas para el diagnóstico; una es queno se necesitan microscopios equipados para la observación con luz ultravioletay otra es que pueden fijarse directamente los cultivos celulares infectados enlas mismas microplacas utilizadas para el aislamiento viral.
Otra prueba diagnóstica es el aislamiento viral, que tiene por inconvenientessu lentitud, ya que tarda al menos una semana; requiere de equipo, material ypersonal especializados. Si las muestras no se trabajan inmediatamente o sonalmacenadas, deben congelarse a -70°C. Cultivos de células en monocapa,homólogas o primarias se incuban a 37°C y se observan diariamentepara comprobar la aparición de efecto citopático, este efecto debevalorarse en comparación con cultivos no inoculados llamados testigosnegativos, en especial en casos de virus que precisan periodos de incubaciónsuperiores a una semana.10,19,20
Algunos autores mencionan que el diagnóstico en abortos sólo seconfirma por examen de tejido fetal.1 Aunque los diferentes aislamientos viralesobtenidos de distintas formas clínicas de la enfermedad difieren en suafinidad por los distintos órganos, resultan serológicamente idénticos.16
A nivel oficial, para diagnóstico de IBR se debe utilizar la pruebade seroneutralización, que ha sido aceptada internacionalmente como pruebade referencia.10,20
Como consecuencia de lo anterior es necesario una prueba alternativa de equivalentevalor o mejor especificidad, sensibilidad y más rápida para detectarapropiadamente a los animales y fetos infectados en las condiciones existentesen campo.
Material y métodos
El estudio se llevó a cabo en el Complejo Agropecuario e Industrial deTizayuca (CAIT), en Tizayuca, Hidalgo, México, mediante un muestreo noprobabilístico por conveniencia en el que se evaluaron los fetos abortadosobtenidos mediante la notificación de los encargados o dueños,o ambos, de los establos al laboratorio de patología del CAIT, y los suerosde las vacas y vaquillas progenitoras de aquéllos a lo largo del peridode estudio.
A los fetos obtenidos se les realizó la necropsia conforme a lo descritopor Aluja,21 disecando: hígado, bazo, riñón y pulmón,de cada uno se obtuvieron aproximadamente 2 cm³, que se colocaron en frascosde vidrio estériles identificados y mantenidos en congelación a-4ºC durante uno a dos días hasta su traslado al Centro Nacionalen Servicios de Diagnóstico en Salud Animal (CENASA), donde se analizaron.
El día en que cada vaca abortó, se le tomaron 10 ml de sangre mediante punciónen la vena coccígea. El suero se clarificó por centrifugacióna 1875 g durante 15 minutos y se colocó en viales estériles;este proceso se repitió a los 30 y 60 días después del aborto.Las muestras se conservaron en congelación a -4?C hasta su análisis.
Análisis de los órganos
A cada muestra de órgano se le realizaron pruebas de: aislamiento viral(AV), inmunoperoxidasa en placa (IPP), inmunoperoxidasa directa (IP) e inmunofluorescenciadirecta (IF).
Para el diagnóstico por AV se realizó un macerado con aproximadamente0.5 g de cada órgano (2 g en total) en 18 ml de MEM (medio esencial mínimo),conteniendo 0.2 ml de bicarbonato al 2%. Se filtró en una membrana de0.45 µm, la técnica se realizó según la OIE.18,19
Se utilizaron las líneas celulares MDBK y PK15 inoculándose cincobotellas de 5 ml por línea celular y por muestra; las botellas se observarondiariamente durante cinco días para detectar efecto citopático.Si no hubo efecto durante esos días se realizaron de tres a cinco pasespor muestra de feto; simultáneamente se realizó IPP en placa de96 pozos para evidenciar que el aislamiento viral fuera IBR.
Inmunofluorescencia
Cada laminilla se lavó con PBS, se decantó y secó, después se agregaron 25 µL de conjugado contra IBR, se incubó a 37ºC durante 30 minutos en cámara húmeda, luego se lavó con PBS y se secó para montarlos con glicerina amortiguada y observarlos al microscopio de epifluorescencia.
InmunoperoxidasaCada laminilla se lavó con solución de lavado SL (PBS y Tween), se decantó y se secó para agregar conjugado (suero de referencia), se incubó una hora a 37ºC en cámara húmeda en una estufa de CO2; posteriormente se decantó y lavó con SL durante tres veces, se secó y se le adicionó proteína G conjugada, se incubó de nuevo durante 30 minutos a 37ºC en cámara húmeda en estufa de CO2, y se lavó en tres tiempos con solución SL.
Se agregaron 50 µL de 3,9 aminoetilcarbazol como indicador diluido en solución de fosfato de sodio y ácido cítrico más el sustrato y se incubó 20 minutos a temperatura ambiente (el indicador se preparaba en el momento de usarlo); se lavó y se observó en microscopio óptico con objetivo seco débil, seco fuerte e inmersión
Para ambas pruebas se consideró una muestra positiva cuando al menos en una de las cuatro muestras de órgano de un solo feto dio una reacción positiva a IP y a IF directa.
Análisis del suero
A los sueros de las madres se les realizó la prueba de seroneutralización(SN) conforme a lo establecido por la OIE y la FAO.19,20 El suero hiperinmunese trabajó a dilución de 1:520.22 Para la comparación entrelas pruebas, el AV se utilizó como estándar diagnóstico(prueba con sensibilidad cercana al 100%).18,19
Análisis estadísticoSe agregaron 50 µL de 3,9 aminoetilcarbazol como indicador diluido en solución de fosfato de sodio y ácido cítrico más el sustrato y se incubó 20 minutos a temperatura ambiente (el indicador se preparaba en el momento de usarlo); se lavó y se observó en microscopio óptico con objetivo seco débil, seco fuerte e inmersión
Para ambas pruebas se consideró una muestra positiva cuando al menos en una de las cuatro muestras de órgano de un solo feto dio una reacción positiva a IP y a IF directa.
Análisis del suero
A los sueros de las madres se les realizó la prueba de seroneutralización(SN) conforme a lo establecido por la OIE y la FAO.19,20 El suero hiperinmunese trabajó a dilución de 1:520.22 Para la comparación entrelas pruebas, el AV se utilizó como estándar diagnóstico(prueba con sensibilidad cercana al 100%).18,19
Al comparar IP e IF directa con AV se obtuvieron las proporciones de verdaderos positivos, verdaderos negativos, falsos positivos, falsos negativos, la Se, la Es, el VP(+) y el VP(-) en cada prueba. Con estos resultados se compararon las pruebas de IP e IF y se calculó el índice de concordancia bruta (ICB) y la concordancia por índice de Kappa (IK) con SN.23,24 Para la realización del análisis estadístico se utilizó el programa EPIINFO 6.
ResultadosEn el periodo de estudio se obtuvieron 86 muestras de fetos abortados, de éstas sólo fue posible analizar 49 debido a la autolisis.
Aislamiento viral
De las 49 muestras de fetos analizadas, en 29 (59%) se aísló el virus de la IBR (Cuadro 1).
Inmunofluorescencia e inmunoperoxidasa
El 26.5% de las muestras fueron positivas por IF y 89.7% a IP (Cuadro1). Al analizar cada prueba por órgano, se encontró que para IFla frecuencia de positividad varió de 13% a 18% para bazo e hígado,respectivamente, sin encontrar diferencia significativa (p = 0.9205) (Cuadro2). Para IP por órgano se encontró variación de positividadde 42% a 74% en hígado y riñón, respectivamente. Dicha variaciónfue significativa (p = 0.012) (Cuadro 2).
Sensibilidad (Se), especificidad (Es) y concordancia entre aislamientoviral e inmunofluorescencia
La prueba de IF presentó Se de 24.1% y Es de 70%, Vp+ de 53.8% y Vp- de38.9%; la concordancia por IK entre ambas pruebas fue de -0.052, la cual no fuesignificativa (IK = -0.052, p = 0.6) (Cuadro 3). Por órgano, IF presentamuy baja Se ya que va de 10% a 20%, mientras que la Es va de 79 a 88% para bazoy pulmón, respectivamente; en todos los órganos la concordanciapor IK con el AV no fue significativa (Cuadro 4).
Sensibilidad, especificidad y concordancia entre aislamiento viral e inmunoperoxidasa
La prueba de IP presentó Se de 96.7% y Es de 20% un Vp(+) de 64.4% y unVp(-) de 80%. La concordancia por IK entre ambas pruebas fue 0.19, que no fuesignificativa (IK = 0.19, p = 0.002) (Cuadro 3). Por órgano IP presentavariaciones en Se, Es, VP(+) y VP(-), teniendo la mejor respuesta en hígadocon una concordancia significativa (IK = 0.3827, p = 0.0033) (Cuadro 4).
Seroneutralización
De los 49 fetos analizados sólo fue posible obtener muestras de suerode 38 de sus madres en el primer muestreo, 34 en el segundo y 26 en el tercero,ya que los ganaderos no permitieron la toma de más muestras. El valorpromedio de anticuerpos contra IBR de los animales que abortaron en generalfue de 1:32. Al comparar SN con AV se encontraron variaciones en su Se y Es,las cuales fueron determinadas por diferentes puntos de corte. Los resultadosmostraron concordancia significativa sólo al considerar como positivoslos sueros del primer muestreo con valores de 1:32 o mayor (IK = 0.27, p = 0.04),y aun en ese caso destaca que la Se fue de 68% y la Es de 61.5% (Cuadro 5).
DiscusiónDe las 49 muestras de fetos analizadas, en 29 (59%) se aísló el virus de la IBR (Cuadro 1).
Inmunofluorescencia e inmunoperoxidasa
El 26.5% de las muestras fueron positivas por IF y 89.7% a IP (Cuadro1). Al analizar cada prueba por órgano, se encontró que para IFla frecuencia de positividad varió de 13% a 18% para bazo e hígado,respectivamente, sin encontrar diferencia significativa (p = 0.9205) (Cuadro2). Para IP por órgano se encontró variación de positividadde 42% a 74% en hígado y riñón, respectivamente. Dicha variaciónfue significativa (p = 0.012) (Cuadro 2).
Sensibilidad (Se), especificidad (Es) y concordancia entre aislamientoviral e inmunofluorescencia
La prueba de IF presentó Se de 24.1% y Es de 70%, Vp+ de 53.8% y Vp- de38.9%; la concordancia por IK entre ambas pruebas fue de -0.052, la cual no fuesignificativa (IK = -0.052, p = 0.6) (Cuadro 3). Por órgano, IF presentamuy baja Se ya que va de 10% a 20%, mientras que la Es va de 79 a 88% para bazoy pulmón, respectivamente; en todos los órganos la concordanciapor IK con el AV no fue significativa (Cuadro 4).
Sensibilidad, especificidad y concordancia entre aislamiento viral e inmunoperoxidasa
La prueba de IP presentó Se de 96.7% y Es de 20% un Vp(+) de 64.4% y unVp(-) de 80%. La concordancia por IK entre ambas pruebas fue 0.19, que no fuesignificativa (IK = 0.19, p = 0.002) (Cuadro 3). Por órgano IP presentavariaciones en Se, Es, VP(+) y VP(-), teniendo la mejor respuesta en hígadocon una concordancia significativa (IK = 0.3827, p = 0.0033) (Cuadro 4).
Seroneutralización
De los 49 fetos analizados sólo fue posible obtener muestras de suerode 38 de sus madres en el primer muestreo, 34 en el segundo y 26 en el tercero,ya que los ganaderos no permitieron la toma de más muestras. El valorpromedio de anticuerpos contra IBR de los animales que abortaron en generalfue de 1:32. Al comparar SN con AV se encontraron variaciones en su Se y Es,las cuales fueron determinadas por diferentes puntos de corte. Los resultadosmostraron concordancia significativa sólo al considerar como positivoslos sueros del primer muestreo con valores de 1:32 o mayor (IK = 0.27, p = 0.04),y aun en ese caso destaca que la Se fue de 68% y la Es de 61.5% (Cuadro 5).
En relación con las características de la IP como prueba diagnóstica, se encontró que la Se fue mayor (96.7%) a la encontrada por Smith et al. y Delgado et al.,15,17 quienes determinaron una Se de 96% por avidina-biotina y de 83.3% por la técnica directa, respectivamente. Sin embargo, la Es encontrada (20%) fue menor a la notificada por Delgado et al.,15 que fue cercana a 100% . La alta cantidad de falsos positivos derivada de la baja especificidad, posiblemente se debió a una coloración inespecífica focal que proporciona la muestra y que da la morfología de los vasos sanguíneos y la presencia de glóbulos rojos en éste, como lo han mencionado Smith y Theodoris.12,25 Otra posible explicación es que el suero o la muestra, o ambos, estuviesen contaminados con otro tipo de proteínas, como las de origen bacteriano y también a la posible reacción cruzada con otros herpes virus.26 Otra causa en la variación de los resultados podría ser una baja concentración de anticuerpos en el suero que se emplea para revelar la presencia del antígeno, como lo menciona Kramps.3 Además, la coloración no puede ser visible si la concentración de antígeno en el tejido es mínima, impidiendo que el conjugado detecte su presencia, como lo señalan Delgado y Kelling.15,26
La IP realizada en placa para confirmar el AV favorece la posibilidad de encontrarel antígeno, ya que para elaborar esta técnica se realiza un maceradode todos los órganos (pool), mientras que la técnica directaen corte por congelación no garantiza que en la porción de tejidoevaluada se encuentre el antígeno en animales seropositivos. Posposil etal.27 han demostrado presencia del virus en hígado, riñón,pulmón y otros órganos de fetos abortados de animales seronegativosy en algunos seropositivos infectados experimentalmente. En casos severos deautolisis, las muestras no pudieron ser evaluadas por IP ni por IF, debido aque el tejido se desprendía al momento de lavarlo durante el proceso delas técnicas.
En los cortes de tejidos congelados, si bien no siempre se apreció laanatomía del órgano evaluado debido a la autolisis, esta condiciónno interfirió con la interpretación de la prueba de IP, ya quela coloración obtenida en los casos positivos fue muy evidente, por loque todos los tejidos pudieron ser evaluados, no así con IF en la cualante condiciones de autolisis se observó coloración inespecíficade color rojizo, dificultando en la interpretación de los resultados,lo cual coincide con lo que mencionan Theodoris et al25. yReed et al.28 Cabe señalar que en las muestras que no presentaronsevera autolisis la fluorescencia encontrada fue focal y poco brillante distribuidauniformemente en el núcleo y citoplasma, consistentemente en riñón,lo cual concuerda con lo encontrado por Reed et al.28
La Se y Es obtenidas por IF (24.1%, 70%) fueron menores a las encontradas porDelgado et al. y Smith et al.15,17 quienes obtuvieron Se de67% y 83.3%, respectivamente, no así la Es, ya que Delgado et al.15encontraron 100% bajo condiciones de laboratorio. La baja Se pudo ser debidaa la autolisis de las muestras, así como a las mismas razones descritaspara IP y al tratamiento que se le da a la muestra, el cual puede afectar elsitio antigénico, a la calidad de los anticuerpos en el suero para revelarla presencia del antígeno.26
La correlación entre el AV y la IF encontrada por Reed et al.28fue de 50%. Por su parte, Bratanich et al.14 menciona una concordanciade 83%, la cual fue mayor a la encontrada en el presente estudio de sólo42.9%.
En este estudio los órganos de elección para envío de muestrasal laboratorio fueron el hígado, riñón y pulmón,ello que concuerda con lo señalado por Smith et al.17
La variación en los valores de SN, que van de 1:2 hasta mayores de 1:128,en las vacas al momento del aborto, coinciden con lo señalado por S. VanDrunen et al.29 Un problema con la evaluación serológicafue tratar de diferenciar los sueros positivos, debido a que podían encontrarseanticuerpos inducidos por infección natural o por vacunación, sobretodo si se considera que los títulos pueden ser semejantes tanto en lavacunación como en la infección natural.30 Cabe señalarque en el CAIT al principio del muestreo algunos animales fueron inoculados convacuna atenuada termosensible, y durante el estudio en todas las vacas se utilizó vacunainactivada o modificada, incluso en algunos casos los animales fueron vacunadoscon los dos tipos de vacuna. Destaca el hecho de que cualquiera de las vacunasaplicadas genera una respuesta observable hasta por más de treinta meses.2,26,30,31
Si bien se ha mencionado que la vacunación puede provocar aborto, algunosautores indican que en hatos de reciente infección los animales presentanserología negativa, por lo que cabe destacar que en el CAIT hubo dos animalescon valores mayores a 1:128 en el momento del aborto y que presentaban signosrespiratorios sugestivos de IBR y no estaban vacunados, lo cual evidencia lacirculación del virus en el área estudiada.2,8,29,32
Los títulos altos de éstos y otros animales encontrados y que presentaronaborto, pudieron deberse a que se infectaron en el lugar de origen, ya que seha encontrado que el tiempo transcurrido entre la infección materna yla fetal es variable y puede fluctuar desde ocho días hasta varios meses.33
Por otra parte, no fue posible evaluar la concordancia de SN con las pruebasde IP e IF, ya que los resultados obtenidos pudieron deberse a la presencia delantígeno en el feto de madres inmunizadas con vacuna inactivada en untiempo no mayor a seis meses entre vacunación y el aborto, no estandode acuerdo con Posposil,27 quien indica que aplicar una vacuna de este tipo evitaque el virus llegue al feto tanto en animales seropositivos como seronegativos;sin olvidar los mecanismos de defensa del huésped y el agente, o posiblementeel virus circulante sea vacunal, por otra parte, se conoce que la interacciónentre IBR y DVB (Diarrea Viral Bovina) tiene efecto inmunosupresor para la activaciónde IBR en ganado infectado.34
Se concluye que la IP e IF directa no fueron métodos rápidos yconfiables para la detección del herpes virus bovino en tejidos fetales.Ambas pruebas tuvieron una Es limitada para detectar al virus; cabe señalarque tanto la IP como la IF resultaron métodos menos laboriosos y costososque el AV para la detección del herpes virus bovis. Otras variables quepueden afectar el resultado de las pruebas son el tiempo que transcurre desdela toma de la muestra hasta la realización de la prueba diagnóstica,la autolisis, la calidad del conjugado, el tiempo de vacunación y el momentodel aborto donde la excreción viral es mínima.
No se encontró relación entre los resultados de IP e IF respectode los de SN; la prueba de SN ha sido aceptada internacionalmente como la técnicade referencia; por lo tanto, es necesario definir el estado endémico del áreadonde se utilice.
Es necesario continuar con los estudios para aumentar la confiabilidad de laspruebas diagnósticas, como lo las técnicas de inmunoperoxidasaen placa y de avidina-biotina para tratar de disminuir los falsos positivos debidosal efecto de los glóbulos rojos presentes en los tejidos, incluso es necesarioevaluar el comportamiento de los anticuerpos en una población de animalesinfectados y animales vacunados durante todos los episodios de la enfermedad,fase de recuperación y reactivación del virus en diferentes zonaslecheras, para determinar la relación de los resultados con el comportamientode la enfermedad y determinar la mejor prueba para su diagnóstico.
AgradecimientosLa IP realizada en placa para confirmar el AV favorece la posibilidad de encontrarel antígeno, ya que para elaborar esta técnica se realiza un maceradode todos los órganos (pool), mientras que la técnica directaen corte por congelación no garantiza que en la porción de tejidoevaluada se encuentre el antígeno en animales seropositivos. Posposil etal.27 han demostrado presencia del virus en hígado, riñón,pulmón y otros órganos de fetos abortados de animales seronegativosy en algunos seropositivos infectados experimentalmente. En casos severos deautolisis, las muestras no pudieron ser evaluadas por IP ni por IF, debido aque el tejido se desprendía al momento de lavarlo durante el proceso delas técnicas.
En los cortes de tejidos congelados, si bien no siempre se apreció laanatomía del órgano evaluado debido a la autolisis, esta condiciónno interfirió con la interpretación de la prueba de IP, ya quela coloración obtenida en los casos positivos fue muy evidente, por loque todos los tejidos pudieron ser evaluados, no así con IF en la cualante condiciones de autolisis se observó coloración inespecíficade color rojizo, dificultando en la interpretación de los resultados,lo cual coincide con lo que mencionan Theodoris et al25. yReed et al.28 Cabe señalar que en las muestras que no presentaronsevera autolisis la fluorescencia encontrada fue focal y poco brillante distribuidauniformemente en el núcleo y citoplasma, consistentemente en riñón,lo cual concuerda con lo encontrado por Reed et al.28
La Se y Es obtenidas por IF (24.1%, 70%) fueron menores a las encontradas porDelgado et al. y Smith et al.15,17 quienes obtuvieron Se de67% y 83.3%, respectivamente, no así la Es, ya que Delgado et al.15encontraron 100% bajo condiciones de laboratorio. La baja Se pudo ser debidaa la autolisis de las muestras, así como a las mismas razones descritaspara IP y al tratamiento que se le da a la muestra, el cual puede afectar elsitio antigénico, a la calidad de los anticuerpos en el suero para revelarla presencia del antígeno.26
La correlación entre el AV y la IF encontrada por Reed et al.28fue de 50%. Por su parte, Bratanich et al.14 menciona una concordanciade 83%, la cual fue mayor a la encontrada en el presente estudio de sólo42.9%.
En este estudio los órganos de elección para envío de muestrasal laboratorio fueron el hígado, riñón y pulmón,ello que concuerda con lo señalado por Smith et al.17
La variación en los valores de SN, que van de 1:2 hasta mayores de 1:128,en las vacas al momento del aborto, coinciden con lo señalado por S. VanDrunen et al.29 Un problema con la evaluación serológicafue tratar de diferenciar los sueros positivos, debido a que podían encontrarseanticuerpos inducidos por infección natural o por vacunación, sobretodo si se considera que los títulos pueden ser semejantes tanto en lavacunación como en la infección natural.30 Cabe señalarque en el CAIT al principio del muestreo algunos animales fueron inoculados convacuna atenuada termosensible, y durante el estudio en todas las vacas se utilizó vacunainactivada o modificada, incluso en algunos casos los animales fueron vacunadoscon los dos tipos de vacuna. Destaca el hecho de que cualquiera de las vacunasaplicadas genera una respuesta observable hasta por más de treinta meses.2,26,30,31
Si bien se ha mencionado que la vacunación puede provocar aborto, algunosautores indican que en hatos de reciente infección los animales presentanserología negativa, por lo que cabe destacar que en el CAIT hubo dos animalescon valores mayores a 1:128 en el momento del aborto y que presentaban signosrespiratorios sugestivos de IBR y no estaban vacunados, lo cual evidencia lacirculación del virus en el área estudiada.2,8,29,32
Los títulos altos de éstos y otros animales encontrados y que presentaronaborto, pudieron deberse a que se infectaron en el lugar de origen, ya que seha encontrado que el tiempo transcurrido entre la infección materna yla fetal es variable y puede fluctuar desde ocho días hasta varios meses.33
Por otra parte, no fue posible evaluar la concordancia de SN con las pruebasde IP e IF, ya que los resultados obtenidos pudieron deberse a la presencia delantígeno en el feto de madres inmunizadas con vacuna inactivada en untiempo no mayor a seis meses entre vacunación y el aborto, no estandode acuerdo con Posposil,27 quien indica que aplicar una vacuna de este tipo evitaque el virus llegue al feto tanto en animales seropositivos como seronegativos;sin olvidar los mecanismos de defensa del huésped y el agente, o posiblementeel virus circulante sea vacunal, por otra parte, se conoce que la interacciónentre IBR y DVB (Diarrea Viral Bovina) tiene efecto inmunosupresor para la activaciónde IBR en ganado infectado.34
Se concluye que la IP e IF directa no fueron métodos rápidos yconfiables para la detección del herpes virus bovino en tejidos fetales.Ambas pruebas tuvieron una Es limitada para detectar al virus; cabe señalarque tanto la IP como la IF resultaron métodos menos laboriosos y costososque el AV para la detección del herpes virus bovis. Otras variables quepueden afectar el resultado de las pruebas son el tiempo que transcurre desdela toma de la muestra hasta la realización de la prueba diagnóstica,la autolisis, la calidad del conjugado, el tiempo de vacunación y el momentodel aborto donde la excreción viral es mínima.
No se encontró relación entre los resultados de IP e IF respectode los de SN; la prueba de SN ha sido aceptada internacionalmente como la técnicade referencia; por lo tanto, es necesario definir el estado endémico del áreadonde se utilice.
Es necesario continuar con los estudios para aumentar la confiabilidad de laspruebas diagnósticas, como lo las técnicas de inmunoperoxidasaen placa y de avidina-biotina para tratar de disminuir los falsos positivos debidosal efecto de los glóbulos rojos presentes en los tejidos, incluso es necesarioevaluar el comportamiento de los anticuerpos en una población de animalesinfectados y animales vacunados durante todos los episodios de la enfermedad,fase de recuperación y reactivación del virus en diferentes zonaslecheras, para determinar la relación de los resultados con el comportamientode la enfermedad y determinar la mejor prueba para su diagnóstico.
Se agradece el apoyo del Centro Nacional de Servicios de Diagnóstico en Salud Animal (CENASA), y del laboratorio de Virología y Patología durante la elaboración práctica; asimismo, se reconoce la participación del Complejo Agropecuario e Industrial de Tizayuca (CAIT), Tizayuca, Hidalgo: Laboratorio de Patología y Diagnóstico, Sanidad Animal, por la obtención de las muestras.
Cuadro 1EVALUACIÓN DE 49 MUESTRAS DE FETOS ABORTADOS, POR LAS PRUEBAS DE INMUNOFLUORESCENCIA, INMUNOPEROXIDASA Y AISLAMIENTO VIRAL PARA IBR, CAIT; MÉXICO, 1997
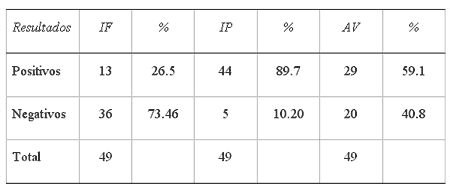
CAIT: Complejo Agropecuario e Industrial de Tizayuca, Tizayuca, Hidalgo; México.
Cuadro 2
DETECCIÓN DE ANTÍGENOS DE IBR MEDIANTE INMUNOFLUORESCENCIA E INMUNOPEROXIDASA, EN ÓRGANOS DE FETOS ABORTADOS. CAIT; MÉXICO, 1997
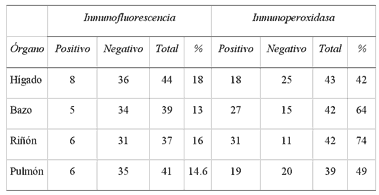
CAIT: Complejo Agropecuario e Industrial de Tizayuca, Tizayuca, Hidalgo; México.
Cuadro 3
SENSIBILIDAD, ESPECIFICIDAD Y VALOR PREDICTIVO DE LAS PRUEBAS DE INMUNOFLUORESCENCIA E INMUNOPEROXIDASA Y SU CONCORDANCIA CON LA PRUEBA DE AISLAMIENTO VIRAL, CAIT; MÉXICO,1997
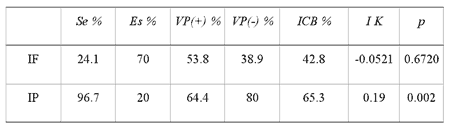
CAIT: Complejo Agropecuario e Industrial de Tizayuca, Tizayuca, Hidalgo; México.
Se = Sensibilidad
Es = Especificidad
Vp(+) = Valor predictivo positivo
Vp(-) = Valor predictivo negativo
ICB = Índice de concordancia bruta.
IK = Índice de Kappa
p = Intervalo de confianza
Cuadro 4
SENSIBILIDAD, ESPECIFICIDAD Y VALOR PREDICTIVO DE LAS PRUEBAS DE INMUNOFLUORESCENCIA E INMUNOPEROXIDASA Y SU CONCORDANCIA CON AISLAMIENTO VIRAL POR ÓRGANO, CAIT, TIZAYUCA- HIDALGO; MÉXICO, 1997
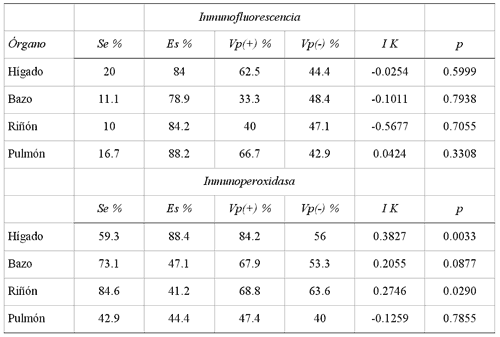
CAIT = Complejo Agropecuario e Industrial de Tizayuca, Tizayuca, Hidalgo; México.
Se = Sensibilidad
Es = Especificidad
Vp (+) = Valor predictivo positivo
Vp(-) = Valor predictivo negativo
ICB = Índice de concordancia bruta.
IK = Índice de Kappa
p = Intervalo de confianza
Cuadro 5
RESULTADOS DE SENSIBILIDAD, ESPECIFICIDAD Y VALOR PREDICTIVO POSITIVO Y NEGATIVO DE SERONEUTRALIZACIÓN Y SU CONCORDANCIA CON AISLAMIENTO VIRAL CAIT; MÉXICO,1997
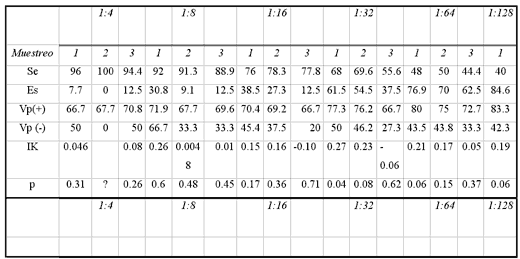
CAIT = Complejo Agropecuario e Industrial de Tizayuca, Tizayuca, Hidalgo; México.
Se = Sensibilidad
Es = Especificidad
Vp(+) = Valor predictivo positivo
Vp (-) = Valor predictivo negativo
IK = Índice de Kappa
p = Intervalo de confianza
COMPARISON BETWEEN THREE DIAGNOSTIC TESTS TO DETECT ABORTION CAUSED BY INFECTIOUS BOVINE RHINOTRACHEITIS IN DAIRY HERDS

Alfa Bracho Cárdenas*,** Carlos J. Jaramillo Arango** José Juan Martínez Maya**
Juan Antonio Montaño Hirose*** Arturo Olguín y Bernal**
* Este trabajo forma parte de la tesis de maestría del primer autor.
** Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónomade México, 04510, México, D. F.
*** Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estadode Hidalgo, 43600, Tulancingo, Hidalgo, México.
Juan Antonio Montaño Hirose*** Arturo Olguín y Bernal**
* Este trabajo forma parte de la tesis de maestría del primer autor.
** Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónomade México, 04510, México, D. F.
*** Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estadode Hidalgo, 43600, Tulancingo, Hidalgo, México.
Referencias
- Barr BC, BonDurant RH. Viral Diseases of the fetus. In: Youngquist RS, editor. Bovine theriogenology. Philadelphia. W:B. Sauders Company, 2000:373-381.
- Van der Poel WH, Kramps JQ, Brand A, Van Oirschot JT. Persistence of bovine herpesvirus-1-specific antibodies in cattle after intranasal vaccination with a live virus vaccine.Vet Rec 1995;137: 347-348.
- Kramps JA, Perrin B. A European inter-laboratoty trial to evaluate the reability of serological of bovine herpesvirus 1 infections. Vet Microbiol 1996; 53:156-161.
- Organización Panamericana de la Salud-Organización Mundial de la Salud. Programa de adiestramiento en salud animal para América Latina, Cuarentena Animal. México (DF): OPS, 1986.
- Aguilar AS. El virus de la rinotraqueitis infecciosa bovina( Bovid herpesvirus1): propiedades y vacunación. Cienc Vet 1987; 4:161-202.
- Barajas J, Riemann H, Franti C. Aplication of enzyme-linked immunosorbent assay for epidemiological studies of diseases of livestock in the tropics of Mexico. Rev Sci Tech Off Int Epiz 1993; 12: 717-732.
- Howard J. Current Veterinary Theraphy 3: Food Animal Practice. Philadelphia: Saunders,1993.
- Pastoret PP, Thiry E, Brochier B, Derboven G. Bovid herpes virus infection of cattle: phathogenesis, latency, consecuences of latency. Ann Rech Vet 1992;13: 221-235.
- Wohlgemuth K, Domínguez J, López L. El complejo respiratorio bovino: etiología viral. Memorias del XIV Congress on Veterinary Sciences. PANVET . 1994 octubre 9-15; Acapulco(Guerrero) México (DF): Asociación Panamericana de Ciencias Veterinarias, 1994: 430-432.
- Oficina Internacional de Epizootias. Manual of Standards for Diagnostic Tests and Vaccines. Organismo Internacional de Epizootias 1995; 322-328.
- Aguilar S. Recomendaciones para la prevención contra la rinotraqueitis infecciosa bovina (Bovis herpesvirus 1, BHV-1). Memorias del V curso Internacional de reproducción Bovina; 1993 mayo 11-13; Distrito Federal (México) México (DF): Academia de la investigación en biología de la reproducción. 1993: 253:260.
- Smith DR. Veterinary clinical epidemiology: A problem oriented approach. Buenos Aires- Argentina: University of Illinois E.U.A, 1990.
- Brock K, Potgieter N. Rapid fluorescence detection of in situ hybridization with biotinylated bovine herpesvirus-1 DNA probes. J Vet Diagn Invest 1989; 1:34-38.
- Bratanich A, Sardi S, Smitsaar E, Estevez M, Schudel A. Comparison of three serological techniques for the diagnosis of bovine herpesvirus type 1: serumneutralization, enzyme-linked immunosorbent assay and indirect immunofluorescence. Rev Argent. Microbiol.1990; 22: 192-198.
- Delgado I, Barrera M, Tuero C, Rodríguez N. Comparación de tres métodos de detección de antígeno para el diagnóstico de herpes bovino tipo 1. Salud Animal 1992; 14: 143-148.
- Babiuk LA, Van Drunen S, Tikoo SK. Inmunology of bovine herpesvirus 1 infection. Vet Microbiol 1996; 53: 31-42.
- Smith GH, Collins KJ, Carman J. Use of immunoperoxidase test for the detection of bovine herpesvirus-1 in aborted fetal tissue. J Vet Diagn Invest 1989;1:39-44.
- Gimeno E, Belak K, Massone A, Echeverria M, Ibargoryen G. Técnicas inmunohistoquímicas en patología Veterinaria: Aspectos Teóricos y Prácticos. Vet Argent 1988; 5: 332-338.
- Oficina Internacional de Epizootias. Manual of recommended diagnostic techniques and requirements for biological products for list A an B diseases. 1990; Vol.II.
- Organización de las Naciones Unidas para la Agricultura y la Alimentación. Oficina regional para América Latina y el Caribe. Red de Cooperación Técnica Entre: Laboratorios de investigación y diagnóstico veterinario. Manual de técnicas para diagnóstico virológico. FAO Centro de investigaciones de ciencias veterinarias INTA, Argentina., 1987.
- Aluja SA. Necropsias en animales domésticos. México DF: Continental, 1985.
- Perrin B, Calvo T, Cordioli P, Edwars S, Eloit M, Guerin B, et al. Selection of european union standard reference sera for use in the serological diagnosis of infectious bovine rhinotracheitis. Rev Sci Tech Off Int Epiz 1994;13:947-960.
- Galen R S. Use of predictive value theory in clinical immunology. Manual of clinical laboratory inmunology. 3a ed. Washington DC : A Soc Micro 1986.
- Morton A, Hebel C. Bioestadística y Epidemiología. 3a ed. México DF: Interamericana, Mc Graw-Hill, 1993.
- Theodoris A. Studies on bovine herpesviruses. Part 1. Isolation and characterization of viruses isolated from the genital tract of cattle. Onderstepoort J Vet Res 1985; 52:239-254.
- Kelling CL, Schipper IA, Haugse CN, Antibody response in calves administration of attenuated infectious bovine rinothracheitis (IBR) vaccine. Can J Comp Med 1973; 37: 309-312.
- Posposil Z, Krejci J, Machatkova M. Development of a disease control programme based on the use of an inactivated vaccine againts infectious bovine rhinotracheitis. Vet Microbiol 1996; 53: 199-206.
- Reed DE, Bicknell EJ, Larson CA, Knudtson WU, Kikbride CA. Infectious bovine rhinotracheitis virus-induced abortion: rapid diagnosis by fluorescent antibody technique. J Vet Res 1971, 32: 1423-1426.
- Van Drunen S, Van den Hurk, Tikoo SK, Babiuk LA, Donkersgoed JV. Protective immunity in cattle following vaccination with conventional and marker bovine herpesvirus-1 (BHV1)vaccines. Vaccine 1997; 15: 36-44.
- Kaashhoek JM, Rijsewijk JT. Persistence of antibodies against bovine herpesvirus 1 and virus reactivation two to three years after infection. Vet Microbiol 1996;53: 103-110.
- Baker JC, Steven RR, Walter DR. Transmission of a vaccinal strain of infectious bovine rhinotracheitis virus from intranasally vaccinated steers commingled with nonvaccinated steers. Am J Vet Res 1989; 50: 814-816.
- Mars MH, Bruschke CJ, Van Oirschot JT. Airborne transmission of BHV1, BRSV, and BVDV among cattle is possible under experimental conditions. Vet Microbiol 1999; 66: 197-207.
- Moraga BL, Berrios PE, Zurita LA, Celedón M, Guajardo U, Ortiga A. Rinotraqueitis Infecciosa Bovina III. Infeccción experimental en vaquillas gestantes. Avances en Cienc Vet1990;5:129-135.
- Biuk RN, Cvetnic S, Madic J, Rudan D. Prevalence of antibodies to IBR and BVD viruses in diary cows with reproductive disorders. Theriogenology 1998; 875-881.
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicaciónAsociación Ecuatoriana de Buiatria
25 de abril de 2011
Exelente artículo y muy buena investigación.
Felicitaciones al autor.
Una pregunta:
Hay evidencias que en algunas partes existen problemas por BHV-1.2 con sintomatología nerviosa, consideras oportuno una vacunación con vacunas que contengan este subtipo aunque no esté confirmada la presencia del subtipo en una zona o país???
Hay vacunas que tienen estos subtipos.
Digo ante posibles introducciones del subtipo y para pervenir infecciones que podrían desencadenar en epidemias.
Claro, con los problemas que conllevaría a la parte diagnóstica.
Saludos
Zoetis
22 de agosto de 2006
Eduardo Puente Casillas
Veterinario
Costa Rica
Muchas felicidades a Alfa Bracho un muy buen trabajo, solo quiero preguntarte si se analizaron otras posibles causas, se que no era el objetivo del trabajo. Espero te acuerdes de mi en Tizayuca, yo trabaje durante 6 anos en la cuenca, ahora radico en Costa Rica y trabajo para Pfizer.
Un gran abrazo para Arturo Olguin de parte de "pons"
28 de noviembre de 2012
Muy buena investigación . soy recién egresado y mi trabajo de investigación es sobre es sobre esta enfermedad y la prueba diagnostica que estoy utilizando es el PCR ..saludos.
18 de julio de 2011
Dr. Patricio Sandoval, es raro que algun laboratorio te diga exactamente que antígeno contenga su vacuna, soy de la idea de no vacunar hasta que tengan casos clinicos, aunado a esto el diagnóstico y el diagnóstico diferencial, desde mi punto de vista y el comportamiento de esta enfermedad en el pais donde radico no es necesario .
18 de julio de 2011
Hola a todos, sobre todo al Dr. Eduardo Puente claro que me acuerdo de ti, con ustedes en tizayuca empeze a trabajar con esto y hasta la fecha es lo que hago dando asesorias; con respecto a tu pregunta no se analizó otras causas debido a tiempo y costo pero extra oficialmente te puedo comentar que algunas de las muestras en donde me dierón resultados positivos muy evidentes, tambien estas fuerón positivas a neospora y algunas a DVB, corraborando la presencia de otros antígenos en el momento del aborto.
Ahora con la experiencia que tengo en campo he encontrado relación cuando existe la presencia de brucella y diarrea viral y sobre todo diarrea viral con leptospirosis. Espero te sirvan los comentarios y estoy a sus ordenes.
23 de abril de 2011
hola soy la dra. Bracho, no se deben sacrificar a los animales positivos ya que con el tiempo la vacunación logra controlar la enfermedad, sin embargo no hay que olvidar que quedan portadores de por vida. Debes de tomar órganos del feto y/o sueros pareados de la madre y analizarlos para verificar que efectivamente sean por esta enfermedad.
6 de septiembre de 2006
Es muy interesante lo he bajado y lo estoy analizando con mas detenimiento grasias y felicitaciones estamos aprendiendo juntos cada dia.
31 de agosto de 2006
Estimados amigos he leido este articulo sobre IBR y me ha interesado mucho dado que en nuestro pais se han registrado brotes recientes de tal enfermedad por mi parte los felicito porque pienso que estan contribuyendo mucho a la formacion profesional de muchos estudiantes que al igual que yo desean conocer mucho mas acerca de estos temas de tan interes profesional
30 de agosto de 2006
Estimado Amigo, esta todo dicho, no queda mas que felicitarlo por compartir sus estudios y logros con todos nosotros e invitarlos a que sigan investigando e informándonos para enriquecer nuestros talentos.
Atte.









.jpg&w=3840&q=75)