Seroprevalencia y factores de riesgo de neosporosis bovina en el valle del Mantaro-Región Junín, Perú
Se determinó la seroprevalencia de neosporosis bovina en hatos lecheros de las cuatro provincias que conforman el Valle del Mantaro, Región Junín, Perú, y los principales factores de riesgo involucrados, mediante la prueba ELISA. Se tomaron muestras de sangre de 425 animales en 37 hatos y se aplicó en forma paralela una encuesta epizootiológica. La prevalencia muestral general para neosporosis bovina fue 15.3%, la prevalencia/hato de 12.8% y la prevalencia predial de 56.8%, sin diferencias significativas entre provincias. Se identificaron como factores de riesgo para la presentación de neosporosis a la presencia masiva y constante de ratas (OR: 18.417), el inadecuado manejo sanitario (OR: 7.5) y el inadecuado manejo de personal (OR: 12.75). Se encontró asociación entre altas prevalencias de neosporosis con la presencia de vacas repetidoras en el hato, con los casos de abortos y nacimientos anómalos, y con el uso de agua de acequias para bebida.
Palabras clave: Valle del Mantaro; neosporosis bovina; prevalencia; factores de riesgo
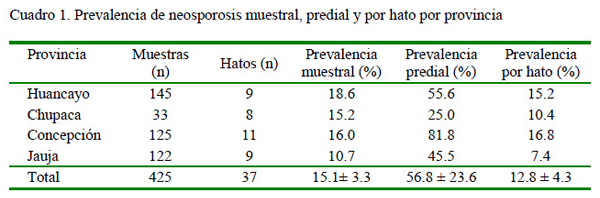

- La prevalencia muestral general para neosporosis bovina fue 15.3%, la prevalencia/hato de 12.8% y la prevalencia predial de 56.8%.
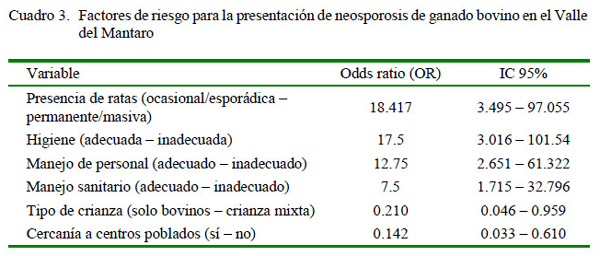
- Los factores de riesgo identificados para la presentación de neosporosis fueron la presencia masiva y constante de ratas (OR: 18.417), el inadecuado manejo sanitario (OR: 7.5) y de manejo de personal (OR: 12.75).
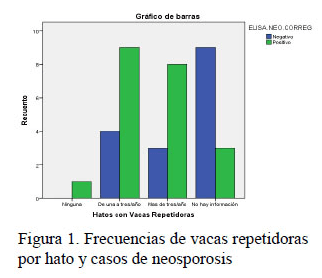
- La asociación entre altas prevalencias de neosporosis con la presencia de vacas repetidoras, con casos de abortos y nacimientos anómalos, y con el uso de agua de acequias para bebida no fue significativa.
1. Alarico ZDA. 2012. Determinación de seroprevalencia de anticuerpos a Neospora caninum en bovinos de leche del distrito de Locumba-Tacna. Tesis de Médico Veterinario Zootecnista. Tacna: Univ. Nacional Jorge Basadre Grohmann. 134 p.
2. Anderson ML, Barr BC, Conrad PA. 1994. Protozoal causes of reproductive failure in domestic ruminants. Vet Clin N Am-Food A 10: 439-461. doi: 10.1016/ S0749-0720(15)30531-4
3. Andresen H. 1997. Neosporosis: enfermedad emergente en los animales domésticos. MV Rev Cs Vet 13: 19-21.
4. Arauco VF. 2015. Epidemiología y caracterización de los factores de riesgo de diarrea viral bovina y neosporosis en bovinos del Valle del Mantaro – región Junín. Tesis Doctoral. Lima, Perú: Univ. Nacional Mayor de San Marcos. 179 p.
5. Atoccsa J, Chávez A, Casas E, Falcón N. 2005. Seroprevalencia de Neospora caninum en bovinos lecheros al pastoreo en la provincia de Melgar, Puno. Rev Inv Vet Perú 16: 71-75. doi: 10.15381/rivep.v16i1.1541
6. Bañales P, Fernandez L, Repiso MV, Gil A, Dargatz DA, Osawa T. 2006. A nationwide survey on seroprevalence of Neospora caninum infection in beef cattle in Uruguay. Vet Parasitol 139: 15- 20. doi: 10.1016/j.vetpar.2006.03.004
7. [CENAGRO-JUNIN] Censo Nacional Agropecuario, Junín. 2012. Resultados definitivos del IV Censo Nacional Agropecuario. [Internet]. Disponible en: http://censos.inei.gob.pe/cenagro/tabulados/
8. Daniel WW. 1996. Bioestadística: base para el análisis de las ciencias de la salud. 5° ed. México:. Limusa. 878 p.
9. Dubey JP. 1999. Neosporosis in cattle: biology and economic impact. J Am Vet Med Assoc 214: 1160-1163.
10. Dubey JP. 2003. Review of Neospora caninum and neosporosis. Kor J Parasiol 41: 1-16. doi: 10.3347/kjp.2003.41.1.1
11. Dubey JP1, Zarnke R, Thomas NJ, Wong SK, Van Bonn W, Briggs M, Davis JW, et al. 2003. Toxoplasma gondii, Neospora caninum, Sarcocystis neurona, and Sarcocystis canislike infections in marine mammals. Vet Parasitol 116: 275-296. doi: 10.1016/S0304-4017(03)00263-2
12. Dubey JP, Schares G, Ortega-Mora LM. 2007. Epidemiology and control of neosporosis and Neospora caninum. Clin Microbiol Rev 20: 323-367. doi: 10.1128/CMR.00031-06
13. Escalona J, García F, Mosquera O, Vargas F, Corro A. 2010. Factores de riesgo asociados a la prevalencia de neosporosis bovina en el municipio Bolívar del estado Yaracuy, Venezuela. Zootecnia Trop 28: 201-211.
14. Fort M. 2011. Neospora caninum: Estudio seroepidemiológico en bovinos de la provincia de La Pampa. Pub. Téc. INTA 52. [Internet]. Disponible en: https://inta.gob.ar/documentos/neosporacaninum-estudio-seroepidemiologico-enbovinos-de-la-provincia-de-la-pampa
15. Fredes MF. 2000. La neosporosis una parasitosis emergente. TecnoVet 6(3). [Internet]. Disponible en: https://revistas.uchile.cl/index.php/RT/issue/view/569
16. Frössling J, Uggla A, Björkman C. 2005. Prevalence and transmission of Neospora caninum within infected Swedish dairy herds. Vet Parasitol 128: 209-218. doi: 10.1016/j.vetpar.2004.-12.006
17. Granados S, Rivera H, Casas E, Suárez F, Carana C, Chávez A. 2014. Frecuencia de Neospora caninum en bovinos lecheros de cuatro distritos del Valle del Mantaro, Junín. Rev Inv Vet Perú 25: 58-64. doi: 10.15381/ rivep.v25i1.8468
18. Justo RV, Manfio JB, Galhardo JA, Garcia JL, Campos AK. 2013. Seroepidemiological inquiry on bovine neosporosis in northern Mato Grosso state, Brazil. Semin-Cienc Agrar 34(Suppl 2): 3897-3902. doi: 10.5433/ 1679-0359.2013v34n6Supl2p3897
19. Mamani J. 2007. Seroprevalencia de Neospora caninum en bovinos lecheros en Moquegua, distrito de Moquegua, provincia Mariscal Nieto y departamento de Moquegua-2007. Tesis de Médico Veterinario Zootecnista. Arequipa, Perú: Univ. Católica Santa María. 85 p.
20. Meléndez R, Valdivia A, Rangel E, Díaz E, Segura J, Guerrero A. 2010. Factores de riesgo asociados a la presencia de aborto y desempeño reproductivo en ganado lechero de Aguascalientes, México. Rev Mec Cienc Pecuarias 1: 391-401.
21. Ogawa L, Freire RL, Vidotto O, Gondim LFP, Navarro IT. 2005. Occurrence of antibodies to Neospora caninum and Toxoplasma gondii in dairy cattle from the northern region of the Paraná State, Brazil. Arq Bras Med Vet Zoo 57: 312-316. doi: 10.1590/S0102-09352005-000300006
22. Ortega-Mora L, Fernández-García A, Gómez M. 2006. Diagnosis of bovine neosporosis: recent advances and perspectives. Acta Parasitol 51: 1-14. doi: 10.2478/s11686-006-0001-0
23. Ould-Amrouche A, Klein F, Osdoit C, Mohammed HO, Touratier A, Sanaa M, Mialot JP. 1999. Estimation of Neospora caninum seroprevalence in dairy cattle from Normandy, France. Vet Res 30: 531-538.
24. Oviedo ST, Betancur HC, Mestra PA, Gonzáles TM, Reza GL, Calonge GK. 2007. Estudio serológico sobre neosporosis en bovinos con problemas reproductivos en Montería, Córdoba, Colombia. Rev MVZ Córdoba 12: 929-933. doi: 10.21897/rmvz.437
25. Paré J, Thurmond MC, Hietala SK. 1996. Congenital Neospora caninum infection in dairy cattle and associated calfhood mortality. Can J Vet Res 60: 133-139.
26. Pérez SP. 1993. Validación de cuestionario para la medición de la satisfacción de los clientes de la DCI. Gestión de Calidad DCI del CNCI, Cienfuegos. Cuba. [Internet]. Disponible en: http://www.monografias.com/trabajos93/validacion-cuestionario-medicion-satisfaccion-clientes-dci/validacion-cuestionario-medicion-satisfaccion-clientes-dci.shtml
27. Puray CN, Chávez A, Casas E, Falcón N, Casas G. 2006. Prevalencia de Neospora caninum en bovinos en empresa ganadera de la sierra central del Perú. Rev Inv Vet Perú 17: 189-194. doi: 10.15381/rivep.v17i2.1542
28. Rivera GH. 2001. Causas frecuentes de aborto bovino. Rev Inv Vet Perú 12: 117-122.
29. Rivera GH, Nelson D, Tabacchi L. 2000. Neospora caninum y otros agentes en fetos abortados de bovinos lecheros del valle de Lima. Rev Inv Vet Perú 11: 1-7. doi: 10.15381/rivep.v11i1.6766
30. Rojas CM. 2009. Neosporosis: parasitosis emergente en la ganadería peruana. [Internet]. Disponible en: http://mrojas.perulactea.com/2009/02/23/neosporosis-parasitosis-emergente-enla-ganaderia-peruana/
31. Romero JJ, Frankena K. 2003. The effect of the dam-calf relationship on serostatus to Neospora caninum on 20 Costa Rican dairy farms. Vet Parasitol 114: 159-171. doi: 10.1016/S0304- 4017(03)00135-3
32. Schares G, Peters M, Wurm R, Bärwald A, Conraths FJ. 1998. The efficiency of vertical transmission Neospora caninum in dairy cattle analysed by serological techniques. Vet Parasitol 80: 87-98. doi: 10.1016/S0304- 4017(98)00195-2
33. [SENASA] Servicio de Sanidad Agraria. 2010. Caracterización de la diarrea viral bovina, neosporosis bovina y rinotraqueitis infecciosa bovina en el Perú. [Internet]. Disponible en: https://www.senasa.gob.pe/senasa/descargasarchivos/jer/BOVINOS/Caracterizacion%-20DVB%20NB%-20y%20RIB.pdf
34. Sierra RC, Medina-Esparza L, Ramos M, García-Vázquez Z, Cruz-Vázquez C. 2011. Factores de riesgo asociados la seroprevalencia de anticuerpos a Neospora caninum en ganado lechero de Aguascalientes, México. Rev Mex Cienc Pecu 2: 15-24.
35. Stenlund S, Kindahl H, Uggla A, Björkman C. 2003. A long-term study of Neospora caninum infection in a Swedish dairy herd. Acta Vet Scand 44: 63-71. doi: 10.1186/1751-0147-44-63
36. Uribe F, Zuluaga AF, Valencia L, Murgueitio E, Ochoa L. 2011. Buenas prácticas ganaderas. Manual 3. Colombia: CIPAV. 82 p.
37. Wouda W, Moen AR, Schukken YH. 1998. Abortion risk in progeny of cows after a Neospora caninum epidemic. Theriogenology 49: 1311-1316. doi: 10.1016/S0093-691X(98)00078-8




