INTRODUCCIÓN
El crecimiento del folículo antral bovino es un proceso controlado de forma endocrina por gonadotropinas, localmente por factores de crecimiento que actúan de manera autocrina y paracrina y además de influencias ambientales como los cambios en la nutrición tienen efectos en la actividad ovárica (Webb et al, 2004).
Cada onda folicular incluye folículos de ambos ovarios y los fenómenos de dominancia folicular afectan tanto al ovario que porta el folículo dominante como al contralateral, lo que permite concluir que los canales de inhibición del desarrollo folicular de los folículos subordinados son más endocrinos que locales. Los factores autocrinos y paracrinos de desarrollo intrafolicular son importantes para el desarrollo, crecimiento y salud folicular individuales, pero parece que no afectan el desarrollo de sus folículos vecinos (Adams et al, 2008).
El objetivo de esta revisión es ilustrar el estado actual de conocimiento sobre los factores endocrinos, paracrinos y autocrinos que regulan las diferentes fases de desarrollo y atresia folicular bovina.
Desarrollo folicular preantral
El antro folicular es aquella cavidad formada por el acúmulo de fluido rico en hormonas esteroideas, especialmente estrógenos, el cual es formado en el ovario bovino cuando el folículo tiene entre 250 y 500 micras de diámetro. Los estadios previos a la formación del antro son denominados preantrales. Los folículos preantrales se originan en la hembra desde la vida embrionaria con el surgimiento de las células germinales primordiales en el saco vitelino, que migran y una vez se alojan en la cresta gonadal originan a las oogonias, las cuales son rodeadas de un grupo de células aplanadas llamadas pregranulosas denominándose esta estructura folículo primordial (Palma, 2008).
El proceso de selección de oogonias a folículos primordiales es muy activo, y se ha calculado que en el bovino de 2.700.000 oogonias iniciales durante la vida fetal, al momento del nacimiento quedan unos 135.000 folículos primordiales. Posterior al nacimiento, las células pregranulosas sufren un proceso de diferenciación, cambiando su apariencia aplanada por una capa de células cúbicas y aquí se denominan folículos primarios. Conforme las células granulosas van proliferando y formando varias capas alrededor del oocito (entre 2 y 6 capas), originan los folículos secundarios. En la última fase de desarrollo, el folículo inicia la formación del antro y crece en diámetro a gran velocidad denominando este estado folículo terciario o antral. Finalmente, el folículo antral de mayor desarrollo destinado a la ovulación es denominado folículo de Graaf (Palma, 2008).
Desarrollo de folículos antrales pequeños
El folículo pequeño con reciente formación de su antro crece lentamente (tarda 27 días en pasar de 0.13 a 0.67 mm); a medida que aumenta su diámetro, se acelera la velocidad de crecimiento (6.8 días para pasar de 0.68 a 3.67 mm). Se estima que se requieren 2 ciclos estrales para que un folículo pase de preantral a antral y que este cambio no se relaciona con cambios en la concentración de gonadotropinas ni con la emergencia de ondas foliculares (Adams et al, 2008).
Estudios recientes reportan que la Hormona Folículo Estimulante (FSH) se une a sus receptores en las células granulosas de los folículos primarios, pero parece que esta unión es incapaz de activar el sistema de segundos mensajeros de la adenil ciclasa y por lo tanto no induce señalización celular para producción de proteínas. Solamente cuando alcanzan de 1 a 3 mm de diámetro los folículos responden a FSH. Recientes estudios sobre dominancia folicular plantean que el futuro folículo dominante es el primero en alcanzar 1 mm de diámetro, emerge 6 a 12 horas antes del primer folículo subordinado y su tamaño es mayor (Adams et al, 2008).
Se sugiere que la formación del antro folicular es debida a que las células granulosas producen hialurona y versican (un proteoglicanos tipo condroitin - sulfato) que generan un gradiente osmótico que atrae fluidos procedentes de los capilares de la teca. El inhibidor de la inter-alfa tripsina también se encuentra en este fluido; éste puede ligarse al versican o a la hialurona, resultando en la retención de éstas moléculas dentro del antro folicular. Las acuaporinas (moléculas que facilitan el transporte de agua en la célula) también están presentes en las células granulosas, por lo que también pueden estar implicadas en el transporte de agua al interior del folículo (Rodgers e Irving-Rodgers, 2010).
Fases de desarrollo folicular
El desarrollo de los folículos antrales bovinos y su posterior selección y dominancia dependen de la sensibilidad de éstos a las gonadotropinas. El desarrollo folicular se puede delimitar en 3 períodos: reclutamiento, selección y dominancia (Senger, 2005). Los mecanismos de expresión génica son variables a lo largo del tiempo, por lo que en las células de la granulosa, la teca y el oocito se incrementa la expresión específica de algunos genes y sus productos. Estas relaciones son las que se detallarán a continuación.
Reclutamiento
Es definido como la iniciación del crecimiento de una cohorte de folículos dependientes de gonadotropinas (principalmente FSH) (Ptaszynska, 2008). Se caracteriza por el crecimiento simultáneo de 8 a 41 folículos hasta 4 mm de diámetro en los 2 ovarios. La FSH se une a sus receptores en la granulosa induciendo la transcripción para la producción de la aromatasa P450, la cual media la conversión a estrógenos de la testosterona proveniente de las células de la teca. El inicio de actividad de la aromatasa en la célula granulosa es un indicador de madurez del folículo en la fase de reclutamiento (Webb et al, 1998; Adams, 1999; Driancourt, 2001; Palma, 2008).
La FSH induce cascadas de señalización que pueden ser mediadas por Proteín Kinasa A (PKA), Proteín Kinasa C (PKC), Kinasas Reguladoras Extracelulares (ERK), Proteín Kinasas Activadoras de Mitógeno de la p38 (MAPK) y Kinasas del 3 Fosfatidil Inositol (PI3K). Junto con la Hormona Luteinizante (LH), la FSH ligada a sus receptores activan cascadas de señalización que inducen la producción de AMPc y PKA, que promueven crecimiento y proliferación celular. Se ha encontrado que la supervivencia de las células granulosas es mediada parcialmente por cascadas de señalización lideradas por PKA, PKB, PKC y MAPK (Forde et al, 2008). Para la competencia oocitaria solo se han descrito 2 activadores de cascadas de señalización: la PKA y la PKC (Sirard et al, 2007). Aún se desconocen muchos de los productos de transcripción que activan estas kinasas.
Otro efecto de la FSH sobre las células de la granulosa es el estímulo a la expresión de ARNm que codifica la síntesis de la proteína conexina Cx43, la cual hace parte de puentes celulares o uniones gap localizadas entre la granulosa y el oocito, o entre la granulosa y la teca. Estos puentes facilitan el intercambio de iones, impulsos eléctricos y moléculas menores de 1 kiloDalton entre estos grupos celulares (Palma, 2008).
Figura 1. Señalización celular en la fase de reclutamiento folicular
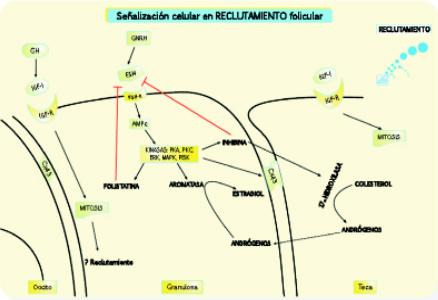
El folículo antral posee varias capas de células de la granulosa, pero en la gráfica sólo se muestra una capa con fines didácticos y facilitar su comprensión. En la imagen se plantean las diferentes cascadas de señalización existentes entre el oocito (a la izquierda), la granulosa (al medio) y la teca (a la derecha), Las flechas negras representan cascadas de señalización activas, mientras que las barras rojas representan interacciones de bloqueo de las mismas. En esta figura se representan las interacciones para la fase de reclutamiento folicular. En esta fase de desarrollo el IGF-I es un estimulador de la mitosis tanto de las células de la granulosa como de la teca; por otra parte la FSH estimula en la granulosa la activación de quinasas que inducen la producción de aromatasa, folistatina e inhibina y proteína formadora de puentes celulares Cx43, que facilita el intercambio paracrino de sustancias de bajo peso molecular.
El reclutamiento folicular se encuentra influenciado positivamente por el Factor de Crecimiento Insulinoide tipo I (IGF-I) y negativamente por la folistatina. El efecto de la IGF-I ha sido demostrado mediante la administración exógena de Hormona de Crecimiento (GH) que indujo el incremento de las concentraciones de IGF-I, lo que resultó en un aumento en el número de folículos reclutados en la cohorte. La aplicación de anticuerpos contra folistatina en vacas resultó en un incremento en el número de folículos de la cohorte, lo que demuestra el efecto antagónico de la folistatina en la producción de FSH, y consecuentemente en el reclutamiento folicular (Adams et al, 2008). La figura 1. Ilustra las cascadas de señalización en la fase de reclutamiento folicular:
Selección
En una segunda fase, el número de folículos en crecimiento disminuye por atresia de folículos subordinados. La atresia se puede definir como la reabsorción de líquidos del antro folicular con apoptosis de los componentes celulares del folículo (oocito, células de la granulosa y de la teca). Esto coincide con la disminución en las concentraciones de FSH, que ocurre de 3-4 días después del reclutamiento (Driancourt, 2001; Adams, 2008). Esta disminución es atribuida a la acción combinada entre la inhibina y el estradiol sobre la secreción hipofisiaria de FSH que afecta el crecimiento de los folículos menores de 5mm de diámetro, los cuales también reducen su sensibilidad a gonadotropinas (Driancourt, 2001; Ptaszynska, 2008). La FSH induce en la granulosa la producción de activina en algunos folículos, (estimulando un mecanismo de retroalimentación positiva con la FSH) y adicionalmente la de folistatina, que incrementa sus niveles conforme aumenta el tamaño folicular. La folistatina tiene la propiedad de ligarse a la activina en el fluido folicular disminuyendo la activina libre, dando como consecuencia un aumento de la relación inhibina: activina (Driancourt, 2001).
El folículo dominante es el primero en un grupo de folículos reclutados en expresar receptores de LH en las células de la granulosa. Los receptores para FSH se encuentran solamente en las células de la granulosa, mientras los de LH se localizan tanto en granulosa como en teca. Durante el nadir (nivel más bajo) de secreción hipofisiaria de FSH, el folículo dominante adquiere más receptores de LH en sus células de la granulosa y el crecimiento folicular se hace dependiente de LH, por lo que los folículos subordinados que son incapaces de producir alta cantidad de receptores de LH, se atresian. Esto se da en bovinos cuando los folículos adquieren un diámetro de unos 6.8 a 8 mm (Driancourt, 2001; Adams, 2008). Aparte de su mayor tamaño, el folículo dominante también presenta diferencias con los subordinados en cuanto al mayor grosor de su pared (Salamone et al, 1999; Adams et al, 2008).
En el folículo hay 3 fenómenos de señalización celular necesarios para que se presente el estatus de dominancia. El primero es la aparición de receptores de LH en las células de la granulosa. Segundo, hay una disminución selectiva en las cantidades del dímero de inhibina de 34 kDaltons presente en el fluido folicular, lo que no ocurre en inhibinas mayores de 160 kDaltons (Driancourt, 2001; Moore et al, 2006). Tercero, hay una reducción de las proteínas ligadas a IGF tales como la IGFBP2, IGFBP4 e IGFBP5 en el folículo dominante. La disminución de IGFBP2 ocurre por menor producción, ya que la FSH en la granulosa suprime la producción de ARNm de IGFBP2; mientras que IGFBP 4 y 5 disminuyen debido a un incremento en la proteólisis. La FSH induce en las células granulosas la producción de Proteína Plasmática Asociada a la Preñez tipo A (PAPP-A), una proteasa que puede desnaturalizar el IGFBP4. El efecto resultante es el incremento en los niveles de IGF-I libre en granulosa e IGF- II en teca (Driancourt, 2001; Moore et al, 2006; Lucy, 2007). En la vaca, el gen de expresión de IGF-II está restringido a la teca de folículos antrales, y entre sus funciones ha demostrado estimular estereidogénesis de las células mediante la activación de receptores de IGF tipo I (Webb et al, 1998; Webb et al, 2004; Webb et al, 2007). Entre tanto IGF-I en granulosa tiene un efecto sinérgico con la FSH para incrementar la actividad de la aromatasa en la célula, promoviendo la síntesis de esteroides. Se ha demostrado que el folículo dominante de una cohorte es el de mayor concentración de IGF-I en su líquido antral (Webb et al, 1998; Moore et al, 2006).
Otros factores de inhibición del desarrollo folicular incluyen al Factor Transformador de Crecimiento Alfa (TGFα), la superóxido dismutasa (SOD) y la proteína 90 de shock térmico, las cuales pueden disminuir la actividad de la aromatasa y consecuentemente la producción de estradiol por las células granulosas, aunque se desconoce si estas sustancias son preferencialmente producidas por el folículo dominante para inhibir los demás folículos. Algunos miembros de la superfamilia del TGFβ, tales como las Proteínas Morfogenéticas del Hueso tipo 4, 6 y 7 (BMP), junto con las IGF, inducen producción de estradiol, inhibinaA, activina-A, folistatina, y proliferación de las células de la granulosa (Webb et al, 2004; Webb et al, 2007; Palma, 2008). La inhibina producida por las células de la granulosa puede tener efectos paracrinos sobre las células de la teca estimulando la producción de andrógenos, particularmente la testosterona, lo que puede relacionarse con incrementos en el reclutamiento folicular (Palma, 2008).
Existen algunos factores que contribuyen en esta etapa a la maduración folicular. En folículos de 6 mm de diámetro se ha identificado que la relación inhibina - activina y la relación entre Factor de Crecimiento Epidermal (EGF) - Factor Transformador de Crecimiento Alfa (TGFα), tienen propiedades estimuladoras de crecimiento y antiapoptóticas. Éstas junto con el Factor de Crecimiento Fibroblástico (FGF) hacen parte de la superfamilia del TGFβ que interviene en el desarrollo folicular (Driancourt, 2001; Webb et al, 2004; Palma, 2008). El EGF y sus receptores se encontraron en oocito y la granulosa, mas no en la teca. En el oocito no se encuentra ARNm que codificara la síntesis de EGF, lo que da a entender que el factor de crecimiento ingresa al oocito proveniente de la granulosa a través de las proyecciones tranzonales de la zona pelúcida (Palma, 2008). Estas cascadas de señalización mencionadas se ilustran en la figura 2.
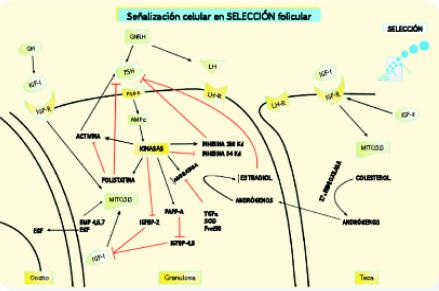
Figura 2. Señalización celular en la fase de selección folicular
La figura muestra las principales cascadas de señalización celular en la fase de selección celular. La actividad mitogénica de IGF-I sobre la granulosa y la teca continúa activa. El IGF-II producido en la teca estimula la formación de receptores de IGF en la misma célula. Por otro lado, se incrementa la producción de hormonas como folistatina, inhibina de alto peso molecular y estrógenos, que deprimen la secreción hipofisiaria de FSH, en esta fase también se incrementa la expresión de receptores de LH y la secreción de estrógenos, producto de un incremento de la actividad aromatasa en las células granulosas.
Ciertos estudios de expresión génica en folículos de 2 a 6 mm, mostraron que las células granulosas de los folículos dominantes disminuyeron los niveles de expresión de ARNm para el receptor de FSH, inhibina alfa, receptor de activina A tipo I, ciclina D2, Proteína de Diferenciación de Célula Mieloide (MCL-1), DICE-1 y también disminución de expresión de genes proapoptóticos FADD y SIVA. El ARNm para receptor beta de estrógenos en el folículo dominante en algunos estudios aparece como incrementado y en otros disminuido. Las células granulosas incrementaron paulatinamente la expresión de aromatasa y receptor de LH y en la teca se incrementó la expresión de factores relacionados con proliferación celular (TIAF1), supervivencia (LASS4), y apoptosis (TNFSF8). Otro hallazgo es que la relación estrógenos: progesterona se encuentra disminuida en el líquido folicular en la fase de dominancia (Evans et al, 2004; Mihm et al, 2006). Se ha encontrado también que la concentración de estrógenos en el folículo dominante es más alta que en el mayor de los subordinados y que la baja concentración de estrógenos intrafoliculares se ha asociado a la expresión de ARNm de células granulosas para factores proapoptóticos tales como fas, fas ligando, beta glicano, Ciclooxigenasa 1 (COX-1), Factor de Necrosis Tumoral Alfa (TNFα), DNAsa activadora de caspasas (CAD) y DRAK-2. En la teca de folículos subordinados entrando en atresia se incrementaron los factores beta glicano, caspasa 13, p58, Factor 1 Activador de Proteasas Apoptóticas (Apaf-1), BTG-3 y Candidato Humano Supresor de Tumores para Células B (TS-BCLL). (Evans et al, 2004) En otro estudio se ha asociado la sobreexpresión de algunos genes con apoptosis (MRPL41, VDAC2), fagocitosis de células de folículos en atresia (STX7) y regresión de folículos subordinados (SPC22 y EHD3) (Zielak et al, 2007). Durante la involución del folículo, el fluído folicular es reabsorbido. Parte de este líquido puede salir a través de la lámina basal del folículo y ser tomado por vasos linfáticos. Otra parte puede filtrarse por la menor presión osmótica intrafolicular, debida a la degradación enzimática de sustancias osmóticamente activas como los glicosaminoglicanos, hialurona, condroitín / dermatán - sulfato y ADN en solución (Clarke et al, 2006) Las relaciones ocurridas en los folículos en atresia se encuentran ilustradas en la figura 3.
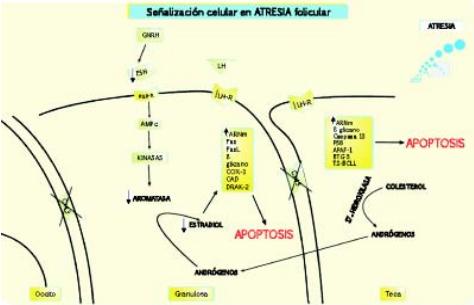
Figura 3. Señalización celular en la fase de atresia folicular
Los folículos cada vez tienen menores cantidades disponibles de FSH. Esto sumado a una baja cantidad de receptores de LH en granulosa y teca disminuye la producción de estradiol, inhibe la producción de puentes celulares e incrementa la expresión de genes proapoptóticos como Fas, Fas Ligando, APAF-1 y Caspasas, entre otros. Todas estas acciones resultan en muerte celular programada de los componentes del folículo y reabsorción de líquidos provenientes del antro folicular.
Dominancia
Esta fase se caracteriza por un rápido crecimiento folicular y maduración oocitaria en el folículo dominante. Las sustancias producidas por éste son responsables de la supresión gradual en la liberación de FSH y de la inhibición de la emergencia de la siguiente onda de desarrollo folicular con inducción de atresia de los folículos restantes y es concomitante con el incremento Vásquez - Señalización Celular en la secreción pulsátil de LH hipofisiaria. El diámetro del folículo dominante en bovinos puede llegar a los 15 mm en momentos previos a la ovulación (Driancourt, 2001). Si el folículo dominante es removido (por ejemplo por punción ovárica o ablación folicular), un pico de FSH se presentará a las 12 horas, resultando en la emergencia de una nueva onda de desarrollo folicular a las 24 (Adams et al, 2008).
Al igual que en el reclutamiento, la IGF-I parece ser un factor de crecimiento indispensable en la dominancia folicular. Animales con deficiencias en su Hormona de Crecimiento (GH), limitan la producción de IGF-I y esto se ha asociado a la suspensión de la dominancia folicular en folículos de 8 mm de diámetro. Esto se debe al parecer a que la falta de IGF-I puede afectar parcialmente la producción de receptores de LH. En esta etapa, la LH puede estimular en la teca la producción de Factor de Crecimiento de Endotelio Vascular (VEGF), un potente estimulador de la angiogénesis. Bajo la acción de VEGF el folículo dominante garantiza el suministro de sangre que transporta las gonadotropinas necesarias para finalizar su crecimiento. En esta función también intervienen las angiopoyetinas y el Factor de Crecimiento Fibroblástico (FGF), el cual también se ha reportado como mitógeno en las células de la teca. En contraste, la producción de estradiol no parece ser un prerrequisito para la dominancia folicular (Webb et al, 1998; Lucy, 2007). La unión de la LH a su receptor en las células de la teca estimula la producción de la enzima 17α Hidroxilasa (conocida también como CYP 17) la cual convierte la pregnenolona y progesterona a dihidroepiandrosterona y androstenediona, respectivamente; ambas son materias primas para la síntesis del estradiol en las células de la granulosa (Palma, 2008). La figura 4 muestra las vías de síntesis de los estrógenos a partir del colesterol en las células de la teca y la granulosa.
Figura 4. Biosíntesis de esteroides en las células de la teca bajo la influencia de LH, en la que el colesterol es convertido a andrógenos. Posteriormente estos son aromatizados en las células de la granulosa bajo la influencia de FSH (Adaptado de Drummond, 2006)
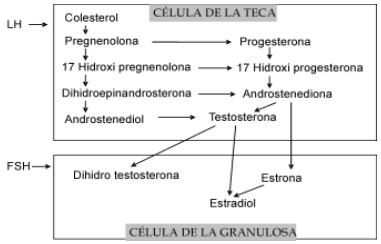
En la fase de dominancia, la actividad aromatasa es regulada por la proteína 3 Beta Hidroxiesteroide Deshidrogenasa (3βHSD) en células de la granulosa (Driancourt, 2001; Webb et al, 2004). La expresión de ARNm de 3βHSD sólo se ha encontrado en folículos mayores a 9 mm de diámetro (Webb et al, 1998). Durante la dominancia también se ha encontrado que la FSH induce incremento en la expresión génica de las células granulosas para ARN mensajero que codifica la traducción de receptores de LH, enzima de clivaje de la cadena lateral de la p450 y para la aromatasa p450, estimulando la estereidogénesis (Lucy, 2007; Peter et al, 2009). La granulosa es sensible a la unión de receptores de LH en estado preovulatorio; esta unión induce la producción de receptores de progesterona PR-A y PRB, que tiene funciones relacionadas con la luteinización. Además, el PR-A está asociado a mecanismos desencadenantes de la ovulación (Palma, 2008).
En estados preovulatorios, la LH induce la fosforilación y modificación de la conexina Cx43, lo que conduce a la interrupción de los puentes intercelulares, desaparición de las uniones gap y separación de las células granulosas del oocito. Esto facilitará el desprendimiento del cumulus oophorus en la ovulación y su expansión en etapas posteriores a ésta. En folículos antrales no ovulatorios la disminución de la Cx43 está asociada con atresia folicular. Adicionalmente, el Factor de Crecimiento Neuronal (NGF), está asociado también con la disminución de las uniones gap y con síntesis de receptores de FSH, incremento en la producción de PGE2, y proliferación de las células de la teca (Palma, 2008).
En el período previo a la ovulación, la teca adicionalmente incrementa los niveles de Proteína Reguladora de la Estereidogénesis Aguda (StAR), cuya función es regular el transporte del colesterol en la mitocondria, estimulando la producción de andrógenos a partir de éste (Kallen et al, 1998).
El oocito produce Factor Diferenciador de Crecimiento 9 (GDF-9) y Proteína Morfogenética del Hueso 15 (BMP15) como factores paracrinos relacionados con la regulación de las funciones del cumulus y la granulosa necesarias para la ovulación y la fertilización en ratones y bovinos (Sirard et al, 2007).
En condiciones normales, el folículo de mayor diámetro de la cohorte, en ausencia de cuerpo lúteo y ante un pico preovulatorio de producción de LH es el seleccionado para la ovulación, la cual se da cuando el folículo tiene entre 17 y 20 mm de diámetro (Driancourt, 2001; Moore et al, 2006; Ptaszynska, 2008). En el caso de que exista un cuerpo lúteo, los niveles circulantes de progesterona harán un bloqueo del centro de picos hipotalámico, disminuyendo la producción de LH y consecuentemente induciendo la atresia del folículo dominante. La disminución de los niveles de hormonas depresoras de la actividad FSH (estrógenos, inhibina, folistatina) posibilitarán un nuevo pico de FSH que inducirá la emergencia de una nueva onda de crecimiento folicular.
Desde el momento de la formación del antro folicular, se reactiva el proceso meiótico del oocito. La principal sustancia involucrada en la detención de la meiosis son los altos niveles de Adenosina Monofosfato Cíclico (AMPc) en el oolema, cuando el AMPc disminuye prosigue el proceso meiótico oocitario, detenido en profase I desde la fase embrionaria del individuo. Si el AMPc disminuye por menor producción en el oocito, o por deterioro de los puentes celulares de la zona pelúcida provenientes de la granulosa, es un asunto pendiente de esclarecer (Sirard et al, 2007; Palma, 2008). La figura 5. Presenta los cambios ocurridos en el folículo dominante, preparándolo para la ovulación.
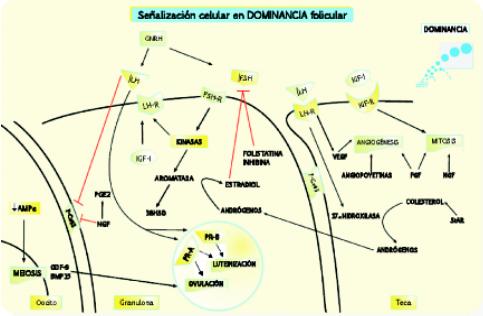
Figura 5. Señalización celular en la fase de dominancia folicular
En esta fase, la actividad aromatasa es altamente dependiente de LH. Los puentes celulares empiezan a disminuir en todo el folículo. Las células de la teca incrementan la mitosis y hay incremento en la vascularización de esta parte del folículo. En la granulosa mientras tanto se inicia la expresión de receptores de progesterona A y B nucleares necesarias para la ovulación y luteinización del tejido. Entre tanto, en el oocito se inicia la disminución de actividad de AMPc necesaria para continuar el proceso meiótico detenido desde la vida fetal del individuo.
Con base en las descripciones de las cascadas de señalización aquí mencionadas se puede concluir que el desarrollo folicular es un fenómeno biológico activo, donde la interacción endocrina, paracrina y autocrina induce eventos al interior del folículo que definirán su supervivencia, o su atresia; y en sus fases finales de desarrollo determinará la posibilidad que el oocito adquiera su capacidad fecundante y generar un nuevo individuo. Aún se desconocen muchas de las interacciones generadas por ésta glándula temporal; el conocimiento de las mismas permitirá intervenciones que posibiliten mejores resultados en las diferentes biotecnologías reproductivas y conocer factores que contribuyan a una mayor fertilidad de los bovinos.
REFERENCIAS
Adams GP. Control of ovarian follicular wave dynamics inmature and prepubertal cattle for synchronization and superstimulation. Proceedings of the XX congress of the world association for buiatrics, 1998; 2: 595-605.
Adams GP. Comparative patterns of follicle development and selection in ruminants. J Reprod Fertil Suppl. 1999; 54: 17-32.
Adams GP, Jaiswal R, Singh J, Malhiet P. Progress in understanding ovarian follicular dynamics in cattle. Theriogenology 2008; 69: 72-80.
Bo G, Baruselli PS y Martinez MF. Pattern and manipulation of follicular development in Bos indicus cattle. Animal Reprod Science. 2003; 78: 307-326.
Clarke H, Hope S, Byers S y Rodgers R. Formation of ovarian follicular fluid may be due to the osmotic potential of large glycosaminoglycans and proteoglycans. Reproduction 2006; 132: 119-131.
Driancourt MA. Regulation of ovarian follicular dynamics in farm animals. Implications for manipulation of reproduction. Theriogenology 2001; 55: 1211-1239.
Drummond A. The role of steroids in follicular growth. Reproductive Biology and Endocrinology. 2006; 4: 16.
Evans A, Ireland JL, Winn M, Lonergan P, Smith G, Coussens P, Ireland JJ. Identification of Genes Involved in Apoptosis and Dominant Follicle Development During Follicular Waves in Cattle. Biology of reproduction. 2004; 70: 1475-1484.
Forde N, Mihm M, Canty M, Zielak A, Baker P, Park S, Lonergan P, Smith G, Coussens P, Ireland J, Evans A. Differential expression of signal transduction factors in ovarian follicle development: a functional role for betaglycan and FIBP in granulosa cells in cattle. Physiol Genomics 2008; 33: 193-204.
Kallen C, Billheimer J, Summers S, Stayrook S, Lewis M, Strauss J. Stereidogenic acute regulatory protein (StAR) is a sterol transfer protein. J. Biol. Chem. 1998; 273: 26285-26288.
Lucy MC. 2007. The bovine dominant ovarian follicle. Journal of Animal Science 85: E89-E99.
Mihm M, Baker P, Ireland J, Smith G, Coussens P, Evans A, Ireland J. Molecular Evidence That Growth of Dominant Follicles Involves a Reduction in FollicleStimulating Hormone Dependence and an Increase in Luteinizing Hormone Dependence in Cattle. Biology of reproduction. 2006; 74: 1051-1059.
Moore K, Thatcher W. Major Advances Associated with Reproduction in Dairy Cattle. Journal of Dairy Science. 2006; 89: 1254-1266.
Palma G. 2008. Biotecnología de la reproducción. Segunda edición. Ed. Reprobiotec. Córdoba. Pp 73- 90.
Peter AT, Vos PL, Ambrose D. Postpartum anestrus in dairy cattle. Theriogenology 2009; 71: 1333-1342.
Ptaszynska M. 2008. Compendium de reproducción animal. Octava edición. Internet internacional.
Rodgers R, Irving-Rodgers H. Formation of the Ovarian Follicular Antrum and Follicular Fluid. Biology Of Reproduction. 2010; 82: 1021-1029.
Salamone DF, Adams GP, Mapletoft RJ. Changes in the cumulus-oocyte complex of subordinate follicles relative to follicular wave status in cattle. Theriogenology 1999; 52: 549-561.
Senger PL. 2005. Pathways to pregnany and parturition. Segunda edición. Current conceptions inc. Washington.
Sirard M, Desrosier S, Assidiet M. In vivo and in vitro effects of FSH on oocyte maturation and developmental competence. Theriogenology 2007; 68: 71-76.
Webb R, Armstrong DG. Control of ovarian function; effect of local interactions and environmental influences on follicular turnover in cattle: a review. Livestock production science. 1998; 53: 95-112.
Webb R, Garnsworthy P, Gong J, Armstrongy D. Control of follicular growth: Local interactions and nutritional influences. Journal of Animal Science. 2004; 82: 63-74.
Webb R, Garnsworthy P, Campbell B, Hunter M. Intra-ovarian regulation of follicular development and oocyte competence in farm animals. Theriogenology 2007; 68: 22-29.
Zielak AE, Forde N, Park SD, Doohan F, Coussens PM, Smith GW. Identification of novel genes associated with dominant follicle development in cattle. Reprod Fertil Dev. 2007; 19: 967-975.