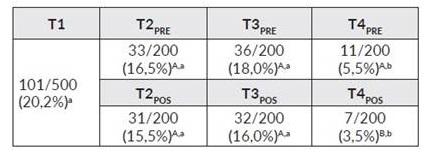
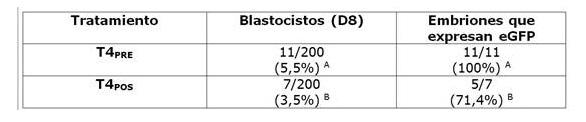
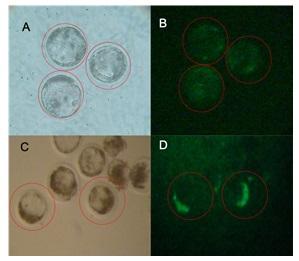
Producción de embriones transgénicos bovinos por microinyección de un vector lentiviral pre y pos fertilización.
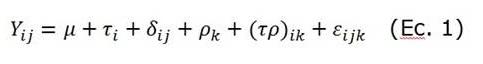
[1] LAIBLE, G. Production of Transgenic Livestock: Overview of Transgenic Technologies. In: Animal Biotechnology 2: Cham: Berne (Switzerland): Springer International Publishing, 2018, p. 95-121. [ Links ]
[2] THYGESEN, P. Clarifying the regulation of genome editing in Australia: situation for genetically modified organisms. Transgenic Research, 28(2), 2019, p. 151-159. [ Links ]
`[3] TONELLI, F., LACERDA, S., TONELLI, F., COSTA, G., DE FRANCA, L. and RESENDE, R. Progress and biotechnological prospects in fish transgenesis. Biotechnology Advances, 35(6), 2017, p. 832-844. [ Links ]
[4] MÉNORET, S., TESSON, L., REMY, S., USAL, C., OUISSE, L.H., BRUSSELLE, L., CHENOUARD, V., NGUYEN, T.H., DAVID, L. and ANEGON, I. Transgenic animals and genetic engineering techniques. Transgenic Research , 24(6), 2015, p. 1079-1085. [ Links ]
[5] LEI., Y., LISHUANG, S., XUEFEI, L., LIGE, B. and GUANGPENG, L. Optimizing protocol for the preparation of transgenic mice (Mus musculus) by pronuclear injection. Journal of Agricultural Biotechnology, 24(8), 2016, p. 1278-1284. [ Links ]
[6] DE OLIVEIRA, S., BAPTISTA, H. and PESQUERO, J. Transgenic animals: principles, methods and applications. In: rodent model as tools in ethical Biomedical Research. Cham. Berne (Switzerland): Springer International Publishing, 2016, p. 169-185. [ Links ]
[7] CHU, V.T., GRAF, R., WIRTZ, T., WEBER, T., FAVRET, J., LI, X., PETSCH, K., TRAN, N.T., SIEWEKE, M.H., BEREK, C., KUHN, R. and RAJWESKY, K. Efficient CRISPR-mediated mutagenesis in primary immune cells using CrispRGold and a C57BL/6 Cas9 transgenic mouse line. PNAS, 113(44), 2016, p. 12514-12519. [ Links ]
[8] YUM, S.Y., LEE, S.J., PARK, S.G., SHIN, I.G., HAHN, S.E., CHOI, W.J., KIM, H.S., KIM, H.J., BAE, S.H., LEE, J.H., MOON, J.Y., LEE, W.S., LEE, J.H., LEE, C.I., KIM, S.J. and JANG, G. Long-term health and germline transmission in transgenic cattle following transposon-mediated gene transfer. BMC Genomics, 19(1), 2018, p. 387-399. [ Links ]
[9] MONZANI, P.S., ADONA, P.R., OHASHI, O.M., MEIRELLES, F.V. and WHEELER, M.B. Transgenic bovine as bioreactors: Challenges and perspectives. Bioengineered, 7(3), 2016, p. 123-131. [ Links ]
[10] CURCIO, A.G., BRESSAN, F.F., MEIRELLES, F.V. and DIAS, A.J.B. Achievements and perspectives in cloned and transgenic cattle production by nuclear transfer: influence of cell type, epigenetic status and new technology. Animal Reproduction, 14(4), 2017, p. 1003-1013. [ Links ]
[11] KARDA, R., PEROCHEAU, D., BUCKLEY, S. and DELHOVE, J. 305. Generation of light-producing, somatic-transgenic mice using lentivirus and adeno-associated virus vectors. Molecular Therapy, 24(1), 2016, p. S123. [ Links ]
[12] CRISPO, M., VILARIÑO, M., DOS SANTOS, P.C., NÚÑEZ, R., CUADRO, F., BARRERA, N., MULET, A.P., NGUYEN, T.H., ANEGON, I. and MENCHACA, A. Embryo development, fetal growth and postnatal phenotype of eGFP lambs generated by lentiviral transgenesis. Transgenic Research , 24(1), 2015, p. 31-41. [ Links ]
[13] PRASHER, D.C., ECKENRODE, V.K., WARD, W.W., PRENDERGAST, F.G. and CORMIER, M.J. Primary structure of the Aequorea victoria green-fluorescent protein. Gene, 111(2), 1992, p. 229-233. [ Links ]
[14] LOIS, C., HONG, E.J., PEASE, S., BROWN, E.J. and BALTIMORE, J. al. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science, 295(5556), 2002, p. 868-872. [ Links ]
[15] HOFMANN, A., ZAKHARTCHENKO, V., WEPPERT, M., SEBALD, H., WENIGERKIND, H., BREM, G., WOLF, E. and PFEIFER, A. Gene ration of transgenic cattle by lentiviral gene transfer into oocytes. Biology Reproduction, 71(2), 2004, p. 405-409. [ Links ]
[16] MIAO, K., GUO, M., AN, L., XU, X.L., WU, H., WANG, D., WU, Z.H. and TIAN, J.H. A new method to efficiently produce transgenic embryos and mice from low-titer lentiviral vectors. Transgenic Research , 20(2), 2011, p. 357-363. [ Links ]
[17] VAN SOOM, A., WRATHALL, A.E., HERRLER, A. and NAUWYNCK, H.J. Is the zona pellucida an efficient barrier to viral infection?. Reproduction Fertility Develoment, 22(1), 2010, p. 21-31. [ Links ]
[18] SOSA, M.A.G., GASPERI, R.D. and ELDER, G.A. Animal transgenesis: an overview. Brain Structure and Functions, 214(2-3), 2010, p. 91-109. [ Links ]
[19] LY, J., MESSICK, K., QIN, A., TAKAHASHI, R.H. and CHOO, E.F. Utility of CYP3A4 and PXR-CAR-CYP3A4/3A7 Transgenic mouse models to assess the magnitude of CYP3A4 mediated Drug-Drug interactions. Molecular Pharmaceutics, 14(5), 2017, p 1754-1759. [ Links ]
[20] McLAURIN, K., BOOZE, R. and MACTUTUS, C. Evolution of the HIV-1 transgenic rat: utility in assessing the progression of HIV-1-associated neurocognitive disorders. Journal of Neurovirology, 24(2), 2018, p. 229-245. [ Links ]
[21] AYALA, L., SAMANIEGO, J., NIETO, P., RODAS, R., DUTÁN, J., CALLE, G., MURILLO, Y., VÁSQUEZ, J., ARGUDO, D. y PEREA., F. Competencia del ovocito bovino obtenido por Ovum pick-up valorado mediante el azul brillante de Cresilo. Maskana, 8(1), 2017, p 77-80. [ Links ]
[22] OTERO, R., HERNÁNDEZ, D. and CAMARGO, L.S. Production of bovine transgenic embryos by microinjection of a lentiviral vector in mature ovocytes. Indian Journal of Science and Technology, 11(31), 2018, p. 1-8. [ Links ]
[23] CHAN, A.W., CHONG, K.Y., MARTINOVICH, C., SIMERLY, C. and SCHATTEN, G. Transgenic monkeys produced by retroviral gene transfer into mature oocytes. Science , 291(5502), 2001, p. 309-312. [ Links ]
[24] OTERO, R., COSTA, P. e PEREIRA, M. Maturação nuclear in vitro de ovócitos bovinos selecionados pelo método azul cresil brilhante. Revista Colombiana de Ciencia Animal, 9(Sulp2), 2017, p. 345-354. [ Links ]
[25] IETS. 5th Edition IETS Manual [online]. Web Site; 2018. Disponible en: Disponible en: https://www.iets.org/pub_manual.asp citado 13 julio de 2019. [ Links ]
[26] CHAN, A.W., HOMAN, E.J., BALLOU, L., BURNS, J. and BREMEL, R. Transgenic cattle produced by reverse-transcribed gene transfer in oocytes. PNAS , 95(24), 1998, p. 14028-14033. [ Links ]
[27] HOFMANN, A., KESSLER, B., EWERLING, S., WEPPERT, M., VOGG, B., LUDWIG, H., STOJKOVIC, M., BOELHAUVE, M., BREM, G., WOLF, E. and PFEIFER, A. Efficient transgenesis in farm animals by lentiviral vectors. EMBO Reports, 4(11), 2003, p. 1054-1060. [ Links ]
[28] CRAIGIE, R. Nucleoprotein Intermediates in HIV-1 DNA Integration: Structure and Function of HIV-1 Intasomes. In: Virus Protein and Nucleoprotein Complexes. Singapore (Singapore): Springer, 2018 p. 189-210. [ Links ]
[29] GONÇALVES, J., MOREIRA, E., SEQUEIRA, I., RODRIGUES, A., RUEFF, J. and BRÁS, A. Integration of HIV in the Human Genome: Which Sites Are Preferential? A Genetic and Statistical Assessment. International Journal of Genomics [online]. 2016 Disponible en: Disponible en: https://www.hindawi.com/journals/ijg/2016/2168590/abs/ citado 5 de julio de 2019. [ Links ]
[30] XU, Y.N., UHM, S.J., KOO, B.C., KWON, M.S., ROH, J.Y., YANG, J.S., CHOI, H.Y., HEO, Y.T., CUI, X.S., YOON, J.H., KO, D.H., KIM, T. and KIM, N.H. Production of transgenic Korean native cattle expressing enhanced green fluorescent protein using a FIV-Based lentiviral vector injected into MII oocytes. Journal of Gene tics and Genomics, 40(1), 2013, p. 37-43. [ Links ]
[31] TIAN, Y., LI, W., WANG, L., LIU, C., LIN, J., ZHANG, X., ZHANG, N., HE, S., HUANG, J., JIA, B. and LIU, M. Expression of 2A peptide mediated tri-fluorescent protein genes were regulated by epigenetics in transgenic sheep. Biochemical Biophysical Research Communications, 434(3), 2013, p. 681-687. [ Links ]
[32] WHITELAW, C.B.A., RADCLIFFE, P.A., RITCHIE, W.A., CARLISIE, A., ELLARD, F.M., PENA, R.N., ROWE, J., CLARK, A.J., KING, T.J. and MITROPHANOUS, K.A. Efficient generation of transgenic pigs using equine infectious anaemia virus (EIAV) derived vector. FEBS Lett, 571(1-3), 2004, p. 233-236. [ Links ]
[33] PFEIFER, A., IKAWA, M., DAYN, Y. and VERMA, I.M. Transgenesis by lentiviral vectors: lack of gene silencing in mammalian embryonic stem cells and preimplantation embryos. PNAS , 99(4), 2002, p. 2140-2145. [ Links ]
[34] PARK, F. Lentiviral vectors: are they the future of animal transgenesis?. Physiology Genomics, 31(2), 2007, p. 159-173. [ Links ]




.jpg&w=3840&q=75)