Parasitosis gastrointestinal de los bovinos: Epidemiología, Control y Resistencia a Antihelmínticos
Publicado: 1 de abril de 2013
Por: César A. FIEL. Área de Parasitología. Fac.Cs. Veterinarias. U.N.C.P.B.A. Tandil
1. Introducción
En una amplia región que abarca el sur de Brasil, Uruguay y Argentina, las condiciones ambientales son favorables para el desarrollo de los nematodes (gusanos) gastrointestinales durante todo el año y dado que los sistemas de producción se establecen sobre pasturas permanentes, las parasitosis internas representan una de las mayores limitantes.
Las parasitosis gastrointestinales ejercen su efecto, sea por mortandad, enfermedad clínica y/o subclínica. Se estiman, para la pampa húmeda argentina, perdidas anuales por mortandad de 25- 30.000 toneladas de carne y perdidas en la producción de 226.000 toneladas de carne dando un total de 260.000 toneladas (Entrocasso, 1989).
Los terneros de destete son altamente susceptibles a las parasitosis debido a su falta de inmunidad y a pesar de ello son expuestos, por cuestiones de manejo, a pasturas con alta contaminación e infectividad, resultando la categoría más perjudicada por los nematodes gastrointestinales. Las épocas del año donde se advierte su mayor efecto son otoño, invierno y principios de la primavera, debido a que el clima es favorable para el desarrollo y sobrevivencia de los estadios larvales, y la baja disponibilidad de forraje hace que los terneros deban ingerir el pasto cercano a las bostas incorporando gran cantidad de larvas. Por otro lado, si los niveles de larvas en hipobiosis son elevados, las pérdidas de peso estivales ocasionadas por la Ostertagiasis tipo II pueden ser severas.
Por ello resulta fundamental el buen control parasitario, teniendo en cuenta que para lograr una aceptable producción de carne se debe asegurar una mínima ganancia de peso durante la invernada. Los métodos de control parasitario necesariamente deben tener en cuenta las características epidemiológicas locales junto al correcto diagnóstico de la situación parasitaria del rodeo en particular. Para alcanzarlo, será necesario integrar técnicas diagnósticas como los conteos de H.p.g. y larvas en pasto; junto a parámetros productivos como el seguimiento de las diferencias en las ganancias de peso del rodeo.
El control parasitario tendrá como finalidad la reducción de los efectos de los parásitos sobre la producción con la menor utilización de antihelmínticos, a fin de evitar la presentación de resistencia antihelmíntica. En este sentido, el manejo del rodeo será fundamental para exponer a los animales a la menor cantidad de L3 y también evitar la contaminación de las pasturas.
El rol del Veterinario es central en el control parasitario, si pretendemos que en el futuro el uso de drogas antihelmínticas continúe siendo una de las herramientas más sencillas y de mayor impacto productivo en el sector ganadero.
2. Dinámica de los Estadios Parasitarios
La dinámica de los estadios parasitarios es diferente en los distintos sistemas productivos, dependiendo del tipo de explotación, el manejo, la categoría animal, las condiciones climáticas y el nivel de infectividad de las pasturas.
La susceptibilidad de los animales a los parásitos esta relacionada con el desarrollo de inmunidad, la cual depende del tiempo de exposición y de la carga de parásitos. Aparece recién cuando los animales sobrepasan el año de edad pero el nivel de exposición puede acortar este proceso. La acción de la inmunidad sobre los parásitos reduce la producción de huevos, su vida media y también impide el establecimiento de nuevos parásitos (Steffan y Fiel, 1994).
2.1 Sistemas de Cría
En los sistemas de cría las pariciones ocurren a fines de invierno y principios de primavera, destetándose los terneros al final del verano. En años con condiciones climáticas normales, los terneros tienen un bajo riesgo de infección debido a que la inmunidad de las madres reduce la contaminación de las pasturas a lo que se suma el efecto de dilución de la infectividad ocasionado por el crecimiento del pasto en primavera y la importante mortandad de las larvas que ocurre durante el verano (Fiel y Steffan, 1994).
Sin embargo, Suárez (1990a), observó en terneros destetados en el mes de mayo una diferencia de peso de 25 Kg., entre los tratados mensualmente y los no tratados. El hecho que tales diferencias se constituyeran a fin del verano y principios del otoño, señala que se trata más de un problema estacional que de categorías, de manera que cuanto más se prolongue el destete hacia el invierno mayores problemas deberían esperarse.
Durante la época del parto ocurre cierta relajación del sistema inmune, especialmente en vaquillonas de primera parición, que permite el desarrollo de las larvas ingeridas hasta alcanzar el estado de adultos aumentando ligeramente los conteos de huevos en materia fecal (H.p.g.) y la contaminación de las pasturas (Fiel et al., 1990; Fiel y Steffan, 1994; Suárez, 1990a). Se produce un aumento de la eliminación de huevos durante el periparto (de menor relevancia que en ovejas), originando larvas que sobreviven en las bostas hasta las primeras lluvias al término del verano. Como consecuencia, aumentarían de L3 en las pasturas, y así los terneros podrían infectarse, pudiendo ocasionar diferencias de peso en el otoño (Suárez, 1990a). Esta situación puede verse agravada en aquellos años en que, por sequías durante el invierno, se traslada la mayor infectividad de las pasturas a la primavera. Como consecuencia, los animales acumularán un elevado número de larvas en hipobiosis llegando a producir casos clínicos de ostertagiasis Tipo II durante el verano (Fiel y Steffan, 1994). Lo expuesto justifica el control parasitario al parto, intentando evitar la contaminación de las pasturas, sobre todo cuando los terneros son destetados bien entrado el otoño (Fiel et al., 1990; Fiel y Steffan, 1994).
Por último, debemos mencionar que los toros tienen una alta susceptibilidad a los parásitos condicionada por sus hormonas sexuales; albergando medianas a altas cargas parasitarias que comprometen su condición corporal y/o producen casos clínicos (Fiel y Steffan, 1994).
2.2 Siste mas de Recría e Invernada
Los terneros destetados a fin del verano, se infectan por larvas provenientes del año anterior que sobrevivieron al verano, en su mayoría dentro de las deposiciones fecales, y que son diseminadas en el pasto por las primeras lluvias de otoño. Los animales ingieren las L3 con el pasto, éstas se desarrollan hasta adultos en 2-3 semanas, y debido a la escasa inmunidad de los terneros se produce un importante incremento en los valores H.p.g.. La alta contaminación de las pasturas en conjunto con las abundantes lluvias de la época, aumenta la infectividad de las pasturas llegando a su máximo nivel entre julio y septiembre. Este ciclo se repite varias veces elevándose la carga de adultos en el animal que originan las mayores pérdidas de peso junto con una mayor frecuencia de casos clínicos durante el invierno (Descarga et al., 1988; Daffner et al., 1990; Fiel et al., 1988; Fiel et al., 1990; Fiel y Steffan, 1994; Suárez, 1990a). Este proceso se ve agravado por el pobre estado nutricional de los animales debido a la reducción en cantidad y calidad del forraje disponible en esta época del año (Steffan y Fiel, 1994).
Durante la primavera la infestación de las pasturas disminuye a raíz de un efecto de dilución ejercido por el crecimiento del pasto. El estado nutricional de los animales, que ya rondan el año de edad, mejora contribuyendo al desarrollo de inmunidad y disminuyendo por consiguiente los conteos de H.p.g. y la contaminación de las pasturas. En el período entre el final de la primavera y principios del verano O. ostertagi se encuentra en su mayor parte como L4i en las glándulas abomasales quedando una pequeña cantidad de adultos; por lo que casi no se eliminan huevos por materia fecal (Descarga et al., 1988; Daffner et al., 1990; Fiel et al., 1990; Fernández et al., 1994; Suárez, 1990a).
La hipobiosis de Ostertagia ostertagi, en la provincia de Buenos Aires, se produce en las L3 que son ingeridas en el período septiembre-diciembre, alcanzando valores máximos de inhibición del orden de 60 a 90% según se trate de ganado lechero o carnicero respectivamente (Fernández et al., 1992, Fernández et al., 1994; Fiel et al., 1988; Fiel et al., 1990), al igual que en el sudeste de Córdoba (Descarga et al., 1988), en la región semiárida y sub húmeda pampeana (Suárez, 1990a,b), y en el norte de Santa Fe (Daffner et al., 1990). Resultados similares son informados por Nari y Risso (1994) en Uruguay y Pinheiro et al. (1982) en Bagé (Río grande do Sul) Brasil.
Durante el verano la infectividad de las pasturas se reduce por acción de las altas temperaturas y la sequía que destruyen la gran mayoría de las L3 presentes en el forraje. Es en este momento que comienza la desinhibición de las L4i de Ostertagia ostertagi. A partir de enero la carga de larvas hipobióticas se reduce, y ya en el mes de marzo los índices de larvas inhibidas en el abomaso son muy bajos (Fernández et al., 1992, Fernández et al., 1994; Fiel et al., 1988). La reanudación del desarrollo de las larvas inhibidas ocurre normalmente en forma gradual, madurando diariamente en cantidades moderadas, o por el contrario en ondas o masivamente, donde un gran número de larvas puede desarrollar en un corto período de tiempo (Williams, 1983). Tal característica determinará la presentación subclínica poniendo en riesgo hasta 20 kg. de peso vivo (Fiel et al. 2003) o clínica (Ostertagiasis tipo II) con muertes agudas.
2.3. Sistemas de Tambo
La acción de los parásitos sobre la producción de vacas lecheras es motivo de una fuerte controversia, ya que diversos trabajos internacionales presentan resultados tanto positivos como neutros a los tratamientos antihelmínticos durante la lactancia (Bullman e Ihde, 1985). En Argentina los pocos ensayos realizados indican un aumento en la producción de leche del 5% en los animales desparasitados durante la lactancia a intervalos mensuales (Biondani y Steffan, 1988; Fiel y Steffan, 1994). Esta diferencia podría deberse a una reacción de hipersensibilidad por parte del animal ante la presencia de los parásitos en el abomaso que ocasiona un escape exagerado de proteínas y un incremento del catabolismo proteico, más que a lesiones directas como ocurre en los animales jóvenes (Biondani y Steffan, 1988).
Las terneras de recría presentan reducciones de la ganancia de peso en los períodos de otoño invierno y segunda mitad de primavera; similares a las observadas en animales de carne de la misma categoría. Sin embargo hay pequeñas diferencias según la época del año en que nacen las terneras; las de otoño sufrirán en mayor medida las parasitosis en la primavera y el otoño siguiente mientras que las nacidas en primavera estarán más expuestas a los parásitos durante el otoño y menos durante la siguiente primavera (Fernández, et al., 1992, 1994).
3. Efectos productivos de las Parasitosis
Los parásitos gastrointestinales generan múltiples trastornos digestivos y metabólicos en los animales que resultan en una baja productividad; principalmente una menor ganancia de peso en los terneros de invernada. Entrocasso (1988) describe pérdidas subclínicas en la ganancia de peso en animales jóvenes de alrededor de un 20% (15 a 40 Kg.), por animal y por año de pastoreo, para toda la Pampa Húmeda. En los casos clínicos de la enfermedad, que presentan diarrea y mal estado general, las perdidas pueden ser de alrededor del 30- 40 % (30-60 Kg.) de peso pudiendo haber mortandad de animales del orden del 1-2% (o superior). Cabe recordar que no solo hay perdidas de peso sino también que hay graves perdidas en la calidad de la carne y del rendimiento de la res (Entrocasso, 1988; 1994). Las lesiones parasitarias provocan trastornos metabólicos y reducción del apetito que conllevan no solo a una menor ganancia de peso, sino también a diferencias en la composición corporal de los animales crónicamente parasitados. Al afectar la digestión y el metabolismo de proteínas se reduce la síntesis y deposición muscular. Del mismo modo se ve afectados el metabolismo energético y mineral en detrimento de la deposición grasa y ósea respectivamente. Estos cambios generan un menor rendimiento de la res debido a la reducción de la deposición de músculo y grasa y al aumento de tamaño del tubo digestivo inducido por las lesiones parasitarias (Entrocasso, 1994; Garriz et al., 1987, Suárez et al., 1991).
En la recría de vaquillonas de reposición el efecto de los parásitos sobre la ganancia de peso es similar al indicado para los animales de invernada pudiendo observarse diferencias de peso de entre 42 y 54 Kg.; situación que afecta el desarrollo corporal y la actividad reproductiva (Fernández et al., 1994; Descarga et al., 1988).
Las vaquillonas de 15 meses parasitadas presentan al tacto un menor desarrollo de los órganos genitales y falta de madurez sexual que las hace no aptas para el servicio. En sistemas con servicio de 27 meses las vaquillonas con buen peso y madurez sexual pueden ver afectado, a consecuencia de la parasitosis, su desarrollo óseo especialmente a nivel del área pélvica cuya reducción genera un mayor índice de partos distócicos (Steffan, 1991; Steffan y Fiel, 1994).
4. Control de los Nematodos Gastrointestinales
Los antihelmínticos en sus comienzos significaban la única opción frente a la forma clínica de las parasitosis. En los últimos años se han empleado no solo para evitar la expresión de síntomas sino para minimizar las pérdidas subclínicas. De esta forma los antihelmínticos han llegado a tener una utilización de tipo productiva (Corwin, 1997; Entrocasso, 1989).
Si bien se dispone en la actualidad de una amplia gama de productos antiparasitarios efectivos, debe evitarse su uso indiscriminado. Los organismos internacionales y los mercados extranjeros son cada vez más exigentes en los niveles permitidos de residuos de fármacos en los productos de origen animal, por lo que uno de los inconvenientes, sobre todo en los antiparasitarios de larga acción, es la permanencia de los fármacos en los tejidos (Vercruysse y Dorny, 1999). Por otro lado, los antiparasitarios endectocidas tienen cierto efecto sobre el medio ambiente ya que son eliminados en su mayor parte como droga activa con la materia fecal y tienen una prolongada persistencia en el ambiente afectando, a muy bajas dosis, a los insectos que "atacan" la deposición fecal, retrasando la degradación de la misma (Herd, 1995, Iglesias et al., 2005). También es cierto que, la aplicación continua y prolongada de los antiparasitarios, con el objetivo de mantener a los animales libres de parásitos, obstaculizaría el desarrollo de una sólida respuesta inmune (Williams, 1997a: Vercruysse y Dorny, 1999). Del mismo modo, la utilización indiscriminada de los antihelmínticos provoca el desarrollo de resistencia antiparasitaria, como ha ocurrido en la Argentina con ovinos (Eddi et al., 1996), y más recientemente en bovinos (Anziani et al., 2000; Fiel et al., 2000; Fiel et al. 2001b).
Por lo enunciado, resulta ineludible integrar el conjunto de conocimientos disponibles, referido a medidas de manejo y epidemiología parasitaria, con el propósito de alcanzar un eficaz control parasitario con el menor número de tratamientos antihelmínticos.
4.1. Métodos de Control Parasitario
Si bien es cierto que se considera "al control de las parasitosis gastrointestinales como tecnología de bajo costo y alto impacto productivo", un considerable número de ganaderos ha tomado a su cargo el control parasitario tras un falso concepto de practicidad, simplificación y economía, prescindiendo de los profesionales veterinarios. Muchos de ellos, especialmente en sistemas de producción intensiva, se han inclinado por los "tratamientos antihelmínticos supresivos", que se aplican intensivamente durante todo el año, en la mayoría de los casos con una frecuencia mensual. El manejo irracional de antiparasitarios, especialmente cuando los niveles de contaminación e infectividad de las pasturas son bajos, se reconoce como la principal causa de resistencia antihelmíntica (Fiel y col, 2001ª)
Teniendo en cuenta el ciclo biológico, las variaciones de infectividad de las pasturas, las técnicas diagnósticas utilizadas, la interpretación epidemiológica y la finalidad de los tratamientos antiparasitarios se proponen diversos tipos de control parasitario
4.1.1. Tratamientos Antihelmínticos Basados en la Información Epidemiológica
♦ Tratamientos Antihelmínticos Estratégicos o Preventivos: orientados a prevenir la contaminación de las pasturas. Se basa en la aplicación de tratamientos antihelmínticos en los primeros meses de pastoreo, abarcando otoño e invierno, con una frecuencia necesaria que impida la postura de huevos por parte de las hembras. El intervalo entre los tratamientos se establece sobre la base del poder residual del producto utilizado, 2-3 días para benzimidazoles y 21-28 días para los endectocidas, sumado a los 21 días que tardan los parásitos hembras en iniciar la eliminación de huevos en materia fecal, (Steffan y Fiel, 1994; Stromberg y Averbeck, 1999). La resultante baja infectividad de las pasturas se extiende hacia primavera y verano disminuyendo el riesgo de la ostertagiasis Tipo II, pudiendo no ser necesaria la desparasitación de diciembre (Steffan y Fiel, 1994). Un efecto equivalente se logra con la utilización de bolos de liberación prolongada de antihelmíntico obteniendo una buena respuesta en la ganancia de peso (Costa y Roan, 1998).
Si bien este régimen reduce drásticamente la infectividad de las pasturas, ya en el primer año de implementación, debe necesariamente ser supervisado por un profesional que efectúe los ajustes precisos para cumplir con el doble propósito de optimizar los resultados con el menor número de desparasitaciones (Descarga, 2001). Especialmente porque encierran, utilizados sin asesoramiento profesional, un alto riesgo de selección hacia la resistencia a antihelmínticos.
4.1.2. Tratamientos Antihelmínticos Basados en el Diagnóstico
♦ Tratamientos Antihelmínticos Tácticos: su principal objetivo es minimizar las pérdidas de producción causadas por el pastoreo sobre praderas con alta infectividad. Los tratamientos son aplicados según los resultados de los conteos de H.p.g., y/o larvas infestantes en la pastura y/o diferencia en la ganancia de peso; junto a la información epidemiológica local. El conteo de H.p.g. en materia fecal es una herramienta sencilla y económica para el diagnóstico de helmintiasis aunque tiene ciertas limitaciones para la detección temprana del efecto parasitario subclínico de las gastroenteritis parasitarias. La ausencia de un determinado conteo que establezca la necesidad de desparasitar se debe a que, si bien en animales menores de un año la correlación con la carga parasitaria es buena (0.70), hay una amplia variación dada por los diferentes niveles nutricionales, el tipo de forraje, los niveles de exposición previa, las razas, el sexo, etc. Por lo tanto, se hace necesario la utilización de otras técnicas diagnósticas complementarias que permitan detectar tempranamente el "efecto parásito" (Fiel et al., 1998). El conteo de larvas infectantes en el pasto es de gran ayuda para estimar el riesgo al que estarán expuestos los animales, colaborando en la determinación de la aplicación del tratamiento antiparasitario cuando los datos de H.p.g. no son muy concluyentes. Se considera que conteos por encima de las 500 larvas/Kg. de pasto seco son suficientes como para que se afecte la ganancia de peso vivo (Entrocasso, 1989; Fiel et al., 1998). También ha demostrado gran utilidad en la detección temprana de las pérdidas subclínicas la medición de la diferencia de ganancia de peso de un grupo desparasitado mensualmente con respecto al resto del rodeo, ya que muchas veces pueden estar ocurriendo pérdidas de peso con niveles de h.p.g. bajos (Entrocasso, 1989; Fernández et al., 1994; Steffan y Fiel, 1994). Este método se basa en una pesada mensual a dos grupos de animales uno desparasitado mensualmente y otro que representa al resto del rodeo. Cuando la diferencia de los promedios de peso entre grupos sea del orden del 10-15% o mayor a 2-3 kg., se realiza el tratamiento antiparasitario al lote rodeo y al resto de los animales que pastorean el mismo potrero. Este sistema reduce el uso de los antiparasitarios minimizando las perdidas de producción; pudiendo alcanzarse similar ganancia de peso que con animales desparasitados mensualmente (Fernández et al., 1992; 1994; Costa y Peluffo, 1999).
4.1.3. Métodos que Combinan Tratamientos Antiparasitarios con Medidas de Manejo
♦ Programa Integrado de Control Parasitario: combina la aplicación de tratamientos antihelmínticos, tácticos o estratégicos, con medidas de manejo que permitan brindar a los animales pasturas poco contaminadas (Steffan y Fiel, 1994;. Williams, 1997a). Para lograr un buen control parasitario es necesario ordenar los distintos tipos de forrajes o pasturas según el nivel de riesgo parasitario, clasificándolas como:
- Pasturas de alto riesgo: generalmente son pasturas viejas o pastizales naturales donde pastorearon categorías jóvenes (recríainvernada) con altas cargas de parásitos o con presentación de casos clínicos.
- Pasturas de riesgo medio: son pasturas nuevas bien manejadas que presentan una infectividad relativamente baja, como las que han sido pastoreadas por animales adultos o animales jóvenes con un buen plan de control.
- Pasturas de bajo riesgo: casi no presentan larvas, son las que usualmente provienen de laboreos de la tierra como son los verdeos o rastrojos (Steffan y Fiel, 1994;. Williams, 1997a; Stromberg y Averbeck, 1999).
Para conseguir la disminución de la infectividad de las pasturas hay varios mecanismos, algunos de ellos son:
• El descanso de las pasturas permite reducir en gran medida la cantidad de larvas aunque esa reducción nunca llega a cero y es necesario un prolongado período de tiempo para que sea efectivo (Stromberg y Averbeck, 1999; Vercruysse y Dorny, 1999). En nuestro país se propone aprovechar las condiciones climáticas de veranos tórridos que, sumado a laboreos que logren reducir la cobertura del forraje (cortes destinados a reservas), producen una gran mortandad de larvas libres en la pastura (Entrocasso, 1989; Steffan y Fiel, 1994).• Desparasitar a los animales antes de ser ingresados a pasturas nuevas, de bajo riesgo, verdeos y/ o rastrojos que todavía no han sido pastoreados (Steffan y Fiel, 1994; Stromberg y Averbeck, 1999).• El pastoreo alternado con distintas especies esta basado en que la transmisión cruzada de los parásitos entre distintas especies es tan restringida que permite la eliminación de la mayoría de los géneros parasitarios; lo habitual es alternar bovinos con ovinos (Entrocasso, 1989; Steffan y Fiel, 1994; Stromberg y Averbeck, 1999; Waller, 1999).• El pastoreo alternado con animales de la misma especie pero de diferente edad. Utilizando a los animales adultos para que, como consecuencia de su inmunidad, disminuyan la contaminación e infectividad de las praderas (Entrocasso, 1989; Steffan y Fiel, 1994; Stromberg y Averbeck, 1999; Williams, 1997a).
Los programas integrados de control encuentran en las explotaciones agrícolo-ganaderas el mayor número de alternativas para brindarles a los animales forrajes con baja carga de larvas infectantes, debido a la variedad de rastrojos, verdeos y pasturas (Steffan y Fiel, 1994).
5. Resistencia a los antihelmínticos
El desarrollo de resistencia a los antihelmínticos por los nematodes que parasitan a los bovinos parece estar incrementándose rápidamente.
Si bien desde hace unas décadas, en muchas partes del mundo incluido nuestro país, los nematodes de pequeños rumiantes han desarrollado resistencia a los antihelmínticos disponibles (Waller, 2003), la resistencia antihelmíntica en bovinos fue considerada durante mucho tiempo como un fenómeno de presentación muy esporádica. Aunque la situación parece ser diferente en algunos países de Oceanía, Europa y América del Sur. En el primero de estos continentes, la mayoría de los casos de campo documentados hasta el presente corresponden a Nueva Zelanda en donde se ha detectado resistencia a los benzimidazoles y a las avermectinas (Mc Kenna 1991, 1996 a; Jackson et al, 1995; Hosking et al, 1996).
En Europa, los dos primeros casos de resistencia a las avermectinas han sido descriptos en el Reino Unido (Stafford & Coles, 1999 ; Coles et al, 2001) e involucran también a especies del género Cooperia.
Con respecto a Sudamérica, la resistencia de los nematodes bovinos a los antihelmínticos ha sido informada en Brasil, Argentina y recientemente en el Uruguay.
En Brasil, el primer hallazgo de resistencia a los benzimidazoles por nematodes del género Haemonchus fue comunicado en 1990 (Pinheiro & Echevarria, 1990). En el 2001, Paiva et al informaron sobre la presencia de resistencia a la ivermectina por Haemonchus placei y Cooperia punctata. Asimismo, informes del 2001 en el sur de ese país indicaban que estos fenómenos podrían estar difundidos, especialmente en lo referente a la resistencia del género Cooperia a las avermectinas (Echevarría & Pinheiro, 2001). En concordancia con estas observaciones se encuentran los recientes hallazgos en el área de San Pablo indicando que poblaciones de Cooperia spp y Haemonchus spp resistentes a las ivermectinas pueden ser comunes en esta región (Soutello et al, 2003).
En Uruguay, se han detectado al menos dos casos de resistencia del género Cooperia a las lactonas macrocíclicas (Salles, 2004. Lorenzelli y Macchi 2004).
Situación en la Argentina
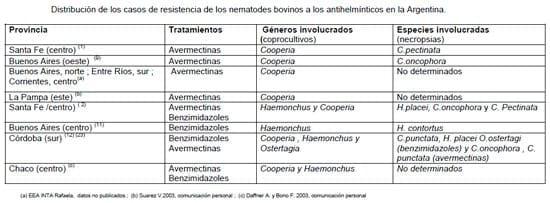
En nuestro país, los primeros hallazgos de nematodes bovinos resistentes a los antihelmínticos fueron informados en forma casi simultánea durante el segundo semestre del 2000 en las provincias de Santa Fe y Buenos Aires (Anziani et al, 2001 ; Fiel et al, 2001a). En ambas oportunidades, los antiparasitarios pertenecían a la familia de las avermectinas (ivermectina y doramectina) y el género involucrado fue Cooperia con las especies C. pectinata y C. oncophora en el primero y en el segundo de los casos, respectivamente. Desde entonces nuevos casos de resistencia de este género a las avermectinas fueron observados en las provincias de Buenos Aires, Entre Ríos, Santa Fe , Córdoba (EEA INTA Rafaela, datos no publicados) y La Pampa (Suarez V., comunicación personal). Así mismo, evidencias circunstanciales obtenidas en la provincia de Buenos Aires indicarían que la resistencia del género Cooperia a las avermectinas podría tener una mayor difusión a la actualmente documentada (Mejia, 2001). Información reciente obtenida en las provincias de Córdoba (Mejía et al, 2003, Fiel et al, 2005 ) y Santa Fe (Anziani et al, 2003) amplían el espectro de la resistencia de Cooperia a los benzimidazoles orales e inyectables.
Lamentablemente, otros géneros de nematodes de mayor patogenicidad han evidenciado resistencia a los antihelmínticos en la Argentina. En el 2003 se informó sobre la presencia de Haemonchus y Ostertagia resistentes a los benzimidazoles (Mejia et al, 2003) en el sur de Córdoba mientras que en el centro de Santa Fe se detectó un aislamiento del primero de estos géneros con resistencia no solo a estas drogas sino también a las avermectinas (Anziani et al, 2003). Este mismo año se observó en un establecimiento de la provincia de Buenos Aires la coexistencia de aislamientos de Haemonchus contortus resistentes a los benzimidazoles en ovinos y bovinos produciendo sintomatología clínica (retraso y agitación en el arreo) en esta última especie (Fiel et al, 2005). Esta información enfatiza la posibilidad de que ambas especies de rumiantes hospeden la misma especie de nematode resistente, estableciendo una limitante a la alternativa de pastoreo mixto (ovino-bovino) para el control de éste género parasitario, al menos en la situación planteada anteriormente.
En la siguiente tabla se sintetiza la información de casos de resistencia de los nematodes bovinos a los benzimidazoles y lactonas macrocíclicas, que han sido publicados, son investigaciones aún en desarrollo o provienen de informantes calificados desde su aparición en el año 2000 en la Argentina.
Importancia productiva de la resistencia antihelmíntica en bovinos:
Debido a lo reciente del problema y a los escasos antecedentes disponibles, no existe aún una cuantificación del impacto productivo de estos fenómenos de resistencia en los bovinos. Probablemente, la resistencia en esta especie se encuentre mucho más difundida de lo que se supone en aquellos establecimientos que utilizan excesiva e indiscriminadamente los principios activos. El desarrollo en los bovinos de una sólida respuesta inmune alrededor del año de vida, constituye una diferencia radical con los ovinos, ya que disminuye drásticamente los conteos de H.p.g. en materia fecal dificultando la detección de la resistencia antihelmíntica. Así mismo, la relativamente baja patogenicidad del género Cooperia, y la ausencia de indicadores clínicos precisos que lleven a sospechar de la falla del tratamiento antiparasitario, pueden influir también para subestimar el problema. Por ejemplo, los dos primeros casos registrados en la Argentina con este género respondieron a hallazgos casuales, como parte de la rutina diagnóstica de otras patologías. Finalmente, la práctica de evaluar el desempeño de los productos antiparasitarios a través del Hpg post-tratamiento está muy poco difundida, por lo que las posibilidades de nuevos hallazgos se mantienen en el terreno de lo azaroso. En tal sentido, hace unos cuatro años decíamos que, "en estas condiciones, parece difícil lograr que ganaderos y profesionales asuman masivamente la resistencia antihelmíntica como "un problema productivo". Claro está que la situación sería distinta si en lugar de los géneros parasitarios intestinales fueran los abomasales, y de mayor patogenicidad los que desarrollen resistencia. En tales circunstancias, y nadie puede asegurar que no ocurrirá, el problema adquiriría dimensiones y gravedad extrema, convirtiéndose en un serio problema productivo". (Fiel y Saumell, 2002)
De hecho, lamentablemente, así fue y hoy confirmamos que la situación es completamente diferente cuando participan los géneros parasitarios abomasales de mayor patogenicidad (Haemonchus y Ostertagia) con los cuales la resistencia antihelmíntica no solo presenta una profusa sintomatología clínica sino también cursa con elevada mortalidad. A modo de ejemplo en uno de los casos recientemente detectado en un establecimiento con sistemas de invernadas intensivas se produjeron, en un período de 20 días, 140 muertes atribuibles a estos nematodes resistentes sobre un total de 4500 novillitos (Fiel et. al, 2005).
Consideraciones sobre algunos factores que influencian el desarrollo de la resistencia.
Aparentemente, entre la multiplicidad de posibles causas, los dos factores de manejo que mayor influencia tendrían en la selección de genes resistentes en nematodes de los bovinos son la frecuencia de los tratamientos y la proporción de parásitos en refugio (Coles 2002 a y b). Por su practicidad y eficacia, se ha observado en la última década un uso generalizado de lactonas macrocíclicas para el control no solo de nematodes pero también de parásitos externos como dípteros productores de miasis, ácaros de sarna y garrapatas. En este mismo período el segundo grupo químico utilizado ha sido el de los benzimidazoles (Suarez, 2002). La aparición de genéricos en ambos grupos impulsó una disminución en el precio relativo de estos insumos y un aumento de aplicación sobre los bovinos, muchas veces en forma innecesaria, dando como resultado una mayor presión de selección sobre las poblaciones parasitarias. Es probable que si se continúa con el uso excesivo de antiparasitarios en los bovinos, la resistencia de los nematodes se desarrollará y extenderá en esta especie en una forma similar a lo ocurrido en los ovinos de nuestro país. Por otra parte, la tecnología no química disponible actualmente no puede sustituir a los antiparasitarios y en la industria farmacéutica no se avizora la aparición en el futuro cercano de nuevos tipos de antihelmínticos para el control de nematodes en rumiantes (Waller, 2003). En este contexto, es imprescindible la aplicación racional de las drogas actualmente en uso para mantener su eficacia y vida útil, integrando la aplicación de las mismas con alternativas no químicas de manejo tendientes al control integrado y a un balance entre productividad y sustentabilidad.
A la proporción de parásitos que no se encuentra sujeta a selección por los tratamientos químicos, se la denomina población en refugio y aparentemente este es el otro factor importante en el desarrollo de la resistencia a los antihelmínticos (van Wyk, 2001 ; Coles 2002 b). Considerando a los nematodes gastrointestinales, cuando mayor es la proporción de la población que se encuentra en las pasturas (refugio), menor es la selección por resistencia (Sangster, 2001). El incremento de la población de nematodes en refugio podría constituir un aspecto fundamental en el manejo de la resistencia y la posibilidad de diluir los genes resistentes por la introducción de nematodes susceptibles aparece como una interesante alternativa que amerita ser investigada, especialmente en bovinos donde es habitual la trashumancia de terneros de destete hacia campos de invernada.
En la Argentina, los casos de resistencia antihelmíntica documentados hasta el presente pertenecen a sistemas de producción de carne, mayoritariamente invernadas, con tratamientos antiparasitarios frecuentes de todas las categorías de bovinos durante los últimos 4 o 5 años. Una situación extrema se observó en un establecimiento dedicado al engorde intensivo de terneros sometidos a un programa de control, implementado durante los últimos cinco años, basados en 13 desparasitaciones anuales con el objetivo de interrumpir el período prepatente y tendiente a "eliminar" la carga de larvas en las pasturas (Fiel et al., 2005).
Otra práctica de manejo común en estos establecimientos ha sido el uso de una misma pastura por al menos tres o cuatro años consecutivos. Bajo estas condiciones, es altamente probable que la gran mayoría de los huevos que pueden desarrollarse en estas pasturas provengan únicamente de parásitos que sobrevivieron a los tratamientos (resistentes). De esta manera las poblaciones en refugio resultan prácticamente negligibles y podrían explicar, al menos parcialmente, los altos niveles de resistencia observados en algunos de estos establecimientos.
El análisis de los diferentes casos de resistencia antihelmíntica a las lactonas macrocíclicas muestra cierta tendencia en sentido de que la aparición de resistencia al género Cooperia parece anteceder a la de los géneros abomasales. Tal elucubración adquiere cierto grado de credibilidad si asumimos que el citado género es, junto a Nematodirus, sobre el cual evidencian menor eficacia en pruebas originales de desarrollo (Benz et al, 1989). En consecuencia resulta lógico, en cierta forma, esperar el desarrollo temprano de resistencia antihelmíntica en estos géneros. En el caso de Nematodirus, podría esperarse la aparición de resistencia especialmente en explotaciones tamberas, y en categorías muy jóvenes (recría 1) donde éste género adquiere cierta relevancia.
En tal sentido, la posterior "escalada" de la resistencia a los géneros abomasales dependerá de la continuidad en la utilización abusiva del antihelmíntico y/o la ausencia de un diagnóstico apropiado. De ser así, ante el riesgo de instalar definitivamente un grave problema de resistencia antihelmíntica, podríamos considerar a la etapa de resistencia del género Cooperia, como "la última oportunidad" de iniciar, sobre la base de un buen diagnóstico, la utilización racional de los antihelmínticos.
Consideraciones sobre los métodos para la detección de resistencia
El método más confiable para detectar la resistencia a los antihelmínticos es el test in vivo conocido como "eficacia controlada" (Presidente, 1985) el cual compara el número de nematodes adultos obtenidos a la necropsia en animales tratados y controles. Por su alto costo económico, este método se encuentra prácticamente restringido a trabajos muy específicos de investigación, limitando su aplicación en situaciones de campo. Así mismo, los test in Vitro actualmente disponibles, basados en la motilidad de las larvas o en la eclosión de huevos, presenta aún inconsistencias en la interpretación de los resultados y requiere del mantenimiento de cepas de referencia susceptibles y resistentes, condicionando por el momento su uso. Por ello, el método más utilizado en todo el mundo para detectar resistencia de los nematodes sigue siendo el test de la reducción del conteo de huevos (TRCH) el cual compara los valores del H.p.g. antes y luego del tratamiento (Presidente, 1985; Taylor et al, 2002). En forma complementaria, este test requiere del cultivo de larvas en las muestras pre y post tratamiento para determinar la participación relativa de cada género parasitario (McKenna, 1996 b). El TRCH puede ser utilizado en todas las especies de animales domésticas y las recomendaciones e información general para su empleo fueron realizadas por la Asociación Mundial para el Desarrollo de la Parasitología Veterinaria -W.A.A.V.P-. (Coles et al, 1992). En rumiantes, los resultados del test deben ser considerados solo una estimación de la eficacia antihelmíntica debido a que la postura de huevos por los nematodes no siempre guarda una estrecha correlación con la carga parasitaria (Suárez 1994). En este contexto, el test podría mostrar mayor eficiencia con géneros que tienen un alto potencial biótico y / o con buena correlación entre el número de huevos y el de nematodes como por ejemplo Haemonchus, pero podría ser menor cuando se considera al género Ostertagia. Otra de la limitantes del test es su baja sensibilidad ya que solo permitiría detectar resistencia cuando la frecuencia de genes resistentes en una población excede el 25 % y ya se podrían observar fallas clínicas al tratamiento (Martin et al, 1989 ; Sangster 2001).
En nuestro país y ante la presencia de los primeros casos de resistencia en bovinos, se realizó una actualización de dicho test describiendo los requerimientos específicos para su empleo en esta especie y asociando la presencia de resistencia a porcentajes de reducción en el H.p.g. inferiores al 90 % e indicando un período de 14-15 días para la toma de muestras luego del tratamiento antihelmíntico (Fiel et al 2001b). No obstante, y debido a que el TRCH estima los efectos del tratamiento sobre la postura de huevos por los nematodes adultos, el período de espera para la toma de muestras luego del tratamiento debería adaptarse al grupo químico utilizado para evitar la posibilidad de errores en su interpretación. Así por ejemplo, estudios posteriores a las primeras recomendaciones sobre el TRCH en bovinos realizados en nuestro país, muestran que en terneros inoculados con un aislamiento de C. pectinata y tratados con lactonas macrocíclicas, las reducciones del h.p.g. podrían ser consideradas como susceptibles o resistentes de acuerdo al día en que se toma la muestra post tratamiento. Se observaron generalmente mayores valores del h.p.g. cuando las determinaciones se realizaron en el día 20 que en el día 12 luego del tratamiento. En este contexto, cuando se utilicen endectocidas las evaluaciones post tratamiento deberían demorarse preferentemente hasta los día 18 a 20 para aumentar la especificidad del método y evitar la posibilidad de falsos negativos. Observaciones similares fueron descriptas previamente en ovinos y caprinos inoculados con cepas resistentes de Teladorsagia circumcincta y se deberían a la inhibición temporaria de la oviposición producida durante las primeras dos semanas post tratamiento con avermectinas, la cual se restablecería parcialmente luego de este período (Jackson, 1993). Por el contrario cuando se emplean antiparasitarios en base a levamisoles, debe considerarse que estas drogas normalmente pueden presentar actividad incompleta contra estadios inmaduros de ciertos nematodos (especialmente Ostertagia), aún cuando se trate de cepas susceptibles (McKellar et al, 1988). De este modo la utilización de períodos mayores a los 7 días puede dar lugar a la maduración y oviposición de los estadios inmaduros susceptibles resultando en falsos positivos en el TRCH (Grimshaw et al, 1996).
En consecuencia, debería considerarse la posibilidad de realizar 3 muestreos de materia fecal en el TRCH, uno el día inicial, otro a los 7 días postratamiento (PT) y el restante a los 19 días PT, abarcando así a los 3 grupos de antihelmínticos de amplio espectro (Imidazothiazoles (levamisoles), Benzimidazoles y Lactonas macrocíclicas).
Algunas recomendaciones que podrían retrasar la presentación de resistencia antihelmíntica.
1. Abandonar definitivamente el concepto de "riesgo cero" y las desparasitaciones empíricas y/o oportunistas tales como "sistemáticas", "mensuales", "supresivas", etc.
2. Evitar los tratamientos antihelmínticos cuando las poblaciones "en refugio" son bajas (ej. Verano). Esta afirmación establece cierto grado de incertidumbre acerca de la validez de desparasitar antes de ingresar a "pasturas limpias".
3. Realizar el TRCH al menos una vez al año en establecientos ganaderos con recría de "propia producción" y en lo posible dos veces al año en aquellos que "acopian" terneros de destete.
4. Aparece como una alternativa práctica "volver" a chequear con H.p.g. cada tratamiento antihelmíntico, a los 7 días si se trata de Levamisole y benzimidazoles, y a los 20 días si se trata de lactonas macrocíclicas. Teniendo en cuenta que no hay antihelmíntico 100% eficaz y se deben aceptar algunos bajos conteos postratamiento. En caso de obtener algunos conteos individuales medianamente altos (por encima de 100 H.p.g.) sería recomiendable la realización del TRCH chequeando los 3 grupos químicos de amplio espectro.
5. Emplear alternativas de manejo tendientes a reducir el uso excesivo y establecer una adecuada rotación de antihelmínticos apuntando al control integrado de parásitos (Nari, 2003)
6. Aunque muy poco se sabe del mecanismo íntimo de la resistencia antihelmíntica en bovinos, y por lo tanto cualquier recomendación presupone un importante riesgo de fracaso, resulta "tentador" establecer "un intervalo mínimo" entre tratamientos; destinado a ejercer una baja selección de capas resistentes, sobre la base de: -la duración del ciclo parasitario, -el tiempo mínimo de exposición compatible con aspectos productivos y -la persistencia de la acción antihelmíntica del antiparasitario.
Bibliografía
1. Anderson, N. 1965. Inhibited development of Ostertagia ostertagi, En: Armour, J. 1980. The epidemiology of helminth disease in farm animals. 1980. Vet. Parasitol. 6:7-46.
2. Anziani, O.; Zimmermann, G.; Guglielmone, A.; Vázquez, R. y Suárez, V. 2000. Resistencia a las ivermectinas de bovinos parasitados por Cooperia spp. Comunicación Preliminar. Vet. Arg. 164, 280-281.
3. Anziani, O.S; Fiel, C,A. (2004) Estado actual de la resistencia antihelmíntica (nematodes gastrointestinales de la Argentina. Vet. Arg, 21 (202): 122-133.
4. Anziani O.S., Guglielmone A.A., Zimmermann G., Vazquez R. & Suarez V.R. (2001). Avermectin resistance to Cooperia pectinata in cattle in Argentina. Vet. Rec. 149: 58-59.
5. Anziani O.S., Suarez V., Guglielmone A.A., Wanker O., Grande H. & Coles G. (2004). Resistance to benzimidazole and avermectin anthelmintics in cattle nematodes in Argentina. Vet. Parasitol. 122: 303-306.
6. Armour, J. 1980. The epidemiology of helminth disease in farm animals. 1980. Vet. Parasitol. 6:7-46.
7. Armour, J. and Duncan, M. 1987. Arrested larval development in cattle nematodes. Parasitol. Today, Vol. 3, 6: 171-176.
8. Barger, I. A., Lewis, R. J. and Brown, G. F. 1984. Survival of infective larvae of nematode parasites of cattle during drought. Vet. Parasitol. 14:143-152.
9. Benz, G.W., Roncalli, R.A. Gross, S.J. (1989). Use of Ivermectin in cattle, Sheep, Goats and Swine, Ivermectin and Abamectin, Merck Institute for Therapeutic Research, USA, W.C. Campbell editor, Chapter 15, pp. 215-229.
10. Berdie, J. et al. 1988. Epidemiological study on gastrointestinal parasites of beef cattle in Uruguay. Proceeding of the final research coordination meeting on the use of parasitic diseases of farm animal. International Atomic Energy Agency. Vienna. pp: 95-105.
11. Biondani, C. A. y Steffan, P. E. 1988. Efecto de las parasitosis gastrointestinales sobre la producción láctea en rodeos lecheros. Vet. Arg. Vol. V, 42:115-127.
12. Borgsteede, F.H.M. and Eysker, M. 1987. Strains of cattle parasites in the Netherlands with different propensities for inhibited development. Vet. Parasitol. 24:93-101.
13. Bulman, G. 1987. Experiencias sobre el control de parásitos en los bovinos, en el nordeste argentino. Bradford, 10:1-8.
14. Bulman, G. M.; Ihde, A. J. 1985. El control de parásitos en el tambo: Una revisión. Therios Vol. 5, 25:376-381.
15. Coles G.C., Bauer C., Borgsteede F.H., Geerts S., Klei T.R., Taylor M..A. & Waller P.J. (1992) World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) methods for the detection of anthelmintic resistance in nematodes of veterinary importance. Vet. Parasitol. 44, 35- 44
16. Coles G.C., Watson C.L. & Anziani O.S. (2001). Ivermectin resistance Cooperia in cattle. Vet. Rec. 148: 283-284.
17. Coles G.C. 2002 a. The sustainable use of anthelmintics in grazing animals. Vet. Rec. 151: 165-9.
18. Coles G.C. (2002 b). Cattle nematodes resistant to anthelmintics. Why so few cases ? Vet. Res. 33 : 481-489.
19. Corwin, R. M. 1997. Economics of gastrointestinal parasitism of cattle. Vet. Parasitol. 72:451-460.
20. Costa, J. y Peluffo, L. 1999. Gastroenteritis verminosa en recría de tambo: observaciones surgidas de su vigilancia entre 1985 y 1993. Therios Vol. 28 Nº 149:199-208.
21. Costa, J. y Roan, P. 1998. Parásitos gastrointestinales en pastoreo racional voisin. Resultados del empleo de bolos de liberación continuada. Rev. Med. Vet. Vol. 78 Nº 6:397-400.
22. Daffner, A. J.; Fiel, C. A.; Ambrústolo, R.R. and Bullman, G. M. 1990. Epidemiology of nematode parasitism in young cattle in the northeastern region of Argentina (Santa Fe province). In: Guerrero, J.; Leaning, W. H. D.; (Eds.), Proc. Symp. Epidemiology of Bovine nematode Parasites in the Americas, in association with XVI World Buiatrics Congress, Salvador-Bahia, Brasil, pp. 15-24.
23. De Bustos, J. Y Herrera, A. 1973. Primera información sobre parasitismo gastrointestinal en terneros de tambo del Valle de Lerma (Salta). Revista de Investigaciones Agropecuarias, INTA. Serie 4, 10(1):1-8.
24. Descarga, C., O. 2001. Efectos epidemiológicos y productivos de una estrategia antihelmíntica durante tres ciclos de invernada pastoril. Rev. Med. Vet. 82 (3): 139-150.
25. Descarga, C. O.; Kloster, A. M.; Davies, P. y Magnasco, R. 1988. Epizootiología y efecto de la parasitosis gastrointestinal sobre la ganancia de peso en vaquillonas de recría Holando Argentino. VI Congreso Argentino de Veterinaria.
26. Descarga, C. O.; Kloster, A. M.; Davies, P. y Marinelli, R. 1994. Parasitismo gastrointestinal en novillos en el sudoeste de la provincia de Córdoba. Rev. Arg. Prod. Anim. Vol. 14 3- 4: 227-236.
27. Echevarria F. & Pinheiro A. (2001). Efficiency of anthelmintics in cattle. 18 th International Conference of the or the World Association for the Advancement of Veterinary Parasitology. 26-30 August, Stressa, Italy. Abst.N18
28. Eddi, C.; Caracostantogolo, J.; Peña, M.; Shapiro, J.; Marangunich, L.; Waller, P.J.; and Hansen, J.W. 1996. The prevalence of antihelmintic resistance in nematodes parasites in sheep in southern Latin America: Argentina. Vet. Parasitol. 62:189-197.
29. Eddi, C.; Ivancovich, J.; Gómez, B; Toledo, H.; Niec, R.; Luciani, C.; Lukovich, R.; Balbuena, O.; Russo, A. y Bonazzi, E. 1981. Parasitismo gastrointestinal de los bovinos en el centro este de la provincia de Formosa (Rep. Arg.) II Evaluación de un tratamiento estratégico. Rev. de Investig. Agropecuarias, INTA. Serie 4,16(2):291-301.
30. Entrocasso, C. 1988. Epidemiology and control of bovine ostertagiasis in South America. Vet. Parasitol. 27:59-65.
31. Entrocasso, C. 1989. Control de la gastroenteritis verminosa en zona templada de la provincia de Buenos Aires. Charla de las Segundas Jornadas de Extensión Ganadera organizadas por veterinaria Pergamino (Pergamino, 2/6/1989).
32. Entrocasso, C. 1994. Fisiopatología del parasitismo gastroentérico, en: Nari, A. y Fiel, C. A. (Eds.), Enfermedades parasitarias de importancia económica en bovinos. Bases epidemiológicas para su prevención y control, Hemisferio Sur (R.O.U.), pp. 95-114.
33. Entrocasso, C. y Steffan, P. E. 1980. Parasitosis gastrointestinal en bovinos. Rev. Arg. Prod. Anim. Vol. I, 4:274-286.
34. Eysker, M. 1997. Some aspects of inhibited development of trichostrongylids in ruminants. Vet. Parasitol. 72:265-283.
35. Fernández, A.S.; Fiel, C.A.; Rodriguez, E. M.; Fusé, L. A., Sominson, P. y Cattoni, P.V. 1992. Parásitos internos en vaquillonas lecheras de recría I. Efecto sobre la ganancia de peso. II. Metodología de control. III. Estudio epidemiológico. Vet. Arg. Vol. IX, 87:473-485.
36. Fernández, A.S.; Fiel, C.A., Rodriguez, E. M.; Sominson, P. y Fusé, L. A. 1994. Endoparasitosis en vaquillonas lecheras de recría. Su epidemiología y control. Vet. Arg. Vol. XI. Nº 106:374-389.
37. Fernández, A.S.; Fiel, C.A. and Steffan P.E. 1999. Study on the inductive factors of hypobiosis of Ostertagia ostertagi in cattle. Vet. Parasitol. 81:295-307.
38. Fiel, C. A.; Anziani, O.; Suárez, V.; Vázquez, R.; Eddi, C.; Romero, J.; Caracostantogolo, J.; C. Saumell, C.; Mejía, M.; Costa, J. y Steffan, P. 2001a. Resistencia antihelmíntica en bovinos: causas, diagnóstico y profilaxis. Vet. Arg. Vol. XVIII, 171:21-33.
39. Fiel, C.A; Figueroa; M; Ercoli, S; Rodríguez, E; Steffan,P; Pereira, C; Pachiani, R. (2003) Respuesta al tratamiento antiparasitario de diciembre como preventivo d la ostertagiasis tipo 2 en novillitos y vaquillonas. Rev. Med. Vet. 8: 48-52
40. Fiel, C. A.; Saumell, C. A.; Steffan, P. A.; Rodriguez, E. M.; Salaberry, G. 2000. Resistencia de los nematodes trichostrongylideos -Cooperia y Trichostrongylus- a tratamientos con avermectinas en bovinos de la Pampa Húmeda, Argentina. Rev. Med. Vet. Vol. 81, 4:310-315.
41. Fiel, C. A.; Saumell, C. A.; Steffan, P. A. and Rodriguez, E. M. 2001b. Resistance of Cooperia to ivermectin treatments in grazing cattle of the Humid Pampa, Argentina. Vet. Parasitol. 97:211-217.
42. Fiel, C. A. y Steffan, P. 1994b. Epidemiología de los nematodes gastrointestinales en la Pampa Húmeda, en: Nari, A. y Fiel, C. A. (Eds.), Enfermedades parasitarias de importancia económica en bovinos. Bases epidemiológicas para su prevención y control, Hemisferio Sur (R.O.U.), pp. 67-94.
43. Fiel, C. A.; Steffan, P. E.; Almada, A.; Ambrústolo, R. R.; Entrocasso, C. M. and Bulman, G. M. 1990. Epidemiology of trichostrongyle infection in grazing cattle of the Humid Pampa (Argentina) with special reference to Ostertagia ostertagi. In: Guerrero, J.; Leaning, W. H. D.; (Eds.), Proc. Symp. Epidemiology of Bovine nematode Parasites in the Americas, in asociation with XVI World Buiatrics Congress, Salvador- Bahia, Brasil, pp. 15-24.
44. Fiel, C. A.; Steffan, P. E.; Ferreyra, D. A. 1998. Manual para el diagnóstico de nematodes bovinos. Ed. División Sanidad Animal, Bayer Argentina S.A.
45. Fiel, C. A.; Steffan, P. E.; Vercesi, H. M.; Ambrústolo, R. R.; Catania, P.; Casaro, A. P.; Entrocasso, C. M. y Biondani, C. A. 1988. Variación estacional del parasitismo interno de bovinos en el sudeste de la Prov. de Buenos Aires (Argentina) con especial referencia al fenómeno de hipobiosis. Rev. Med. Vet. Vol. 69: 1:57-64.
46. Fiel, C.A; Saumell, C.A. (2002) Resistencia antihelmíntica en bovinos. En: Resistencia genética del ovino y su aplicación en sistemas de control integrado de parásitos. Ed: Castells, D. FAO animal production and health paper: 67-72.
47. Fiel, C.A., Saumell, C.A., Fusé, L.A., Seguí, R., Freije, E., Steffan, P.E., Iglesias, L.E. Resistencia antihelmíntica en bovinos. Dos escenarios diferentes como resultado de: 1) el sistema de manejo y 2) la excesiva frecuencia de tratamientos antiparasitarios. En: Resistencia a los antiparasitarios en Argentina. FAO, (2005) 53-59, Roma, Italia.
48. Garriz, C. A.; Gallinger, M. .M.; Touraille, C.; Steffan, P. E.; Fiel, C. A.; Ambrústolo, R. R.; Biondani, C. A.; Zamoranos, M. and Bulman, G. M. 1987. Gastrointestinal parasitism: Its effects on muscle, fat and bone composition of the carcase and organoleptic characteristics of meat. In the economic impact of parasitism in cattle. Eds. W. H. D. Leaning and J. Guerrero. Proceedings of the MSD AGVET Symposium, Montreal, Canada. Pp 59-68.
49. Grimshaw W.T.R., Hong C.& Hunt K.R. (1996). Potential for misinterpretation of the faecal egg count reduction test for levamisole resistance in gastriointestinal nematode of sheep. Vet. Parasitol. 62: 267-273
50. Hamilton A.S., Mason P. & Coles G.C. (2001). Anthelminticresistant Cooperia species in cattle.Vet. Rec. 149: 719-720.
51. Herd, R. 1995. Endectocidal Drugs: Ecological risks and counter-measures. Int J. Parasitol. 25:875-885.
52. Hosking B.C., Watson T.G.& Leathwick D.M. (1996) Multigeneric resistance to oxfendazole by nematodes. Vet. Rec. 13: 67-68
53. Iglesias, L.E.; Saumell, C.A.; Fusé, L.A. ; Lifchitz, A.L. ; Rodriguez, E.M. ; Steffan, P.E. ; Fiel, C.A. Impacto ambiental de la ivermectina eliminada por bovinos tratados en otoño, sobre la coprofauna y la degradación de la materia fecal en pasturas (Tandil, Argentina), Revista de Investigaciones agropecuarias, 34: 83-103.
54. Jackson F. (1993) Anthelmintic resistance – the state of play. Brit. Vet. Jour. 149: 123-138.
55. Jackson, R.A., Townsend, K.G., Pyke ,C. & Lance ,D.M. (1995) Isolation of oxfendazole resistant Cooperia oncophora in cattle. New Zealand Vet. Jour. 35, 187-189.
56. Le Richie, P.; Kühne, G. and Dwinger, R. 1982. An epidemiological study of helminthiasis in cattle in subtropical Argentina. Tropical animal Health Production 14:207-215.
57. Lombardero, O.; Moriena, R. y Schiffo, H. 1976. Epizootiología de la gastroenteritis verminosa bovina en la zona norte de la provincia de Corrientes. Gaceta Veterinaria, 38 (310): 143-169.
58. Lorenzelli, E; Macchi.I. (2004). Diagnóstico de resistencia antihelmíntica en bovines en el Uruguay. Jornadas de resistencia antihelmíntica en bovinos. Centro Médico de Durazno (ROU), 20 de agosto.
59. Martin, P.J,., Anderson, N. & Jarrett, R.G. (1989). Detecting benzimidazole resistance with faecal egg count reduction tests and in vitro assays. Aust. Vet . Jour. 66: 236-240.
60. McKellar, Q., Marriner, S. & Bogan, J. (1988). Comparison of ivermectin, oxfendazole and levamisole for use as anthelmintic during the periparturient period in sheep. Vet. Rec. 122: 558-560.
61. McKenna P.B. (1991) Resistance to benzimidazole anthelmintic in cattle in New Zealand. New Zealand Vet.Jour. 39, 154-155.
62. McKenna P.B. (1996 a) Anthelmintic resistance in cattle nematodes in New Zealand ; is it increasing ? New Zealand Vet. Jour. 44, 76.
63. McKenna P.B. (1996 b). Potential limitations of the undifferentiated faecal egg count reduction test for the detection of anthelmintic resistance in sheep. New Zealand Vet. Jour. 44: 73-75.
64. Mejia M. E. (2001). Bovine nematodes resistance to avermectins in Argentina. 18 th International Conference of the or the World Association for the Advancement of Veterinary Parasitology. 26-30 August, Stressa, Italy. Abst.N18
65. Mejia M. E., Fernández Igartúa B.M., Schmidt E.E. & Cabaret J. (2003). Multispecies and multiple anthelmintic resistance on cattle nematodes in a farm in Argentina : the begining of high resistance. Vet. Res. 34, 461-467.
66. Nari, H y Cardozo, H. 1986. Bases epidemiológicas para el control de nematodes gastrointestinales en rumiantes del Uruguay. XIV Jornadas Uruguayas de Buiatría. Paysandú, Uruguay. B.1 y B.3.
67. Nari, A y Risso, E. 1994. Epidemiología y control de nematodes gastrointestinales. en: Nari, A. y Fiel, C. A. (Eds.), Enfermedades parasitarias de importancia económica en bovinos. Bases epidemiológicas para su prevención y control, Hemisferio Sur (R.O.U.), pp. 155-201.
68. Nari, A. (2003) Resistencia a los antiparasitarios. Estado actual con énfasis en América Latina. FAO: Producción y sanidad animal Nº 157: 1-60.
69. Paiva F., Sato M.O., Acuña A.H., Jensen J.R. & Bressan M.C.R.V. (2001) Resistencia a ivermectina constatadas en Haemonchus placei e Cooperia punctata en bovinos. A Hora Veterinaria (Brasil) 20: 29-32.
70. Pinheiro, A.C; Ribeiro, J.B; Alves Branco, F.P. (1982) Epidemiología de helmintos de bovinos com bezerros traçadores na regioa de Bagé, R.S. XVIII Congresso Brasileiro de medicina veterinaria.: 29-35.
71. Pinheiro A.C. & Echevarria F.A.M. (1990). Susceptibilidade de Haemonchus spp en bovinos ao tratamiento antihelmíntico con albendazole e oxfendazole. Pesq. Vet. Bras. 10: 19-21.
72. Pinheiro, A.C. Evolución de las estrategias de control e impacto económico de los parásitos. (2002) Reunión de especialistas en parasitología veterinaria de Argentina, Brasil, Paraguay, Chile y Uruguay. Organizado por FAOF. C.Vet. UNICEN-AAPaVet. Tandil, 22-24 de mayo: 121-124
73. Presidente P.J.A. (1985). Methods for the detection of resistance to anthelmintics. In: Anderson, N., Waller, P.J. (Eds). Resistance in nematodes to Anthelmintic Drugs. Division of Animal Helath, CSIRO, Australia, pp 13 – 27.
74. Rossanigo, C.; Avila, J.; Vasquez, R.; Sager, R. y Poli, M. 1988. Estudios epizootiológicos del parasitismo gastrointestinal bovino en las provincias de San Luis y Córdoba (Argentina). Rev. Arg. Prod. Anim. Vol. 8, 3: 259- 269.
75. Salles, J; Rodríguez, M; Cardozo; N; Rizzo, E; Cardozo, H. (2004) Resistencia entihelmíntica en vacunos en uruguay: primera comunicación. Jornadas de Buiatría del Uruguay. Paysandú, R.O.U.
76. Sangster, N.C. (2001). Managing parasiticide resistance. Vet. Parasitol. 98: 89-109.
77. Smeal, M. G. and Donald, A. D. 1981. Effects on inhibition of development of the transfer of Ostertagia ostertagi between geographical regions of Australia. Parasitology 82:389-399.
78. Smeal, M. G. and Donald, A. D. 1982a. Inhibited development of Ostertagia ostertagi in relation to production systems for cattle. Parasitology 85:21-25.
79. Smeal, M. G. and Donald, A. D. 1982b. Inhibition of development of Ostertagia ostertagi- effect of temperature on the infective larval stage. Parasitology 85:27-32.
80. Smeal, M. G. and Donald, A. D. 1984. Inhibited development of Ostertagia ostertagi in Australia related to survival over summer in the host or on pasture. Parasitology 89:597-602.
81. Soutello R.V.G., Amarante A.M., & Zocoller-Seno M.C. (2003). The prevalence of anthelmintic resistance in nematode parasites of cattle in Sao Paulo state, Brazil. 19 th International Conference of the World Association for the Advancement of Veterinary Parasitology. 10-14 August, New Orleans, USA pp 257.
82. Stafford, K. & Coles, G.C. (1999). Nematode control practices and anthelmintic resistance in dairy calves in the south west of England. Vet. Rec. 144: 659-661.
83. Steffan, P. E. 1991. Efectos de la parasitosis gastrointestinal sobre la aptitud reproductiva de vaquillonas. VI Simposio Argentino de Producción Animal, AAPA, Tandil, Junio de 1991.
84. Steffan, P. E. y Fiel, C. A. 1986. Bioecología de los nematodes gastrointestinales de los bovinos. Rev. Arg. Prod. Anim. 6:139-140.
85. Steffan, P. E. y Fiel, C. A. 1994. Efectos en producción y control de nematodes gastrointestinales en bovinos, en: Nari, A. y Fiel, C. A. (Eds.), Enfermedades parasitarias de importancia económica en bovinos. Bases epidemiológicas para su prevención y control, Hemisferio Sur (R.O.U.), pp. 131-153.
86. Stromberg, B. E. 1997. Enviromental factors influencing transmission. Vet. Parasitol. 72:247-264.
87. Stromberg, B. E. and Averbeck, G. A. 1999. The role of parasite epidemiology in the management of grazing cattle. Int. J. Parasitol. 29:33-39.
88. Suárez, V. H. 1990a. Variación estacional de las poblaciones de helmintos parásitos de bovinos en sistemas de invernada, en la región semiárida y subhúmeda pampeana. Rev. Med. Vet. Vol. 71, 1:6-18.
89. Suárez, V. H. 1990b. Inhibition patterns and seasonal availability of nematodes for beef cattle grazing on Argentina's Western Pampas. Int. J. Parasitol. Vol. 20, 8:1031-1036.
90. Suárez, V. H. 1994. Epidemiología de los nematodes gastrointestinales en la región Subhúmeda y Semiárida Pampeana, en: Nari, A. y Fiel, C. A. (Eds.), Enfermedades parasitarias de importancia económica en bovinos. Bases epidemiológicas para su prevención y control, Hemisferio Sur (R.O.U.), pp. 95-114.
91. Suárez, V. H. and Bedotti, D. O. 1991. Effects of an integrated control programme with ivermectin on growth, carcase composition and nematode infection of beef cattle in Argentina's western pampas. Res. Vet. Sci. 50:195-199.
92. Suárez, V. H.; Busetti, M. R. y Fort, M. C. 1992. Epidemiology and effects of nematode infections on beef cow-calf systems of Argentina´s Western Pampas. Vet. Parasitol. 42:73-81.
93. Suárez, V. H.; Ciminari, O. E.; Bedotti, D. O.; Busetti, M. R. y Bello E. M. 1990c. Epidemiology, effects and control of nematode infections on Zebu crossbred, Hereford and Hereford X Brahman calves of Argentina´s Western Pampas. Vet. Parasitol. 35:79-91.
94. Suárez, V. H.; Busetti, M. R.; Lorenzo, R. M. 1995. Comparative effects of nematode infection on Bos taurus and Bos indicus crossbred calves grazing on Argentina's Western Pampas. Vet. Parasitol. 58:263-271.abstract.
95. Suarez V.H. (2002). Helminthic control on grazing ruminants and environmental risks in south america. Vet. Res. 33: 563- 573.
96. Taylor M.A., Hunt K.R. & Goodyear K.L. (2002). Anthelmintic resistance detection methods. Vet. Parasitol. 103 : 183-194.
97. Toledo, J.; Luciani, C.; y Balbuena, O. 1984. Control de la gastroenteritis verminosa en bovinos bajo pastoreo rotativo. X Congreso de Producción Animal (AAPA), Rosario, Santa Fe, Argentina.
98. Vercruysse, J. and Dorny, P. 1999. Integrated control of nematode infections in cattle: A reality? A need? A future? Int. J. Parasitol 29:165-175.
99. Van WYK J.A. (2001). Refugia-overlooked as perhaps the most potent factor concerning the development of anthelmintic resistance. Ondestepoort Jour. Vet. Res. 68: 55- 67.
100. Waller, P. J. 1999. International approaches to the concept of integrated control of nematode parasites of livestock. Int. J. Parasitol. 29:155-164.
101. Waller P.J. (2003). The future of anthelmintics in sustainable parasite control programs for livestock. Helminthologia 2: 97- 102.
102. Williams, J. C. 1997a. Antihelmintic treatment strategies: current status and future. Vet. Parasitol. 72:461-477.
103. Williams, J. C. 1983. Ecology and control of gastrointestinal nematodes of beef cattle. Vet. Clinics N. America: Large animal practice Vol. 5, 1:183-205.
Temas relacionados
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación1 de abril de 2013
Muy buen articulo Dr.
Esperemos repercuta en los productores, creando conciencia sobre las consecuencias del uso masivo y consecutivo de drogas ATP.
Felicitaciones ¡¡¡¡¡¡¡¡




