Lípidos en los alimentos de rumiantes
Los lípidos están formando parte de los alimentos comunes y de suplementos (concentrados) naturales o artificiales. Los principales constituyentes de los lípidos incluyen Trigliacilgliceroles, forma en que estánpresentes en granos de cereales, semillas oleaginosas, grasas animales y sub-productos; Glicolípidos, que son los principales lípidos de los forrajes verdes, Fosfolípidos, componentes menores que forman parte de las membranas celulares de vegetales y animales, y Ácidos grasos libres, un componente menor en los alimentos pero el componente principal en algunos suplementos lípidos (industriales) como Energy Booster 100 y Megalac. Launidad básica de los triacilgliceroles (TG) es una molécula de glicerol y 3ácidos grasos (AG). El termino “grasa” se usa para describir TG que son sólidos o semi-sólidos a la temperatura ambiente, siendo la expresión “aceite” utilizada para TG que son líquidos a esa temperatura. Este comportamiento está relacionado con la estructura de los AG; si son predominantemente saturados se hablará de grasa y si son insaturados de aceite. Los AG insaturados tienen uno o más dobles enlaces uniendo átomos de carbono de la cadena. Los Glicolípidos, son semejantes a los TG pero con uno o más azúcares unidos al glicerol en reemplazo de un AG. Los AG de los glicolípidos son generalmente insaturados. En los Fosfolípidos un grupo fosfato ha reemplazado a un AG. Este grupo se une a una base orgánica (colina, etanolamina, serina o inositol). En los alimentos se encuentran generalmente AG con cadenas de entre 14 y 18 carbonos pero en los aceites marinos (e.g. aceites de pescado) se encuentran AG de hasta 20 y 24 carbonos. El AG más abundante en los forrajes es el ácido linolénico(C18:3), que tiene 3 dobles enlaces. En los granos de cereales y semillas oleaginosas el más abundante es el ácido linoleico (C18:2). En las grasasanimales el ácido oleico (C18:1) es el más común; este ácido se incluye entre los “mono-insaturados”, siendo considerados “poli-insaturados” (en inglés abreviados PUFA) todos los AG que tienen 2 o más dobles enlaces. En los AG insaturados el doble enlace puede tener la constitución espacial “cis” o “trans”. La configuración “cis” le confiere un menor punto de fusión al AG. Todos los AG insaturados en los vegetales tienen la configuración “cis”. La estructura “trans” resulta de la modificación microbiana de enlaces “cis” o de una hidrogenación química. Entre los ácidos poli-insaturados se encuentran aquellos del tipo omega 3 u omega 6. La expresión omega 3 (ω3), por ejemplo, indica que el primer doble enlace de un ácido poli-insaturado está entre los carbones 3 y 4, contados desde el terminal metilo (CH3).
Composición de los lípidos de la dieta
Los lípidos en la dieta de los rumiantes están presentes en los forrajes y en suplementos, agregados como granos de cereales y/o de semillas de oleaginosas o sus extractos; también pueden ser suplementos lípidos industrialmente preparados. En los forrajes verdes el contenido de extracto etéreo (EE) es más alto en la medida que sean más inmaduros y ricos en hojas y en lípidos asociados a los cloroplastos; el EE es bastante variable y fluctúa entre 4 y 12 % de la MS. Los AG representan sólo entre 45 y 65 % del EE en los forrajes verdes. Los principales ácidos son el linolénico (50 a 70 % del total de AG) y, en menor grado, el linoleico (15 hasta 25 % en la mayoría de los forrajes verdes). La relación ácidos ω6/ ω3 varía entre 0,2 y 0,3. Los forrajes secos, henos en particular, tienen un contenido menor de EE (1,5 a 5 %) por efecto de la oxidación y polimerización de los lípidos insaturados durante la henificación y una relación ω6/ ω3 mas elevada (i.e. 0,5 a > 1); estos cambios son mayores con una henificación inadecuada (i.e. muy larga) y mínima si el proceso es optimo (rápido). El ensilaje de maíz tiene una composición próxima al grano de maíz, con una alta proporción de ácidos linoleico y oleico y baja de <l. En los granos de cereales y semillas de oleaginosas, a diferencia de los forrajes verdes, ricos en pigmentos y lípidos complejos, el contenido de EE es prácticamente equivalente al de los TG y los AG representan el 95 % del EE. En los granos de cereales el contenido de lípidos totales puede llegar a 8 % (avena nuda) pero normalmente es mucho menor (2 a 4 %). El ácido linoleico representa un alto % de los AG pero de linolénico contienen solo trazas, con niveles variables de ácido oleico. Entre semillas de oleaginosas, el contenido de lípidos totales es muy alto en la semilla de raps (45-46 %), es similar o un poco menor en la de maravilla y es de aproximadamente 23 % en la de algodón. La grasa bovina (i.e. tallow) es particularmente alta en ácido oleico (aprox. 40 %), los aceites de pescado son relativamente ricos en ácido oleico y contienen cantidades apreciables de C 20:5 y de C 22:6 ( e i c o s a p e n t a e n o i c o, EPA y docosahexaenoico, DHA, respectivamente, ambos con la estructura ω3).
Metabolismo de los lípidos en el rumen
El rumen es un sitio de intenso metabolismo de lípidos. Los 2 principales procesos que experimentan aquí los lípidos de los alimentos son hidrólisis (lipólisis) de los enlaces ester(con liberación del glicerol y de los AG-o del azúcar en el caso de los glico-lípidos) y la posterior hidrogenaciónde los AG insaturados. La hidrólisis ocurre por la actividad de lipasas (u otras enzimas) bacterianas; los AG mono o poli-insaturados liberados son (bio) hidrogenados. Para que esta reacción pueda ocurrir se requiere que el AG esté libre. Como consecuencia la tasa de hidrogenación es siempre menor a la tasa de hidrólisis.
Los patrones de bio-hidrogenación fueron establecidos utilizando cultivos puros de microorganismos y las bacterias involucradas en este proceso se clasificaron en 2 grupos, A y B, basados en sus caminos metabólicos. Aunque el grupo A contiene muchas b a c t e r i a s ( e . g . b u t i r i v i b r i o s , espiroquetas) que pueden hidrogenar los ácidos poli-insaturados a ácidos C18:1 con configuración trans, sólo unas pocas especies, caracterizadas como grupo B, pueden efectuar la última etapa e hidrogenar el ácido C18:1 trans a ácido esteárico (C18:0). Esta característica de la bio-hidrogenación explica porqué al aumentar los aportes de PUFA en la ración se produce un aumento simultáneo de AG mono-insaturados y una disminución de la concentración de AG saturados. La tasa de bio-hidrogenación es típicamente más rápida al aumentar los aportes dietarios de AG insaturados. En vacas lecheras se ha estimado que entre 70 y 90 % del ácido linoleico y entre 85 y 100% del ácido linolénico son hidrogenados en el rumen. La hidrogenación menos extensiva del ácido linoleico se explica en parte por su incorporación a bacterias. El grado de bio-hidrogenación depende principalmente del tipo de dieta: cuando los concentrados comprenden un alto % de la ración (> de 70% la bio-hidrogenación es en promedio sólo 50 y 65 % (linoleico y linolénico, respectivamente). Esto está relacionado a una baja del pH ruminal, que limita inicialmente la lipólisis y luego la bio-hidrogenación (ya que esta ocurre sólo en AG libres). Hay también una extensa bio-hidrogenación de los ácidos EPA (C20:5) y DHA (C22:6) pero generalmente estos AG no se saturan completamente.
Se considera que los ácidos grasos insaturados son mas tóxicos para las bacterias que los saturados; muchas bacterias ruminales (e.g. B. fibrisolvens) utilizan la bio-hidrogenación como una reacción de detoxificación. El ácido linolénico seria más tóxico que el linoleico por que las bacterias afectadas deben remover tres (en lugar de 2) dobles enlaces.
Modificaciones de los lípidos en el rumen
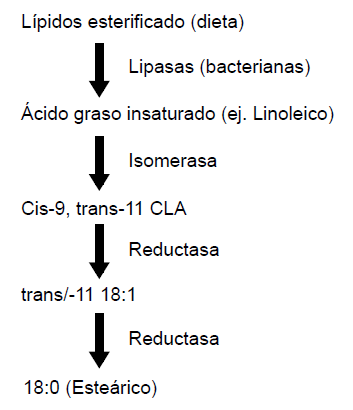
La hidrólisis de los lípidos alimentarios es rápida aunque su cinética precisa ha sido poco estudiada, especialmente en el caso de los lípidos atípicos (e.g. lípidos protegidos). El glicerol liberado de los triacilgliceroles (por lipasas de origen bacteriana) se transforma en ácidos grasos volátiles (AGVs) mientras que los AG libres, no pueden ser oxidados en las condiciones anaeróbicas del rumen y son modificados por la acción de enzimas isomerasas y reductasas. Las primerastransforman enlaces cis a enlaces trans, mientras que las reductasas saturan (i.e. agregan hidrógeno) a estos enlaces. La Figura 1 muestra la transformación en el rumen de ácido linoleico (cis-9, cis12-18:2) en un ácido linoleico conjugado y otros intermediarios, con la producción final de ácido esteárico (C18:0). Los microbios del rumen pueden sintetizar endógenamente sus lípidos a partir de precursores de cadena corta: ácidos acético, propiónico o valérico o a partir de cadenas carbonadas ramificadas, provenientes de la degradación de aminoácidos del mismo tipo (valina, leucina e isoleucina). Estos microorganismos pueden también incorporar AG libres, tanto saturados como insaturados, en el curso de la síntesis celular microbiana. Finalmente, como las bacterias ruminales pueden sustituir propionil CoA y valeril CoA por acetilCoA como punto de partida en la síntesis de AG, los lípidos bacterianos incluyen un contenido significativo de AG de cadena impar. Por estos procesos los AG contenidos en los lípidos ruminales y en la digesta post-ruminal difieren de aquellos presentes en la dieta, siendo marcadamente enriquecidos en ácido esteárico (18:0), a costa de AG presentes en la dieta como linoleico y linolénico.
Modificación del patrón de ácidos grasos de la grasa de rumiantes
El consumo de grasas de rumiantes ha sido asociado a un aumento en la incidencia de enfermedades coronarias, por tanto un importante objetivo de investigación ha sido tratar de optimizar la composición en AG de estos productos, disminuyendo los AG saturados y aumentando en particular los AG ω3, así como el contenido del CLA (cis-9, trans-11 18:2), ya que a este último se le atribuyen propiedades de prevención de cáncer, disminución de ateroesclerosis, mejora en la respuesta inmune, etc. Para lograr lo anterior hay que poder alterar los procesos de bio-hidrogenación en el rumen.
Los principales tipos de lípidos de la dieta que llegan al rumen (triacilgliceroles, fosfo-lípidos y galacto-lípidos) son rápidamente hidrolizados por las enzimas microbianas (e.g. lipasas, galactosidasas y fosfolipasas), con formación de AG y glicerol; en el caso de los galacto-lípidos por ejemplo se liberan también los ácidos grasos y galacto-glicerol. Se ha postulado que lipasas provenientes de los vegetales ingeridos podrían también ser importantes en el rumen pero comparativamente parece ser que su rol es menor aunque este punto no está totalmente clarificado; en todo caso son importantes en la lipólisis que sufren los lípidos de los granos de cereales procesados durante el almacenamiento. Al menos en algunas bacterias ruminales (e.g. Anaeorovibrio lipolytica) se han detectado 2 enzimas hidrolíticas, una ligada a las células y otra extracelular.
Bio-hidrogenación. Para que pueda haber hidrogenación de dobles enlaces es necesario que previamente ocurra lipólisis. La etapa inicial es una isomerización, transformándose un enlace cis en enlace trans por acción de una isomerasa bacteriana especifica. (Figura 1, ejemplo del ácido linoleico). La isomerización de enlaces cis a trans es común en bacterias, incluyendo algunas ruminales. Se considera que esta capacidad les permite alterar la permeabilidad de las membranas como una protección contra inhibidores de crecimiento o insultos ambientales.
Rol de las bacterias en la biohidrogenación. Los estudios microbiológicos iniciales tendientes a aclarar la bio-hidrogenación (BH) bacteriana se realizaron antes de que se conocieran los roles positivos para la salud humana de los AG poli-insaturados ω3 (e.g. ácido linolénico), del CLA (cis-9, trans-11 18:2) y del trans-11 C 18:1. Ya en 1964 se identificó a Butyrivibrio fibrisolvens como una de las bacterias capaces de BH ácidos grasos y de formar CLA y trans-11 C18:1. Esta bacteria no es capaz sin embargo de formar ácido esteárico a partir de ácido linoleico. Estudios posteriores, (utilizando métodos que no incluyen elementos radioactivos, muy sensibles pero que requieren concentraciones muy pequeñas de los ácidos en estudio, lo que no permite identificar bien intermediarios en las reacciones), han hecho posible descubrir bacterias capaces de formar ácido esteárico a partir de ácido linoleico, incluyendo a Clostridium proteoclastinum, comprobándose además la importancia de B. fibrisolvens en el proceso de BH aunque este es capaz de llegar solo hasta trans-11 C18:1. Unas (pocas) bacterias capaces de formar CLA, trans-11-C18:1 o ambos a partir de ácido linoleico también forman ácido esteárico. Las productoras de este último ácido están emparentadas con C.proteoclastinum. Esta (y similares bacterias), capaces de remover en forma irreversible estos ácidos benéficos (CLA y trans-11 C18:1) del medio son, por este motivo, considerados candidatos a ser selectivamente suprimidos de la población ruminal por algún tipo de manipulación.
Rol de los protozoos ciliados. Los protozoos pueden constituir hasta un 50% de la biomasa microbiana en el rumen y aproximadamente ¾ de los AG asociados a los microbios presentes en este compartimiento pueden estar presentes en ellos. Estos AG son proporcionalmente más insaturados que los ácidos grasos presentes en las bacterias por lo que pueden representar una importante fuente de PUFA, de CLA y de trans-11 18:1 para su eventual incorporación en la grasa láctea o cárnea. En un estudio reciente se encontró que la mezcla de protozoos (aislados del rumen de ovinos) contenía 2 a 3 veces más AG insaturados que las bacterias, 8 veces más CLA y 3 veces más trans-11 C18:1. Se observó que diferentes especies de protozoos variaban en su composición: las mas grandes (e.g. Ophryoscolex caudatus) tenían contenidos mucho mayores (mas de 10x) de CLA y de ácido vaccénico. A pesar de su alto contenido de CLA y de ácido vaccénico los protozoos parecen incapaces de sintetizar estos 2 AG a partir de estearato. La explicación más probable es que los obtienen al ingerir estos ácidos pre-formados contenidos en bacterias. Así, aunque los protozoos no producen CLA o ácido vaccénico pueden hacer una importante contribución al aporte de estos AG al animal huésped. En un estudio se midió en novillos que los protozoos contribuían con entre 30 y 43 % del CLA y con 40 % del flujo duodenal de ácido vaccénico; la situación en cuanto a los PUFA en general no esta clara.
Rol de los hongos anaeróbicos. Los hongos anaeróbicos aunque constituyen un porcentaje menor de la bio-masa de microorganismos ruminales, tienen sin embargo una alta actividad celulolítica. Investigaciones recientes confirmaron que su principal producto del metabolismo del ácido linoleico fue el CLA (cis-9, trans 11-18:2) y demostraron que el hongo Neocallismatix frontalis es capaz demetabolizar ácido linoleico con formación de este CLA. La velocidad de esta reacción es, sin embargo, muy lenta comparada con la de la bacteria B. fibrisolvens.
Intermediarios en el proceso de bio-hidrogenación. Esta es un área que ha recibido recientemente considerable atención, tratando de identificar el origen de uno o más ácidos con configuración trans-18:1 o CLAs originados de la BH de AG insaturados específicos. Así se ha aprendido mucho sobre los intermediarios de la BH de los ácidos oleico y linoleico pero se sabe mucho menos sobre los ácidos ω3, es decir el ácido linolénico y los principales ácidos grasos de origen marino (i.e. EPA y DHA).
La bio-hidrogenación del ácido oleico se presenta frecuentemente en la literatura como una transformación directa a ácido esteárico, sin la formación de intermediarios, la que es posible aunque es claro que este ácido puede dar origen a una variedad de compuestos, además del C 18:0. La utilización reciente de técnicas específicas ha permitido identificar una serie de posibles intermediarios (la mayoría de ellos isomeros trans-C18:1). Por ejemplo, se ha encontrado un total de 12 isomeros trans, siendo el más abundante el ácido vaccénico (trans-11-C18:1).
En el caso de la BH del ácido linoleico, su conversión a ácido esteárico aun se representa generalmente como incluyendo solo 2 intermediarios: cis-9, trans 11 CLA y trans-11 C18:1 (Figura 1). Sin embargo se ha identificado actualmente una amplia variedad de CLAs en los contenidos de digesta de bovinos (hasta 14 diferentes CLAs; sin embargo en la mayoría de los casos el isomero cis-9, trans-11, CLA es el principal y fueprobablemente el único detectado con muchas técnicas cromatograficas antiguas. La disponibilidad actual de columnas mas largas (de 100 o más m) de cromatografía gas-líquido junto con nuevas técnicas de espectroscopia de masa ha permitido la separación e identificación de CLA presentes en cantidades muy pequeñas.
Además del cis-9, trans-11 CLA, otro CLA proveniente de la BH del ácido linoleico es el trans-10, cis-12 CLA. Se han identificado varias bacterias capaces de producir este ácido (e.g.
Megasphaera eldesnii, Propionibacterium, y otros). Varias de estas ocurren en el rumen, aunque en bajos números, pero algunas aumentan con dietas ricas en concentrados, lo que sería consistente con una mayor producción de este AG en estas circunstancias. Se han documentado muy pocos otros intermediarios de la BH de ácido linoleico. Por ejemplo Butyrivibrio fibrisolvens produjo trans-9, trans-11 CLA a partir de ácido linoleico a una concentración de aprox. 1/10 de la del cis-9, trans-11 CLA en un estudio reciente.
Figura 1. Etapas claves en el proceso de conversión de lípidos esterificados (de la dieta) por lipólisis y bio-hidrogenación en el rumen (Jenkins, 1993).
Ácidos grasos omega -3 (ω3). De acuerdo a los caminos metabólicos mas aceptados la BH del ácido linolénico no produce CLAs como intermediarios. Determinar si esto es efectivo para este y otros ácidos de configuración ω3 (e.g. DHA, EPA) es de importancia debido al amplio rango de efectos metabólicos y fisiológicos identificados para diversos isomeros CLA. La meta (práctica) eventual sería poder regular la BH de linoleato hasta el punto de producir más o menos a voluntad isómeros CLA deseados.
Manipulación de la fermentación lipídica ruminal
La manipulación del metabolismo ruminal de los lípidos tiene 2 objetivos prácticos: 1) Controlar los efectos antimicrobianos de los AG para minimizar la alteración de la fermentación ruminal, de modo que se puedan agregar a la dieta suplementos ricos en grasas o en aceites insaturados y 2) controlar los procesos de bio-hidrogenación para permitir la absorción intestinal de AG (insaturados) selectos que pueden mejorar las cualidades nutritivas de los productos animales o mejorar el desempeño animal vía efectos positivos en su metabolismo.
En relación al primer objetivo es sabido que los efectos de una suplementación con lípidos sobre la fermentación ruminal dependen de la cantidad y del tipo de lípido (longitud de la cadena de los AG y su grado de insaturación). En general los AG de cadena corta causan una mayor depresión que los de cadena larga (LCFA), los insaturados son mas dañinos que los saturados, los AG libres causan una mayor depresión que los triacilgliceroles correspondientes, y las mezclas de grasas animales-vegetales son menos tóxicas que niveles equivalentes de grasas puras. Un grupo carboxilo (COOH-) libre parece importante para la modificación de la fermentación, lo que se ha explotado para producir (industrialmente) lípidos “inertes” en el rumen como, por ejemplo, las sales cálcicas de ácidos grasos de cadena larga, entre otras alternativas (ver mas adelante y para detalles consultar Jenkins, 2006)
En relación al segundo objetivo (i.e. aumentar el flujo de AG insaturados al duodeno), el enfoque utilizado es la inclusión en la dieta de AG específicos “protegidos” contra la bio-hidrogenación ruminal. Este ultimo enfoque, sin embargo, no permite por ejemplo aumentar el flujo de ácidos grasos que se sintetizan (al menos en parte) en el rumen, como es el caso del CLA cis-9, trans 11, 18:2.
Protección de lípidos de la dieta
Se ha revisado recientemente este tema considerando sobre todo aumentar el aporte de ácidos grasos esenciales a los tejidos de los rumiantes. En ese contexto 2 AG requieren protección especial: el ácido linoleico y el ácido linolénico, aunque excepcionalmente pudiera ser conveniente proteger otros como el ácido oleico, por ejemplo para tratar de aumentar su concentración en la grasa láctea o los ácidos DHA o EPA, para mejorar el desempeño reproductivo en vacas lecheras.
Justificación. Se calculó que al aportar diversas dietas a vacas lecheras lactantes solo el 23 % del ácido linoleico ingerido (sin protección) llegaba al duodeno, o solo 65 g/d (de 287 g ingeridos). Al comparar cifras de vacas lactantes que recibían una ración testigo (sin lípidos agregados) versus raciones que aportaban diferentes lípidos sin proteger, las cifras correspondientes fueron 41 g de ácido linoleico/d al duodeno (sin grasa agregada) y hasta 90 gr/d (con aceites suplementarios, no protegidos). Esta alternativa (i.e. aportar aceites no protegidos) frecuentemente es inconveniente ya que afecta en forma negativa la fermentación ruminal por las razones ya indicadas.
Grasas protegidas. Se utiliza esta expresión si el procedimiento utilizado permite resistir el proceso de bio-hidrogenación ruminal y, por tanto, aumentar el flujo post-ruminal de uno o más AG. Criterios de éxito de un procedimiento determinado de protección incluyen: 1) aumento predecible y consistente del flujo de los AG protegidos al duodeno, 2) liberación y absorción adecuadas de los respectivos ácidos en el intestino y 3) mínimos efectos adversos sobre la fermentación ruminal.
Se han estudiado una serie de métodos de protección, desde el uso de semillas de oleaginosas (e.g. de raps o de soya), protección vía encapsulado dentro de una capa de caseína tratada con formaldehído, sales cálcicas de ácidos grasos y otros procedimientos industriales (e.g. preparación de amidas de ácidos grasos). Las opciones comercialmente disponibles son pocas, principalmente sales cálcicas de AG. La alternativa de protección con formaldehído no está disponible comercialmente o se cuestiona su uso. Este autor concluye que las grasas “protegidas” disponibles confieren una protección solo parcial de la bio-hidrogenación ruminal y solo un modesto aumento en el flujo de AG insaturados al duodeno.
Ácido linoleico conjugado
La expresión ácido linoleico conjugado (abreviado, en inglés CLA), es un término colectivo que describe una serie de AG de 18 carbonos con dos dobles enlaces conjugados, separados por un enlace simple. Los dobles enlaces de la mayoría de los AG poli-insaturados están separados por dos enlaces simples. Parodi (1977, citado por Corl, 2006) fue el primero en identificar al cis-9, trans-11 CLA como un isómero presente en la grasa láctea. Posteriormente se han identificado (con la ayuda de metodologías analíticas cada vez más precisas) muchos más isómeros CLAs, todos presentes en muy pequeñas cantidades, algunos de los cuales tienen propiedades muy diferentes a las del cis-9, trans-11. Jenkins y col (2008) identifican por ejemplo más de 14 isómeros CLA en el contenido ruminal de bovinos.
El isómero CLA cis9, trans-11 es el que ha recibido mayor atención por sus varios efectos benéficos demostrados en modelos animales de enfermedades humanas, incluyendo efectos anti-carcinogénicos. Otro CLA bastante estudiado es el isómero trans-10, cis-12, que se considera que tiene un rol importante en la reducción de la síntesis de grasa (ver más adelante).
Origen del CLA (cis-9, trans-11). En forma resumida este isómero tiene (principalmente) 2 orígenes. Uno es su conversión, en el rumen, a partir de su precursor el ácido linoleico. Este CLA puede ser absorbido a través de la pared ruminal o transformado, en el rumen, a ácido vaccénico (trans-11 C18:1). Este último puede, a su vez, ser absorbido y llegar a la glándula mamaria (y otros tejidos) y allí, por acción de la enzima Δ9 –desaturasa, transformarse en cis-9, trans-11 CLA. El ácido trans-vaccénico puede también originarse a partir del ácido linolénico. Se considera que la síntesis endógena (con participación de Δ9 –desaturasa) es la fuente principal del CLA cis-9, trans-11 en la grasa láctea.
El síndrome de bajo contenido de grasa en la leche
La causa más aceptada actualmente para explicar una baja no deseada en el % de grasa de la leche asociada a problemas de la dieta está relacionada con la producción de ciertos CLA en el rumen (diferentes al cis 9, trans 11, C18:2). El primero con esta capacidad que se descubrió fue el isómero trans-10, cis-12 CLA, intermediario del proceso de bio-hidrogenación del ácido linoleico. Se ha demostrado que bastan 2 g de este compuesto para producir una reducción de un 20 % en el contenido de grasa láctea. Recientemente se han identificado otros 2 intermediarios que regulan la síntesis de grasa láctea (trans-9, cis-11 CLA y cis-10, trans-12 CLA). Se atribuye a estos CLA, intermediarios en la bio-hidrogenación ruminal del ácido linoleico, ser los causantes de todos los casos de baja en el porcentaje de materia grasa láctea inducidos por la dieta. El mecanismo propuesto consiste en que el CLA producido en el rumen, pasa al intestino delgado, es absorbido y en la glándula mamaria señala una depresión de la expresión de enzimas lipogénicas (y por tanto de la síntesis de novo de ácidos grasos a partir de ácidoacético y β-OH butírico, producidos en el rumen).
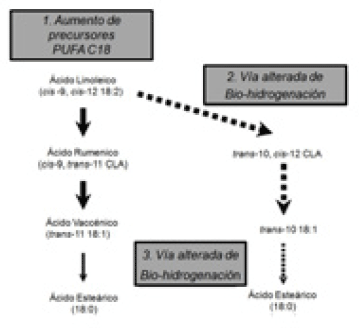
Se postula que para que se generen estos CLA se deben dar 2 situaciones: una fermentación ruminal alterada y la presencia de ácidos grasos poli-insaturados en el rumen. Entre los factores de riesgo asociados a una fermentación ruminal alterada se incluyen un bajo pH ruminal, un alto consumo de concentrados (fuentes de CHO no estructurales, particularmente si son rápidamente degradables en el rumen) y una baja concentración de fibra efectiva en la dieta. En la Figura 2 se muestra que, en esas condiciones, además de formarse trans-10, cis-12 CLA, en lugar de ácido vaccénico se produce el ácido trans-10 18:1, que no inhibe directamente la síntesis de grasa en la glándula mamaria pero que se detecta en la leche, pudiendo por ello utilizarse como un indicador de una bio-hidrogenación ruminal alterada, conducente a una baja en la materia grasa láctea.
La Figura 2 indica que hay 3 formas predominantes de alterar el contenido de grasa láctea. 1) Aumentar los aportes de sustrato (AG poli-insaturados de 18 C, principalmente ácido linoleico), en forma no protegida; 2) Alterar el ambiente ruminal y los patrones de bio-hidrogenación, y 3) Cambios en la tasa de bio-hidrogenación en distintas etapas de este proceso.
Suplementacióncon lípidos y reproducción
La suplementación con lípidos ha producido en varios estudios (e.g. Staples y col 2007) una mejora en la tasa de concepción. Se han considerado varias posibles explicaciones para esta observación incluyendo: 1) la posible corrección de un déficit de AG esenciales y 2) inhibición de la producción uterina de prostaglandina F2α.
Figura 2. Esquema que muestra la bio-hidrogenación normal del ácido linoleico (izquierda) y una bio-hidrogenación anormal (derecha) conducente a la síntesis de intermediarios como trans-10, cis-12 CLA. (Lock y col 2008).
La corrección de un posible déficit de AG esenciales parecería posible ya que vacas suplementadas con fuentes que aportan ya sea ácido linoleico o linolénico han producido un folículo dominante de mayor tamaño, que produce a su vez un cuerpo luteo mayor, el que secreta mas progesterona. Todo lo cual ha sido asociado a una mayor probabilidad de preñez exitosa. La inhibición de la síntesis de PGF2α se ha asociado a la suplementacion con lípidos que aporten específicamente ácidos grasos ω3 (e.g linolénico), maniobra que ha estado asociada a una menor perdida de embriones. Finalmente, se ha demostrado también que la suplementación con fuentes que aporten ácido linolénico o trans 18:1, han producido otro efecto: embriones calificados como de “alta calidad”. En este caso no esta claro si el efecto observado esta explicado por el aporte de ácido linolénico o de trans 18:1.