Liberación de predadores para el control de ácaros plaga en Guayacán de Manizales Lafoensia acuminata (Ruiz & Pav.) DC. (Myrtales: Lythraceae) en casa de malla
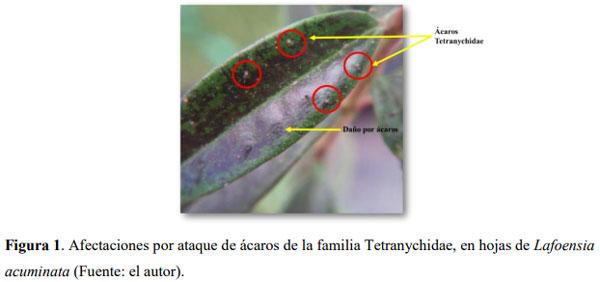
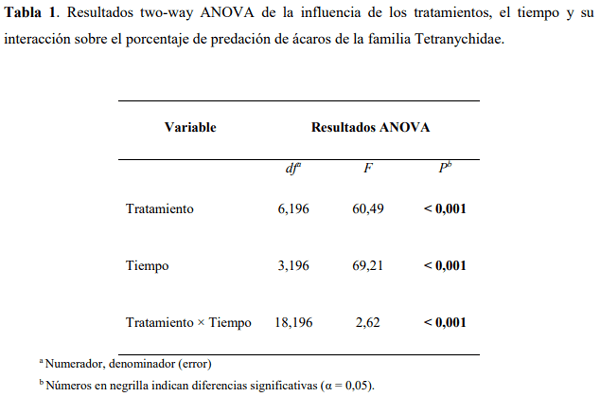
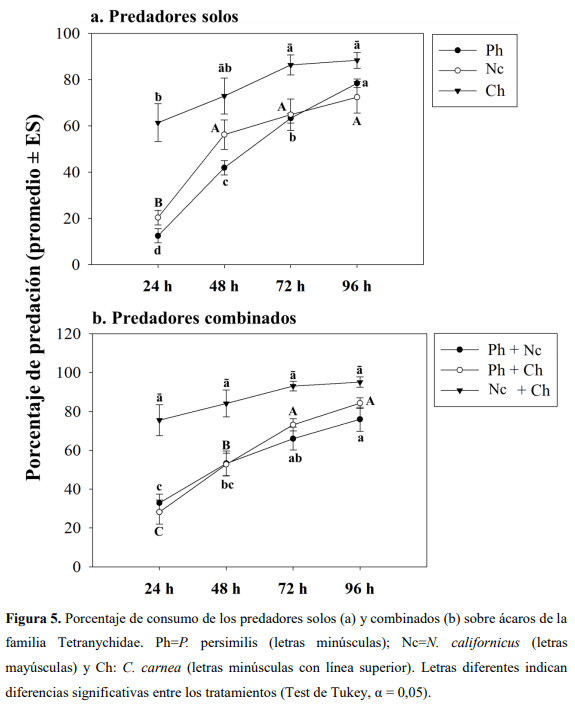
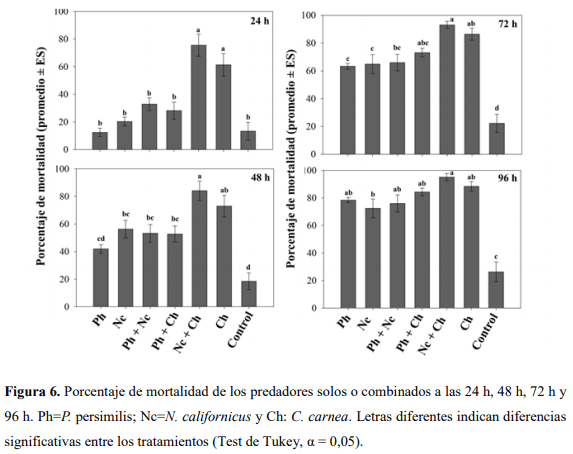
El Guayacán de Manizales Lafoensia acuminata (Ruiz & Pav.) DC. (Myrtales: Lythraceae) se caracteriza por ser usado en la reforestación de áreas degradadas y en la recuperación de cuencas hidrográficas. Esta especie en condiciones de vivero es atacada por ácaros del genero Tetranychus incrementándose las aplicaciones de productos de síntesis química para su control. Por lo tanto, este trabajo tuvo como objetivo evaluar tres artrópodos predadores para el control de ácaros de la familia Tetranychidae en L. acuminata. En casa de malla en el vivero la Florida (km 3 vía Engativá-Cota) se instalaron jaulas donde fueron colocadas 8 plantas (6 meses de edad) de L. acuminata por tratamiento, los cuales fueron: 1) Phytoseiulus persimilis Athias-Henriot (Phytoseiidae) solo, 2) Neoseiulus californicus McGregor (Phytoseiidae) solo, 3) P. persimilis + N. californicus, 4) P. persimilis + Chrysoperla carnea Stephens (Neuroptera: Chrysopidae), 5) N. californicus + C. carnea, 6) C. carnea solo y 7) control (sin predadores). Cada planta fue infestada con ~100 ácaros fitófagos dejándolos por 72 horas para su establecimiento. Se realizaron evaluaciones a las 24, 48, 72 y 96 horas para medir el impacto de los predadores (10 predadores/planta) sobre la presa. Se evaluó la tasa de consumo contando el número de ácaros vivos. Se encontró que la combinación de C. carnea + N. californicus a las 24 (C. carnea: 61,35 ± 8,17%; N. californicus + C. carnea: 75,51 ± 8,02%) y 48 h (C. carnea: 72,89 ± 7,78; N. californicus + C. carnea: 84,07 ± 6,96%) fue la más eficaz para el control de ácaros Tetranychidae. Estos resultados tienen implicaciones en el control biológico aumentativo para el control de ácaros y se espera que puedan ser implementados en condiciones de campo para L. acuminata.
Palabras clave: Control biológico, Chrysopidae, Phytoseiidae, Tetranychidae.
INTRODUCCIÓN
- Evaluar el porcentaje de consumo de Phytoseiulus persimilis (Acari: Phytoseiidae), Neoseiulus californicus (Acari: Phytoseiidae) y Chrysoperla carnea (Neuroptera: Chrysopidae) solos en plantas de Lafoensia acuminata infestadas con ácaros Tetranychidae.
- Evaluar el porcentaje de consumo de P. persimilis en combinación con N. californicus en plantas de L. acuminata infestadas con ácaros Tetranychidae.
- Evaluar el porcentaje de consumo de P. persimilis en combinación con C. carnea en plantas de L. acuminata infestadas con ácaros Tetranychidae.
- Evaluar el porcentaje de consumo de N. californicus en combinación con C. carnea en plantas de L. acuminata infestadas con ácaros Tetranychidae.

3.2 Obtención de ácaros plaga

3.4 Evaluación de la predación

Abad, R., Pina, T., Dembilio, O., Ferragut, F., Urbaneja, A. (2009). Survey of natural enemies of spider mites (Acari: Tetranychidae) in citrus orchards in Eastern of Spain. Experimental and Applied Acarology, 47, 49–61.
Abdallah, A., El-Saiedy, E., El-Fatih, M. & Shoula, M. (2012). Effect of some biological and biochemical control agents against certain squash pests. Archives of phytopathology and plant protection, 45(1), 73-82.
Ail, C., Flores, M., Cerna, E., Badii, M., Landeros, J., Ochoa, Y. & Aguirre, L. (2012). Respuesta funcional de diferentes instares larvales de Chrysoperla carnea (Stephens) (Neuroptera: Chrysopidae) sobre ninfas de Bactericera cockerelli (Sulc) (Homoptera: Psyllidae). Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo, 44(2), 279-288.
Badii, M., Landeros, J., & Cerna, E. (2010). Regulación poblacional de ácaros plaga de impacto agrícola (Population Regulation of Pest Mites of Agricultural Significance). Daena: International Journal of Good Conscience, 5(1), 270-302.
Biobee, (2017). Biological Systems. Bichopolis. Recuperado de, http://biobee.co/mip- biologico/acariraptor/. Biológicos de Colombia. (2014). Biocol.
Boregas, K., Carvalho, C. & Souza, B. (2000). Aspectos biológicos de Chrysoperla externa (Hagen, 1861) (Neuroptera: Chrysopidae) em casa de vegetação (Doctoral dissertation, Universidade Federal de Lavras.).
Brooks, & Barnard, (1990). P. C. The green lacewings of the world: a generic review (Neuroptera: Chrysopidae). Bulletin of the British Museum of Natural History, 59, 117-286.
Çakmak, I. & Çobanoglu, S. (2006). Amblyseius californicus (McGregor, 1954) (Acari: Phytoseiidae), a new record for the Turkish Fauna. Turkish Journal of Zoology, 30(1), 55– 58.
Çakmak, I., Janssen, A. & Sabelis, M. (2006). Intraguild interactions between the predatory mites Neoseiulus californicus and Phytoseiulus persimilis. Experimental & applied acarology, 38(1), 33-46.
Castagnoli, M., Liguori, M., & Simoni, S. (1999). Effect of two different host plants on biological features of Neoseiulus californicus (McGregor). International Journal of Acarology, 25(2), 145-150.
Corzo., G. (2010). Manejo del arbolado urbano en Bogotá. territorios, (16-17).
Cuesta, A., & Guarín, J. (2003). Estudios de Chrysoperla externa, bioinsumo para el manejo de. Thrips palmi Karny en el oriente antioqueño. Juan H, Guarín (Ed.). Rionegro, Antioquia. Corpoica-Pronatta.
Chacón, J., Cerna, E., Ochoa, Y., Hernández, A., Palacios, L., & Landeros, J. (2016). Distribución espacial y fluctuación poblacional de Tetranychus urticae (Koch) y Phytoseiulus persimilis (Athias-Henriot) en cultivos de rosal. Phyton (Buenos Aires), 85(2), 236-245.
Daza, M., Cantor, F., Rodríguez, D., Bustos, A. & Cure, J. (2010). Criterios para la producción de Phytoseiulus persimilis (Parasitiformes: Phytoseiidae) bajo condiciones de invernadero. Acta biol. Colomb., 15(1), 37–46.
De la Peña, A., Nino, P., Bustos, A., Fernando, C. & Rodríguez, D. (2011). Effect of Different Times of Cold Storage on Some Parameters of Phytoseiulus persimilis (Athias Henriot) and Neoseiulus californicus. (Parasitiformes: Phytoseiidae). Acta Biológica Colombiana, 16(2), p. 63-74.
Del Puerto., A. Suárez, S. & Palacio, D. (2014). Efectos de los plaguicidas sobre el ambiente y la salud. Revista Cubana de Higiene y Epidemiología, 52(3), 372-387.
Eleawa, M.; Waked, D., Othman, A. (2014). Interactions between the released predaceous mite, Phytoseiulus persimilis and naturally occurring insect predators on cucumber crop for controlling Tetranychus urticae. Global Journal of Environmental Sciences and Toxicology, 1, 110-118.
El-Sawi, S. & Momen, F. (2005). Biology of some phytoseiid predators (Acari: Phytoseiidae) on eggs of Phthorimaea operculella and Spodoptera littoralis (Lepidoptera: Gelechiidae and Noctuidae). Acarologia, 45(1), 23-30.
Escudero, L. & Ferragut, F. (2005). Life-history of predatory mites Neoseiulus californicus and Phytoseiulus persimilis (Acari: Phytoseiidae) on four spider mite species as prey, with special reference to Tetranychus evansi (Acari: Tetranychidae). Biological Control, 32(3), 378–384.
Ferragut, F., Soler, E., & Rodrigo, E., (2006). Colonización, comportamiento alimenticio y producción de daños en las arañas rojas Tetranychus urticae y T. turkestani (Acari, Tetranychidae). Boletín de Sanidad Vegetal del MAGRAMA, 32, 523-534.
Fiedler, Z. (2012). Interaction between beneficial organisms in control of spider mite Tetranychus urticae (Koch.). Journal of plant protection research, 52(2), 226-229.
Forero, G., Rodríguez, M., Cantor, F., Rodríguez, D., & Cure, R. (2008). Criterios para el manejo de Tetranychus urticae Koch (Acari?: Tetranychidae) con el ácaro depredador Amblyseius sp, Neoseiulus sp . (Acari?: Phytoseiidae) en cultivos de rosas. Agronomía Colombiana, 26(1), 78–86.
Gamboa, S., Souza, B. & Morales, R. (2016). Actividad depredadora de Chrysoperla externa ( Neuroptera?: Chrysopidae ) sobre Macrosiphum euphorbiae ( Hemiptera?: Aphididae ) en cultivo de Rosa sp . Revista Colombiana de Entomología 42(1), 54–58.
Gilstrap, F. & Friese, D. (1985). The predatory potential of Phytoseiulus persimilis, Amblyseius californicus, and Metaseiulus occidentalis (Acarina: Phytoseiidae). International journal of Acarology, 11(3), 163-168.
Greco, N., Sánchez, N. & Liljesthröm, G. (2005). Neoseiulus californicus (Acari: Phytoseiidae) as a potential control agent of Tetranychus urticae (Acari: Tetranychidae): effect of pest/predator ratio on pest abundance on strawberry. Experimental & applied acarology, 37(1-2), 57-66.
Gugole, (2013). Manejo integrado de la plaga Tetranychus urticae (Acari: Tetranychidae) en cultivos de frutilla del Cinturón Hortícola Platense (Doctoral dissertation, Facultad de Ciencias Naturales y Museo). Pag. 36 a 39
Gugole, F. (2013). Manejo integrado de la plaga Tetranychus urticae (Acari: Tetranychidae) en cultivos de frutilla del Cinturón Hortícola Platense (Doctoral dissertation, Facultad de Ciencias Naturales y Museo). Pag. 36 a 39
Harter, L. & Risk, A (2006). Assessment of the exotic predatory mite Neoseiulus californicus for use as an augmentative (inundative) biological control agent in Northern Europe.
Hassanpour, M., Nouri, G., Mohaghegh, J., & Enkegaard, A. (2009). Functional response of different larval instars of the green lacewing, Chrysoperla carnea (Neuroptera: Chrysopidae), to the two-spotted spider mite, Tetranychus urticae (Acari: Tetranychidae). Journal of food, agriculture & environment, 7(2), 424-428.
Iwassaki, L., Sato, M.; Calegario, F.; Poletti, M.; Maia, A. (2015). Comparison of conventional and integrated programs for control of Tetranychus urticae (Acari: Tetranychidae). Experimental and Applied Acarology, 65, 205–17.
Kain, D. Nyrop, J. (1995). Predatory mites. Insect identification fact sheet. No. 23. www.nysaes.cornell.edo/ent/biocontrol/predators/
Landis, T. (2000). Manual de viveros para la producción de especies forestales en contenedor (No. Folleto 16175).
Landis, D. (2004). Manual de viveros para la producción de especies forestales en contenedor volumen 1. Planeación, establecimiento y manejo de viveros. Capítulo 5 manejo del vivero. Página 186.
Lema, M. (2013). Control biológico de araña roja Tetranychus urticae, en tres variedades de rosas (Rosa sp) de exportación a través de dos depredadores biológicos en la empresa Texas Flowers SA Cotopaxi Trabajo de grado Universidad técnica de Cotopaxi Ecuador.
Liburd, O.E., White, J.C., Rhodes, E.R., Browdy, A.A. (2007) The residual and direct effects of reduced-risk and conventional miticides on twospotted spider mites, Tetranychus urticae (Acari: Tetranychidae) and predatory mites (Acari: Phytoseiidae). Florida Entomology, 90, 249–257.
Liu, X., & Chen, Y. (2001). Effects of three aphid species (Homoptera: Aphididae) on development, survival and predation of Chrysoperla carnea (Neuroptera: Chrysopidae). Applied Entomology and Zoology, 36(3), 361-366.
López, B. (2016). Análisis de la interacción de acaricidas de nueva generación con los agentes de control biológico Typhlodromus pyri (Acari: Phytoseiidae) y Beauveria bassiana (Hypocreales: Clavicipitaceae) para su correcta incorporación al manejo integrado de Tetranychus urticae (Acari: Tetranychidae) (Tesis doctoral). Universidad de la Rioja, Logroño, España.
López, C., & Guzmán, H. (2017). Evaluación de la expresión de genes implicada en la producción del coctel enzimático de Chrysoperla carnea (Stephens) bajo condiciones de ayuno y alimento. Jóvenes en la ciencia, 3(2), 650-654.
Marafeli, P., Reis, R., Silveira, D., Souza-Pimentel, C., & Toledo, D. (2014). Life history of Neoseiulus californicus (McGregor, 1954) (Acari: Phytoseiidae) fed with castor bean (Ricinus communis L.) pollen in laboratory conditions. Brazilian Journal of Biology, 74(3), 691-697.
Mahecha, G., Barrero, D., Camelo, D., Ovalle, A., & Rozo Fernández, A. (2004). Vegetación del territorio CAR 450 especies de sus llanuras y montañas. Bogotá 2004. Corporación Autónoma Regional De Cundinamarca, CAR. Página 329.
Manners, A. (2015). Managing two-spotted mite in production nurseries. Nursery Levy at Work: Nursery Production, Plant Health and Biosecurity Project, 10. Retrieved from
Mesa, C. (1999). Ácaros de importancia agrícola en Colombia. Revista Facultad Nacional de Agronomía Medellín, 52(1), 321-363.
Moghadasi, M., Allahyari, H., Saboori, A., & Zahedi Golpayegani, A. (2016). Life table and predation capacity of Phytoseiulus persimilis Athias-Henriot (Acari: Phytoseiidae) feeding on Tetranychus urticae Koch (Acari: Tetranychidae) on rose. Journal of Agricultural Science and Technology, 18(5), 1279-1288.
Monserrat, V. & Díaz, L. (1989). Nuevos datos sobre los crisópidos ibéricos Neuróptera, Planipennia: Chrysopidae. Boletín de la Asociación española de Entomología, 13, 251-267.
Mothes, U., & Seitz, K. A. (1982). Fine structural alterations of bean plant leaves by feeding injury of Tetranychus urticae Koch (Acari: Tetranychidae). Acarologia, 23(2), pag, 149-157.
Moreno, J., León, J. & Osorio, N., (2016). Tree seedling growth promotion by dual inoculation with Rhizoglomus fasciculatum (Thaxt.) Sieverding. Acta Agronómica, 65(3), 239-247.
Nájera-Miramontes, D., Ordóñez-García, M., Ríos-Velasco, C., Berlanga-Reyes, D., Acosta- Muñiz, C., Zamudio-Flores, P., ... & Jacobo-Cuéllar, J. L. (2016). Depredación por Podisus maculiventris (Say) sobre larvas de Choristoneura rosaceana (Harris). Acta zoológica mexicana, 32(2), 147-152.
Nájera, M., & Souza, B. (2010). Insectos benéficos: guía para su identificación. Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias, México. [INIFAP]. volumen. (1) p. 26
Navarro, V., Acebedo, M., Rodríguez, M. & Belda, J. (2006). Organismos para el control biológico de plagas en cultivos de la provincia de Almería. Cajamar. 2a Ed. Almeria España. p, 72.
Nieto, V., & Rodríguez, J. (2000). Lafoensia speciosa, Corporacion Nacional de investigacion forestal Santafé de bogotá. Colombia (Rodriguez 1988), p. 517–536.
Oatman, E., Sances, F., LaPré, L., Toscano, N. C., & Voth, V. (1982). Effects of different infestation levels of the twospotted spider mite on strawberry yield in winter plantings in southern California. Journal of economic entomology, 75(1), 94-96.
Oliveira, H., Janssen, A., Pallini, A., Venzon, M., Fadini, M., & Duarte, V. (2007). A phytoseiid predator from the tropics as potential biological control agent for the spider mite Tetranychus urticae Koch (Acari: Tetranychidae). Biological Control, 42(2), 105-109.
Oliveira, A., Auad, M., Souza, B., Carvalho, A., Souza, S., Amaral, L., & Silva, M. (2009). Benefícios do mel e pólen de forrageiras nos parâmetros biológicos de Chrysoperla externa (Hagen, 1861) (Neuroptera: Chrysopidae). Arq. Inst. Biol, 76, 583-588.
Onzo, A., Hanna, R., Janssen, A., & Sabelis, M. (2004). Interactions between two neotropical phytoseiid predators on cassava plants and consequences for biological control of a shared spider mite prey: a screenhouse evaluation. Biocontrol Science and Technology, 14(1), 63- 76.
Ordóñez, O., & Lalama, K. (2006). Experiencias del manejo apícola en Uritusinga. Fundación Ecológia Arcoiris. Loja Ecuador 2006. Página 36
Palevsky, E., Maoz, Y., Gal, S., Argov, Y., Berkeley, M., Zilberstein, M., & Coll, M. (2007). Potenciales depredadores nativos y exóticos para el control biológico de la reciente introducción del ácaro de la palta, Oligonychus perseae en huertos de palto en Israel. In VI Congreso Mundial de la Palta, Viña del Mar, Chile (pp. 12-16).
Pickett, H., & Gilstrap, E. (1986). Inoculative releases of phytoseiids (Acari) for the biological control of spider mites (Acari: Tetranychidae) in corn. Environmental Entomology, 15(4), 790-794.
Poletti, M. (2010). Ácaros predadores no controle de pragas. Controle alternativo de pragas e doenças. Viçosa: Epamig, 213-232.
Pinheiro, J., Bates, D., DebRoy, S., & Sarkar, D. (2016). the R Development Core Team. 2011. nlme: linear and nonlinear mixed effects models. R package version 3.1-101. R Foundation for Statistical Computing, Vienna, Austria. www. r-project. orgi.
Raworth, A., Fauvel, G., & Auger, P. (1994). Location, reproduction and movement of Neoseiulus californicus (Acari: Phytoseiidae) during the autumn, winter and spring in orchards in the south of France. Experimental & applied acarology, 18(10), 593-602.
Reddy, G. (2001). Comparative effectiveness of an integrated pest management system and other control tactics for managing the spider mite Tetranychus ludeni (Acari: Tetranychidae) on eggplant. Experimental & applied acarology, 25(12), 985-992.
Ribera, I., & Melic, A. (2015). Orden Neuroptera s. s. (Planipennia). Revista IDE@ - SEA, (58)1– 12.
Riddick, E., & Wu, Z. (2010). Potential long-term storage of the predatory mite Phytoseiulus persimilis. BioControl, 55(5), 639-644.
Rincón, F. (2009). Evaluación del establecimiento de Phytoseiulus persimilis (Parasitiformes: Phytoseiidae) para el control de Tetranychus urticae-Koch (Acariformes: Tetranychidae) en Rosa.
Ruiz, A. (2014) Esperanza de Vida de Tetranychus urticae Bajo la Presencia de Phytoseiulus persimilis (Acari: Phytoseiidae: Tetranychidae) en 4 Variedades de Rosal (Tesis. Universidad Autónoma Agraria Antonio Narro Coahuila Mexico) p,18
Salamanca, J., Varón, E. & Santos, A. (2010). Cría y evaluación de la capacidad de depredación de Chrysoperla externa sobre Neohydatothrips signifer, trips plaga del cultivo de maracuyá. Corpoica. Ciencia y Tecnología Agropecuaria, 11(1), 31-40.
Salamanca, J., Souza B, Lundgren, G., & Rodríguez, C. (2017) From laboratory to field: electro- antennographic and behavioral responsiveness of two insect predators to methyl salicylate. Chemoecology 27, 51–63.
Salamanca, J., Pareja, M., Rodriguez-Saona, C., Resende, A. & Souza, B. (2015). Behavioral responses of adult lacewings, Chrysoperla externa, to a rose aphid coriander complex. Biological Control, 80, 103-112.
Salamanca, J., Souza, B. & Rodriguez-Saona, C (2018). Cascading effects of combining synthetic herbivore-induced plant volatiles with companion plants to manipulate natural enemies in an agro-ecosystem. Pest Management Science, 74, 2133-2145.
Salas, M., Salazar, E. Martínez, O. & Guzmán., (2014). Insectos benéficos en el cultivo de fresa en Irapuato, Guanajuato. México. Entomología Mexicana, (1), (289–294).
Shapiro, S. & Wilk, M. (1965). An analysis of variance test for normality (complete samples). Biometrika, 52(3/4), 591-611.
Shrestha, G., Enkegaard, A., & Giray, T. (2013). The green lacewing, Chrysoperla carnea: preference between lettuce aphids, Nasonovia ribisnigri, and western flower thrips, Frankliniella occidentalis. Journal of insect science, 13(1).
Schausberger, P., Walzer, A. (2001). Combined versus single species of predaceous mites: Predator predator interactions and pest suppression. Bio Control. 2001;20(3):269-278.
Silva., G. Carvalho, C. & Sousa, B. (1999). Aspectos biológicos de Chrysoperla externa (Hagen, 1861) (Neuroptera: Chrysopidae) alimentada com lagartas de Alabama argillacea (Hübner, 1818) (Lepidoptera: Noctuidae), em diferentes temperaturas (Doctoral dissertation, Universidade Federal de Lavras.).
Song., Z. Zheng, & Zhang, B. (2016). Prey consumption and functional response of Neoseiulus californicus and Neoseiulus longispinosus (Acari: Phytoseiidae) on Tetranychus urticae and Tetranychus kanzawai (Acari: Tetranychidae). Systematic & Applied Acarology, 21, 936–946.
Souza, G., Reis, R., Silveira, C., Marafeli, P., Silva, A., Andrade, B. (2014). Biological control of Tetranychus urticae (Tetranychidae) on rosebushes using Neoseiulus californicus (Phytoseiidae) and agrochemical selectivity. Revista Colombiana de Entomología, 40, 80-84.
Soto, J., & Iannacone, J. (2008). Efecto de dietas artificiales en La biología de adultos de Chrysoperla externa (Hagen , 1861) (Neuroptera: Chrysopidae), 24(2), 1–22.
Toldi, M., Reichert, B., Rode, P., Johann, L., Ferla, J. (2016). Influence of various preys in soybean and the biological performance of the predatory mite Neoseiulus californicus (Phytoseiidae). Systematic and Applied Acarology, 21, 1662-1669.
Uddin, M., Alam, Z., Miah, R., Mian, I., Mustarin, K. (2016). Life table parameters of an indigenous strain of Neoseiulus californicus McGregor (Acari: Phytoseiidae) when fed Tetranychus urticae Koch (Acari: Tetranychidae). Entomological Research, 47, 84-93.
Valencia, L., Romero, J., Valdez, J., Carrillo, J. & López, V. (2006). Taxonomía y registros de Chrysopidae (Insecta: Neuroptera) en el estado de Morelos, México. Acta zoológica mexicana, 22(1), 17-61.
Villamagua, C., & Muñoz, J. (2017). Especies maderables comercializadas en mercados locales: Un estudio del. Bosques Latitud Cero, 6(2).
Wafaa, G., & Eid, M. (2008). Release of Chrysoperla carnea (Stephens)(Neuroptera: Chrysopidae) and the predacious mite, Phytoseiulus macropilis (Banks)(Acari: Phytosiidae) to control, Tetranychus urticae Koch (Acari: Tetranychidae) in greenhouse in Egypt. Egyptian Journal of Biological Pest Control, 18(2), 381-384.
Walzer, A., Paulus, H., & Schausberger, P. (2004). Ontogenetic shifts in intraguild predation on thrips by phytoseiid mites: the relevance of body size and diet specialization. Bulletin of Entomological Research, 94(6), 577-584.
Walzer, A., & Schausberger, P. (1999). Cannibalism and interspecific predation in the phytoseiid mites Phytoseiulus persimilis and Neoseiulus californicus: predation rates and effects on reproduction and juvenile development. BioControl, 43(4), 457-468.
Walzer, A., Blümel, S., & Schausberger, P. (2001). Population dynamics of interacting predatory mites, Phytoseiulus persimilis and Neoseiulus californicus, held on detached bean leaves. Experimental & applied acarology, 25(9), 731-743.
Yao, D., & Chant, D. (1989). Population growth and predation interference between two species of predatory phytoseiid mites (Acarina: Phytoseiidae) in interactive systems. Oecologia, 80(4), 443-455.



