Infección persistente de Campylobacter fetus fetus en hembra bovina preñada
Publicado: 25 de agosto de 2006
Por: María Catena, Pedro Soto, Monteavaro, C Echevarría, (Dpto. de Sanidad Animal y Medicina Preventiva Fac Cs. Vet. U.N.C.P.B.A H.) y Racciatti, M. (Actividad privada)
Durante un ensayo de vacunación contra campilobacteriosis genital bovina en un establecimiento de tambo de la Pcia de Buenos Aires, en una hembra de tres años de raza Holando Argentino con una preñez de 4 meses, se detecta en el área cervico-vaginal la presencia de Campylobacter fetus.
De dicho animal se efectuaron muestreos seriados de mucus cérvico-vaginal (MCV) para determinar la persistencia de la infección, mediante inmunofluorescencia directa (IFD), cultivo en medios selectivos y posterior tipificación bioquímica. La respuesta inmune fue medida a través de los sueros y MCV obtenidos en los diferentes muestreos, mediante Enzimainmunoensayo e Inmunofluorescencia indirecta (IFI). Posteriormente, por Western blotting se realizó el reconocimiento de bandas.
Las cepas aisladas en los diferentes muestreos fueron identificadas bioquímicamente como Campylobacter fetus subsp. fetus. En el Western blotting no se observó el reconocimiento de la mayoría de las bandas y las titulaciones de inmunoglobulinas séricas y en MCV presentaron títulos negativos o muy bajos.
Los datos obtenidos demuestran la persistencia de la infección vaginal con Campylobacter fetus fetus durante la gestación, con escasa o nula respuesta inmune a nivel sistémico y del tracto reproductivo.
Palabras claves:infección persistente, Campylobacter fetus fetus, preñez, bovino vacunado
Introducción
La campilobacteriosis genital bovina (CGB) es una enfermedad infecciosa venérea, causada por Campylobacter fetus fetus (C.f.f.) y Campylobacter fetus venerealis (C.f.v.) que se caracteriza por producir mortalidad embrionaria y abortos esporádicos, con pérdidas económicas que van en detrimento del desarrollo en los sistemas de producción de nuestra ganadería.(Bryner et al, 1971), considerando que un 10% de las pérdidas durante la gestación temprana corresponden a enfermedades infecciosas. La hembra se infecta durante el servicio, mediante el cual, el Campylobacter fetus (C.f.) es depositado en vagina en forma conjunta con el semen pudiendo quedar acantonado en el área cérvico-vaginal o colonizar útero provocando mortalidad embrionaria o aborto.
La presencia de la enfermedad durante varios ciclos reproductivos, puede ser atribuible a que no sean detectados la totalidad de los animales enfermos, ya sea, por fallas en el diagnóstico, en las medidas de manejo, profilaxis, o a la presencia de hembras portadoras dentro del rodeo. Estas hembras no siempre son detectadas y tienen importancia epidemiológica por estar persistentemente infectadas y ser transmisoras de la enfermedad de un período reproductivo a otro pudiendo presentar fallas reproductivas o no, con presencia de la bacteria en el área cérvico-vaginal.
Dicha persistencia puede ser de hasta 14 meses (Corbeil, L. 1975, Blaser, M.1993) coincidiendo con variaciones antigénicas de la superficie bacteriana de C.f. asociadas a proteínas de alto peso molecular (S-Layer), las cuales están relacionadas con la virulencia de la bacteria y la resistencia de las cepas a la fagocitosis. (Blaser, M.; 1993). Cepas de C.f. con iguales patrones de restricción de bandas, difieren su comportamiento cuando son enfrentadas con sueros específicos, con un pequeño rango de antígenos expresados que son reconocidos por el huésped y de esta manera, permitiendo su persistencia en el tracto reproductor (Lisle, G. 1987). La respuesta inmune sistémica en animales vacunados demuestra altos niveles de IgG, estando también presente en secreciones uterinas y vaginales con predominio de la IgA, con prevención en infecciones posteriores y algunos casos la cura de animales con infección crónica. (Corbeil, L., 1974, 1999).
En este trabajo, se presenta un caso particular de infección persistente a Campylobacter fetus fetus en el área cérvico-vaginal de una hembra preñada desde a los 4 meses de gestación hasta el momento del parto. Las cepas aisladas durante la infección presentaron variaciones antigénicas asociadas a proteínas de diferente peso molecular no siendo reconocidas por los anticuerpos a nivel local y sistémico.
Materiales y métodos
Rodeo:
Se tomaron muestras de una hembra Holando Argentino con 4 meses de gestación hasta el momento del parto, proveniente de un establecimiento de tambo del partido de Tandil, Pcia. de Bs. As, con antecedentes de la enfermedad, en el cual se realizó un ensayo de vacunación para medir la respuesta inmune sérica y local, utilizando una bacterina comercial a Campylobacter fetus con las dos subespecies, en dos dosis, siendo inoculada la ultima dosis 15 días previos al servicio.
Las muestras consistieron en mucus cérvico-vaginal (MCV) extraídas mediante la jeringa de Cassou y vainas azules y sangre para la extracción de suero, con intervalos de aproximadamente 30 días durante 6 meses.
Identificación bacteriana:
Los MCV se procesaron por IFD y fueron sembrados en medio Skirrow con sangre equina hemolizada y mezcla antibiótica de rutina para el aislamiento de Campylobacter. (Terzolo, H y col.,1993). Las placas se incubaron hasta 10 días a 37º C, con una atmósfera de 85% de N2, 10% de CO2, y 5% de O2.
Las bacterias aisladas posteriormente se tipificaron bioquímicamente, realizando las siguientes pruebas: catalasa, oxidasa, producción de H2S en medios sensibilizados con 0,002% de cisteína, utilizando para la detección tiras de papel embebidas en acetato de plomo, crecimiento en glicina 1%, ClNa 4% y desarrollo a 42º C. (On, S, 1996; Vandamme, P et al, 2005)
Obtención de extracto bacteriano para electroforesis en gel de poliacrilamida:
Las células bacterianas fueron colectadas con 0.01 M de buffer fosfato pH 7 y lavadas 3 veces por centrifugación. La concentración de los pellet bacteriano se ajustó a 3,5 mg/ml de proteína (Brooks,B. et al, 1996).
Electroforesis:
Las preparaciones bacterianas para SDS-PAGE se procesaron según la metodología de Laemmli (1970). Diez microlitros de cada muestra ajustadas por densidad óptica, fueron separadas en geles de poliacrilamida al 10% utilizando una cuba de electroforesis vertical (Hoefer, USA).
Western blotting:
Se transfirieron las bandas proteicas obtenidas a papel de nitrocelulosa mediante la aplicación del método de Towbin y col (1979) utilizando un equipo de transferencia electroforética horizontal (Nova Blot Pharmacia).
Para el reconocimiento de las diferentes bandas se usaron los sueros puros y en diluciones 1/10 correspondientes a los diferentes muestreos y como segundo anticuerpo una antigammaglobulina bovina marcada con peroxidasa (Sigma A-7414). Se utilizó como control un suero bovino proveniente de una vaquillona infectada experimentalmente, el cual fue titulado por IFI y microaglutinación en 1/800.
Determinación de patrones de bandas
Se efectuó con un densitómetro de barrido utilizando para su lectura un software adecuado (Hoeffer GS 300). Para determinar los patrones de banda se utilizó una mezcla de estandares de peso molecular conocido.
Inmunofluorescencia indirecta:
Se utilizaron portaobjetos adecuados para I.F. conteniendo doce áreas marcadas de 6 mm. En cada área se fijó mediante acetona C.f.f. en concentraciones constantes, posteriormente se enfrentaron con diluciones seriadas 1/ 10 de los sueros y MCV. Como segundo anticuerpo se utilizó una antigamaglobulina bovina realizada en conejo, utilizando para su detección una IgG anticonejo marcada con isotiocianato de fluoresceína (Sigma, F-0382). En cada portaobjetos se utilizaron controles positivos con los sueros mencionados anteriormente y como negativos sueros de terneros.
Enzimainmunoensayo
Un pool de las cepas obtenidas en los diferentes muestreos fue cultivado según lo descripto anteriormente. La suspensión obtenida de las placas fue lavada 3 veces con PBSS pH 7 a 4º C a 8000 rpm. El pellets del lavado de las placas, fue resuspendido en buffer carbonato (0.05 M pH 9.6) para ser ajustada su concentración por D.O. Se sembraron 100 ml de antígeno por pocillo en placas de 96 pocillos (inter Med NUNC)
Se utiliza como primer anticuerpo diluciones seriadas de 1/10 del MCV y suero de los diferentes muestreos. Las muestras se colocan por triplicado, con controles positivos de título conocido y controles negativos. Como segundo anticuerpo una antigamaglobulina bovina realizada en conejo marcada con peroxidasa. El revelado se efectúa con ABTS (SIGMA A 4798)
La D.O. se determinó con Titertek Multiscan a 450 nm. Los resultados fueron expresados en D.O. de acuerdo a las diluciones séricas o de MCV.
Resultados
Identificación bacteriana: En los MCV se observaron por IF formas compatibles con Campylobacter fetus en los 6 muestreos, obteniendo cultivos positivos en 4 de ellos. Las cepas aisladas fueron identificadas con el número del animal, más un número de orden correspondiente a la secuencia del aislamiento (281-1, 281-2, 281-3, 281-4). Cada aislamiento se identificó, de acuerdo a las pruebas bioquímicas citadas anteriormente.
Electroforesis: Las corridas electroforéticas coloreadas con Coomasie blue permitieron visualizar bandas proteicas distribuidas en un rango de peso molecular de 29 a 225 kDa, como se observa a manera de ejemplo la cepa del primer muestreo en la figura 1, que fue utilizada para Wester blooting .
IFI: Fue negativa para los sueros y MCV enfrentados con las diferentes cepas utilizadas, siendo positiva 1/800 para el suero bovino control.
Determinación de patrones de bandas: Se encontraron variaciones en las corridas de las bandas proteicas en los diferentes muestreos. (Figura 1)
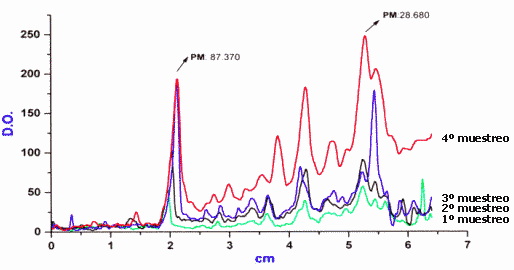
Figura 1: Análisis densitométrico de proteinas de los diferentes aislaientos de Campylobacter fetus fetus
Western blotting: No se obtuvo reconocimiento de las bandas proteicas transferidas a nitrocelulosa de las 4 cepas aisladas por los sueros y MCV obtenidos en los diferentes muestreos. Siendo la totalidad de las bandas reconocidas por el suero bovino control (Imagen 1). Las bandas denominadas a, b y c son las reconocidas por sueros y MCV de animales vacunados con bacterinas comerciales (Figura 3).
Enzimoinmunoensayo: El título máximo obtenido en los diferentes muestreos fue de 1/10. Con dicha dilución se realizó la dinámica de los anticuerpos séricos y del MCV., observándose en el suero la mayor densidad óptica (D.O. 0623) al día 50 descendiendo bruscamente a partir del día 60. El MCV registró su mayor nivel (D.O. 0147) el día 30 para descender en forma moderada, también a partir del día 60. (Figura 2).
Conclusiones
- Se comprobó la persistencia de Campylobacter fetus fetus en el área cérvico-vaginal desde los 4 meses de gestación hasta 1 mes post-parto en un animal vacunado con bacterina comercial.
- Se observaron variaciones en los patrones de las bandas proteicas a través del tiempo.
- Las inmunoglobulinas presentes en suero y MCV no reconocieron las diferentes bandas antigénicas transferidas a nitrocelulosa (Western blotting).
- El título de anticuerpos séricos presentes en MCV es bajo (1/10 por ELISA y negativo por IFI).
Discusión
La persistencia de animales infectados con Campylobacter fetus venerealis hasta 14 meses fue confirmada por diferentes autores (Corbeil, L. et al 1975, 1981 y Blaser, M.1993), no hallando referencias sobre la persistencia en hembras preñadas vacunadas.
Las variaciones en la migración de acuerdo a los pesos moleculares de las bandas proteicas, en los muestreos indican que podrían estar relacionadas con las variaciones antigénicas que permiten persistir al C. f. en el área cérvico-vaginal (Corbeil, L et al 1981y Blaser, M 1993, Grogono-Thomas,R et al .,1999).
Las proteínas denominadas S-Layer pueden expresarse tanto in vivo como in vitro con diferentes masas moleculares y diferente antigenicidad que permiten evadir la respuesta inmune, sumando a dicha variación, la resistencia de S-Layer al sistema de complemento. En nuestro ensayo dichas proteínas persistieron durante la infección presentando variaciones de PM detectadas por densitometría que podrían estar relacionadas con las variaciones antigénicas que permiten al Campylobacter fetus persistir en el área cérvico-vaginal (Corbeil, L et al 1981y Blaser, M 1993, Grogono-Thomas,R et al .,1999).
Lisle, J en 1987 estudia el comportamiento de cepas frente a distintos sueros patrones, encontrando variaciones en la respuesta inmune. En nuestro estudio se obtiene respuesta muy baja en suero y en MCV durante la totalidad del ensayo (títulos máximo 1/10), no encontrando los niveles altos de anticuerpos citados en animales vacunados (Corbeil, L. et al 1974, 1981,1999).
Las bandas proteicas de las diferentes cepas aisladas no son reconocidas en el Western blotting por el suero y MCV del animal, pero son bandas inmunocomprometidas reconocidas por el suero control. Lisle, J et al en 1985 hace referencia a antígenos de Campylobacter fetus que podrían ser enmascarados por anticuerpos locales y así ser capaces de evadir el sistema inmune.
Cobeil, J.; 1981 en un ensayo con dos vacas encuentra que sueros con alto título obtenido a los 49 y 61 días de la infección no reconocen las cepas utilizadas como infectantes. Schuring et al., 1973 comprueba que diferentes antígenos son reconocidos por diferentes sueros obtenidos en un ensayo en los muestreos posinfección.
Este estudio abre un nuevo camino de análisis teniendo en cuenta, la persistencia de infección por Campylobacter fetus fetus en un animal vacunado y preñado hasta el momento del parto, la no repuesta a un inmunógeno comercial por la vía clásica y el no reconocimiento antigénico por parte de la inmunidad local y sistémica, que implican estudios más profundos sobre los factores inherentes al agente infeccioso y al huésped susceptible en esta enfermedad venérea.
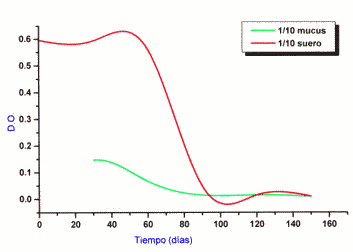
Figura 2: Dinámica de anticuerpos de hembra bovina vacunada en suero y MCV
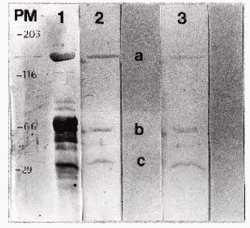
PM: Peso molecular
Línea 1: Bandas reconocidas por suero de animal experimentalmente infectado
Línea 2 y 3: Bandas reconocidas frente a suero y MCV de bovino vacunado, respectivamente
Figura 3: Wester blotting con cepa C.f. suero de hembra bovina experimentalmente infectada, suero y MCV correspondientes al primer muestreo.
Bibliografía
BLASER, M. Role of the S- Layer proteins of Campylobacter fetus in Serum-Resistance and antigenic variation: A model of bacterial pathogenesis. Inf. Imun.306 5 : 325-329.1993
CATENA M, CALLEJAS S, SOTO P, ABA M, ECHEVARRÍA H, MONTEAVARO C, MAZZOLLI A. Efectos de la infección experimental con Campylobacter fetus venerealis sobre la preñez temprana en vaquillonas. In Vet; 2003, 1: 37-44.
CORBEIL, L., Inmunization and Diagnosis in Bovine Reproductive Tract Infections. Adv.Vet. Med. 41- 217:239 1999
CORBEIL, L.;. CORBEIL, A.;.WINTER, A. Bovine venereal vibriosis: Activity of inflammatory cells in protective immunity. Am. J. Vet. Res. vol 36, 4 : 403-406. 1975.
CORBEIL, L.;. DUNCAN,J.; SCHURING, G.; WINTER, A. Bovine venereal vibriosis variation in immunoglobulin class of antibodies in genital secretions and serum. Infect.Immun.10, 1084-1090 1974
CORBEIL, L.; SCHURING, G.; PIER, P.; WINTER, A. Bovine venereal vibriosis: Antigenic variation of the bacterium during infection. Inf. Inmun. 3, 854 1981
DUBREIL, J.; KOSTRZYNSKA, M., AUSTIN, J.; TRUST, T. Antigenic differences among Campylobacter fetus S-Layer proteins. J. Bacteriol. 172. 9: 5035-5043. 1990.
DUNCAN, J.; WILKIE, B.; Natural and immune antibodies of Vibrio fetus in serum and vaginal mucus. Infect. Immun, 109: 422-429. 1972.
GROGONO-THOMAS, R.; DWORKIN, J.; BLASER, M.; NEWELL, D.Roles of the Surface Layer Proteins of Campylobacter fetus subsp. fetus in ovine abortion. Infect. Inmun. 68: 1687-1691. 2000.
LAEMMLI, U.K.Cleavage of structural proteins during the assembly of the head of bacteriophageT4. Nature 227: 680-685. 1970.
LISLE,G., A.; PETTETT, A.; WALL, E.; COLLINS D. An examination of Campylobacter fetus subsp. fetus by restriction endonuclease analysis and serology. Vet. Microbiol. 14: 53-60. 1987
ON, S Identification Methods for Campylobacter, Helicobacter and related organisms. Clin. Microbiol.Rev. 9. 3: 405-422 .1996
TERZOLO, H.; ARGENTO, E, CATENA, M.; CIPOLLA, A.; CORDEVIOLA, J. ; TEJADA, G.; VILLA, J. Procedimientos de laboratorio para el diagnóstico de la campilobacteriosis y trichomoniasis genital bovina. AAVLD, C.C.P. de Enfermedades Venéreas. 1: 33. 1993
TOWBIN, H, ; STAEHELIN, T.; GORDON, J. Electrophoretic transfer of protein from polyacrilamide gels to nitrocellulose sheets: procedure and some applications. Proc. Natl. Acad. Sci. 74: 4350-4354. 1979
VANDAMME P., DEWHIRST F, PASTER, B.J. ON, S. L. W. Genus I. Campylobacter .In Bergey`s Manual of Systematic Bacteriology. Second edition, 2005. Ed. Spriger. 1147-1168
WESLEY, I; BRYNER, J Antigenic and restriction enzyme analysis of isolates of Campylobacter fetus subsp venerealis recovered from persistently infected cattle. Am. J. Vet. Res, vol 50: 807-813. 1989
De dicho animal se efectuaron muestreos seriados de mucus cérvico-vaginal (MCV) para determinar la persistencia de la infección, mediante inmunofluorescencia directa (IFD), cultivo en medios selectivos y posterior tipificación bioquímica. La respuesta inmune fue medida a través de los sueros y MCV obtenidos en los diferentes muestreos, mediante Enzimainmunoensayo e Inmunofluorescencia indirecta (IFI). Posteriormente, por Western blotting se realizó el reconocimiento de bandas.
Las cepas aisladas en los diferentes muestreos fueron identificadas bioquímicamente como Campylobacter fetus subsp. fetus. En el Western blotting no se observó el reconocimiento de la mayoría de las bandas y las titulaciones de inmunoglobulinas séricas y en MCV presentaron títulos negativos o muy bajos.
Los datos obtenidos demuestran la persistencia de la infección vaginal con Campylobacter fetus fetus durante la gestación, con escasa o nula respuesta inmune a nivel sistémico y del tracto reproductivo.
Palabras claves:infección persistente, Campylobacter fetus fetus, preñez, bovino vacunado
Introducción
La campilobacteriosis genital bovina (CGB) es una enfermedad infecciosa venérea, causada por Campylobacter fetus fetus (C.f.f.) y Campylobacter fetus venerealis (C.f.v.) que se caracteriza por producir mortalidad embrionaria y abortos esporádicos, con pérdidas económicas que van en detrimento del desarrollo en los sistemas de producción de nuestra ganadería.(Bryner et al, 1971), considerando que un 10% de las pérdidas durante la gestación temprana corresponden a enfermedades infecciosas. La hembra se infecta durante el servicio, mediante el cual, el Campylobacter fetus (C.f.) es depositado en vagina en forma conjunta con el semen pudiendo quedar acantonado en el área cérvico-vaginal o colonizar útero provocando mortalidad embrionaria o aborto.
La presencia de la enfermedad durante varios ciclos reproductivos, puede ser atribuible a que no sean detectados la totalidad de los animales enfermos, ya sea, por fallas en el diagnóstico, en las medidas de manejo, profilaxis, o a la presencia de hembras portadoras dentro del rodeo. Estas hembras no siempre son detectadas y tienen importancia epidemiológica por estar persistentemente infectadas y ser transmisoras de la enfermedad de un período reproductivo a otro pudiendo presentar fallas reproductivas o no, con presencia de la bacteria en el área cérvico-vaginal.
Dicha persistencia puede ser de hasta 14 meses (Corbeil, L. 1975, Blaser, M.1993) coincidiendo con variaciones antigénicas de la superficie bacteriana de C.f. asociadas a proteínas de alto peso molecular (S-Layer), las cuales están relacionadas con la virulencia de la bacteria y la resistencia de las cepas a la fagocitosis. (Blaser, M.; 1993). Cepas de C.f. con iguales patrones de restricción de bandas, difieren su comportamiento cuando son enfrentadas con sueros específicos, con un pequeño rango de antígenos expresados que son reconocidos por el huésped y de esta manera, permitiendo su persistencia en el tracto reproductor (Lisle, G. 1987). La respuesta inmune sistémica en animales vacunados demuestra altos niveles de IgG, estando también presente en secreciones uterinas y vaginales con predominio de la IgA, con prevención en infecciones posteriores y algunos casos la cura de animales con infección crónica. (Corbeil, L., 1974, 1999).
En este trabajo, se presenta un caso particular de infección persistente a Campylobacter fetus fetus en el área cérvico-vaginal de una hembra preñada desde a los 4 meses de gestación hasta el momento del parto. Las cepas aisladas durante la infección presentaron variaciones antigénicas asociadas a proteínas de diferente peso molecular no siendo reconocidas por los anticuerpos a nivel local y sistémico.
Materiales y métodos
Rodeo:
Se tomaron muestras de una hembra Holando Argentino con 4 meses de gestación hasta el momento del parto, proveniente de un establecimiento de tambo del partido de Tandil, Pcia. de Bs. As, con antecedentes de la enfermedad, en el cual se realizó un ensayo de vacunación para medir la respuesta inmune sérica y local, utilizando una bacterina comercial a Campylobacter fetus con las dos subespecies, en dos dosis, siendo inoculada la ultima dosis 15 días previos al servicio.
Las muestras consistieron en mucus cérvico-vaginal (MCV) extraídas mediante la jeringa de Cassou y vainas azules y sangre para la extracción de suero, con intervalos de aproximadamente 30 días durante 6 meses.
Identificación bacteriana:
Los MCV se procesaron por IFD y fueron sembrados en medio Skirrow con sangre equina hemolizada y mezcla antibiótica de rutina para el aislamiento de Campylobacter. (Terzolo, H y col.,1993). Las placas se incubaron hasta 10 días a 37º C, con una atmósfera de 85% de N2, 10% de CO2, y 5% de O2.
Las bacterias aisladas posteriormente se tipificaron bioquímicamente, realizando las siguientes pruebas: catalasa, oxidasa, producción de H2S en medios sensibilizados con 0,002% de cisteína, utilizando para la detección tiras de papel embebidas en acetato de plomo, crecimiento en glicina 1%, ClNa 4% y desarrollo a 42º C. (On, S, 1996; Vandamme, P et al, 2005)
Obtención de extracto bacteriano para electroforesis en gel de poliacrilamida:
Las células bacterianas fueron colectadas con 0.01 M de buffer fosfato pH 7 y lavadas 3 veces por centrifugación. La concentración de los pellet bacteriano se ajustó a 3,5 mg/ml de proteína (Brooks,B. et al, 1996).
Electroforesis:
Las preparaciones bacterianas para SDS-PAGE se procesaron según la metodología de Laemmli (1970). Diez microlitros de cada muestra ajustadas por densidad óptica, fueron separadas en geles de poliacrilamida al 10% utilizando una cuba de electroforesis vertical (Hoefer, USA).
Western blotting:
Se transfirieron las bandas proteicas obtenidas a papel de nitrocelulosa mediante la aplicación del método de Towbin y col (1979) utilizando un equipo de transferencia electroforética horizontal (Nova Blot Pharmacia).
Para el reconocimiento de las diferentes bandas se usaron los sueros puros y en diluciones 1/10 correspondientes a los diferentes muestreos y como segundo anticuerpo una antigammaglobulina bovina marcada con peroxidasa (Sigma A-7414). Se utilizó como control un suero bovino proveniente de una vaquillona infectada experimentalmente, el cual fue titulado por IFI y microaglutinación en 1/800.
Determinación de patrones de bandas
Se efectuó con un densitómetro de barrido utilizando para su lectura un software adecuado (Hoeffer GS 300). Para determinar los patrones de banda se utilizó una mezcla de estandares de peso molecular conocido.
Inmunofluorescencia indirecta:
Se utilizaron portaobjetos adecuados para I.F. conteniendo doce áreas marcadas de 6 mm. En cada área se fijó mediante acetona C.f.f. en concentraciones constantes, posteriormente se enfrentaron con diluciones seriadas 1/ 10 de los sueros y MCV. Como segundo anticuerpo se utilizó una antigamaglobulina bovina realizada en conejo, utilizando para su detección una IgG anticonejo marcada con isotiocianato de fluoresceína (Sigma, F-0382). En cada portaobjetos se utilizaron controles positivos con los sueros mencionados anteriormente y como negativos sueros de terneros.
Enzimainmunoensayo
Un pool de las cepas obtenidas en los diferentes muestreos fue cultivado según lo descripto anteriormente. La suspensión obtenida de las placas fue lavada 3 veces con PBSS pH 7 a 4º C a 8000 rpm. El pellets del lavado de las placas, fue resuspendido en buffer carbonato (0.05 M pH 9.6) para ser ajustada su concentración por D.O. Se sembraron 100 ml de antígeno por pocillo en placas de 96 pocillos (inter Med NUNC)
Se utiliza como primer anticuerpo diluciones seriadas de 1/10 del MCV y suero de los diferentes muestreos. Las muestras se colocan por triplicado, con controles positivos de título conocido y controles negativos. Como segundo anticuerpo una antigamaglobulina bovina realizada en conejo marcada con peroxidasa. El revelado se efectúa con ABTS (SIGMA A 4798)
La D.O. se determinó con Titertek Multiscan a 450 nm. Los resultados fueron expresados en D.O. de acuerdo a las diluciones séricas o de MCV.
Resultados
Identificación bacteriana: En los MCV se observaron por IF formas compatibles con Campylobacter fetus en los 6 muestreos, obteniendo cultivos positivos en 4 de ellos. Las cepas aisladas fueron identificadas con el número del animal, más un número de orden correspondiente a la secuencia del aislamiento (281-1, 281-2, 281-3, 281-4). Cada aislamiento se identificó, de acuerdo a las pruebas bioquímicas citadas anteriormente.
Electroforesis: Las corridas electroforéticas coloreadas con Coomasie blue permitieron visualizar bandas proteicas distribuidas en un rango de peso molecular de 29 a 225 kDa, como se observa a manera de ejemplo la cepa del primer muestreo en la figura 1, que fue utilizada para Wester blooting .
IFI: Fue negativa para los sueros y MCV enfrentados con las diferentes cepas utilizadas, siendo positiva 1/800 para el suero bovino control.
Determinación de patrones de bandas: Se encontraron variaciones en las corridas de las bandas proteicas en los diferentes muestreos. (Figura 1)

Figura 1: Análisis densitométrico de proteinas de los diferentes aislaientos de Campylobacter fetus fetus
Western blotting: No se obtuvo reconocimiento de las bandas proteicas transferidas a nitrocelulosa de las 4 cepas aisladas por los sueros y MCV obtenidos en los diferentes muestreos. Siendo la totalidad de las bandas reconocidas por el suero bovino control (Imagen 1). Las bandas denominadas a, b y c son las reconocidas por sueros y MCV de animales vacunados con bacterinas comerciales (Figura 3).
Enzimoinmunoensayo: El título máximo obtenido en los diferentes muestreos fue de 1/10. Con dicha dilución se realizó la dinámica de los anticuerpos séricos y del MCV., observándose en el suero la mayor densidad óptica (D.O. 0623) al día 50 descendiendo bruscamente a partir del día 60. El MCV registró su mayor nivel (D.O. 0147) el día 30 para descender en forma moderada, también a partir del día 60. (Figura 2).
Conclusiones
- Se comprobó la persistencia de Campylobacter fetus fetus en el área cérvico-vaginal desde los 4 meses de gestación hasta 1 mes post-parto en un animal vacunado con bacterina comercial.
- Se observaron variaciones en los patrones de las bandas proteicas a través del tiempo.
- Las inmunoglobulinas presentes en suero y MCV no reconocieron las diferentes bandas antigénicas transferidas a nitrocelulosa (Western blotting).
- El título de anticuerpos séricos presentes en MCV es bajo (1/10 por ELISA y negativo por IFI).
Discusión
La persistencia de animales infectados con Campylobacter fetus venerealis hasta 14 meses fue confirmada por diferentes autores (Corbeil, L. et al 1975, 1981 y Blaser, M.1993), no hallando referencias sobre la persistencia en hembras preñadas vacunadas.
Las variaciones en la migración de acuerdo a los pesos moleculares de las bandas proteicas, en los muestreos indican que podrían estar relacionadas con las variaciones antigénicas que permiten persistir al C. f. en el área cérvico-vaginal (Corbeil, L et al 1981y Blaser, M 1993, Grogono-Thomas,R et al .,1999).
Las proteínas denominadas S-Layer pueden expresarse tanto in vivo como in vitro con diferentes masas moleculares y diferente antigenicidad que permiten evadir la respuesta inmune, sumando a dicha variación, la resistencia de S-Layer al sistema de complemento. En nuestro ensayo dichas proteínas persistieron durante la infección presentando variaciones de PM detectadas por densitometría que podrían estar relacionadas con las variaciones antigénicas que permiten al Campylobacter fetus persistir en el área cérvico-vaginal (Corbeil, L et al 1981y Blaser, M 1993, Grogono-Thomas,R et al .,1999).
Lisle, J en 1987 estudia el comportamiento de cepas frente a distintos sueros patrones, encontrando variaciones en la respuesta inmune. En nuestro estudio se obtiene respuesta muy baja en suero y en MCV durante la totalidad del ensayo (títulos máximo 1/10), no encontrando los niveles altos de anticuerpos citados en animales vacunados (Corbeil, L. et al 1974, 1981,1999).
Las bandas proteicas de las diferentes cepas aisladas no son reconocidas en el Western blotting por el suero y MCV del animal, pero son bandas inmunocomprometidas reconocidas por el suero control. Lisle, J et al en 1985 hace referencia a antígenos de Campylobacter fetus que podrían ser enmascarados por anticuerpos locales y así ser capaces de evadir el sistema inmune.
Cobeil, J.; 1981 en un ensayo con dos vacas encuentra que sueros con alto título obtenido a los 49 y 61 días de la infección no reconocen las cepas utilizadas como infectantes. Schuring et al., 1973 comprueba que diferentes antígenos son reconocidos por diferentes sueros obtenidos en un ensayo en los muestreos posinfección.
Este estudio abre un nuevo camino de análisis teniendo en cuenta, la persistencia de infección por Campylobacter fetus fetus en un animal vacunado y preñado hasta el momento del parto, la no repuesta a un inmunógeno comercial por la vía clásica y el no reconocimiento antigénico por parte de la inmunidad local y sistémica, que implican estudios más profundos sobre los factores inherentes al agente infeccioso y al huésped susceptible en esta enfermedad venérea.

Figura 2: Dinámica de anticuerpos de hembra bovina vacunada en suero y MCV

PM: Peso molecular
Línea 1: Bandas reconocidas por suero de animal experimentalmente infectado
Línea 2 y 3: Bandas reconocidas frente a suero y MCV de bovino vacunado, respectivamente
Figura 3: Wester blotting con cepa C.f. suero de hembra bovina experimentalmente infectada, suero y MCV correspondientes al primer muestreo.
Bibliografía
BLASER, M. Role of the S- Layer proteins of Campylobacter fetus in Serum-Resistance and antigenic variation: A model of bacterial pathogenesis. Inf. Imun.306 5 : 325-329.1993
CATENA M, CALLEJAS S, SOTO P, ABA M, ECHEVARRÍA H, MONTEAVARO C, MAZZOLLI A. Efectos de la infección experimental con Campylobacter fetus venerealis sobre la preñez temprana en vaquillonas. In Vet; 2003, 1: 37-44.
CORBEIL, L., Inmunization and Diagnosis in Bovine Reproductive Tract Infections. Adv.Vet. Med. 41- 217:239 1999
CORBEIL, L.;. CORBEIL, A.;.WINTER, A. Bovine venereal vibriosis: Activity of inflammatory cells in protective immunity. Am. J. Vet. Res. vol 36, 4 : 403-406. 1975.
CORBEIL, L.;. DUNCAN,J.; SCHURING, G.; WINTER, A. Bovine venereal vibriosis variation in immunoglobulin class of antibodies in genital secretions and serum. Infect.Immun.10, 1084-1090 1974
CORBEIL, L.; SCHURING, G.; PIER, P.; WINTER, A. Bovine venereal vibriosis: Antigenic variation of the bacterium during infection. Inf. Inmun. 3, 854 1981
DUBREIL, J.; KOSTRZYNSKA, M., AUSTIN, J.; TRUST, T. Antigenic differences among Campylobacter fetus S-Layer proteins. J. Bacteriol. 172. 9: 5035-5043. 1990.
DUNCAN, J.; WILKIE, B.; Natural and immune antibodies of Vibrio fetus in serum and vaginal mucus. Infect. Immun, 109: 422-429. 1972.
GROGONO-THOMAS, R.; DWORKIN, J.; BLASER, M.; NEWELL, D.Roles of the Surface Layer Proteins of Campylobacter fetus subsp. fetus in ovine abortion. Infect. Inmun. 68: 1687-1691. 2000.
LAEMMLI, U.K.Cleavage of structural proteins during the assembly of the head of bacteriophageT4. Nature 227: 680-685. 1970.
LISLE,G., A.; PETTETT, A.; WALL, E.; COLLINS D. An examination of Campylobacter fetus subsp. fetus by restriction endonuclease analysis and serology. Vet. Microbiol. 14: 53-60. 1987
ON, S Identification Methods for Campylobacter, Helicobacter and related organisms. Clin. Microbiol.Rev. 9. 3: 405-422 .1996
TERZOLO, H.; ARGENTO, E, CATENA, M.; CIPOLLA, A.; CORDEVIOLA, J. ; TEJADA, G.; VILLA, J. Procedimientos de laboratorio para el diagnóstico de la campilobacteriosis y trichomoniasis genital bovina. AAVLD, C.C.P. de Enfermedades Venéreas. 1: 33. 1993
TOWBIN, H, ; STAEHELIN, T.; GORDON, J. Electrophoretic transfer of protein from polyacrilamide gels to nitrocellulose sheets: procedure and some applications. Proc. Natl. Acad. Sci. 74: 4350-4354. 1979
VANDAMME P., DEWHIRST F, PASTER, B.J. ON, S. L. W. Genus I. Campylobacter .In Bergey`s Manual of Systematic Bacteriology. Second edition, 2005. Ed. Spriger. 1147-1168
WESLEY, I; BRYNER, J Antigenic and restriction enzyme analysis of isolates of Campylobacter fetus subsp venerealis recovered from persistently infected cattle. Am. J. Vet. Res, vol 50: 807-813. 1989
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicaciónUNICEN
12 de febrero de 2007
El artículo completo fue presentado en la XI Reunión Científico Técnica de la AVVLD. Azul, Pcia de Bs. As, Argentina. Diciembre de 1998.
UNICEN
30 de agosto de 2006
El trabajo refleja el comportamiento de una hembra con infección persistente en la cual se muestra la variación antigénica de las cepas, lo que permite persistir a la bacteria en el área cérvico-vaginal, la pòsibilidad de llevar una preñez a término y el reconocimiento del sistema inmune de las cepas actuantes.
Con referencia a la cantidad de animales con infección persistente en un rodeo se desconoce aunque se estimaría en un 10.
29 de agosto de 2006
Es interesante el tema. Deseo saber, si es posible, qué porcentaje de hembras infectadas logran una gestación normal, ya que considero sería el punto clave para erradicar la enfermedad en un rodeo problema.

12 de febrero de 2007
Oi sou estudante de veterinaria e estou fazendo minha monografia, gostei muito desse artigo e gostaria de utiliza-lo para compor meu trabalho. Porem, a data em que este artigo foi publicado nao aparece, seria possivel me ceder? Grata.
Renata

4 de septiembre de 2006
Me parecio interesante el estudio, lo que saco en limpio de todo esto es que lo mejor seria hacer autovacunas, con las cepas actuantes de cada establecimiento, ya que las vacunas comerciales no dan proteccion,algo similar a lo que ocurre con Moraxella bovis, en la queratoconjuntivitis.

30 de agosto de 2006
Soy Alejo Carretto de Suipacha (Bs As) y me dedico a la insemiancion artificial en mi zona y alrededores y con respecto a esta enfermedad me gustaria saber un par de cosas si alguien me podria ayudar.
1) Como fue servida esta vaca? me supongo que con toro
2)Como es posible que se enferme una vez preñada, o sea, en periodo de gestacion?
3)Influye la edad y raza del animal para esta enfermedad?
4)Como seria el tratamiendo mientras esta preñana y si es algo remediable y puede seguir prestando servicios?
5)El echo de que este enferma mientras gesta significa la perdida de la cria?
Muchisimas gracias para quien me pueda aclarar estas preguntas, tengo 24 años y me intereza mucho la reproduccion y genetica animal y por consecuente todo lo que refiere a ello. Saludos
29 de agosto de 2006
Muy interesente el trabajo de las colegas, pero a ver si entendí bien: lo que tratan de demostrar es que la bacteria se acomoda inmunológicamente en la mucosa, y no es tomada en cuenta por el organismo del animal, y por ende no se presentan síntomas, dependiendo del tipo de vacuna usada con las cepas correspondientes?









