Propiedades nutracéuticas de la carne de bovinos
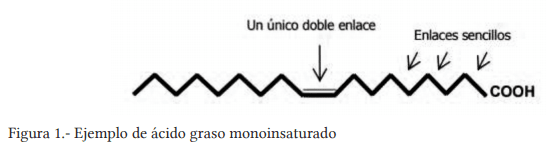
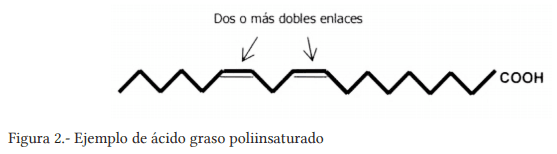
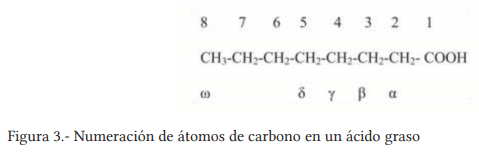
Banu, J., Bhattacharya, A., Rahman, M., Rahman M., O´shea M., and Fernandes G. 2006. Effects of conjugated linoleic acid and exercise on bone mass in young male Balb/C mice. Lipids Health Dis. 5:7.
Bauman D.E. and Griinari J.M. 2001. Regulation and nutritional manipulation of milk fat: Low-fat milk syndrome. Livest. Prod. Sci. 70:15–29.
Bauman D.E., Baumgard L.H., Corl B.A., and Griinari J.M. 1999. Biosynthesis of conjugated linoleic acid in ruminants. J. Anim. Sci. 77:1-15.
Bauman D.E., Barbano D.M., Dwyer D.A., and Griinari J.M. 2000. Technical note: Production of butter with enhanced conjugated linoleic acid for use in biomedical studies with animal models. J. Dairy Sci. 83:2422–2425.
Bhattacharya, A., Banu, J., Rahman, M., et al. 2006. Biological effects of conjugated linoleic acid in health and disease. J. Nutr. Biochem. 17: 789-810.
Brownbill, R.A., Petrosian, M., Ilich, J.Z. 2005. Association between dietary conjugated linoleic acid and bone mineral. J. Am. Coll. Nutr. 24: 177-181.
Cesano, A., S. Visonneau, J.A. Scimeca, D. Kritchevsky, and D. Santoli. 1998. Opposite effects of linoleic acid and conjugated linoleic acid on human prostatic cancer in SCID mice. Anticancer Res. 18:833-838.
Cook M. E., Miller C. C., Park Y., and Pariza M. 1993. Immune modulation by altered nutrient metabolism: Nutritional control of immune-induced growth depression. Poult. Sci. 72:1301-1305.
Grummer R. R. and Rabelo E. 1999. Factors affecting digestibility of fat supplements. Proceedings of the Pacific Northwest Animal Nutrition Conference. pp 159-173.
Ha Y. L., Grimm N. K., and Pariza M. W. 1987. Anticarcinogens from fried ground beef: heat altered conjugated linoleic acid. Carcinogenesis 8, 1881-1887.
Houseknecht, K. L., J. P. Vanden Heuvel, S. Y. Moya-Camarena, C. P. Portocarrero, L. W. Peck, K. P. Nickel, and M. A. Belury. 1998. Dietary conjugated linoleic acid normalizes impaired glucose tolerance in the Zucker diabetic fatty fa/fa rat. Biochem. Biophys. Res. Commun. 244:678-682.
Innis S. M. 1992. Plasma and red blood cell fatty acid values as indexes of essential fatty acids in the developing organs of infants fed with milk or formula. J. Pediatr 120:S78-86
Ip, C., Lisk D. J. and Scimeca J. A. 1994. Potencial of food modification in cancer prevention. Cancer Res., 54 (Supp.): 1957S-1959S.
Khanal, R.C. 2004. Potential health benefits of conjugated linoleic acid (CLA): A review. Asian-Australian Journal of Animal Sciences 17(9): 1315-1328.
Kinsella J. E. 1986. Food components with potential therapeutic benefit: the n-3 polyunsaturated fatty acids of fish oils. Food Technol. 40:89-97
Lapillone A., Clark S. D., and Heird W. C. 2004. Polyunsaturated fatty acids and gene expressio. Lipid metabolism and therapy. Curr Opin Clin Nutr Metab Care 7:151-6
Lee K. N., Kritchevsky D., and Pariza M. 1994. Conjugated linoleic acid and atherosclerosis in rabbits. Atherosclerosis 108:19-25.
Li Y. and Watkins B. A. 1998. Conjugated linoleic acids alter bone fatty acid composition and reduce ex vivo prostaglandin E2 biosynthesis in rats fed n-6 or n-3 fatty acids. Lipids 33:417-425.
Lock A.L., Bauman D.E., and Garnsworthy P.C. 2005. Short communication: Effect of production variables on the cis-9, trans-11 conjugated linoleic acid content of cows milk. J. Dairy Sci. 88:2714-2717.
McGuire, M. A., and McGuire M. K. 2000. Conjugated linoleic acid (CLA): A ruminant fatty acid with beneficial effects on human health. Proc. Am. Soc. Anim. Sci., 1999.
Menard C. Patenaude C., Gagne A. M., and Massicotte G. 2009. AMPA receptor-mediated cell death is reduced by docosahexaenoic acid but not by eicosapentaenoic acid in área CA1 of hippocampal slice cultures. J. Neurosci Res. 87:876-886.
Miller C. C., Park Y., Pariza M., and Cook M. E. 1994. Feeding conjugated linoleic acid to animals partially overcomes catabolic responses due to endotoxin injection. Biochem. Biophys. Res. Commun. 198:1107-1112.
Moloney, F., Toomey, S., Noone, E., Nugent A., Allan B., Loscher C. E., and Roche H. M. 2007. Antidiabetic effects of cis-9, trans-11-conjugated linoleic acid may be mediated via anti-inflammatory effects in white adipose tissue. Diabetes 56: 574-582.
Munday J. S., Thompson K. G., and James K. A. M. 1999. Dietary conjugated linoleic acids promote fatty streak formation in the C57BL/6 mouse atherosclerosis model. Br. J. Nutr. 81:251-255.
Nicolosi R. J., Rogers E. J., Kritchevsky D., Scimeca J. A., and Huth P. J. 1997. Dietary conjugated linoleic acid reduces plasma lipoproteins and early aortic atherosclerosis in hypercholesterolemic hamsters. Artery 22:266-277.
NRC. 1996. Carcinogens and Anticarcinogens in the Human Diet. National Academy Press, Washington, D.C.
Ostrowska E., Muralitharan M., Cross R. F., Bauman D. E., and Dunshea F. R. 1999. Dietary conjugated linoleic acids increase lean tissue and decrease fat deposition in growing pigs. J Nutr. 129:2037-2042.
Pariza M. W., Loretz L. J., Storkson J. M. and Holland N. C.1983. Mutagens and modulators of mutagenesis in fried ground beef. Cancer Research 43:2444s-2446s.
Pariza, M.W. 2004. Perspectiva on the safety and effectiveness of conjugated linoleic acid. Am. J. Clin. Nutr., 79(Supp.): 1132S-6S.
Park Y., Albright K. J., Liu W., Storkson J. M., Cook M. E., and Pariza M. 1997. Effect of conjugated linoleic acid on body composition in mice. Lipids 32:853-858.
Park, Y., M. K. McGuire, R. Behre, M. A. McGuire Park Y., Storkson J.M., Albright K.J., Liu W., and Pariza M.W. 1999. Evidence that the trans-10, cis12 isomer of conjugated linoleic acid induces body composition changes in mice. Lipids. 34: 235–241.
Parodi P. 2004. Milk fat in human nutrition. Australian J. Dairy Technol. 59:3-59.
Ritzenthaler K., Michelle K., McGuire R.F., Shultz T.D., Nairanjana D., McGuire M.A. 2001. Estimation of conjugated linoleic acid intake by written dietary assessment methodologies underestimates actual intake evaluated by food duplicate methodology. J. Nutr. 131:1548-1554.
Ruiz-Flores A., Sagarnaga-Villegas M.L., Salas-González J.M., Mariscal-Aguayo V., Estrella-Quintero H., González-Alcorta M., Juárez-Zárate A. 2004. Impacto del TLCAN en la Cadena de Valor de Bovinos para Carne. Universidad Autónoma Chapingo. http://www.cnog.com.mx/Estudios/ Estudios/Impacto%20del%20TLCAN%20e n%20la%20cadena%20Bovinos%20para%20Carne.pd.
Simopoulos A. P. 2010. Genetic variants in the metabolism of omega-6 and omega-3 fatty acids: their role in the determination of nutritional requirements and chronic disease risk. Exp. Biol. Med. 235:785-795
Song H.J., Grant I., Rotondo D., Mohede I., Sattar N., Heys S. D., Wahle K. W. 2005. Effect of CLA supplementation on immune function in young healthy volunteers. Eur. J. Clin. Nutr. 59(4): 508-517.
Tricon S., Burdge G.C., Kew S., Banerjee T., Russell J. J., Grimble R. F., Williams C. M., Calder P. C., and Yaqoob P. 2004. Effects of cis-9, trans-11 and trans-10, cis-12 conjugated linoleic acid on immune cell function in healthy humans. Am. J. Clin. Nutr. 80(6): 1626-1633.
Vilaboa, A., J., P. Díaz R., O. Ruiz R., D. Platas R., S. González M., F. Juárez L. 2009. Patrones de consumo de carne bovina en la región del Papaloapan, Veracruz, México. Agricultura, Sociedad y Desarrollo 6:145-159.
Visonneau S., Cesano A., Tepper S. A., Scimeca J. A., Santoli D., and Kritchevsky D. 1997. Conjugated linoleic acid suppresses the growth of human breast adenocarcinoma cells in SCID mice. Anticancer Res. 17:969-974.
Wall R., Ross R. P., Fitzgerald G. F., and Stanton C. 2010. Fatty acids from fish: the antiinflammatory potential of long-chain omega-3 fatty acids. Nutr. Rev. 68:280-289.





