Introducción
La enorme complejidad de la materia orgánica (MO) y su importancia en la fertilidad del suelo han promovido una gran cantidad de estudios orientados a conocer su naturaleza y relaciones con los procesos productivos en sistemas agrícolas. Los fraccionamientos de la MO del suelo basados en fracciones definidas físicamente se están utilizando intensamente para interpretar la dinámica de la MO del suelo ya que se ha comprobado que los fraccionamientos químicos tienen poca explicabilidad en estudios agronómicos porque tanto los ácidos húmicos como los fúlvicos tienen tasas de reciclaje muy bajas (Anderson y Paul, 1984) por lo que no están involucrados en los procesos a corto plazo que determinan la productividad de un cultivo. También es desconocida la importancia de esas fracciones en los grandes procesos del suelo, tales como la agregación y la mineralización de la MO (Feller y Beare, 1997).
Las asociaciones de la MO con los constituyentes minerales del suelo, principalmente arcillas minerales son muy importantes, ya que regulan la mineralización y el almacenaje de MO (Greenland, 1965a, 1965b). Es reconocida la relación entre la dinámica de la MO con la textura y la estructura del suelo, por lo cual, conseguir una cuantificación de la MO ligada a las fracciones granulométricas, permite mejorar el poder explicativo de los fraccionamientos.
En los últimos años, el reconocimiento de los efectos perjudiciales del laboreo sobre las propiedades físicas, químicas y biológicas del suelo, ha conducido a la adopción creciente de prácticas de manejo que diminuyen el disturbio del suelo. En Argentina, la superficie bajo siembra directa (SD) alcanzó 11 millones de ha en 2001 (AAPRESID, 2001); por lo que hay gran interés en estudios sobre dinámica de nutrientes bajo este sistema. La SD en general aumenta la cantidad de N activo del suelo y de C y N de la biomasa microbiana, produciendo una estratificación de estas fracciones en el perfil del suelo (Doran, 1987; Follet y Schimel, 1989; Alvarez et al., 1998). La inclusión de pasturas en las rotaciones agrícolas produce recuperación de suelos degradados por laboreo; en el SE de Buenos Aires se ha verificado que una pastura de 3 a 4 años después de un ciclo agrícola de 6 a 7, aumenta la MO hasta un nivel próximo al original (Studdert et al., 1997), aunque es posible que ya en los primeros años de pastura ocurra un aumento en disponibilidad de N debido a la contribución vegetal a fracciones lábiles fácilmente mineralizables.
Los objetivos del presente trabajo fueron: a) ajustar la técnica para fraccionar la materia orgánica y b) analizar el efecto de los sistemas de manejo del suelo (labranza convencional, siembra directa y pastura) sobre la distribución por tamaño de partículas de la materia orgánica de un suelo sometido durante 23 años a laboreos de tipo convencional. Se presupone que los efectos del laboreo sobre la distribución de la materia orgánica alteran sólo las fracciones más lábiles, es decir las de mayor tamaño, ya que las menores estarían físicamente protegidas (Kristensen et al., 2000) y por lo tanto, no resultarían alteradas por el manejo.
Materiales y Métodos
Sitio experimental.El experimento se realizó en el campo Experimental del INTA Balcarce (37º 45´ S, 58º 18´ W, 130 m sobre o nivel del mar, precipitación media anual 870 mm, temperatura media anual 13,7ºC). El área está ubicada sobre un complejo de suelos Paleudol petrocálcico - Argiudol típico, sometidos a rotaciones agrícolas bajo labranza convencional (arado de rejas, rastra de discos) durante 17 años (desde 1976 a 1993). A partir de 1994 se instalaron tres manejos: Labranza Convencional (LC), Siembra Directa (SD) y pastura (P), en un diseño en bloques al azar con 3 repeticiones. Algunas propiedades del suelo son: pH (relación suelo:H2O 1: 2,5) 6,3, CIC 33,1 cmol(+) kg-1, arcilla 265 g kg-1, limo 337 g kg-1, P disponible, Bray y Kurtz I 22 mg kg-1, C orgánico 27,1 g kg-1, N total 2,87 g kg-1 .
En diciembre de 2000 se tomaron muestras de suelo compuestas en las parcelas LC, SD y P, de 0-10 y 10-20 cm, se secaron al aire, se tamizaron por 2 mm y se almacenaron hasta su análisis. Los contenidos de C orgánico de estas muestras fueron 26,2, 26,8 y 28,2 g C kg-1, para LC, SD y P, respectivamente.
Ajuste metodológico. El principal objetivo metodológico de un fraccionamiento físico es alcanzar la máxima dispersión del suelo (separación de arena, limo y arcilla) con una mínima alteración de la MO asociada. Debido a que el método utilizado en este trabajo fue inicialmente desarrollado para suelos tropicales (Gavinelli et al., 1995) y, a la naturaleza diferente de los agentes cementantes en suelos templados (mayor predominio de cationes bivalentes, Ca y Mg y arcillas de tipo 2:1), se decidió realizar algunas pruebas para confirmar si el método era adecuado para dispersar las partículas sin desnaturalizar la MO. Para dicho ajuste, se utilizó el suelo del tratamiento Pastura (P) de 0-10 cm de profundidad. Para comprobar la calidad del fraccionamiento debida al agente dispersante, se compararon la distribución de la fracción mineral del suelo con la MO destruida por calentamiento con agua oxigenada (H2O2) vs. a) dispersión en agua (30 g de suelo en 100 mL de agua desionizada) y b) dispersión con hexametafosfato de sodio (30 g de suelo en 100 mL de HMP 0,5 %). Todas las pruebas fueron realizadas por triplicado, agitando la suspensión a 50 rpm 2 h con 3 perlas de vidrio de 10 mm de diámetro. Antes de la agitación, se dejó la suspensión en refrigerador por 16 h para favorecer la posterior ruptura de agregados durante la agitación como consecuenciade la contracción ocasionada por la baja temperatura. Después de la agitación, la suspensión se tamizó por 200 y 50 μm y se lavó con pulverizador de gota fina con agua desionizada. La fracción > 200 μm fue separada en liviana (L) y pesada (P) por flotación en agua. El suelo que pasó por la malla de 50 μm fue sometido a ultrasonido durante 4 a 8 m. La duración del tratamiento fue regulada para alcanzar una dispersión adecuada (verificada por observación al microscopio óptico). Posteriormente, la suspensión fue tamizada por 20 μm, secada hasta peso constante a 60°C en estufa con circulación de aire, pesada y molida. En cada fracción separada fue determinado C total (como las muestras no contenían CaCO3, C total se considera igual al C orgánico), N total y d13C en un espectrómetro de masas Europa Scientific Ltda. (Krewe, UK) acoplado a un analizador de C y N.
El d13C es una expresión de la abundancia natural de un isótopo relativa a un material de referencia del laboratorio calibrado contra un patrón internacional; se expresa en unidades por mil (‰) y se calcula a través de la siguiente ecuación:
d13C = 1000 (Rmuestra - Restándar) / Restándar
donde: Rmuestra es la relación del isótopo pesado (13C) al liviano (12C) medido en la muestra y Restándar es la relación equivalente para el estándar (carbonato fósil Bellemnitella american de la formación Peedee de Carolina del sur, USA, abreviado a PDB) (Boutton, 1996). Existe una discriminación isotópica de las plantas al CO2 durante la fotosíntesis, debida a las propiedades bioquímicas de las enzimas que fijan C y al proceso de difusión que controla la entrada de CO2 a las hojas. Esta discriminación es variable entre las plantas terrestres, las que se agrupan en 3 tipos de ciclos fotosintéticos (C3, C4 o CAM). Esta diferencia es mucho mayor que los pequeños cambios que ocurren durante la descomposición de la MO en el suelo, por lo que el C orgánico retiene la marcación de la vegetación que le dio origen, permitiendo conocer y datar cambios en la vegetación (Balesdent y Mariotti, 1996).
Fraccionamiento de las muestras.Las muestras de las parcelas bajo P, LC y SD, de las profundidades de 0-10 y 10-20 cm fueron fraccionadas según los resultados del ajuste anteriormente descripto. Se pesaron 30 g de suelo seco al aire y se tamizaron por 2 mm, se dejaron 16 h en heladera con 100 mL HMP 0,5 %. Se agitaron 2 h a 50 rpm y posteriormente se tamizaron por 200 y 50 μm. Las fracciones retenidas en cada tamiz fueron lavadas y secadas en estufa con circulación de aire a 60°C. La fracción menor de 50 μm fue sometida a ultrasonido y posteriormente tamizada por 20 μm. Después de secadas, las fracciones fueron pesadas y molidas para la determinación de C y N total con un analizador de C y N ANCA -SL acoplado a un espectrómetro de masas Europa Scientific Ltda. (Krewe, UK). Las fracciones de suelo fueron expresadas en Mg ha-1, utilizando densidades aparentes de 1,10, 1,19, 1,27 Mg m-3 de 0-10 cm y de 1,12, 1,16, 1,25 Mg m-3 para P, SD y LC de10-20 cm, respectivamente, las que fueron medidas por el método del cilindro.
Se separaron las siguientes fracciones:
>200L: fracción retenida en el tamiz de 200 μm y separada por flotación en agua, constituida fundamentalmente por restos de raíces y plantas,
>200P: fracción retenida en el tamiz de 200 μm y que sedimentó al suspenderse en agua, constituida fundamentalmente por partículas de arena,
200-50L: fracción retenida en el tamiz de 50 μm y separada por flotación en agua, constituida fundamentalmente por material orgánico que no es reconocible al microscopio óptico,
200-50P: fracción retenida en el tamiz de 50 μm y que sedimenta rápidamente al suspenderse en agua, de naturaleza organo-mineral,
50-20: fracción retenida en el tamiz de 20 μm después de sometida a ultrasonido a 240 watts de potencia, también de naturaleza organo-mineral,
<20: fracción que pasó por el tamiz de 20 μm y que incluye partículas minerales de tamaño limo y arcilla, microagregados organominerales muy estables y materia orgánica amorfa, humificada y fuertemente ligada a las partículas minerales.
Resultados y discusión
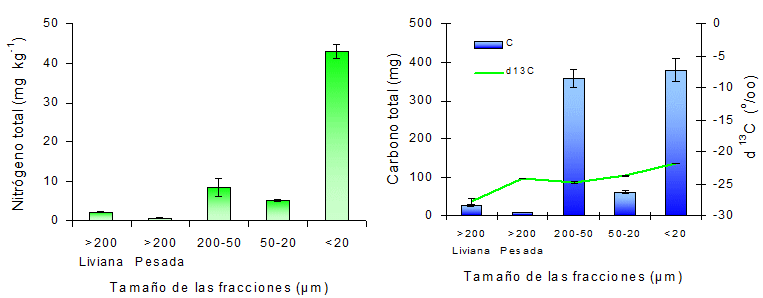
Ajuste metodológico.La destrucción de MO con H2O2 para obtener las fracciones minerales en cada tamaño granulométrico no fue completamente efectiva, ya que se observó que en la fracción <20 μm quedaron pequeñas cantidades de C (Fig. 1). Es conocido que la materia orgánica que está formando microagregados con coloides inorgánicos está muy protegida y por esto es menos oxidada por H2O2, pero aún no se conoce el significado biológico de esta susceptibilidad a la oxidación con H2O2 (Van Veen y Kuikman, 1990). Se considera que esta materia orgánica es altamente resistente al ataque de los microorganismos y, por lo tanto, su aporte de nutrientes por mineralización es pequeño. Asimismo, no es esperable que estas fracciones sean alteradas por el manejo del suelo, por lo que igualmente se utilizaron los datos de esta distribución granulométrica para verificar la eficiencia de recuperación de los métodos de fraccionamiento examinados.
Figura 1. Distribución de la masa, nitrógeno y carbono total en las fracciones después de la destrucción de la materia orgánica con H2O2.
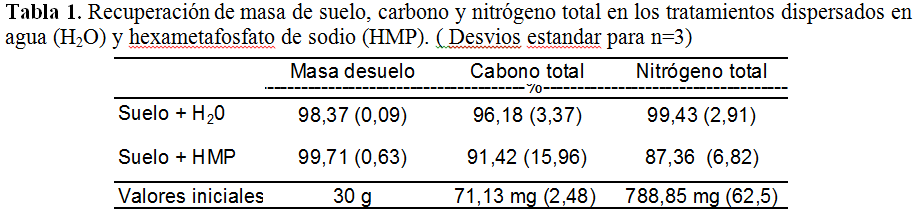
Las recuperaciones acumuladas de masa de suelo, N y C fueron satisfactorias en general, pero el tratamiento dispersado en agua produjo las mayores recuperaciones (Tabla 1). El tratamiento con HMP tuvo mayor variabilidad que el tratamiento con agua, principalmente en los valores de C y N total, lo que podría relacionarse a las bajas concentraciones de N y C en algunas fracciones separadas o aún a la posibilidad de pérdidas de N por volatilización de NH3 originadas en el aumento de pH ocasionado por el HMP.
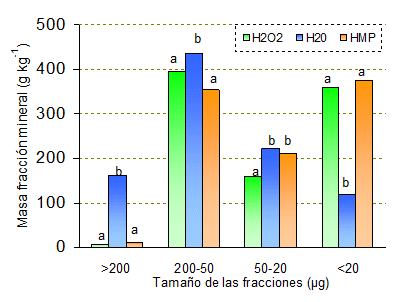
Con H2O no se alcanzaron niveles adecuados de dispersión, en todas las fracciones, excepto en la de 50-20 mm, se observaron diferencias significativas en la distribución de la fracción mineral con respecto al suelo con la materia orgánica destruida (Fig. 2) obteniéndose un coeficiente de correlación relativamente bajo (r=0,46).
Con H2O como dispersante, se observó que una gran masa de suelo de las fracciones >200, 200-50 y 50-20 mm no fue dispersada, por lo que se encontraron mayores masas en comparación con el suelo con la MO destruida con H2O2, mientras que la fracción <20 mm fue subestimada, ya que parte de ella quedó formando agregados de mayor tamaño.
Figura 2.Distribución de la masa de la fracción mineral del suelo con la materia orgánica destruida (H2O2), y los dispersos con agua (H2O) y hexametafosfato de sodio (HMP). Las letras indican diferencias significativas entre tratamientos a nivel p<0,005, para cada tamaño de fracción.
HMP consiguió dispersar adecuadamente los agregados, lo que se comprueba a través de la correlación de masas de la fracción mineral con este método y la de aquél con la MO destruida con H2O2 (r=0.97), y se traduce en ausencia de diferencias entre las fracciones minerales de estos dos tratamientos (Fig. 2).
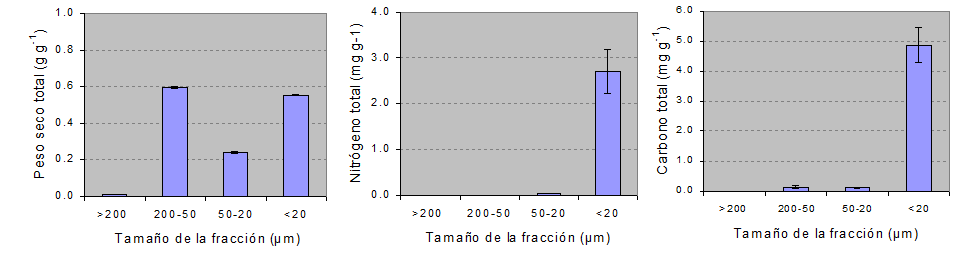
Al analizar la distribución de C y N en las fracciones del suelo dispersado con HMP, se observa una gran cantidad de C y N en las fracciones de menor tamaño. El 72 % del N se encuentra en la fracción <20 µm, en cuanto que el C se acumula también en la fracción entre 200-50 µm (Fig. 3). Esta gran concentración de N justifica las bajas tasas de mineralización de estos suelos, ya que la MO ligada a fracciones de tamaño limo y arcilla constituye complejos altamente humificados, difíciles de mineralizar (Edwards yBremner, 1967).
Figura 3. Distribución del nitrógeno, carbono y δ 13C en las fracciones del suelo dispersado con HMP.
Para el suelo disperso con HMP se encontraron δ13C próximos a –20 ‰ en la fracción <20 μm y de –27 ‰ en la fracción más gruesa. El δ13C de la fracción <20 μm es similar a los valores característicos de estos suelos en la condición original, ya que fueron desarrollados bajo una vegetación de pradera mezcla de especies C3 y C4 (Andriulo, 1995). La disminución de δ13C con el aumento del tamaño de las fracciones, es un reflejo de la historia agrícola del suelo, con la inclusión de una mayor proporción de cultivos de especies de metabolismo C3 como trigo, girasol, soja, las que discriminan en contra del 13CO2 (Boutton, 1996).
En base a los resultados anteriores: niveles de recuperación de masa, C y N dentro del rango aceptable (Gavinelli et al., 1995) y distribución de fracción mineral con buena correlación con la distribución del suelo con MO destruida con H2O2, se considera que el método de dispersión con HMP es adecuado para el fraccionamiento granulométrico de un suelo templado, por lo que se realizaron los fraccionamientos de las muestras con este agente dispersante.
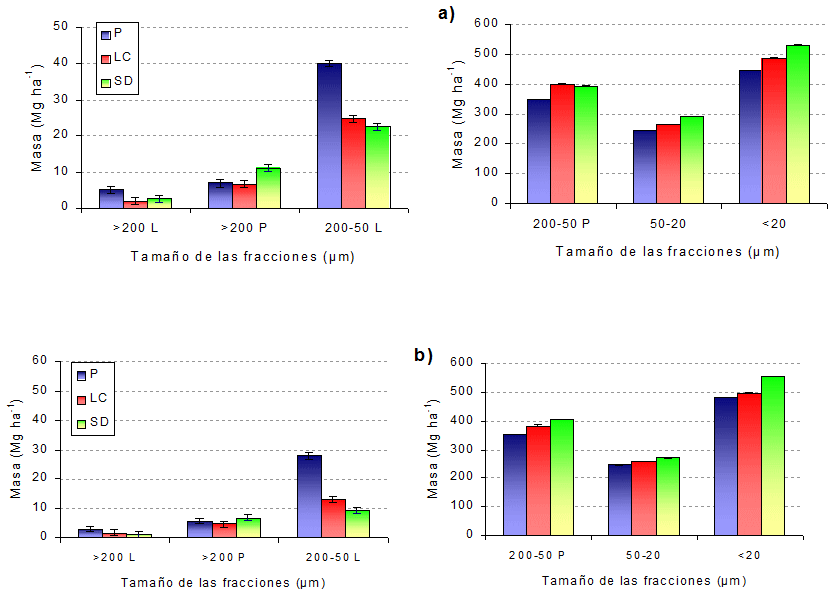
Fraccionamiento de las muestras. La distribución de la masa de suelo presentó grandes variaciones en respuesta al manejo al que fue sometido el suelo en las fracciones de mayor contenido orgánico: >200L y 200-50L, tanto de 0-10 como de 10-20 cm (Fig. 4). Esta diferencia en masa se debe a acumulación de MO. En 6 años desde el comienzo del experimento, P produjo una acumulación de MO, principalmente en las fracciones de mayor tamaño, mientras que SD mostró una tendencia similar, aunque con valores menores y no significativos estadísticamente.
P presentó fracciones livianas en los tamaños >200 y 200-50 mayores que LC y SD de 0-10 cm, mientras que de 10-20 cm estas diferencias no fueron significativas, y hubo una tendencia a mayor acumulación de MO en LC que en SD (Fig. 4). Las fracciones >200P y 200-50P, constituidas principalmente por minerales, no tuvieron respuesta al manejo, como era de esperar ya que el manejo no altera la composición de los minerales del suelo.
En las fracciones 50-20 y <20 μm SD presentó diferencias significativas con respecto a P, tratándose de fracciones organo-minerales donde se encontraría principalmente materia orgánica altamente humificada y resistente a la degradación (Tisdall y Oades, 1982) por lo que es difícil comprender el motivo de estas diferencias originadas en el manejo del suelo en tan corto período de tiempo. En la profundidad de 10-20 cm, las diferencias fueron menores entre tratamientos, sólo en la fracción 200-50L aparecieron diferencias a favor de P (Fig. 4).
De 0-10 cm, P presentó mayor contenido de C y N que SD y LC en las fracciones >200L y 200-50L, y de N en la fracción menor que 20 μm, no habiendo diferencias entre SD y LC (Tabla 2). Las fracciones >200P y 200-50P, constituidas principalmente por fracción mineral, no presentaron diferencias en C, N ni en δ13C. Sólo en la fracción 200-50L el tratamiento P presentó un δ13C más negativo que SD y LC, seguramente como consecuencia de la composición botánica de P, con predominio de Festuca arundinácea y Trifolium repens, ambas especies con metabolismo C3 (Tabla 2). De 10-20 cm las fracciones pesadas (>200 y 200-50) no presentaron diferencias en ninguna de las variables. Las relaciones C/N fueron más altas en las fracciones de mayor tamaño, disminuyendo hacia las de menor tamaño, pero no se detectaron diferencias originadas en los tratamientos de manejo en ninguna fracción.
Figura 4: Distribución de la masa de suelo después del fraccionamiento en los tratamientos P, LC y SD a la profundidad de a) 0-10 cm y b) 10-20 cm.
Tabla 2. Carbono, nitrógeno, δ13C y relación C/N en las fracciones granulométricas de 0-10 cm de un suelo sometido a diferentes manejos (P= pastura, LC= labranza convencional y SD= siembra directa). Las letras minúsculas indican diferencias significativas a nivel P‹0,05, según test de Tukey n=3).
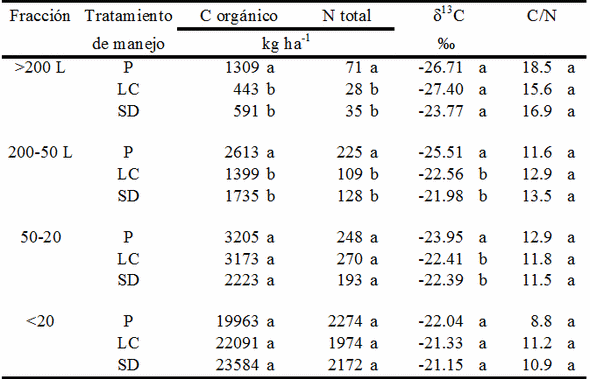
Las grandes cantidades de N y C encontradas en las fracciones <50 μm, en todos los tratamientos de manejo, entre 85 y 93% del C y entre 89 y 93% del N, las que poseen MO amorfa, altamente humificada y fuertemente ligada a las arcillas, con tiempos de reciclaje muy lentos (entre 20 y 40% cada 20 años) (Feller, 1994) explican la respuesta a fertilización nitrogenada habitualmente encontrada en estos suelos a pesar de sus aparentemente altos contenidos de MO y Nya que el aporte por mineralización es bajo para los niveles de potencial de rendimiento de los híbridos y variedades cultivadas en la actualidad. Las menores proporciones de C y N en la fracciones <50 μm se encontraron en P, dato verificado a través de las mayores tasas de mineralización bruta del N en este tratamiento (Videla et al., 2002). Incrementos en el C orgánico de fracciones leve, media y pesada (fraccionamiento densimétrico) bajo pastura en comparación con el mismo suelo bajo SD y LC fueron verificados también en suelos similares a los del presente experimento, aunque las mayores diferencias ocurrieron en las fracciones media y leve, lo que explicaría la mayor mineralización de C encontrada (Alvarez et al., 1998).
Después de 6 años de implementación de este experimento, no se observaron diferencias estadísticamente significativas entre LC y SD, aunque sí una tendencia a que SD acumule más C y N en las fracciones livianas. Esa tendencia, implicaría una mayor disponibilidad de la MOen las fracciones más fácilmente mineralizables, como se puede comprobar por las diferencias en mineralización bruta entre SD y LC (Videla, et al., 2002). Es posible que las menores temperaturas habitualmente encontradas bajoSD respecto a LC, favorezcan el secuestro de C por parte de SD, aunque en los primeros años de implementación del sistema sean pequeñas y no suficientes para ser detectadas por los análisis estadísticos.
Conclusiones
El método de Gavinelli et al., (1995) resulta adecuado también para fraccionar suelos templados. A los 6 años de la implantación de una pastura después de 17 años de ciclos agrícolas bajo labranza convencional, se observa una importante recuperación de la MO del suelo, fundamentalmente en las fracciones de mayor tamaño (>200 y de 200-50µm), mientras que la siembra directa sólo muestra una tendencia en este sentido.
Agradecimientos
Los autores agradecen a la Sra. Sandra M. Nicoleti del Laboratorio de Biogeoquímica CENA-USP por su colaboración en el fraccionamiento granulométrico. Este trabajo fue financiado con fondos de los proyectos U.N.MdP (15/A107) y Fundación Antorchas-Vitãe (13816-5). La primera autora es becaria del convenio CAPES (Brasil) – SPU (Argentina).
Referencias
- AAPRESID (2001). Superficie de trigo en siembra directa. Jornadas de intercambio técnico. AAPRESID, 95 p.
- ALVAREZ CR, ALVAREZ R, GRIGERA MS AND LAVADO RS (1998). Associations between organic matter fractions and the active soil microbial biomass. Soil Biol. Biochem. 30: 767-773.
- ANDERSON DW, PAUL EA. (1984). Organo-mineral complexes and their study by radiocarbon dating. Soil Sci. Soc. Am. J. 48: 298-301.
- ANDRIULO A. (1995). Modellisation de l´evolution des matieres organiques des sols de la Pampa. Relation avec les systemes de culture. These Doctorat. IÍNA-PG. 143 pp.
- BALESDENT J, MARIOTTI A. (1996) Measutement of soil organic matter turnover using 13C natural abundance. (pag. 83-111) En: Mass spectrometry of soils. Thomas W. Boutton Ed. 517 p.
- BOUTTON, TW (1996). Stable carbon isotope ratios of soil organic matter and their use as indicators of vegetation and climate change. En: Mass spectrometry of soils. Thomas W. Boutton Ed. 517 p.
- DORAN JW (1987). Microbial biomass and mineralizable nitrogen distributions in no-tillage and plowed soils. Biol. Fert. Soils 5: 68-75.
- EDWARDS AP, BREMNER JM. (1967). Microaggrgates in soils. J. Soil Sci.18: 64-73.
- FELLER C (1994). La matière organique dans les sols tropicaux à argile 1:1. Recherche de compartiments organiques fonctionnels. Une approuche granulométrique. Thèse Dr. ès sciences naturelles. Université Louis Pasteur. Strasbourg. France.
- FELLER C, BEARE MH (1997). Physical control of soil organic matter dynamics in the tropics. Geoderma 79: 69-116.
- FOLLET RF, SCHIMEL DS (1989). Effect of tillage practices on microbial biomass dynamics. Soil Sci. Soc. Am. J. 53: 1091-1096.
- GAVINELLI E, FELLER C, LARREÉ-LARROUY MC, BACYE B, DJEGUI N, NZILA JD (1995). A routine method to study soil organic matter by particle-size fractionation: examples for tropical soils. Commun. Soil Sci. Plant. Anal., 26: 1749-1760.
- GREENLAND DJ. (1965a). Interaction between clays and organic compounds in soils. Part I. Mechanisms of interaction between clays and defined organic compounds. Soil Fert. 28: 415-425.
- GREENLAND DJ. (1965b). Interaction between clays and organic compounds in soils. Part II. Adsorption of soil organic compounds and this effect on soil properties. Soil Fert. 28: 521-532.
- KRISTENSEN HL, Mc CARTY GW, MEISINGER JJ. (2000) Effects of soil disturbance on mineralization of soil organic matter. Soil Sci. Soc. Am J. 64: 371-378.
- STUDDERT GA, ECHEVERRÍA HE, CASANOVAS EM (1997). Crop-pasture rotation for sustaining the quality and productivity on a Typic Argiudoll. Soil Sci. Soc. Am. J. 61: 1466-1472.
- TISDALL JM, OADES JM. (1982). Organic matter and water stable aggregates in soils. J. Soil. Sci. 33: 141-4-163.
- VAN VEEN JA AND KUIKMAN PJ. (1990). Soil structural aspects of decomposition of organic matter by micro-organisms. Biogeochemistry 11: 213-233.
- VIDELA C, TRIVELIN PCO, STDDERT GA, ECHEVERRÍA HE, BENDASOLLI JA. (2001). Mineralização bruta do nitrogênio em solos de alta fertilidade. Efeito do manejo e da profundidade de amostragem. VI ENAN, National Meeting on Nuclear Applications, Rio de Janeiro, agosto de 2002. Resumen expandido 4 hojas, Libro de Actas en CD.
Trabajo presentado en XIX Congreso Argentino de la Ciencia del Suelo. AACS. Argentina, Paraná, junio de 2004








.jpg&w=3840&q=75)