Introducción
Ustilago filiformis (= Ustilago longissima) es el agente causal en diferentes especies del género Glyceria como ocurre en G. fluitams, G. grandis, G. multiflora, G. nemoralis, G. obtusa, G. pilcata y G. striata. (Mordue 1991). U. filiformis produce una sintomatología de clorosis y necrosis sobre las láminas, denominada como “carbón de la estría en la hoja”. El signo enfermedad se manifiesta como una masa carbonosa de teliosporas y es como se propaga el patógeno en el campo. La planta infectada produce nuevos macollos que pueden estar atrofiados y de color verde pálido a verde-amarillento. Estos macollos por lo general no llegan a florecer y en ellos se observa la esporulación del hongo que ocurre durante el desarrollo del cultivo que es de ciclo primavero-estival.
La distribución geográfica está generalizada para distintas zonas templadas del mundo como se detalla:
1. Asia: Zona norte de la India (Nilgiri Hills) y Siberia.
2. Europa: Suecia, Suiza, Reino Unido, Austria, Bulgaria, Checoslovaquia, Dinamarca, Finlandia, Francia, Alemania, Hungría, Italia, Países Bajos, Noruega, Polonia, Rumania, España, Reino Unido, ex URSS (Estonia, Rep. de Georgia, Letonía, Rusia) y ex Yugoslavia.
3. América del Norte: Canadá (Alberta, Columbia Británica, Ontario, Que, Sask) y EE.UU. (Connecticut, Colorado, Idaho, Illinois, Iowa, ME, Maine, Michigan, Minnesota, Mt, Nebraska, New Hampshire, Nueva York, Dakota del Norte, Oregón, Pensilvania, Utah, Vermont, estado de Washington).
4. América del Sur: Argentina (La Plata, Jeppener).
La transmisión del patógeno se realiza a través de las teliosporas que son diseminadas por el viento y por el agua. En la actualidad no hay estudios sobre el proceso de infección del carbón en el hospedante (Hirschhorn 1986, Astiz Gassó et al. 2006, Mordue 1991).
Glyceria multiflora Steudel, es una especie nativa, acuática glabra, perenne, cespitosa ascendente, rizomatosa, con cañas largas, nudos comprimidos en seco, oscurecidos, lígula ancha, panoja laxa angosta, de 20-60 cm de longitud y fruto cariopse elíptico-alargado rojizo-oscuro (Burkart 1969). Es una especie sudamericana, común en Argentina y en Chile. En nuestro país habita las zonas de pastizales bajos de la Mesopotamia y la cuenca del Salado. Vegeta en invierno y florece en primavera. Habita lugares anegadizos, las bordes de las lagunas, zanjas, etc. Es considerada una forrajera valiosa, muy común en la provincia de Buenos Aires, donde es muy buscada y apreciada por el ganado (Vidal & Piergentili 1973). La alta productividad y la buena palatabilidad de esta especie constituyen aspectos relevantes desde el punto de vista forrajero. Existe de estudios para su posible uso como una alternativa forrajera en áreas marginales ganaderas de nuestro país (Rossi, et al 2006).
Objetivos
- Determinar el proceso de infección patógeno
- Clarificar la biología reproductiva U. filiformis
- Analizar las alteraciones histopatológicas asociadas al ataque del hongo.
Etiología
Materiales y Métodos
Las metodologías utilizadas en este trabajo se adecuaron para el tipo de ambiente donde crece y se desarrolla el hospedante, en base a otras técnicas utilizadas para carbones del orden Ustilaginales y hongos fitopatogenos (Fernández et al., 1978; Matyac, 1985; Craig and Frederiksen, 1992), Maurya et al. (2010) and Kosiada (2011).
Aislamiento y cultivo in vitro del hongo
Las muestras de Glyceria sanas e infectadas con U. filiformis fueron recolectadas en el año 2009 en la localidad de Jeppener (35°16′39.5″S 58°11′53.7″O / -35.277639, -58.19825.), perteneciente a la Cuenca del Salado, ubicada en la provincia de Buenos Aires, Argentina. Posteriormente las plantas con síntomas fueron llevadas al laboratorio para realizar las observaciones morfobiométricas del hongo e identificar la especie del carbón. Además, se efectuaron aislamientos del hongo para estudiar el tipo de germinación de las teliosporas y el desarrollo de colonias.
Para la identificación taxonómica del hongo se realizaron preparaciones microscópicas de las esporas que fueron montadas en lactofenol y observadas con microscopio óptico (MO). Además, se acondicionaron los preparados de teliosporas del hongo para microscopia electrónica. Para ello se montaron en platina y se metalizaron con una capa de oro paladio para su observación bajo microscopio electrónico de barrido (MEB).
Para el aislamiento se procedió a desinfectar 0,5 g de esporas del hongo con una solución de hipoclorito sodio al 2% durante tres minutos. Posteriormente fueron enjuagadas tres veces con agua destilada estéril para retirar el exceso del desinfectante y centrifugadas a 200 rpm.
Una parte de las teliosporas así, tratadas fueron sembradas en dos medios de cultivo: i. Agar Agua al 2% (AA) para realizar observaciones sobre la germinación; ii. Papa Dextrosa Agar al 2% (PDA) para analizar morfología de las colonias del hongo y la obtención de cultivos axénicos.
Los cultivos obtenidos en ii fueron conservados en frío a 5ºC ± 2 para ser utilizados posteriormente en inoculaciones sobre el hospedante.
Pruebas de patogenicidad
Preparación inoculó
Para este experimento se partió de cultivos de basidiosporas axénicos obtenidos a partir de la metodología descripta anteriormente. Los cultivos del hongo fueron sembrados en Erlemeyers con 200 cm3 de medio cultivo caldo de papa al 2% Difco (CP). Posteriormente, fueron colocados en agitador rotativo (CAT-S20) a 200 rpp y llevados a estufa de cultivo (BINDER KBF LQC) a 25ºC± 2 en oscuridad. Cada 24 h se extrajo una muestra de la suspensión para cuantificar el inoculó de basidiosporas. Para la determinación se usó un hematocrito de Neubauer. Cuando la concentración de las basidiospora alcanzó 106-8/ml se procedió a conservarlas en la heladera hasta ser utilizadas en las inoculaciones de laboratorio y campo.
Acondicionamiento de plantas de Glyceria
Un total de 6 plantas sanas de G. multifloras fueron extraídas con el pan de tierra del humedal donde habita esta especie en marzo-abril del año 2009. Para realizar el trasplante de las plantas, previamente se acondicionaron dos contenedores de 2 m de ancho x 10 m de largo que se revistieron con plástico negro de 200 micrones de espesor para evitar la pérdida de humedad y conservar las condiciones ambiente semejantes a dónde se desarrolla esta especie. En cada contenedor se colocaron tres plantas que se mantuvieron inundadas en forma permanente para evitar la desecación durante el período otoño-invernal. En la primavera (septiembre-octubre) cuando se inició el crecimiento vegetativo de las plantas con la aparición de los macollos, se comenzó con la extracción de las muestras de brotes para realizar las experiencias de laboratorio y se seleccionó un contendor para las inoculaciones a campo.
Métodos de inoculación
La metodologías utilizadas en esta investigación fueron adaptadas y modificadas en base a técnicas utilizadas para el estudio de otras especies de Ustilaginales, como se ha mencionado por Fernández et al. (1978), Matyac (1985), Craig y Frederiksen (1992), Qasida (2011)
1. Ensayo de inoculación en laboratorio
Para este el ensayo se extrajeron muestras de las plantas jóvenes mantenidas en el campo y, que procesaron en el laboratorio realizando cortes de hojas de 2 cm las cuales se inocularon con: i. basidiosporas producidas por el hongo en el medio de cultivo CP; ii. Suspensión en agua destilada estéril de teliosporas a razón de una concentración 106-8 esporas/ml.
i. Inoculación con basidiosporas:
Los cultivos obtenidos de basidiosporas del hongo procedentes del medio PC, fueron inoculados sobre tejidos de la lámina de gliceria utilizando una alícuota de 0,01ml, extraída con micropipeta (concentración 106-8 basidiosporas/ml). Los testigos fueron tratados con medio PC sin el cultivo del patógeno. El material tratado se dispuso en portaobjetos colocados sobre papel de filtro estéril húmedos con agua destilada estéril en cajas de Petri. Luego llevados a estufa de cultivo BINDER KBF LQC a 25ºC± 2 con fotoperíodo de 12hs luz/12hs oscuridad. A partir de las 24 h se procedió a extraer muestras que fueron observadas con microscopio óptico (Olympus CX21).
ii. Inoculación con teliosporas
Se utilizó una alícuota de 0,01ml extraída con micropipeta de la suspensión de teliosporas que se inoculó sobre la lámina de la hoja de gliceria. Las muestras se acondicionaron como en el caso anterior.
Para ambos ensayos se precedió a extraer las muestras de tejidos de la hoja y realizar cortes histológicos, los cuales fueron montados en lactofenol-azul de algodón para la observación del hongo.
2. Ensayo de inoculación a campo
Durante la primavera del año 2009, se seleccionó un contenedor con tres plantas G. multiflora para inocular con el patógeno, y otro contenedor con tres plantas se reservó como testigo sin inocular.
Para favorecer la infección del hongo se procedió a usar el inoculó previamente preparado en un Erlermeyer que contenía 200 cm3 de medio de PC y una concentración de (106-8 esporas/ml). Las plantas no tratadas (controles) fueron regadas con el medio PD sin el patógeno.
Para inocular las plantas se procedió a usar la técnica de riego sobre la zona o área de emergencia de los macollos de gliceria. Esta metodología se ejecutó cada vez que las plantas producían los rebrotes de yemas vegetativas, (aproximadamente cada 20 días). Las infecciones se realizaron entre los meses de Noviembre-Diciembre del año 2009 en condiciones de campo.
Las observaciones y extracción de las muestras a campo se realizaron a partir de las 24 h de inoculadas las plantas, tanto para las plantas inoculadas como los controles, y hasta observar los primeros síntomas y el signo producido por el patógeno.
Posteriormente, las plantas se dejaron por dos años (2010- 2011) en el campo para verificar si se producían reinfecciones de U. filiformis en forma natural. Para comprobar la evolución de esta patología se realizaron observaciones macroscópicas, microscópicas y reaislamientos del hongo durante este periodo.
3. Cortes histológicos para el análisis histopatológico
Para estos experimentos se extrajeron periódicamente muestras de las plantas G. multiflora inoculadas a campo en las que se observó el desarrollo de síntomas del patógeno (clorosis, alteraciones morfológicas, etc.) y los controles sin tratar. Las muestras de hojas infectadas y los controles se fijaron en formalina-acético-alcohol (FAA). Posteriormente, se pretrataron con ácido fluorhídrico al 10% durante 24hs, para ablandar el tejido y eliminar el sílice presente en la epidermis. La inclusión se realizó en parafina para los cortes transversales y longitudinales de aproximadamente 10-12 μm de espesor usando un micrótomo tipo Minot (Senior Rotary micrótomo Marca Arcano, Modelo-RTM-30). La observación microscópica se realizó en microscopio óptico (Olympus CX21), siguiendo la metodología indicada por Bracegirdle y Miles, (1975) y D”Ambrogío Argüeso, (1986) utilizando la coloración doble de safranina-fast-green y el adhesivo de montaje bálsamo de Canadá.
Resultados y Discusión
Identificación de la especie y morfología de las colonias
Las observaciones macroscópicas y con lupa estereoscópica de los síntomas de la lámina de gliceria confirmaron que los soros corresponden a los típicos de la especie U. filiformis. Esta especie forma estrías oscuras de color marrón a negras, de tamaño de 1-2 mm a varios centímetros de longitud (Figura 1 A-B) (Hirschhorn, 1986; Mordue, 1991).

Las teliosporas son simples, de forma redondeada a sub-globosa; tamaño de 4-7 x 3-5 ?m; episporio aparentemente liso y de color amarillo claro a marrón oscuro, tal como se comprobó en los preparados de microscopio óptico (Figura 2 A). La observación de la ornamentación de la espora con microscopio electrónico de barrido (MET) permitió visualizar un episporio finamente granulado (Figura B). En nuestra investigación verificamos el tipo de germinación in vitro los cuales corresponden a la especie y las características morfobiométricas de las teliosporas comparado con la información registrada en observaciones realizadas por Brook 1957 y Hirschhorn (1986).
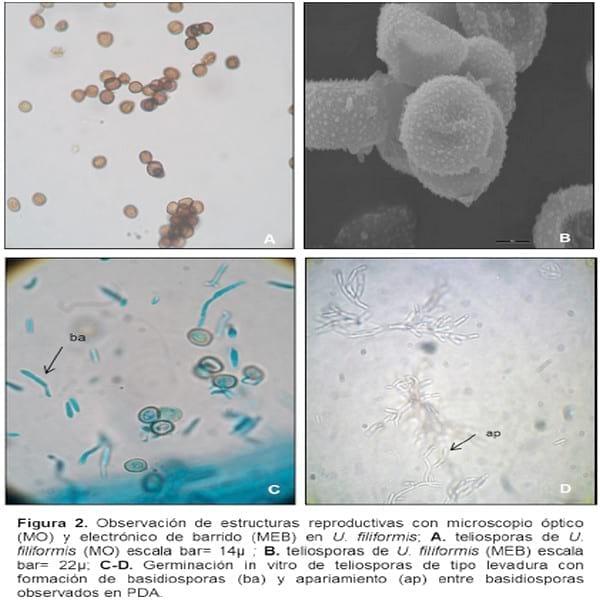
Las teliosporas germinaron in vitro sobre el medio A.A. después de 3 días cuando emitieron las basidiosporas de 10-100 μm de largo, con septos o formación de escasos septos. Las basidiosporas (= esporidios) hijas, pueden ser laterales o terminales. La multiplicación es por brotación y se producen a su vez una cantidad abundante (Figura 2 C-D). Resultados similares fueron registrados por Butler et al. (1978). Las basidiosporas forman rápidamente colonias del tipo levadura de color marrón claro al ocre, con rugosidades en la superficie de la colonia y zonas de hifas del tipo algodonoso de color blanco en PDA. También presentan un crecimiento del tipo radial que a los 10 días cubrió la caja de Petri de 9 cm de ? (Figura 3 A).
Ensayos de laboratorio
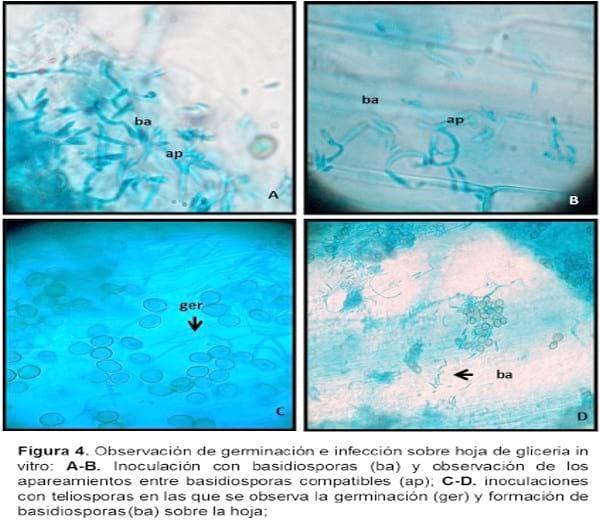
La metodología aplicada en las inoculaciones in vitro sobre trozos de hoja de gliceria, tanto con la utilización de basidiosporas o de teliosporas, fueron igualmente eficientes para producir la infección y dilucidar el proceso infectivo del carbón de la estría de gliceria y su interacción con el hospedante.
En la Figura 3 B-C-D se registran los pasos del procedimiento. En el caso de las basidiosporas, se observó una rápida multiplicación y producción de nuevas basidiosporas (n) por brotación tipo levadura sobre la lámina de la hoja dentro de las 6-8 h de inoculadas. Paralelamente, se observó sobre en el tejido los apareamientos entre basidiosporas compatibles (-n+n) que originan posteriormente a la hifa infectiva (Figura 4 A-B). En el caso de las teliosporas la germinación se produce entre 3-6 días de inoculadas y rápidamente se inicia la proliferación de basidiosporas laterales, proceso que continúa hasta la formación de la hifa infectiva como se registró en la aplicación de basidiosporas (Figura 4 C-D).
Pruebas de patogenicidad a campo
El experimento de pruebas de patogenicidad, en el que se utilizó como inoculó basidiosporas en condiciones a campo, nos permitió observar las primeras lesiones del ataque del patógeno entre los 10-15 días de la inoculación en las plantas de gliceria (Figura 5 A-B. Los síntomas correspondientes a la primera etapa de la infección de U. longissima se evidenciaron en forma sub-epidérmica, paralelas a las nervaduras. Se observó i. clorosis, en algunos casos amarillamiento, y posterior necrosis del tejido epidérmico. Cabe destacar que este síntoma no es usual en el orden de las Ustilaginales por tratarse de patógenos biotróficos. Asimismo se observó ii. Formación de estrías oscuras y/o ampollas sub-epidérmicas. Posteriormente, estas lesiones maduran y producen la ruptura de la epidermis. Como resultado, se liberan las teliosporas oscuras correspondientes al signo de la enfermedad (Figura 5 C-D-E). También se observó la presencia de panojas con espiguillas estériles comparadas a las plantas testigos que no presentaron síntomas ni signo de la enfermedad. Esta sintomatología fue similar a las registradas en otras especies del orden de las Ustilaginales tales como ejemplo las estrías y ampollas sobre la hoja producidas por el carbón de la hoja bandera del trigo (Urocystis agropyri=Urocystis tritici) y la presencia de espiguillas estériles producidas por Sporisorum reiliana (= Sphacelotheca reiliana), carbón de la panoja del sorgo (Wilson y Frederiksen 1970; Bhatnagar et al 1978; Mordue y Walker 1981; Beniwal 1992; Vanky y Shivas 2008).
También se registraron reinfecciones naturales de U. filiformis procedentes de las inoculaciones artificiales originalmente realizadas en el año 2009, que fueron comprobadas por la observación periódica de síntomas y signos correspondiente al carbón y análisis en laboratorio.
Análisis histopatológico
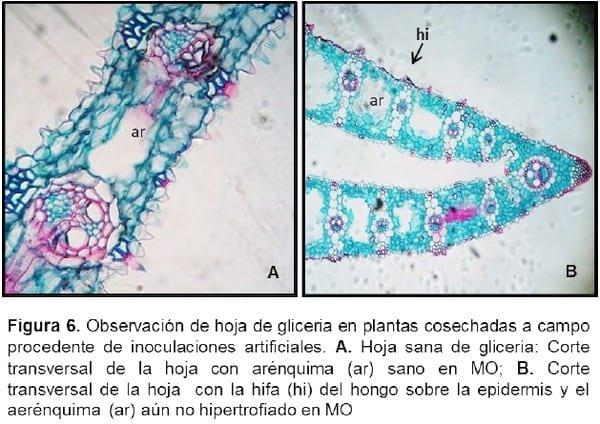
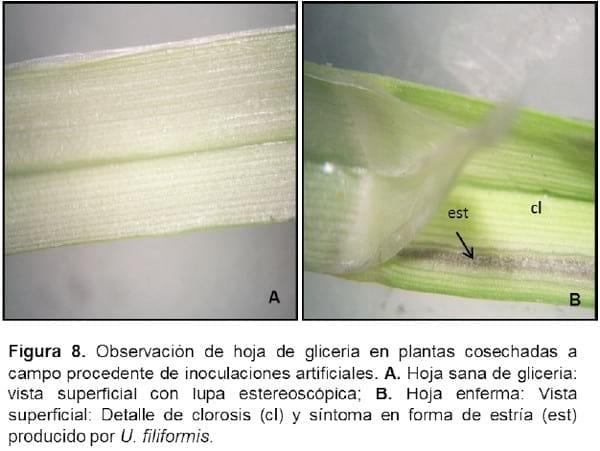
La anatomía de la hoja de Glyceria vista en corte transversal presenta una estructura de tipo festucoide. Los cortes de los testigos sanos presentan un clorénquima poco desarrollado y espacios intercelulares muy notables entre los haces vasculares secundarios, en donde se observó la presencia de células estrelladas correspondiente al tejido parenquimático con reserva de aire denominado comúnmente aerénquima (Figura 6 A). El desarrollo de éste último se debe a que la planta habita en zonas anegadas que permiten la oxigenación y flotación de plantas (Burkart, 1969).
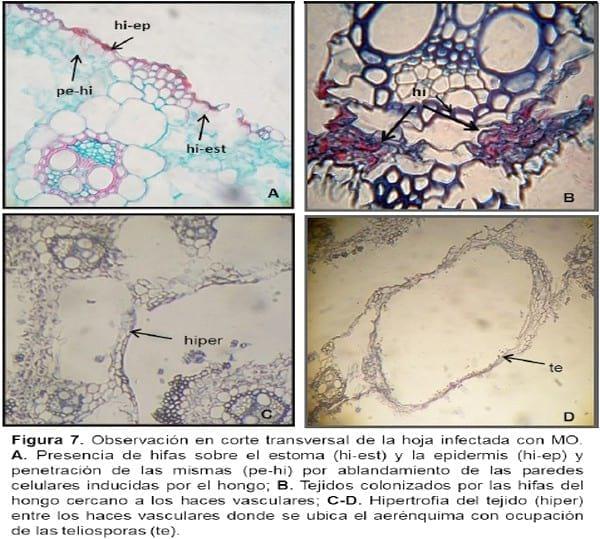
Las observaciones sobre el material infectado, en comparación con el testigo, mostraron que el hongo penetra en la lámina a través de los estomas o por el ablandamiento de las paredes y de la laminilla media, producido por enzimas (Figura 6 B). Luego el micelio fúngico penetra en el clorénquima, en posición subepidérmica, invadiendo lateralmente los tejidos e incluso se observa también por debajo de los haces vasculares (Figura 7 A-B). Las hifas penetran principalmente por la cara abaxial de la hoja o filodio. Una vez que el micelio se fragmenta, se induce a la esporogénesis y los espacios intercelulares entre haces vasculares, donde estaba ubicado el aerénquima, se observan expandidos por hipertrofia de los tejidos con las paredes interiores cubiertas de teliosporas de color marrón oscuro. Estas zonas, externamente presentan síntomas en estrías o ampollas castaño-oscuras entre las nervaduras paralelas de la hoja o filodio (Figura 8 A), a diferencia de lo observado en la superficie de la hoja sana (Figura 8 B). Dichas estrías no se encuentran dispuestas en forma continua a lo largo de la superficie de la lámina, sino que están interrumpidas. No se observó la presencia del hongo en los cortes realizados en los tallos de las plantas infectadas ni en los meristemas vegetativos y reproductivos. Por lo expuesto, se puede establecer que la infección de U. filiformis es de “tipo local” y no sistémica. Resultados similares se registraron para otros carbones que producen la enfermedad en el mismo órgano que infectan, colonizan y esporulan, como por ejemplo es el caso de Ustilago maydis y Thecaphora frezii (Hirschhorn, 1986; Astiz Gassó y Molina 2010; Astiz Gassó et al 2010).
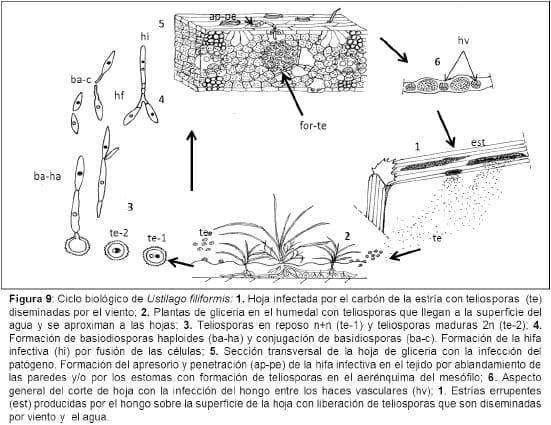
Los resultados preliminares aquí obtenidos fueron presentados en un reporte preliminar (Astiz Gassó et al. 2012). Además, nos permitió confeccionar el ciclo biológico de U. longissima en gliceria, tal como se detalla a continuación (Figura 9). .
Ciclo Biológico de Ustilago longissima (Astiz Gassó, 2013)
El proceso infectivo del carbón de la estría de gliceria comienza con hojas infectadas con teliosporas del hongo, que son diseminadas y dispersadas por el viento (Figura 9 1). Las plantas de gliceria se encuentran en humedales donde las teliosporas llegan a la superficie del agua y por flotación se aproximan a las hojas (Figura 9 2). Las teliosporas en reposo son n+n y en presencia del hospedante se induce a la maduración que luego al fusionarse se transforman en 2n (Figura 9 3). A continuación se forman las basiodiosporas haploides (n) y la fusión de células compatibles para generar la hifa infectiva (n+n) (Figura 9 3-8). La infección del patógeno se produce cuando la hifa infectiva forma el apresorio y penetra al tejido a través de los estomas o por ablandamiento de paredes celulares (Figura 9 5). Posteriormente, se produce la colonización de la hoja de gliceria y la infección del hongo avanza entre los haces vasculares formando estrías o ampollas internervales (Figura 9 5-6). Las teliosporas (n+n) se forman en el clorénquima aerífero del mesófilo o aerénquima (Figura 9 5-6). La presión que ejercen las teliosporas sobre el tejido de la hoja produce la ruptura en la superficie de la hoja y son diseminadas por el viento y/o el agua (Figura 9 1). La supervivencia del patógeno es a través de las teliosporas que se encuentran en el suelo, como así también en los restos vegetales infectados.
Conclusión
Las investigaciones realizadas durante la ejecución de este trabajo de U. filiromis en Glyceria sp, nos permitió arribar a las siguientes conclusiones:
I. Los métodos utilizados en esta investigación son eficientes para la determinación de la histopatología del carbón de la estría sobre su hospedante.
II. Se pudo determinar el proceso de penetración, infección y colonización del patógeno sobre las plantas de gliceria.
III. Se determinó que la característica de la infección es de tipo local y no sistémica.
IV. Se presume una disminución de la disponibilidad del forraje para el ganado debido al ataque directo de U. filiformis sobre las hojas. También habría que determinar su posible toxicidad en los animales al ser consumido.
V. Se estableció y esquematizó el ciclo biológico de U. filiformis sobre Glyceria spp. por primera vez en nuestro país y en el mundo, constituyendo un aporte de valor para entender la epidemiología de la enfermedad.
Bibliografia
- Alonso S.I., Guma I.R., Nuciari M.C. y van Olphen A. 2009. Flora de un área de la Sierra Borrosa (Balcarce) y fenología de especies con potencial ornamental. Rev. FCA UNCuyo 41 (2):23-44.
- Astiz Gassó M. M. and Molina M. del C. 2010. Physiological specialization of Ustilaginales (smut) of genera Bromus, Zea and Triticum in Argentina. Cap. 11. Managenent of fungal plant pathogens. Págs. 138-146. CAB International 2010 SBN: 81-7233-468-0.
- Astiz Gassó, M.M., Lovisolo, M. De Magistris, A. y Leis, R. 2006. Reporte del carbón Ustilago longissima (Sch) Meyen sobre Glyceria multiflora Stued. (Poaceae) en la provincia de Buenos Aires. Actas XII Jornadas Fitosanitarias Argentinas Pág. 278.
- Astiz Gassó M.M., Lovisolo M., y Mollá Kralj A. 2010. Histopatología del carbón Thecaphora frezii en Arachis hypogaea. Boletín Editado en la Estación Experimental Agropecuaria Manfredi. ISSN On line 1851-4987 pág 1-3.
- Astiz Gassó, M.M., Lovisolo, M. y Perelló A. 2012. Biología e histopatología del carbón Ustilago longissima sobre Glyceria multiflora. Actas XIV Jornadas Fitosanitarias Argentinas. Pág. 49.
- Bhatnagar , G.C., Gupta R.B.L., Mishra V.L.1978. Effect of flag smut, caused by Urocystis agropyri, on yield components of wheat cultivars in Rajasthan, India. Plant disease Reporter, 62:348-350
- Beniwal, M.S. 1992. Effect of flag smut on yield and yield components of wheat varieties. Crop Research (Hisar) 5:348-351.
- Brook, S. D. 1957. Additions to the smut fungi of New Zealand, II Transactions of the Royal Society of New Zealand 84 (4): 643-648.
- Burkart A 1969. Flora ilustrada de Entre Ríos (Argentina). Parte II. Gramíneas. La familia botánica de los pastos. Colección científica del INTA, Tomo VI, II. Buenos Aires, Argentina.
- Butler, G., Boughey, H. and Cauwood, H. 1978. The mating system of Ustilago longissima in vitro. Translations Britain Mycology. Society 71(2) 203-208.
- Hirschhorn, E. 1986. Las Ustilaginales de la flora Argentina. C.I.C. Comisión de Investigaciones Científicas de la Provincia de Buenos Aires 530 pp.
- Kosiada T. 2011. In Vitro influence of selected fungicides on Sphacelotheca reiliana and Ustilago maydis. Journal of Plant Protection Research 51(4): 342-348.
- Maurya S., Singh U.P., Singh R., Singh A., Singh H.B. 2010. Role of air and light in sclerotial development and basidiospore formation in Sclerotium rolfsii. Journal of Plant Protection Research 50(2): 206-209.
- Mordue, J.E.M. 1991. Ustilago longissima, (Descripciones de hongos y bacterias).IMI Description of Phytopathogenic Fung and Bacteria-110:1099.
- Mordue,J.E.M. and Walker J.M.1981. Urocystis agropyri. CMI Description of Phytopathogenic Fung and Bacteria- 716:1-2.
- Rossi, C.A., Ferrari L. and Postulka E. 2006. Germination conditions for cebadilla de agua (Glyceria multiflora Steudel), a native grass of the flooding Pampa Rangeland (Argentine). International Journal of Botany 2 (3) 300-306.
- Rossi, C.A., González, G., De Magistris, A.A. y Torrá E.. 2009. Composición botánica del pastizal natural en un sistema silvopastoril del Delta del Paraná: clasificación forrajera. Actas del 1º Congreso Nacional de Sistema Silvopastoriles. Pág. 321-326.
- Vanky, K. and Shivas R.G. 2008. Fungi of Australia: The smut fungi. ABRS/Canberra. Melbuorne, Victoria, Australia: CSIRO Publishing, 266 pp.
- Vidal A y Piergentili D. 1973. Valor forrajero de algunas especies de ambientes hidromórficos de la provincia de Buenos Aires. De la Revista de la Facultad de Agronomía (3a época). XLIX. La Plata, República Argentina.
- Wilson J.M. and Frederiksen 1970. Histopatology of resistance in the Sorghum bicolor-Sphacelotheca reiliana interaction. Phytopathology 60:828-932












.jpg&w=3840&q=75)