Introducción
Como es sabido la mayor cantidad de proteínas de la sangre se encuentra en la fracción del paquete globular, específicamente en la hemoglobina de los eritrocitos. El paquete globular desecado se usa generalmente en la alimentación animal, principalmente en dietas para animales monogástricos. Debido a la amplia gama de aplicaciones de la sangre animal, dejaremos para un posterior capitulo los detalles de su utilización. En la industrialización del paquete globular se pueden aplicar las mismas técnicas y procesos que para la sangre entera (publicados recientemente por Pérez-Gavilán y col; 2017) tales como: el composteo, la manufactura de morcilla o moronga, la aplicación de procesos de secado en tambor, secado en anillo y flash o por aspersión. En cuanto a la alimentación humana. El paquete globular está ligado tradicionalmente a productos de color oscuro como las morcillas, embutidos de sangre o pasteles de sangre. La baja demanda del paquete globular en la alimentación humana se le atribuye a que induce un color demasiado oscuro, indeseable si se incorpora a los alimentos, (Fontes et al, 2004; Fontes et al 2010; Pereira et al, 2014) se han hecho esfuerzos para poder hacer más atractiva la incorporación del paquete globular a través de diferentes métodos como: la estabilización, el enmascaramiento del color o la decoloración de la hemoglobina. Los métodos se detallan a continuación.
Estabilización y enmascaramiento del color de la hemoglobina.
Estabilización del color de la hemoglobina: Cuando la hemoglobina se combina con el oxígeno forma oxihemoglobina, tal combinación no es una reacción de oxido reducción sino una fijación del oxígeno por el fierro (Fe2+) si el fierro se oxida (Fe 3+) se forma la metahemoglobina que es incapaz de transportar el oxígeno ( Valdez, 1998; Rodríguez 1986). Mas detalles sobre la estructura de la hemoglobina se encuentran en Ballesteros; 2015.
Como todos los pigmentos la estructura tetrapirrólica, el hem de la hemoglobina posee dos bandas de absorción en el campo visible. Una de ellas es poco intensa y presenta un máximo de absorción entre los 550 y 660 nm característica del color rojo del pigmento cuya longitud de onda máxima puede variar según el estado del Hem (oxihemoglobina, metahemoglobina etc).
para la estabilización del color, se han ensayado numerosas sustancias reductoras para estabilizar el color rojo intenso de la sangre fresca, con el fin de utilizar la hemoglobina como colorante (en jamones, por ejemplo). Los ensayos realizados han mostrado que reductores suaves, tales como el ácido ascórbico, lo más que consiguen es retardar la oxidación de la hemoglobina y solamente compuestos como el óxido de carbono o los nitritos generan combinaciones estables. La hemoglobina estabilizada por nitrosilación podría servir también para dar color a productos análogos a la carne preparados a partir de proteínas vegetales texturizadas (Cheftel et al; 1989). La Estabilización del color por medio de monóxido de carbono consiste en la saturación con CO, lo que resulta en la conversión de hemoglobina a carboxi hemoglobina que tiene un color rojo cereza (Fontes et al, 2004; Fontes et al, 2010; Pereira et al,2014). Tal método se aplicó a sangre completa, que se colocó en un reactor donde se burbujeó CO puro a través de un disco poroso (1 L / min) con agitación suave hasta saturación. Se encontró que a un pH más bajo reduce el tiempo para saturar completamente la hemoglobina. Sin embargo, el color rojo puede perderse durante el almacenamiento debido a un proceso de oxidación. Otro estudio informó que la sangre, que fue estabilizada por este método, se puede aplicar en la formulación de mortadela (Fontes et al; 2015).
Enmascaramiento del color de la hemoglobina:Para el enmascaramiento, se propone utilizar la sangre o el paquete globular y hacer mezclas con leche descremada a 95°C en presencia de CaCl2. Se obtiene un precipitado proteico que puede ser empleado para reemplazar hasta el 15 % de la carne de vaca en salchichas.
Métodos de decoloración de la hemoglobina.
En cuanto a las técnicas de decoloración de la sangre todas tienen por principio el permitir la ruptura del enlace hemo-proteína de la molécula de hemoglobina y la separación de estas dos fracciones. Según las técnicas consideradas, la ruptura del enlace puede obtenerse por vía química o enzimática; la separación de las fracciones está basada en su diferencia de masa molecular, o en la solubilidad diferencial en los solventes empleados. Se han propuesto varios procedimientos, pero ninguno de ellos parece verdaderamente haber alcanzado la escala industrial. (linden y Lorient; 1996). A continuación, se describen los procedimientos utilizados:
a) Precipitación del grupo hemo con carboximetil celulosa (CMC)
Sato et al; (1981) desarrollaron un método para la preparación de globina usando carboximetil celulosa en cromatografía en columna, pero este método no es aplicable en tecnología a gran escala (Autio et al; 1985b), Por lo que, en 1984 Autio et al. modificaron el proceso con carboximetilcelulosa (CMC). Según Autio et al (1985b) el paquete globular se separa del plasma por centrifugación, se hemoliza el paquete con agua destilada y se adiciona ácido clorhídrico, hasta obtener un pH menor de 3 para romper los enlaces entre la globina y el hemo. Se agrega una solución de CMC con una concentración que va de 0.06 a 0.35 %, para obtenerse un precipitado de color café obscuro (complejo hem-CMC) que puede separarse de la solución de globina por medio de centrifugación a 8 000 x g, en un período de tiempo que puede ser desde 30 min hasta 178 horas. En esta patente no se especifica la calidad del producto obtenido y la metodología donde se emplea cromatografía en columna, la solución de globina obtenida es incolora.
b) Precipitación del grupo hemo con carboximetil celulosa (CMC) y efecto de la temperatura
Las interacciones CMC-hemo y proteína-hemo son competitivas a pH bajo; al desnaturalizar la proteína por medio de un tratamiento térmico las interacciones hemo-proteína se debilitan y se incrementa la interacción de la CMC con el grupo prostético, por lo que se puede decolorar de una manera más eficiente. Por esto en 1986, Hayakawa et al. propusieron el siguiente método: la hemoglobina se disuelve en agua destilada (5 g/100 mL), ajustando el pH a un valor inicial de 1.50 con HCI 1 N y calentando la solución a 77 °C por 10 min. Posteriormente se mezcla la solución de hemoglobina con un volumen equivalente de solución de CMC al 0. 72 %, se ajusta inmediatamente el pH final a 2.25. Después se agita por 30 min a 20 °C y se centrifuga la mezcla a 1000 x g. por 10 min. El sobrenadante corresponde a la solución de globina (Hayakawa et al; 1986).
c) Precipitación del grupo hemo con Alginato de sodio
Se ha sugerido que la mayoría de los iones metálicos divalentes forman complejos con alginatos; además se ha encontrado que la capacidad de intercambio del ion del ácido algínico es cuatro veces mayor que de la carboximetil celulosa. Por lo anterior en 1990, Zoon et al. propusieron un método para la precipitación del grupo hemo de la hemoglobina, con alginato de sodio, el método consiste en lo siguiente:
La hemoglobina es disuelta en agua desionizada hasta obtener una concentración de 0.3 % y es usada como una solución stock. También se prepararon soluciones de alginato de sodio y cloruro de sodio, ambas a una concentración de 2.5 % p/v, las cuales son adicionadas a 20 mL de solución de hemoglobina hasta obtener una concentración de 0.107 % y 0.348 % respectivamente en la solución final, a la cual se le ajustó el pH a 2.25. El volumen final es ajustado a 25 mL con agua desionizada. Los experimentos de precipitación se realizaron a 20 °C, con agitación constante por 20 min y posterior centrifugación a 5000 x g por 15 min, con lo que se obtuvo una porción sobrenadante la cual correspondió a la proteína en solución. El pH fue ajustado con soluciones de HCI y/o NaOH 0.5N, (Li et al: 2012)
d) Precipitación de la globina con acetona ácida
El más popular proceso para la separación de la hemoglobina en sus fracciones grupo hemo y globina es el método de acetona ácida; (RossiFanelli et al; 1958) y en 1975 Tybor et al., desarrollaron un proceso continuo a nivel de planta piloto para la decoloración de la globina utilizando este solvente (Zoon et al; 1990) aunque también se ha precipitado la globina con etanol (Autio et al; 1990). Las cadenas globulares de las proteínas precipitan debido a la desnaturalización de las moléculas, siendo la acetona más efectiva que el alcohol (Ockermann y Hansen; 1994).
El proceso a nivel piloto para la preparación de globina de Tybor et al; (1973, 1975) es el siguiente: La sangre entera fue recolectada del rastro y se mezcló con una solución de NaCI al 0.85 % y citrato de sodio al 0.02 % para evitar la coagulación. La mezcla fue mantenida a 5 °C y separada después de 24 horas, en plasma y paquete globular. El plasma se secó por spray y el paquete globular se hemolizó hipotónicamente, para lo cual el paquete celular se diluyó 1:1 con agua y se adicionó cloroformo a la solución de hemoglobina (1:4 v/v) para remover los estromas los cuales fueron eliminados de la suspensión por decantación de la proteína sobrenadante. Enseguida se adicionó el ácido ascórbico a la solución de hemoglobina hasta alcanzar un pH de 4 y se mezcló a alta velocidad. Un volumen de la solución de proteína se mezcló gradualmente con 4 volúmenes de acetona acidificada con HCI al 1 % y se agitó severamente por unos minutos para remover el grupo heme y precipitar la proteína. La proteína se recolectó por filtración a través de tela de muselina y se lavó continuamente con acetona acidificada hasta obtener un precipitado casi blanco (Tybor et al; 1973 y 1975; RossiFanelli et al; 1958).
Algunos investigadores comienzan el proceso de decoloración transformando la hemoglobina del paquete globular en colehemoglobina bajo la acción del ácido ascórbico antes de realizar la extracción con acetona ácida; otros han propuesto concentrar la solución de hemoglobina precipitando con NaCI antes del tratamiento con el solvente para reducir el volumen del mismo. Sin embargo, este método ya antiguo no se ha extendido, probablemente por la cantidad de solvente necesario y por los problemas de seguridad alimentaria planteados por la utilización de tales productos, pero también sin duda a causa del sabor y olor más bien desagradable del producto obtenido. (Linden y Lorient; 1996; Ockermann y Hansen; 1994). Este método resulta muy eficiente, pero costoso por el uso de solventes. Además, los solventes utilizados son altamente flamables y la remoción de los residuos del solvente del producto final viene a ser una dificultad. (Autio et al, 1985b; Zoon et al,1990; Ockermann y Hansen, 1994). Otras sustancias que se han usado para este propósito además de la acetona son: metil-etil-cetona, dimetil formamida (Autio et al; 1985b) y como se ha mencionado el etanol.
e) Hidrólisis enzimática
Novo Nordisk ha propuesto un método basado en la precipitación del grupo heme después de una hidrólisis enzimática parcial de la hemoglobina con una proteasa bacteriana alcalina cuyo nombre comercial es Alcalase® 2.4L, el método es el siguiente:
Inmediatamente después de recolectar la sangre debe añadirse un agente anticoagulante. La sangre puede separarse por centrifugación en sus fracciones plasma y paquete globular. Después de la separación. la fracción celular se diluye con agua en una proporción de 1:3, lo que ocasiona una hemólisis rápida. Posteriormente la hidrólisis se efectúa a un pH de 8.5 con Alcalase® 2.4L al 1.0 % p/p. La hidrólisis se realiza bajo condiciones controladas, hasta obtener un grado de hidrólisis (GH) de un 18 a 20 %. La proteasa bacteriana es producida por Bacillus licheniformis y actúa como endopeptidasa.
La hidrólisis se termina añadiendo ácido clorhídrico hasta pH de 4.0 y la mezcla se deja reposar durante 30 min para inactivar la enzima. Puede separarse el hidrolizado de las células sanguíneas y un residuo de color negro que contiene el grupo hemo. Después de la separación el hidrolizado de las células sanguíneas (HCS) se purifica y se puede adicionar carbón activado para perfeccionar el color y el sabor, y por último se neutraliza hasta alcanzar un pH de 6.5 a 7.0. (Novo Norsdisk, SIA).
El método enzimático proporciona un sabor amargo de la fracción hidrolizada de los eritrocitos el cual puede ser eliminado con carbón activado o con ácidos fuertes como el clorhídrico (Ockermann y Hansen, 1994). El sabor de la proteína es afectado, por la hidrólisis, la tendencia a adquirir el sabor amargo depende del grado de hidrólisis, pero también de la estructura de los péptidos producidos. (Novo Nordisk, 1995). El valor nutritivo de los productos hidrolizados puede resultar considerablemente reducido como consecuencia de la destrucción del triptófano, además el contenido de cenizas suele ser elevado (Ockermann y Hansen; 1994).
La degradación de las proteínas por vía enzimática incrementa la solubilidad de la proteína, además de afectar otras propiedades funcionales como la capacidad emulsificante, espumante, viscosidad, gelificación, y capacidad de retención de agua (Novo Nordisk, 1995; Cheftel et al, 1989).
f) Oxidación del grupo hemo
La decoloración de la hemoglobina se puede realizar o se puede obtener por la destrucción oxidativa de la molécula del grupo hemo. El peróxido de hidrógeno es muy eficiente para destruir la molécula del hemo, pero cuando los eritrocitos están como material crudo en la hemoglobina están protegidos del impacto del peróxido de hidrógeno por la actividad de la catalasa. Por lo que la inactivación de la catalasa es un prerrequisito para la decoloración. La actividad de la catalasa puede ser inactivada completamente a altas temperaturas, pero la hemoglobina decolorada está completamente coagulada y pierde sus propiedades funcionales. La catalasa también se inactiva en una solución ácida, a un pH de 2 a 4.5 (Wismer-Pedersen; 1987).
El procedimiento para la decoloración de la sangre por oxidación del grupo hemo según Wismer-Pedersen, es el siguiente:
Los eritrocitos se diluyen con agua hasta tener una concentración de proteína de aproximadamente 7 %; mientras se agita, se adiciona lentamente HCI 4 N hasta tener un pH de 2.5. Después de 20 min la solución se centrifuga a 18000 x g. durante 20 min. El pH del sobrenadante se ajusta de 4 a 5 con la adición de NaOH 2 N, también se agrega una solución de peróxido de hidrógeno al 35 % hasta obtener una concentración de 0.3 %. La solución se incuba a 20 °C, por 20 horas aproximadamente. Después de la incubación el pH de la solución se ajusta a 5 y el aislado de la proteína se seca por liofilización. En algunos experimentos el peróxido de hidrógeno residual se elimina por adición de ácido ascórbico.
Otra forma de decolorar la hemoglobina con peróxido de hidrógeno sugiere hemolizar los eritrocitos con 7 volúmenes de agua y calentar de 50 a 70 °C. Se añade entonces una solución de peróxido de hidrógeno al 3% que oxida la hemoglobina a metahemoglobina prácticamente incolora o ligeramente verdosa. Una vez completa la reacción la temperatura se reduce a 30 °C y el exceso de peróxido de hidrógeno se elimina con la catalasa; las proteínas decoloradas precipitan en forma de pequeñas esferas que se recogen por filtración (Ockermann y Hansen; 1994: Wismer-Pedersen, 1987, Linden y Lorient; 1996). El material resultante es prácticamente insípido e insoluble en agua; (Ockermann y Hansen; 1994; Linden y Lorient; 1996).
Cuando este material se añade a los embutidos se comporta como un ingrediente inerte, haciendo que los productos sean más blandos y modificando el color desde el tono rosado original a un color marrón o incluso amarillento si se añade a nivel del 10 %. Si se agrega en concentraciones del 1-1.5 %, el sabor y la textura de los embutidos se modifica sólo ligeramente (Ockermann y Hansen; 1994). La proteína obtenida por este método puede ser utilizada para aumentar el valor nutricional en algunos productos cárnicos (Linden y Lorient; 1996). Cabe hacer la aclaración que el hierro presente no es eliminado, sino sólo cambia su estado de oxidación, efecto que más que benéfico parece resultar problemático (Rodríguez; 1986).
Los diferentes métodos usados para la decoloración de la hemoglobina afectan la calidad de esta, nos referimos sobre todo al demerito de las propiedades funcionales que la hacen factible para su industrialización y fabricación de diversos productos, tales propiedades como: la solubilidad, gelificación y emulsificación. Estás deben ser evaluadas para determinar o buscar en otros ingredientes y así mantener la funcionalidad de la proteína que pretenda ser usada en la industria de alimentos (Foegeding and Davis 2011; Kudre et al, 2013; Arfat et al,2014; Heertje 2014; Intarasirisawat et al,2014; Rocha et al,2014). Para la globina, se describen a continuación:
Propiedades funcionales de la Globina
a) Solubilidad.
La solubilidad se ve influenciada notablemente por el pH, obteniéndose la solubilidad mínima en el rango de pH de 7-9 (Tybor et al; 1973 y 1975; Hayakawa et al; 1982; Autio et al; 1984; Shadhidi et al; 1984) la globina es soluble al 10% en la región del punto isoeléctrico (pH 7-9) siendo la hemoglobina soluble al 80% en ese rango de pH. La solubilidad de la globina disminuida a esos pH´s, ha sido atribuida a la interacción entre grupos hidrofóbicos exhibidos por la remoción del grupo hemo (Morrissey et al; 1991).
Autio et al; (1984) compararon las curvas de solubilidad contra pH de la globina preparado por el método de cromatografía con CMC con la globina preparada por precipitación con acetona. Ambas preparaciones presentaron una solubilidad mínima a pH 8. Sin embargo, la globina preparada por el método de la acetona era más soluble a pH neutro esta diferencia se atribuyó a que la globina preparada por el método CMC contiene mayor cantidad de sal, encontrándose que la adición de sal disminuye la solubilidad de la globina en todos los valores de pH.
Tybor et al; (1975) reportaron que ninguna temperatura de secado ni la incorporación de lactosa antes del secado tienen un efecto significativo en la solubilidad de la globina, mientras que Hayakawa et al; (1982) encontraron que la globina seguía siendo altamente soluble, (aproximado al 100%) cuando se calentaba por encima de 100°C a un pH menor de 5. Sin embargo, la solubilidad de la globina sometida a tratamiento térmico disminuye en un rango de pH de 5 a 8 (Morrissey et al; 1991); (Álvarez et al;2009).
b) Propiedades de hidratación.
No se han informado estudios fundamentales de las propiedades de hidratación de la globina. sin embargo , se han usado métodos empíricos para determinar la capacidad de retención de agua (Autio et al ; 1984, ; Shadhidi et al; 1984) y se ha encontrado que esta propiedad es mayor en la globina respecto a la proteína de soya ,lactoalbúmina y gluteína (Autio et al ; 1984) la capacidad de retención de agua disminuye calentando a temperaturas mayores a 60°C, al aumentar la fuerza iónica ; por lo tanto la adición de NaCl reduce esta capacidad , especialmente a concentraciones mayores a 0.2M (Autio et al ,1984; Morrissey et al, 1991).
c) Viscosidad
La viscosidad aparente de la globina es altamente dependiente de la temperatura y del pH en un rango de 5 a 6. (Hayakawa et al; 1982). A pH de 5.7- 5.8, la viscosidad aparente de una solución de globina incrementa ligeramente al calentarla a 55°C, alcanzando su máximo a 60°C y disminuye al aumentar la temperatura. Sin embargo, se observó un gran aumento en la viscosidad cuando la solución de globina al 1% se calienta por arriba de 80°C (alcanzando su máximo a 95°C) en un estrecho rango de pH 5.2-5.4 (Hayakawa et al; 1982). Lo anterior fue confirmado por Autio et al; (1984) quienes no observaron cambio alguno en la viscosidad como función de la temperatura a pH´s menores a 5 y mayores a 6. Sin embargo, observaron un aumento excesivo en la viscosidad cuando soluciones al 5% de globina a pH 5.2 a 5.8 se calentaron a 95°C. Bajo estas mismas condiciones, pero con la adición de NaCl al 0.2% M la viscosidad aparente fue casi nula (Autio et al; 1984).
Hayakawa et al; (1982) midieron la viscosidad de la globina y observaron que aumentó dramáticamente cuando la proteína se calentaba por arriba de 80°C y mostraron la marcada dependencia de la concentración a 90°C. la viscosidad intrínseca aumentó de 10 mL/g a 60°C a 60mL/g a 80°C. el cambio en la viscosidad coincidió con la transición de las partículas globulares (PM= 8x10-8) a 60°C. Hayakawa et al; (1983) especularon , que la asociación por el calentamiento de la globina ocurre debido al desplegamiento de las moléculas de la globina nativa que espontáneamente forman agregados globulares que se extienden y se asocian para formar fibras de macro agregados y finalmente de matriz de gel.
d) Gelatinización
Se ha considerado que las soluciones de globina calentadas no gelifican, (Morrissey et al; 1991) Sin embargo, la globina preparada por el método de Sato et al; (1981) forma un gel transparente a concentraciones mayores a 3%, a un pH aproximado de 5, cuando se calienta a 80°C (Hayakawa et al,1982; Morrissey et al ,1991) Por eso se ha sugerido que a altas concentraciones de globina, se formas geles debido a un enredado de fibras , que forman macroagregados . Las propiedades de gelificación de la globina han sido estudiadas por Autio et al; (1984 1985a) la fuerza de los geles incrementa al aumentar la temperatura (60-95°C) y la concentración de proteína (1.4-5.0%) a un pH de 5.4 a 6.4 y en ausencia de NaCL (Bah et al; 2013). El pH de gelificación es dependiente de la concentración de proteína y de sal. Los geles que se prepararon con soluciones al 2% y 4% de proteína, sin adición de NaCl presentaron una fuerza máxima a pH´s de 6.2 y 5.2, respectivamente, (Morrissey et al; 1991). Se ha reportado que la globina preparada por el método de acetona acidificada no forma geles después de calentamiento. aunque también, se ha reportado que la globina preparada de acuerdo a este método puede formar geles a altas concentraciones de globina (7%) (Liu et al; 1996).
En el Instituto de Investigaciones sobre alimentos de Japón, se estudiaron las propiedades de agregados hidrolizados de globina obtenida por el método de Tybor; la hidrolisis de la proteína fue realizada mediante el calentamiento a 95°C por 15 minutos y la adición de 0.8M de ácido cítrico. En estudios anteriores, se había encontrado que los agregados de globina tienen mayor solubilidad y mejor capacidad para la formación de geles que la globina sin hidrolizar. Estos resultados también sugieren que la hidrolisis ácida es un método eficiente para modificar y dar nuevas propiedades funcionales a la proteína (Liu et al; 1996).
e) Propiedades espumantes
La capacidad espumante de la globina es mayor a la de la albúmina de huevo y tiene un máximo a pH de 6 y una concentración de globina de 1.7 % p/v. (Tybor et al; 1975) Al parecer la estabilidad de la espuma de la globina tiene un máximo a pH de 6 y es comparable con la albúmina de huevo (Shadhidi et al; 1984, Morrissey et al; 1991). Rodríguez, P; (1986) también encontró que la globina de bovino aislada por el método de acetona ácida es un excelente agente espumante (Toldrá et al ;2004).
f) Capacidad emulsificante
La capacidad emulsificante (CE) es definida como la máxima cantidad de aceite que puede emulsificar una proteína bajo condiciones establecidas. La globina tiene mayor capacidad emulsificante que el concentrado de soya, la harina de semilla de algodón o la leche en polvo descremada; pero menor que el plasma (Morrissey et al; 1991, Nakamura et al; 1984). La contribución de la CE en emulsiones cárnicas por la adición de globina es menos en un 10%, en comparación con la adición de plasma o proteínas cárnicas, la contribución de la globina puede mejorar cuando se usa en combinación con plasma en una proporción de 4:1, produciéndose una salchicha aceptable (Caldironi y ockermann; 1982).
La CE de la globina aumentó al incrementar la concentración de proteína hasta 0.4g /100mL y ya no cambió al aumentar esta concentración (Nakamura et al; 1984, Tybor et al; 1975, Shadhidi et al; 1984) Se ha sugerido que cuando las concentraciones de globina exceden 0.4g por 100 mL, ocurre un mezclado inadecuado durante la preparación de la emulsión debido a la alta viscosidad de la dispersión. La capacidad de la globina de estabilizar emulsiones de aceite en agua es afectada seriamente por el pH (Morrissey et al, 1991; Nakamura et al, 1984; Autio et al, 1984; Shadhidi et al,1984).
La actividad emulsificante (EA) es el área interfacial (m2) creada por peso de proteína (g) y obtuvo los valores mínimos en un rango de pH de 7 a 8 donde la solubilidad de la globina es baja (Nakamura et al, 1984; Tybor et al, 1975; Autio et al, 1984) La EA es muy buena en el rango de pH de 3-6 y por arriba de 9 (Nakamura et al; 1984), esta actividad disminuye con la adición de NaCl al 2%. El pH y el NaCl afectan las interacciones electrostáticas y son responsables de la agregación de la proteína y la pérdida de solubilidad en el punto isoeléctrico y como una consecuencia de la absorción de la proteína puede reducirse (Morrissey et al; 1991).
Para incrementar la solubilidad de la globina en la zona isoeléctrica, se pueden aplicar dos métodos: la modificación química con anhídrido acético y la hidrolisis con pepsina. La acetilación con anhídrido acético aumenta significativamente la carga neta negativa, causando la expansión molecular, mejorando notablemente la EA de la globina a pH de 6 a 9 (Nakamura et al; 1984). La actividad disminuye rápidamente a pH´s menores de 6, debido a la baja solubilidad de las proteínas acetiladas en la región ácida. los hidrolizados peptídicos de globina, que son totalmente solubles en la región del punto isoeléctrico no muestran un aumento en la EA lo que también se ha observado en los hidrolizados de proteína del suero (Nakamura et al, 1984; Morrissey et al, 1991), Rodríguez; (1986) encontró que la globina es un excelente agente emulsificante.
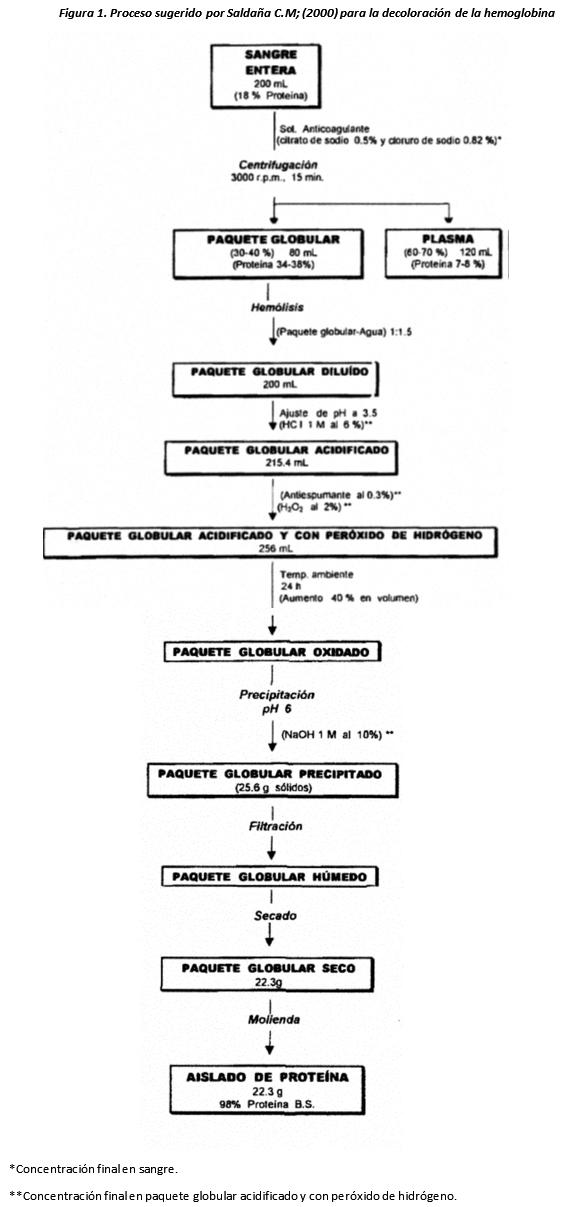
Por otra parte, Saldaña C.M; (2000) ensayó los diferentes métodos antes mencionados para la decoloración de hemoglobina y encontró que el método más efi
ciente para la decoloración es la extracción del grupo hemo con acetona ácida, pero que su implantación a gran escala resultaría muy costosa. Por lo que propuso que para la decoloración de la hemoglobina la técnica más factible y económicamente es la decoloración con peróxido de hidrógeno que implica el blanqueo del grupo prostético por oxidación (Fig. 1). El proceso muy general comienza con la ruptura de los eritrocitos por dilución con agua 1:1.5; mientras se agita, se adiciona lentamente HCI 1 M hasta tener un pH de 3.5. Después se le agrega antiespumante y H2O2 al 2%, se incuba a temperatura ambiente durante 24 horas, se le agrega NaOH 1N hasta pH 6 para precipitar la hemoglobina, se filtra y se seca.
Los diferentes métodos usados para la decoloración de la hemoglobina afectan la calidad de esta, por ello, para la hemoglobina decolorada con el método anterior se determinó sus propiedades funcionales de solubilidad, gelificación y emulsificación. Descritos a continuación:
Propiedades funcionales de la hemoglobina decolorada con peróxido de hidrógeno
a) Solubilidad
La solubilidad de la proteína está muy influenciada por el pH del medio, los cambios de este afectan la ionización y la magnitud de la carga neta de las moléculas de proteína. alterándose las fuerzas de atracción y repulsión.
La solubilidad en la zona cercana a la neutralidad y a pH ligeramente básico es nula (6-9), en esos puntos las fuerzas de repulsión son mínimas, lo que hace que las proteínas tiendan a agregarse dando como resultado la precipitación; la máxima solubilidad ocurre a pH de 2 y a pH de 11 (Saldaña C.M ,2000).
b) Gelatinización
La hemoglobina decolorada con peróxido de hidrógeno no gelifica, a pesar de que se utilizaron altas concentraciones de proteína (5 y 10 %). En cambio, en estudios realizados por Autio et al; (1984) y 1985, con la globina obtenida por el método de precipitación del grupo hemo con carboximetilcelulosa, la proteína forma un gel transparente a concentraciones menores a las utilizadas en la decoloración con peróxido (2 a 4%). Aunque también se ha reportado que esta proteína no forma geles (Saldaña C.M ;2000).
c) Emulsificación
La capacidad de emulsificar de las proteínas es evaluada por el llamado Índice de Actividad Emulsificante (EAI) y el Índice de Estabilidad Emulsificante (ESI), (Pearse y Kinsella;1978). Para el caso de la hemoglobina decolorada con peróxido estos parámetros se compararon con suero de albúmina bovina (BSA) que es un buen agente emulsificante. Se encontró que La actividad emulsificante del BSA aumenta al incrementarse el pH, lo cual también ocurre con la hemoglobina tratada con peróxido de hidrógeno, pero en el rango de pH de 1 a 4 presenta el EAI más bajo, debido probablemente a los cambios sufridos en la conformación de la proteína.
Las propiedades emulsificantes dependen en gran medida del balance de aminoácidos hidrófobos e hidrófilos que cada proteína contiene; la parte hidrofóbica de las proteínas se orienta hacia la fase oleosa y la parte polar hacia el agua de la fase acuosa. En la formación y en la estabilidad de las emulsiones el pH es un factor importante, debido a los grupos ionizables carboxilo y amino que contienen los aminoácidos de las proteínas, los cuales tienen la capacidad de desarrollar una carga positiva o negativa según el pH del medio.
El índice de actividad emulsificante a todos los valores de pH es mayor, aunque no en gran medida, en la BSA en comparación con la hemoglobina tratada con peróxido de hidrógeno, por lo que puede considerarse una buena actividad emulsificante para la proteína en estudio, tomando en cuenta que la BSA es un excelente agente emulsificante, Comparando el ESI de las emulsiones de hemoglobina tratada con emulsiones de suero de albúmina bovina, estas últimas presentan una estabilidad mucho mayor. La baja estabilidad es debida probablemente a los cambios generados en la conformación de la proteína durante el tratamiento de decoloración (Saldaña C.M ;2000).
Por último, se puede decir de los métodos que existen para la decoloración de la hemoglobina, que: los procedimientos químicos bajan la solubilidad al pH isoeléctrico, pero mantienen las propiedades funcionales, mientras que la decoloración por vía enzimática tiene efectos inversos; (Cheftel et al; 1989) la eliminación del grupo hemo reduce la estabilidad de la proteína globular, que en consecuencia es mucho más sensible a los agentes desnaturalizantes y al calor. La eliminación o el blanqueo del grupo prostético produce una proteína menos satisfactoria desde el punto de vista nutritivo, reduciéndose el valor biológico y la utilización neta de la proteína. Este fenómeno es menos grave en las globinas decoloradas que en los productos en que se elimina el grupo hemo (Ockermann y Hansen; 1994). Por último, nos referiremos al artículo publicado muy recientemente por Lynch A. S et al; (2017) que concluye en su revisión del estado del arte en el procesamiento de la sangre, es necesario incluir más grupos de investigación e industria de alimentos para conjuntar esfuerzos e invertir tiempo y recursos para mejorar el procesamiento de la sangre animal.










.jpg&w=3840&q=75)