Síndrome Respiratorio
Publicado: 2 de mayo de 2010
Por: MVZ MC Juan Carlos Valladares de la Cruz, Asesoría Avícola Independiente. Nuevo León, México
Se describe la presentación de un cuadro respiratorio en pollo de engorda de 19 días de edad y los análisis de laboratorio requeridos para realizar un diagnóstico integral. El diagnóstico integral fue Bronquitis Infecciosa con complicación bacteriana por Escherichia coli. Fue necesario realizar análisis adicionales de biología molecular para tipificar el virus de Bronquitis Infecciosa aislado. Los resultados de las pruebas realizadas indican que el virus de Bronquitis Infecciosa aislado e identificado tiene un grado elevado de homología de la proteína S-1 con el genotipo BL-56.
INTRODUCCIÓN
Las enfermedades respiratorias representan uno de los mayores problemas en la producción del pollo de engorda, debido a su incidencia elevada y a la interacción de agentes infecciosos y condiciones medioambientales que aumentan la susceptibilidad de los pollos criados en condiciones de producción comercial. Existe una gran cantidades de agentes virales y bacterianos capaces de producir enfermedades respiratorias por lo que el uso de las pruebas de laboratorio es un recurso muy importante para conocer las causas del problema, ya que ni los signos ni las lesiones son específicos de un agente en particular (2,5,12).
ANTECEDENTES Y EPIDEMIOLOGÍA DE LA REGIÓN
Caso clínico presentado en la región noreste de México, la cual posee un Clima BS1(h1), semi seco cálido y muy cálido, con una precipitación pluvial de 585 ml y una temperatura media anual de 22°C, con fluctuaciones promedio entre 13 y 31 °C, los meses más calurosos son mayo y junio, con temperaturas superiores a los 37 °C. La región se encuentra a una altitud de 430 m snm; Latitud Norte 25°47´ y Longitud Oeste 100° 11´ (7)
La región es productora de pollo de engorda en granjas con diversos niveles de tecnificación, aproximadamente el 60% de las granjas son de ambiente natural y el resto de ambiente controlado. Existe producción de pollo ligero sin pigmentar para y pollo pesado y fuertemente pigmentado. Los índices de productividad de las granjas se pueden clasificar como moderados y presentan grandes fluctuaciones a lo largo del año. La región está clasificada como zona libre de Influenza Aviar, Enfermedad de Newcastle presentación Velogénica y Salmonelosis Aviar (17), pero hay enfermedades enzoóticas en la región como Bronquitis Infecciosa, Infección por Pneumovirus Aviar e Infección de la bolsa de Fabricio (13).
INTRODUCCIÓN
Las enfermedades respiratorias representan uno de los mayores problemas en la producción del pollo de engorda, debido a su incidencia elevada y a la interacción de agentes infecciosos y condiciones medioambientales que aumentan la susceptibilidad de los pollos criados en condiciones de producción comercial. Existe una gran cantidades de agentes virales y bacterianos capaces de producir enfermedades respiratorias por lo que el uso de las pruebas de laboratorio es un recurso muy importante para conocer las causas del problema, ya que ni los signos ni las lesiones son específicos de un agente en particular (2,5,12).
ANTECEDENTES Y EPIDEMIOLOGÍA DE LA REGIÓN
Caso clínico presentado en la región noreste de México, la cual posee un Clima BS1(h1), semi seco cálido y muy cálido, con una precipitación pluvial de 585 ml y una temperatura media anual de 22°C, con fluctuaciones promedio entre 13 y 31 °C, los meses más calurosos son mayo y junio, con temperaturas superiores a los 37 °C. La región se encuentra a una altitud de 430 m snm; Latitud Norte 25°47´ y Longitud Oeste 100° 11´ (7)
La región es productora de pollo de engorda en granjas con diversos niveles de tecnificación, aproximadamente el 60% de las granjas son de ambiente natural y el resto de ambiente controlado. Existe producción de pollo ligero sin pigmentar para y pollo pesado y fuertemente pigmentado. Los índices de productividad de las granjas se pueden clasificar como moderados y presentan grandes fluctuaciones a lo largo del año. La región está clasificada como zona libre de Influenza Aviar, Enfermedad de Newcastle presentación Velogénica y Salmonelosis Aviar (17), pero hay enfermedades enzoóticas en la región como Bronquitis Infecciosa, Infección por Pneumovirus Aviar e Infección de la bolsa de Fabricio (13).
PRESENTACIÓN CLÍNICA DEL CASO
HISTORIA CLINICA
Granja de pollo de engorda de ambiente controlado, con capacidad de 554,974 aves alojadas en 14 casetas equipadas con comederos automáticos y bebederos de niple. La producción de la granja es de pollo blanco, sin pigmentar, con un peso promedio de 1.847 kg, una conversión alimenticia de 1.982 y una mortalidad anual promedio del 6.37%. La granja tiene antecedentes de problemas respiratorios recurrentes a partir de la tercera semana de edad.
El presente caso corresponde a una parvada producida en el mes de mayo.
El calendario de vacunación utilizado fue el siguiente:
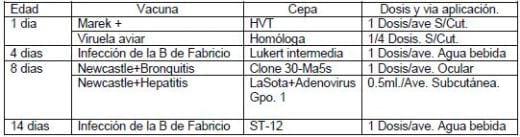
La granja presento una mortalidad acumulada del 1% durante la primera semana de vida. Posteriormente presento una reacción post vacunal moderada a los 12 días de edad, la reacción fue tratada con un expectorante y un antibiótico durante cuatro días, obteniendo una respuesta moderada al tratamiento.
TIPO DE MUESTREO
Se enviaron al Laboratorio de Diagnóstico 18 aves vivas y 100 sueros para un Monitoreo Completo y para el muestreo ce Campaña para Influenza Aviar, con un Diagnóstico Clínico de "Reacción Respiratoria Complicada". A partir de las muestras recibidas se realizaron los estudios correspondientes (13) y se obtuvieron los siguientes resultados:
PRUEBAS Y RESULTADOS DE LABORATORIO
INSPECCION CLINICA (4,13): Sin signos clínicos en 14 aves; estertores traqueales en 4 aves y postración en una ave..
NECROPSIA (4,13): El Diagnóstico morfológico post mortem fue aereosaculitis fibrinopurulenta en 4 aves; aereosaculitis caseosa en 4 aves; congestión pulmonar en 8 aves; pericarditis fibrinopurulenta en 4 aves y congestión leve de la bolsa de Fabricio en tres aves.
ESTUDIO SEROLOGICO:
SUEROS
-- Prueba de Inhibición de la hemaglutinación:
INFLUENZA AVIAR (13,15): Negativo (< 1:16) 100/100
AVES
- Prueba de Aglutinación en Placa:
M gallisepticum (8,13): (+) 0/10; M synoviae (9,13): (+) 0/10
-- Prueba de Inhibición de la hemaglutinación:
INFLUENZA AVIAR (13,15): Negativo (< 1:16) 18/18
ENF DE NEWCASTLE (13,17): 1:8 2/18, 1:16 4/18, 1:32 5/18, 1:64 2/18, 1:128 3/18, 1:256 2/18, media geométrica 1:40.30
- Prueba de ELISA para Bronquitis Infecciosa (10,13):, promedio 688; media geométrica 66, desviación estándar 700; coeficiente de variación 56.90
SUEROS
-- Prueba de Inhibición de la hemaglutinación:
INFLUENZA AVIAR (13,15): Negativo (< 1:16) 100/100
AVES
- Prueba de Aglutinación en Placa:
M gallisepticum (8,13): (+) 0/10; M synoviae (9,13): (+) 0/10
-- Prueba de Inhibición de la hemaglutinación:
INFLUENZA AVIAR (13,15): Negativo (< 1:16) 18/18
ENF DE NEWCASTLE (13,17): 1:8 2/18, 1:16 4/18, 1:32 5/18, 1:64 2/18, 1:128 3/18, 1:256 2/18, media geométrica 1:40.30
- Prueba de ELISA para Bronquitis Infecciosa (10,13):, promedio 688; media geométrica 66, desviación estándar 700; coeficiente de variación 56.90
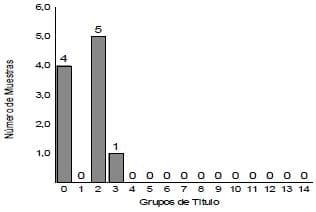
- Prueba de ELISA para Infección de la bolsa de Fabricio (10,13): promedio 0, media geométrica 1, desviación estándar 0.
- Pruebas de ELISA para Pneumovirus Aviar (11,13): (+) 0/10.
- Pruebas de ELISA para Pneumovirus Aviar (11,13): (+) 0/10.
ESTUDIO HISTOPATOLÓGICO (1,13):
- Bolsa de Fabricio: sin lesiones 13/18; depleción linfoide medular, multifocal, leve 5/18.
Grado promedio de lesión bursal 0.13 (escala de grado de lesión bursal de 0 a 7).
- Timo: sin lesiones 18/18.
- Bazo: sin lesiones 18/18.
- Hígado: sin lesiones 15/18; pericolangitis no supurativa leve 1/18; necrosis fibrinoide multifocal leve 2/18.
- Tráquea: sin lesiones 5/18: traqueítis no supurativa leve 3/18; traqueítis no supurativa moderada 6/18; traqueítis no supurativa moderada con hiperplasia de folículos linfoides en la lámina propia de la mucosa 4/18.
- Pulmón: congestión difusa severa 14/18; bronconeumonía supurativa severa 14/18.
ESTUDIO BACTERIOLÓGICO (3,13):
- Tráquea: se aisló Escherichia coli en cantidad abundante.
- Pulmón: se aisló Escherichia coli en cantidad abundante.
- Bazo: se aisló Escherichia coli en cantidad abundante.
- Hígado: se aisló Escherichia coli en cantidad abundante.
ESTUDIO VIROLÓGICO:Aislamiento viral en embrión de pollo comercial, a partir de tráquea, pulmón, bazo y tonsilas cecales:
- Virus de Enf. de Newcastle (13.14): Negativo al aislamiento viral al 1°, 2°, 3°, 4°, 5° y 6° pase.
- Virus de Influenza Aviar (13,15): Negativo al aislamiento viral al 1°, 2°, 3°, 4°, 5° y 6° pase.
- Virus de Bronquitis Infecciosa (6,13,16): Negativo al aislamiento viral al 1°, 2°, y 3° pase; Positivo al aislamiento viral al 4°, 5° y 6° pase.
INTERPRETACIÓN DE RESULTADOS:
Se emitió un diagnóstico Integral de Infección por el Virus de Bronquitis Infecciosa y Colibacilosis sistémica (13).
Sin embargo el Diagnóstico resulto no ser concluyente ya que con los estudios realizados no se pudo determinar el tipo de virus de Bronquitis Infecciosa y su posible origen.
Por tal motivo, se decidió enviar la muestra del aislamiento para su tipificación por medio de pruebas de Biología Molecular. Para dichos estudios se utilizó una mezcla del fluído alantoideo de los embriones inoculados al 4° pase, el cual fue positivo a la detección del virus de Bronquitis Infecciosa por la prueba de hemaglutinación rápida en placa desarrollada por Ruano y col. (16)
ESTUDIOS DE BIOLOGIA MOLECULAR:
Se realizaron los siguientes estudios a partir de la mezcla de fluido alantoide de embriones de 4° pase, para identificar al virus de Bronquitis Infecciosa y para descartar otras infecciones virales que pudieron mo ser detectadas con las pruebas convencionales utilizadas.
- RT-PCR en Tiempo Real para el virus de la Enfermedad de Newcastle que tiene como blanco el gene que codifica la Proteína Matriz de los virus de Newcastle mesogénicos y velogénicos (6): Resultado Negativo.
- RT-PCR en Tiempo Real para el virus de Influenza Aviar, que tiene como blanco el gene de la Proteína Matriz del virus de Influenza Aviar (6). Resultado Negativo.
- RT-PCR para Bronquitis Infecciosa S15/CK2, con un juego universal de iniciadores RT-PCR-IBV que tiene como blanco la región final 5´del gene que codifica la glucoproteína de la espícula, incluyendo su región hipervariable (6): Resultado Positivo.
- El producto de la prueba de RT-PCR para BI fue adicionalmente secuenciado para el gene S-1 (6): Resultado: Similitud del 91.5% y 91.3% con respecto a la cepa BL-56
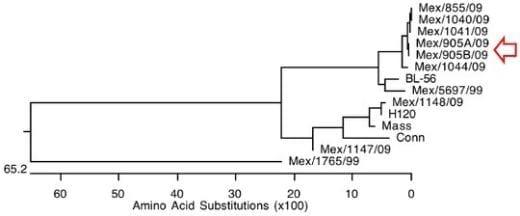
En las siguientes figuras se presentan los valores de similitud de la proteína S1 de los aislamientos del caso (identificados como Mex/905A//09 y Mex/905B/09, con las cepas de referencia, determinado por el análisis CLUSTAL-W (6),
Los dos aislamientos enviados son iguales entre sí, basados en la secuenciación parcial de la proteína S-1. El análisis de la similitud de estos aislamientos indica que con altamente similares (91.3-91.5%) al genotipo BL-56 del virus de Bronquitis Infecciosa (5).
DIAGNOSTICO INTEGRAL: Bronquitis Infecciosa, Colibacilosis.
Figura 1: Homología de dos aislamientos del virus de Bronquitis Infecciosa, por secuenciación parcial del gene de la proteína S-1 (6).
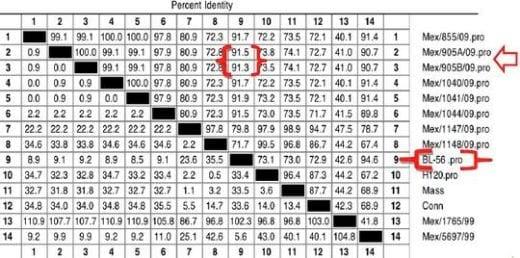
Figura 2.- Relación filogenética de dos aislamientos del virus de Bronquitis Infecciosa con el Genotipo BL-56 (6)
CONTROL Y PREVENCION DEL CASO
La Bronquitis Infecciosa (BI) es una enfermedad respiratoria aguda altamente contagiosa de los pollos. Se caracteriza por producir signos respiratorios como estertores, tos, estornudos y descarga nasal.(2,5,12) La BI es causada por un coronavirus. El virus de BI posee numerosos serotipos que están determinados por el glucopéptido S-1 de la proteína S de la superficie viral (2,5,12). En el presente estudio se aisló y caracterizo una cepa de Bronquitis Infecciosa filogenéticamente muy relacionada con el Genotipo BL-56. El Genotipo BL-56, es un genotipo aislado y descrito por primera vez en México por Lozano y col. en 1998 (12).
- Virus de Enf. de Newcastle (13.14): Negativo al aislamiento viral al 1°, 2°, 3°, 4°, 5° y 6° pase.
- Virus de Influenza Aviar (13,15): Negativo al aislamiento viral al 1°, 2°, 3°, 4°, 5° y 6° pase.
- Virus de Bronquitis Infecciosa (6,13,16): Negativo al aislamiento viral al 1°, 2°, y 3° pase; Positivo al aislamiento viral al 4°, 5° y 6° pase.
INTERPRETACIÓN DE RESULTADOS:
Se emitió un diagnóstico Integral de Infección por el Virus de Bronquitis Infecciosa y Colibacilosis sistémica (13).
Sin embargo el Diagnóstico resulto no ser concluyente ya que con los estudios realizados no se pudo determinar el tipo de virus de Bronquitis Infecciosa y su posible origen.
Por tal motivo, se decidió enviar la muestra del aislamiento para su tipificación por medio de pruebas de Biología Molecular. Para dichos estudios se utilizó una mezcla del fluído alantoideo de los embriones inoculados al 4° pase, el cual fue positivo a la detección del virus de Bronquitis Infecciosa por la prueba de hemaglutinación rápida en placa desarrollada por Ruano y col. (16)
ESTUDIOS DE BIOLOGIA MOLECULAR:
Se realizaron los siguientes estudios a partir de la mezcla de fluido alantoide de embriones de 4° pase, para identificar al virus de Bronquitis Infecciosa y para descartar otras infecciones virales que pudieron mo ser detectadas con las pruebas convencionales utilizadas.
- RT-PCR en Tiempo Real para el virus de la Enfermedad de Newcastle que tiene como blanco el gene que codifica la Proteína Matriz de los virus de Newcastle mesogénicos y velogénicos (6): Resultado Negativo.
- RT-PCR en Tiempo Real para el virus de Influenza Aviar, que tiene como blanco el gene de la Proteína Matriz del virus de Influenza Aviar (6). Resultado Negativo.
- RT-PCR para Bronquitis Infecciosa S15/CK2, con un juego universal de iniciadores RT-PCR-IBV que tiene como blanco la región final 5´del gene que codifica la glucoproteína de la espícula, incluyendo su región hipervariable (6): Resultado Positivo.
- El producto de la prueba de RT-PCR para BI fue adicionalmente secuenciado para el gene S-1 (6): Resultado: Similitud del 91.5% y 91.3% con respecto a la cepa BL-56
En las siguientes figuras se presentan los valores de similitud de la proteína S1 de los aislamientos del caso (identificados como Mex/905A//09 y Mex/905B/09, con las cepas de referencia, determinado por el análisis CLUSTAL-W (6),
Los dos aislamientos enviados son iguales entre sí, basados en la secuenciación parcial de la proteína S-1. El análisis de la similitud de estos aislamientos indica que con altamente similares (91.3-91.5%) al genotipo BL-56 del virus de Bronquitis Infecciosa (5).
DIAGNOSTICO INTEGRAL: Bronquitis Infecciosa, Colibacilosis.
Figura 1: Homología de dos aislamientos del virus de Bronquitis Infecciosa, por secuenciación parcial del gene de la proteína S-1 (6).

Figura 2.- Relación filogenética de dos aislamientos del virus de Bronquitis Infecciosa con el Genotipo BL-56 (6)

CONTROL Y PREVENCION DEL CASO
La Bronquitis Infecciosa (BI) es una enfermedad respiratoria aguda altamente contagiosa de los pollos. Se caracteriza por producir signos respiratorios como estertores, tos, estornudos y descarga nasal.(2,5,12) La BI es causada por un coronavirus. El virus de BI posee numerosos serotipos que están determinados por el glucopéptido S-1 de la proteína S de la superficie viral (2,5,12). En el presente estudio se aisló y caracterizo una cepa de Bronquitis Infecciosa filogenéticamente muy relacionada con el Genotipo BL-56. El Genotipo BL-56, es un genotipo aislado y descrito por primera vez en México por Lozano y col. en 1998 (12).
La prevención de la BI se obtiene a través de un programa de bioseguridad eficiente. Una segunda línea de defensa en los pollos es la vacunación con virus vivos modificados, sin embargo, la gran cantidad de serotipos puede ser un problema para diseñar un calendario de vacunación efectivo. Por tal motivo es necesario identificar a los serotipos prevalentes en el campo para determinar el potencial de protección cruzada que tienen las vacunas disponibles en el mercado . En norteamérica los serotipos mas comunes usados en los programas de vacunación son Massachusetts. Connecticut y Arkansas y están disponibles como vacunas vivas modificadas y como vacunas inactivadas en emulsiones oleosas (2). Con tantos serotipos identificados, elegir una cepa apropiada para un calendario de vacunación puede ser una tarea difícil, sin embargo, es posible que la respuesta inmune inducida por una cepa puede generar un grado significativo de protección contra un desafío heterólogo; la protección cruzada ha sido demostrada especialmente con vacunas vivas (2).
LITERATURA CITADA:
(1) Avian Histopathology, American Association of Avian Pathologist, University of Pennsylvania, USA, Edited by O. Fletcher, 2008.
(2) Butcher, G., Shapiro, D. and Miles, R.: Infectious Bronchitis Virus. Classical and Variant Strains, University of Florida, IFAS Extension, 2002.
(3) A Laboratory Manual for the Isolation and Identification of Avian Pathohens, Fourth Edition, Published by The American Association of Avian Pathologist, University of Pennsylvania, USA , 1998.
(3) Bermudez, A. and Stewart-Brown B.: Disease Prevention and Diagnosis, in Chapter 1, Principles of disease prevention: diagnosis and control. Diseases of Poultry, eleventh edition 2003, editor in Chief Y.M. Saif, Iowa State Press.
(5) Gelb, Y. and M. Jackwood: Chapter 32. Infectious Bronchitis, in A Laboratory Manual for the Isolation and Identification of Avian Pathohens, Fourth Edition, Published by The American Association of Avian Pathologist, University of Pennsylvania, USA, 1998.
(6) Gelb, Y, Deparment of animal and food Sciences, University f Delaware.
(7) Instituto Nacional de Estadistica y Geografia, Reportes meteorológicos 2001.
(8) Instructivo de uso, Nobilis MG antigeno, Intervet International B.V., Boxmeer - Holland.
(9) Instructivo de uso, Antígeno MS Biotecnología Veterinaria de Puebla, S.A. de C.V. .Tehuacán, Pue, México
(10) Instructivo de uso Synbiotics Corporation, Gaithersburg Maryland, USA.
(11) Instructivo de uso. Flock Check, Idexx Laboratories, Inc. One IDEXX Drive, Westbrook, Maine 04092, USA
(12) Lozano, B.D., Gay, G.M., Suárez, A., Sote, P.E, Sarfati, D. y García G. J.: Aislamiento y caracterización de un virus de Bronquitis Infecciosa designado BL-56 . Memorias del X Curso de Actualización Avimex, 1998.
(13) MANUAL DE PROCEDIMIENTOS DE LABORATORIO, Laboratorio de Control de Calidad y Patología Aviar, PAPSA, editado por MVZ J.C. Valladares, 2007,
(14) NOM-013-ZOO-1994, Campaña Nacional contra la Enfermedad de Newcastle
(15) NOM-044-Z00-1994, Campaña Nacional contra la Influenza Aviar, modificada el 30 de enero de 2006
(16) Ruano, M., J El-Actrache and P. Villegas: A rapid plate hemagglutination assay for the detection of Infectious Bronchitis Virus. Avian Diseases 44: 99-104, 2000.
(17) SIVE: SAGARPA-SENASICA-DSA-DVE, Situación zoosanitaria en los estados de la República Mexicana, junio 2009)
(18) Thayer, S. and Beard, W. Chapter 46. Serologic Procedures, in A Laboratory Manual for the Isolation and Identification of Avian Pathohens, Fourth Edition, Published by The American Association of Avian Pathologist, University of Pennsylvania, USA , 1998.
LITERATURA CITADA:
(1) Avian Histopathology, American Association of Avian Pathologist, University of Pennsylvania, USA, Edited by O. Fletcher, 2008.
(2) Butcher, G., Shapiro, D. and Miles, R.: Infectious Bronchitis Virus. Classical and Variant Strains, University of Florida, IFAS Extension, 2002.
(3) A Laboratory Manual for the Isolation and Identification of Avian Pathohens, Fourth Edition, Published by The American Association of Avian Pathologist, University of Pennsylvania, USA , 1998.
(3) Bermudez, A. and Stewart-Brown B.: Disease Prevention and Diagnosis, in Chapter 1, Principles of disease prevention: diagnosis and control. Diseases of Poultry, eleventh edition 2003, editor in Chief Y.M. Saif, Iowa State Press.
(5) Gelb, Y. and M. Jackwood: Chapter 32. Infectious Bronchitis, in A Laboratory Manual for the Isolation and Identification of Avian Pathohens, Fourth Edition, Published by The American Association of Avian Pathologist, University of Pennsylvania, USA, 1998.
(6) Gelb, Y, Deparment of animal and food Sciences, University f Delaware.
(7) Instituto Nacional de Estadistica y Geografia, Reportes meteorológicos 2001.
(8) Instructivo de uso, Nobilis MG antigeno, Intervet International B.V., Boxmeer - Holland.
(9) Instructivo de uso, Antígeno MS Biotecnología Veterinaria de Puebla, S.A. de C.V. .Tehuacán, Pue, México
(10) Instructivo de uso Synbiotics Corporation, Gaithersburg Maryland, USA.
(11) Instructivo de uso. Flock Check, Idexx Laboratories, Inc. One IDEXX Drive, Westbrook, Maine 04092, USA
(12) Lozano, B.D., Gay, G.M., Suárez, A., Sote, P.E, Sarfati, D. y García G. J.: Aislamiento y caracterización de un virus de Bronquitis Infecciosa designado BL-56 . Memorias del X Curso de Actualización Avimex, 1998.
(13) MANUAL DE PROCEDIMIENTOS DE LABORATORIO, Laboratorio de Control de Calidad y Patología Aviar, PAPSA, editado por MVZ J.C. Valladares, 2007,
(14) NOM-013-ZOO-1994, Campaña Nacional contra la Enfermedad de Newcastle
(15) NOM-044-Z00-1994, Campaña Nacional contra la Influenza Aviar, modificada el 30 de enero de 2006
(16) Ruano, M., J El-Actrache and P. Villegas: A rapid plate hemagglutination assay for the detection of Infectious Bronchitis Virus. Avian Diseases 44: 99-104, 2000.
(17) SIVE: SAGARPA-SENASICA-DSA-DVE, Situación zoosanitaria en los estados de la República Mexicana, junio 2009)
(18) Thayer, S. and Beard, W. Chapter 46. Serologic Procedures, in A Laboratory Manual for the Isolation and Identification of Avian Pathohens, Fourth Edition, Published by The American Association of Avian Pathologist, University of Pennsylvania, USA , 1998.
Presentado en el Curso de Integración del Diagnóstico en la Industria Avícola y Curso de Patología comparada de aves comerciales y especies no convencionales de la Asociación Nacional de Ciencias Avícolas de México A.C. (ANECA), 02-12-2009.
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación5 de mayo de 2010
Estimado Dr.
Saludos desde Venezuela
Excelente trabajo, sobre todo por que se resalta la importancia de apoyarse en las herramientas que nos proporciona el laboratorio de diagnostico para llegar a un diagnostico acertado y dejar a un lado las conjuturas sobre las posibles causas y sobre la base de los resultados poder dar las recomendaciones mas apropiadas para el control del problema.
AGRONEGOCIOS DE MONTERREY
5 de mayo de 2010
ESTIMADO JUAN CARLOS EXCELENTE PRESENTACION, FELICIDADES.
COMO MENCIONAS EN TU PROGRAMA PREVENTIVO DEL CASO LA BIOSEGURIDAD ES UN PUNTO IMPORTANTISIMO EN EL CONTROL DE ESTE TIPO DE CONDICIONES Y QUE AL FINAL DE LA ENGORDA NO PODEMOS SACAR TODOS LOS POLLOS DE UN SOLO EMBARQUE PORQUE TENEMOS VARIAS EDADES Y ESTE PUNTO ES OTRO FACTOR QUE MUCHAS VECES NOS AGRAVAN LOS PROBLEMAS DE CAMPO YA QUE LA POLUCION DE MICROORGANISMOS ES SUMAMENTE ALTA EN EL AMBIENTE DE LA GRANJA Y LA ROTACION DE PROBLEMAS ES MUY GRAVE ADEMAS DE LAS REACCIONES EN CADENA QUE SE NOS PRESENTAN POR CONSECUENCIA DE ESTAS EDADES MULTIPLES EN LA PARVADA Y EN OTRAS OCASIONES POR FALLAS EN LA APLICACION DE LAS VACUNAS, ADEMAS SE DEBE DE TENER UNA COORDINACION EFICIENTE EN LA SALIDA DE LOS POLLOS Y LA DESINFECCION Y DESCANSO DE LAS CASETAS PARA RECIBIR NUESTRA SIGUIENTE PARVADA QUE POR LO GENERAL NOS DAN POCO TIEMPO.
DE NUEVO FELICIDADES POR TU PRESENTACION
SALUDOS AMIGOS FORISTAS
3 de mayo de 2010
interesante investigacion del doctor juan carlos . Casos similares se estan presentando en la region donde tengo mi granja Valledupar , Cesar Colombia , con mortalidades altas en la tercera semana de vida, con la misma sintomatologia, claro que en esta region se manejan temperaturas mucho mas altas y no contamos con laboratorios que nos indiquen un diagnostico acertado y sus respectivos controles. Valioso aporte porque nos aclara el porque del comportamiento de la parvada en esta edad. Felicitaciones y de nuevo gracias por importante aporte.









.jpg&w=3840&q=75)