Perfil residual de fosfomicina tras su administracion oral a pollos parrilleros
Publicado: 29 de agosto de 2011
Por: N Mestorino, M Daniele, A Moncada Cárdenas, M Dadé, Jorge O. Errecalde Cátedra de Farmacología. Facultad de Ciencias Veterinarias. Universidad Nacional de La Plata, Buenos Aires, Argentina. INCAM S.A.
Resumen
Para garantizar la entrega de alimentos inocuos a los consumidores, deben establecerse para cada nueva formulación los tiempos de espera adecuados según los LMRs establecidos por los organismos reguladores. Se realizó este estudio en pollos parrilleros tratados PO en el agua de bebida con una formulación a base de fosfomicina a razón de 10 mg/kg durante 5 días. Treinta pollos fueron tratados y sacrificados a diferentes tiempos hasta 8 días post-tratamiento; se obtuvieron muestras de músculo, piel/grasa, hígado y riñón. La presencia de fosfomicina en los tejidos obtenidos fue cuantificada por método microbiológico con Micrococcus luteus ATCC 9341 como microorganismo control.
Palabras Clave: Fosfomicina, Pollos, Tejidos, Residuos.
Introducción
La seguridad del consumidor se basa en una serie de medidas que incluyen límites máximos de residuos e ingestas diarias aceptables como las más importantes. Los consumos diarios aceptables se determinan en animales de laboratorio y se extrapolan a humanos por medio de la aplicación de factores de seguridad. De esa manera y sabiendo qué cantidad de un determinado alimento consume diariamente un humano, se determina cual es la cantidad máxima de un determinado químico que puede estar presente en el alimento en condiciones de total seguridad. Fosfomicina (ácido L-cis-1,2-epoxipropil-fosfónico) es un antibiótico bactericida con un amplio espectro de actividad que actúa inhibiendo la síntesis de la pared celular bacteriana. Se ha comprobado su efectividad in vitro frente a bacterias Gram-positivas y Gram-negativas (Kahan et al., 1974). Es utilizada en pollos para el tratamiento de infecciones producidas por Escherichia coli y Salmonella spp. (Fernández et al., 1998; 2001; 2002; Prescott, 2000). Los estudios farmacocinéticos en pollos parrilleros han demostrado que la sal sódica de fosfomicina es un producto muy soluble en agua, con escasa unión a proteínas y de bajo peso molecular, lo que dificulta su difusión en el interior de tejidos como el músculo o la grasa, alcanzando una alta concentración en el riñón. Aramayona et al. (1997) demostraron que los niveles de fosfomicina en tejidos de pollo a las 24 horas de finalizar el tratamiento eran inferiores al límite de detección. No se ha establecido, aún, en la Comunidad Europea un Límite Máximo de Residuos para fosfomicina en tejidos comestibles, sin embargo The Japan Food Chemical Research Foundation ha fijado un límite máximo de residuos (LMR) para tejidos bovinos de 0.5 ppm. Si bien existen en la industria farmacéutica veterinaria varias formulaciones a base de fosfomicina, son escasos los estudios farmacocinéticos y de perfiles residuales en animales destinados al consumo del hombre. De manera tal que el objetivo del presente estudio fue establecer un período de restricción para que tejidos provenientes de pollos tratados con una formulación a base de fosfomicina elaborada por Cevasa S.A., de acuerdo a las instrucciones del fabricante, se encuentren en los niveles de residualidad aceptables para su consumo siguiendo los lineamientos de The Japan Food Chemical Research Foundation.
Materiales & Métodos
Se utilizaron 30 animales, los que fueron mantenidos y alimentados en forma convencional con acceso a agua y alimento balanceado "ad libitum". El alimento fue controlado durante el período que duró el ensayo, a los efectos de tener la certeza de ausencia de sustancias con poder antimicrobiano.
Se administró la formulación por la vía oral en el agua de bebida, durante cinco días consecutivos, siguiendo las indicaciones del laboratorio. Los animales fueron tratados con una formulación elaborada por Cevasa a base de fosfomicina cálcica 25 % a razón de 0.6 g/L de agua.
Una vez concluido el tratamiento se procedió al sacrificio de 6 animales por grupo a los días 1, 2, 4, 6 y 8 días post-última administración del medicamento. Se obtuvieron muestras de hígado, riñón, piel-grasa y músculo. Las muestras fueron lavadas con solución fisiológica y se colocaron en bolsas de nylon perfectamente rotuladas para ser almacenadas a -20° C hasta el momento de la extracción y ensayo.
Las concentraciones de fosfomicina, en las muestras obtenidas, fueron determinadas por método microbiológico (técnica cilindro placa) utilizando Sarcina lutea ATCC 9341 como cepa control estandarizada a 50 % de transmitancia. Se utilizaron placas de 25 x 25 cargadas con 120 ml de medio de cultivo inoculado en monocapa. Se colocaron 49 cilindros de acero inoxidable en cada placa, siguiendo un diseño previamente establecido. Los estándares (100 µL) se sembraron por duplicado y cada muestra problema (100 µL) fue sembrada por cuadruplicado.
El tiempo de espera (withdrawal time, WT) fue calculado aplicando el programa estadístico WT1.4 de la EMEA.
Se administró la formulación por la vía oral en el agua de bebida, durante cinco días consecutivos, siguiendo las indicaciones del laboratorio. Los animales fueron tratados con una formulación elaborada por Cevasa a base de fosfomicina cálcica 25 % a razón de 0.6 g/L de agua.
Una vez concluido el tratamiento se procedió al sacrificio de 6 animales por grupo a los días 1, 2, 4, 6 y 8 días post-última administración del medicamento. Se obtuvieron muestras de hígado, riñón, piel-grasa y músculo. Las muestras fueron lavadas con solución fisiológica y se colocaron en bolsas de nylon perfectamente rotuladas para ser almacenadas a -20° C hasta el momento de la extracción y ensayo.
Las concentraciones de fosfomicina, en las muestras obtenidas, fueron determinadas por método microbiológico (técnica cilindro placa) utilizando Sarcina lutea ATCC 9341 como cepa control estandarizada a 50 % de transmitancia. Se utilizaron placas de 25 x 25 cargadas con 120 ml de medio de cultivo inoculado en monocapa. Se colocaron 49 cilindros de acero inoxidable en cada placa, siguiendo un diseño previamente establecido. Los estándares (100 µL) se sembraron por duplicado y cada muestra problema (100 µL) fue sembrada por cuadruplicado.
El tiempo de espera (withdrawal time, WT) fue calculado aplicando el programa estadístico WT1.4 de la EMEA.
Resultados & Discusión
El método microbiológico fue lineal en concentraciones entre 0.125 y 1 µg/mL Se obtuvo un límite de cuantificación de 0.125 µg/mL o µg/g en todos los tejidos ensayados, y un límite de detección de 0.0625 µg/mL o µg/g. El porcentaje de recuperación fue en músculo de 71.50 ± 5.48 % con un coeficiente de variación de 7.67 %; en piel/grasa fue de75.55 ± 7.77 % con un coeficiente de variación de 10.26 %; en hígado fue de82.69 ± 15.83 % con un coeficiente de variación de 19.32 % y en riñón fue de 74.38 ± 6.21 % con un coeficiente de variación de 8.11 %.
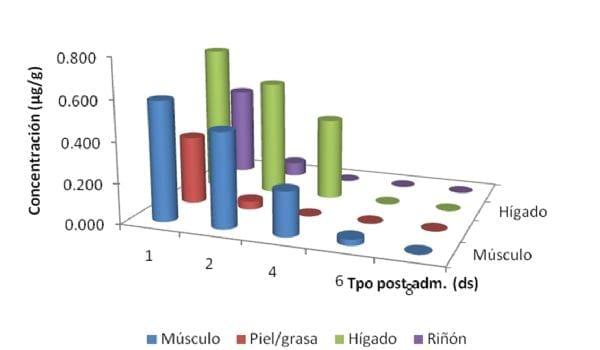
En músculo, fosfomicina fue detectada en concentraciones por encima del LMR establecido por The Japan Food Chemical Research Foundation para tejidos bovinos (0.5 ppm) en 5 de 6 muestras obtenidas 1 día post-administración. A los 2 días post-administración se cuantificó fosfomicina en 2 de los 6 animales tratados, mientras que en el resto de los tiempos, los niveles se encontraron por debajo del LOD (0.0625 µg/g).). En piel/grasa las concentraciones fueron 0.337 ± 0.15 µg/g en la primer muestra post-administración para caer por debajo del LOQ al segundo día post-administración. En hígado, fue el tejido donde se encontraron las mayores concentraciones, las cuales se mantuvieron hasta 2 días post-administración por arriba del LMR establecido, para caer por debajo del mismo a los 4 días de finalizado el tratamiento. Este hallazgo coincide en términos generales con un estudio anterior realizado por nuestro grupo de investigación, pero con fosfomicina sódica. En riñón las concentraciones fueron 0.447 ± 0.169 el primer día post-finalizado el tratamiento para caer al LOD a partir del día 2 y no poder detectarse más a partir de ese momento (Fig. 20).
En cuanto al cálculo del tiempo de espera aplicando el programa WT 1.4, solamente se pudo realizar para músculo e hígado, tejidos en los cuales se determinaron concentraciones al menos en tres puntos de muestreo (1, 2 y 4 días post finalización del tratamiento), mientras que en grasa y riñón solo se midieron niveles en dos puntos (1 y 2 días post finalizado el tratamiento). Como el programa aplica el método de regresión lineal de los datos logotransformados, como mínimo necesitamos contar con 3 puntos.
Finalmente en la Fig. 1 se presentan las concentraciones promedio determinadas en cada tejido ensayado (N = 6) y los tiempos de espera establecidos para músculo (6.62 días) e hígado (5 días).
En músculo, fosfomicina fue detectada en concentraciones por encima del LMR establecido por The Japan Food Chemical Research Foundation para tejidos bovinos (0.5 ppm) en 5 de 6 muestras obtenidas 1 día post-administración. A los 2 días post-administración se cuantificó fosfomicina en 2 de los 6 animales tratados, mientras que en el resto de los tiempos, los niveles se encontraron por debajo del LOD (0.0625 µg/g).). En piel/grasa las concentraciones fueron 0.337 ± 0.15 µg/g en la primer muestra post-administración para caer por debajo del LOQ al segundo día post-administración. En hígado, fue el tejido donde se encontraron las mayores concentraciones, las cuales se mantuvieron hasta 2 días post-administración por arriba del LMR establecido, para caer por debajo del mismo a los 4 días de finalizado el tratamiento. Este hallazgo coincide en términos generales con un estudio anterior realizado por nuestro grupo de investigación, pero con fosfomicina sódica. En riñón las concentraciones fueron 0.447 ± 0.169 el primer día post-finalizado el tratamiento para caer al LOD a partir del día 2 y no poder detectarse más a partir de ese momento (Fig. 20).
En cuanto al cálculo del tiempo de espera aplicando el programa WT 1.4, solamente se pudo realizar para músculo e hígado, tejidos en los cuales se determinaron concentraciones al menos en tres puntos de muestreo (1, 2 y 4 días post finalización del tratamiento), mientras que en grasa y riñón solo se midieron niveles en dos puntos (1 y 2 días post finalizado el tratamiento). Como el programa aplica el método de regresión lineal de los datos logotransformados, como mínimo necesitamos contar con 3 puntos.
Finalmente en la Fig. 1 se presentan las concentraciones promedio determinadas en cada tejido ensayado (N = 6) y los tiempos de espera establecidos para músculo (6.62 días) e hígado (5 días).
Fig. 1. Perfil tisular promedio de fosfomicina en tejidos comestibles de pollos tras la administración de fosfomicina cálcica 25 % a razón de 0.6 g/L de agua durante 5 días
Conclusión
Como conclusión final, se desprende del presente estudio que luego de administrar fosfomicina cálcica 25 % (Cevasa S.A.) a razón de 0.6 g/L de agua de bebida durante 5 días se deberían esperar 7 días para enviar los animales a consumo del hombre.
Bibliografía
Aramayona J, Bregante M, Solans C, Rueda S, Fraile LJ, García MA. 1997. Pharmacokinetics of fosfomycin in chickens after a single intravenous dose and tissue levels following chronic oral administration. Veterinary Research 28:51-588.
Fernández A, Payuelo R, Gómez J, Ramos J, Loste A, Marca M. 1998. Efficacy of phosphomycin in the control of Escherichia coli infection of broiler chickens. Research in Veterinary Science, 65:201-204.
Fernández A, Lara C, Loste A, Calvo S, Marca M. 2001. Control of Salmonella enteritidis phage type 4 experimental infection by fosfomycin in newly hatched chicks. Comparative Immunology. Microbiology and Infectious Diseases 24:207-216.
Fernández A, Lara C, Loste A, Marca M. 2002. Efficacy of calcium fosfomycin for the treatment of experimental infections of broiler chickens with Escherichia coli O78: k80. Veterinary Research Communications 26:427-436.
Japan Food Chemical Research Foundation. URL:http://www.m5.ws001.squarestart.ne.jp/
foundation/agrdtl.php?a_inq=71900. Acceso: 01/04/2011.
foundation/agrdtl.php?a_inq=71900. Acceso: 01/04/2011.
Kahan FM, Kahan JS, Cassidy PJ, Kropp H. 1974. The mechanism of action of fosfomycin (phosphonomycin). Ann N Y Acad. Sci. 235:364-86.
Prescott JF. 2000. Peptide antibiotics: polymixins, glycopeptides, streptogramins and bacitracin. pp. 190. In Antimicrobial Therapy in Veterinary Medicine, 3rd edn. Eds Prescott J, Baggot D, Walter R, Iowa State University Press, Ames, IA.
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación





.jpg&w=3840&q=75)