Laringotraqueítis Infecciosa, Aspectos a tener en cuenta a la hora de diseñar estrategias de prevención y control
Publicado: 28 de noviembre de 2018
Por: Dr. Ariel Vagnozzi, Instituto de Virología, CICVyA, INTA. Argentina
Introducción
La Laringotraqueítis (LT) Infecciosa de los pollos es una enfermedad viral, altamente contagiosa, de distribución mundial, la cual presenta mayor pre-valencia en regiones con producción avícola intensiva. El agente etiológico es el Gallid herpesvirus-1 (GaHV-1), comúnmente denominado Virus de laLaringotraqueítis Infecciosa (ILTV), perteneciente a la subfamilia alfa-her-pesvirinae, familia Herpesviridae (Davison et al., 2009). El ILTV es un virus envuelto, sensible a los desinfectantes y que se inactiva fácilmente por ca-lor; características que facilitan su eliminación de ambientes contaminados (García et al., 2013). Este virus tiene un estrecho rango de hospedador. Solo las aves pertenecientes a la especie Gallus gallus domesticus se infectan naturalmente, y aunque hay reportes de infecciones en otras aves pertene-cientes a la familia Phasianidae, estas infecciones no parecen ser frecuentes y por lo tanto no tendrían importancia como reservorio del ILTV (Crawshaw et al., 1982; García et al., 2013).
Este virus produce una enfermedad respiratoria aguda en aves susceptibles cuya gravedad depende de la virulencia de la cepa actuante. En los primeros reportes de la enfermedad se mencionaban epizootias con lesiones severas. Sin embargo, en años recientes se han observado formas suaves de Larin-gotraqueítis en las explotaciones intensivas (Doufour-Zavala, 2008).
El período de incubación en infecciones experimentales es de 2 a 4 días (Vagnozzi et al., 2015), aunque se suele considerar que en infecciones natu-rales este período puede ser mayor a 6 días (García, et al., 2013). La infec-ción se localiza fundamentalmente en el tracto respiratorio alto, observándo-se: conjuntivitis severa con epífora, disnea marcada, estertores traqueales, tos y expectoración mucoso-sanguinolenta, en los casos más severos. En las formas leves a moderadas puede observarse ligera conjuntivitis, sinu-sitis, tos, jadeo y descarga nasal. Para el caso particular de ponedoras el cuadro puede manifestarse también mediante un descenso en la producción de huevos (García, et al., 2013).
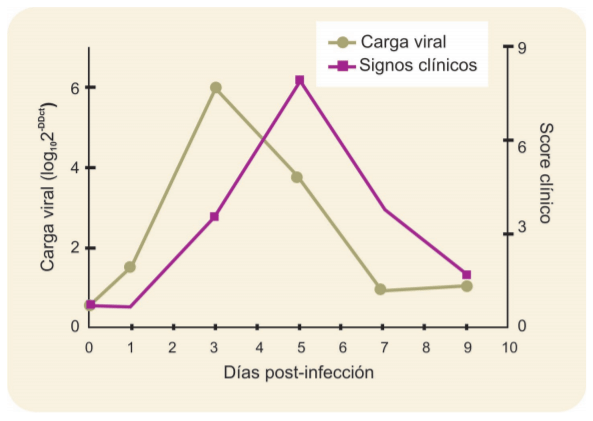
En estudios de infección experimental en pollos parrilleros, se ha reportado que la replicación viral comienza unas pocas horas luego de la infección, alcanzando el pico a los 3 días posinfección. Por su parte, los signos clínicos empiezan a ser distinguibles luego de las 72 horas, alcanzando el máximo a los 5 días posinfección (Vagnozzi et al., 2015). En otras palabras, la dise-minación viral es significativamente elevada antes de que los signos clínicos sean evidentes (Figura 1).
Figura 1: Infección experimental de ILTV. El gráfico muestra la dinámica designos clínicos (scores) y carga viral. Es evidente el aumento de carga viral (la cual es un marcador de replicación viral) previo a la aparición de signos clínicos.
Es importante tener en consideración que, aun cuando existen cepas de dife-rente grado de virulencia, hay un único serotipo de ILTV, por lo que se asume que un animal adecuadamente inmunizado no sufre reinfección. También se ha reportado que la respuesta inmune contra el ILTV es eminentemente celular y local (Fahey et al., 1984). Al respecto, se han realizado trabajos que demostraron que la respuesta inmune humoral tiene una importancia relativa en la protección contra ILTV. Aves vacunadas que previamente fueron “bur-sectomizadas” (sin capacidad para producir anticuerpos) resultaron protegi-das contra la infección con una cepa virulenta de ILTV (Fahey et al., 1983).
Dicho estudio demostró que los anticuerpos producidos por la infección (o vacunación) no son necesarios para proteger contra una nueva infección. Experimentos posteriores indicaron la importancia de la respuesta inmune celular en la protección contra el virus (Fahey et al., 1984). Por ello es que se considera que la evaluación de los niveles de anticuerpos, ya sea mediante técnicas de neutralización viral como con la técnica de ELISA, tienen un va-lor relativo, y no es útil como predictor de inmunidad contra la infección (por ej.: el ave puede no tener anticuerpos y sin embargo estar protegida).
Otro aspecto a tener en consideración es la edad de los animales suscepti-bles. Las aves jóvenes muestran una mayor resistencia a la infección (Dou-four-Zavala, 2008). Empíricamente esta característica es observada en la práctica ya que los brotes de LT muy raramente aparecen en pollos menores de 21 días de edad. Si bien se desconoce la base de esta resistencia, se sabe que no está relacionado con los niveles de anticuerpos maternos deri-vados (García et al., 2013).
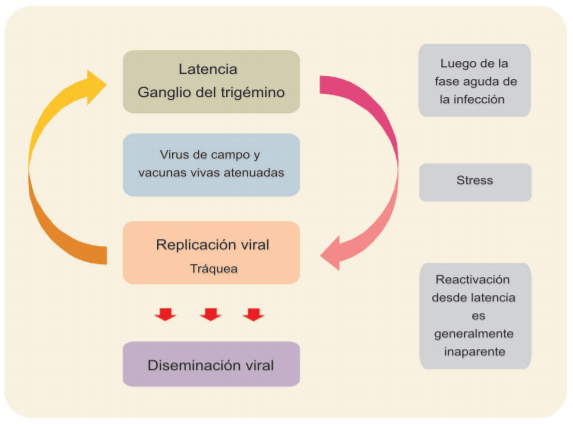
Otro aspecto de patogenia con implicancias epidemiológicas es la capacidad del virus de generar latencia. Se ha determinado que el ILTV (tanto el virus de campo como vacunas vivas atenuadas) puede persistir en los animales infectados en forma de latencia, la cual se produce luego de la fase aguda de la replicación viral (Bagust et al., 1985; Bagust, 1986; Williams et al., 1992). El establecimiento del estado de latencia es el mecanismo biológico de supervivencia que le permite al ILTV evadir la respuesta inmune del hos-pedador que conduce al clearence viral (Bagust et al., 1995). Eventualmente, se produce la reactivación de la infección desde la latencia (el estrés es un disparador de la reactivación) con la consecuente replicación y diseminación viral (Bagust et al., 1995). Este fenómeno de reactivación usualmente cursa sin manifestaciones clínicas (figura 2).
Figura 2: Esquema de replicación viral, latencia y diseminación.
Conceptos generales para el control de la enfermedad
Como punto de partida es importante considerar que el control de todo pro-blema sanitario (no solo LT) debe basarse en medidas de bioseguridad. Di-chas medidas de bioseguridad pueden ser entendidas como “toda práctica tendiente a reducir la entrada (y transmisión) de agentes infecciosos (y vec-tores) a las granjas”.
Esta es una definición muy amplia, que prescinde de detalles, pero que sirve como concepto general de guía. Para el caso particular de la LT las medidas de bioseguridad pueden organizarse en:
1. Disposición final de aves muertas;
2. Desinfección de instalaciones (ILTV es susceptible a la mayoría de los desinfectantes);
3. Tratamiento de los residuos (p.ej.: se ha documentado que el tra-tamiento térmico de la cama por 5 días, redujo la presencia de ILTV por debajo de límites de detección); y
4. Restricción de ingreso a los galpones de vehículos, personas y animales.
2. Desinfección de instalaciones (ILTV es susceptible a la mayoría de los desinfectantes);
3. Tratamiento de los residuos (p.ej.: se ha documentado que el tra-tamiento térmico de la cama por 5 días, redujo la presencia de ILTV por debajo de límites de detección); y
4. Restricción de ingreso a los galpones de vehículos, personas y animales.
Otro elemento importante en el control de LT es la vacunación, que por de-finición debería ser considerado parte de las medidas de bioseguridad. Sin embargo, por cuestiones prácticas, en este artículo se considerará a la vacu-nación como un procedimiento complementario a dichas medidas.
De un modo simple podemos plantear que el control de LT (como cualquier otra enfermedad trasmisible) se basa en una consigna: “evitar que el virus virulento contacte al hospedador susceptible”. En otras palabras; se debe evitar la trasmisión.
Siguiendo con el mismo tipo de planteo, podemos afirmar que el control de la LT consiste en la implementación de medidas de Bioseguridad y Vacunación, las cuales impactan en diferentes puntos críticos de la transmisión de la enfermedad.
Desde un punto de vista epidemiológico es posible identificar algunos facto-res críticos donde actuar:
1. La fuente de infección.
2. La vía de trasmisión.
3. El hospedador susceptible.
2. La vía de trasmisión.
3. El hospedador susceptible.
La fuente de infección es el “soporte biológico” donde el agente infeccioso replica y desde donde se disemina. Para el caso de ILTV, la fuente de infec-ción es el ave infectada, que puede estar sufriendo la fase aguda de la in-fección (ave enferma) o bien padecer reactivación desde la fase de latencia (que generalmente es inaparente).
La vía de trasmisión está constituida por todo aquel elemento que pueda servir de transporte al agente etiológico desde la fuente de infección hacia el hospedador susceptible. En el caso de ILTV, se pueden mencionar: I) aire (aerosoles); II) residuos (guano, camas y aves muertas; III) fómites y IV) per-sonal (incluyendo vehículos).
Figura 3: Puntos críticos para el control de la Laringotraqueítis. La fuentede infección y las vías de trasmisión pueden controlarse empleando medi-das de bioseguridad. La fuente de infección también puede reducirse me-diante vacunación que también debe usarse para disminuir la susceptibili-dad del plantel.
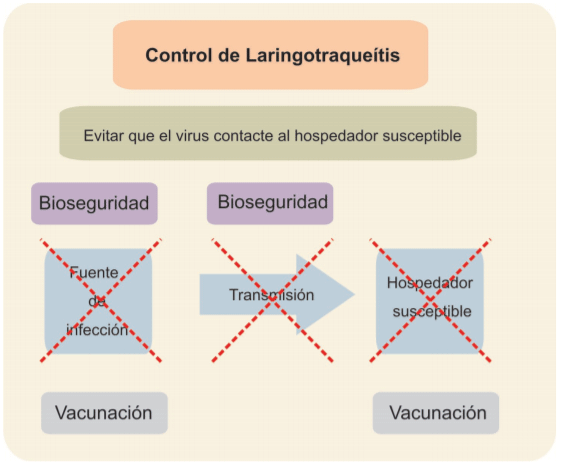
El hospedador susceptible es toda ave (Gallus gallus domesticus) que pueda sufrir la infección del ILTV.
Una vez identificados estos factores críticos es más sencillo apreciar la importancia que tienen tanto la aplicación de las medidas de bioseguridad como la vacunación en el control de la LT. Dado que:
1. La aplicación de medidas de bioseguridad e higiene impacta fuer-temente en las vías de trasmisión y también limitan la disemina-ción desde la fuente de infección.
2. La vacunación juega un rol fundamental al incrementar la resisten cia a la infección en los hospedadores susceptibles y como con secuencia de ello también se reducirán las fuentes de infección 1 (Figura 3).
2. La vacunación juega un rol fundamental al incrementar la resisten cia a la infección en los hospedadores susceptibles y como con secuencia de ello también se reducirán las fuentes de infección 1 (Figura 3).
De este modo se intenta mostrar la importancia de emplear Bioseguridad y Vacunación (juntas) en el control de la LT.
Nota: Es importante enfatizar que no todo animal infectado es un animal enfermo, ya quehay infecciones que cursan sin manifestaciones clínicas. De hecho luego de la fase aguda de la infección las aves pueden quedar infectadas con el virus en estado de latencia. Estos animales infectados, pero no enfermos representan un desafío para el control de la enferme-dad porque mantienen al ILTV en el sistema en forma insidiosa. En concreto, es importante tener en cuenta que todo animal infectado (clínicamente enfermo o no) es una potencial fuente de infección.
Vacunas y vacunación
Hasta aquí se ha enfatizado ciertos aspectos de la infección del ILTV que se deben considerar para implementar la mejor estrategia de control de la enfermedad. También se ha mencionado la importancia de la vacunación, ya que reduce la susceptibilidad (o aumenta la resistencia) de los hospeda-dores a la infección y consecuentemente previene la aparición de fuentes de infección.
Queda claro por lo tanto que las vacunas contra LT son herramientas valio-sas para el control de la enfermedad. Sin embargo debe tenerse presente que no son todas iguales, y que existen ciertas diferencias que deben ser tenidas en cuenta a la hora de elegirlas para un plan de prevención y control. Comencemos mencionando que en el mercado existen distintos tipos de vacunas contra LT que pueden integrarse en dos grupos: las vacunas vivas atenuadas y las vacunas vectorizadas, comúnmente conocidas como vacu-nas “recombinantes”.
El grupo de vacunas vivas atenuadas está integrado por la vacuna CEO (por Chicken Embryo Origin), la cual es obtenida por pasaje en serie del ILTVen embrión pollo, y por la vacuna TCO (por Tissue Culture Origin) obtenida fundamentalmente por pasaje en cultivo celular (Figura 4).
Por otro lado, las vacuna vectorizadas o “recombinantes”, están constituidas básicamente por un vector viral que ha sido modificado empleando técni-cas de ingeniería genética para que exprese ciertas proteínas del ILTV. En esta construcción genética, tanto el vector viral como las proteínas de ILTV expresadas, estimulan una respuesta inmune en el hospedador. Comercial-mente hay dos tipos de vacunas disponibles las cuales basan su función en la utilización de dos vectores virales, el Herpesvirus de Pavo (HVT) y el FowlPoxvirus (FPV). De esta forma, estas vacunas vectorizadas cumplen con undoble propósito, por un lado inducen una respuesta inmune contra LT, y por otro lado contra la enfermedad de Marek o Viruela, dependiendo si emplea como vector viral al HVT o al FPV, respectivamente (Figura 4)
Como se expresó previamente, el uso de las vacunas tiene como objetivo específico común el otorgar (o incrementar la) resistencia del plantel a la in-fección con el ILTV. También se mencionó que no todas ellas son iguales y que las diferencias de cada vacuna deberían ser contempladas a la hora de incluirla en el plan de vacunación. En líneas generales se pueden analizar los atributos particulares de cada tipo de vacuna y considerar en qué condi-ciones estos representan ventajas o desventajas (Figura 5). Por ejemplo, las vacunas vivas atenuadas replican en el mismo tejido que el virus de campo. Debido a la compartimentalización de la respuesta inmune, ello representa una ventaja, ya que la respuesta inmune local (que es de fundamental im-portancia en la infección del ILTV) es estimulada más eficientemente con este tipo de vacuna que replica en forma similar al virus de campo. Además, dentro del grupo de vacunas vivas atenuadas, estudios comparativos de pro-tección contra la infección con ILTV demostraron que la protección conferida por la vacuna CEO es significativamente mayor, más uniforme y consistente que la conferida por la vacuna TCO (Vagnozzi et al., 2010; 2012).
Figura 4: En esta figura se enumeran las vacunas comercialescontra ILTV disponibles en la República Argentina, junto con su principal característica distintiva (en el caso de las vivas ate-nuadas se indica el soporte biológico usado para la propaga-ción, y en las vectorizadas se indica el gen de ILTV que porta y la proteína que expresa el vector).

También es importante considerar la vía de administración de la vacuna, ya que ésta es de crucial importancia en la eficiencia de la protección conferida. Así, la vacuna CEO puede ser aplicada en forma masiva (p.ej. en agua de bebida), mientras que la TCO solo puede ser aplicada por gota en ojo (Fulton et al., 2000), con el consecuente incremento en el costo de la vacunación.
Además, del mismo modo que se observa con el virus de campo, los anima-les muy jóvenes son resistentes a la infección con el virus vacuna (la vacu-nación con un virus atenuado no deja de ser una infección). Por lo tanto no es útil administrar vacunas vivas atenuadas a aves menores de 12-14 días de edad, ya que la vacuna no replica eficientemente en esos animales y por lo tanto no confiere la protección buscada.
Figura 5: Ventajas y desventajas de las vacunas atenuadas y vectorizadas

Un elemento que pocas veces se considera, es la capacidad que tienen las vacunas vivas atenuadas de ILTV de revertir a la forma virulenta por pasaje en serie (Guy et al., 1991). Este fenómeno se produce cuando el virus vacu-na alcanza un grupo de animales susceptibles (no inmunizados) y comienza a replicar (pasaje en serie). Ello puede suceder cuando en el proceso de vacunación un número significativo de animales no recibe la vacuna. Tam-bién se dan las condiciones para un pasaje en serie cuando la vacuna es subdosificada (administración de una dosis menor a la recomendada por el fabricante), quedando muchos animales sin recibir el título mínimo de virus vacuna necesario para estimular el sistema inmune. Cuando la vacuna es administrada de esta forma suele ocurrir que algunos pocos animales reci-ben una dosis suficiente de vacuna, la cual replica en ellos y se trasmite a los animales que inicialmente no la recibieron, estableciéndose así un pasaje en serie con el riesgo de reversión. En este sentido, ha sido demostrado que la reversión se produce en forma más rápida (requiere menos pasajes) con la vacuna CEO que con la TCO (Guy et al., 1991).
Otra característica desventajosa de las vacunas vivas atenuadas es la posi-bilidad de que hagan latencia en los animales vacunados (del mismo modo que lo hace el virus de campo). Ello podría ser un problema en animales de larga vida como reproductores o ponedoras, ya que en algún momento esos animales podrían sufrir una reactivación de la latencia con la consecuente diseminación viral. Esta situación se vuelve más complicada en estableci-mientos que tienen animales de diferentes edades, debido a que ello implica la existencia (y potencial interacción) de grupos de aves con diferentes sus-ceptibilidades, que facilitaría la transmisión (y pasaje en serie) entre las aves más susceptibles, con el consecuente riesgo de reversión.
Por su parte las vacunas “recombinantes” son más seguras, ya que no tie-nen virulencia residual ni tienen posibilidad de reversión por pasaje en serie, de modo que su uso no implica peligro de convertirse en el origen de un brote de ILTV. Respecto a la administración de estas vacunas vectorizadas, la LT-HVT puede aplicarse en forma masiva (in ovo). La posibilidad de admi-nistrar esta vacuna en estadios tempranos (in ovo o en nacedora) hace que las aves jóvenes (menores de 12-14 días) puedan obtener cierto nivel de co-bertura por el cual estarían protegidas en forma más temprana. Sin embar-go, debe tenerse en cuenta que la protección conferida por estas vacunas no tiene la misma magnitud que las vivas atenuadas, específicamente que la CEO (Vagnozzi et al., 2012). De la evaluación de la protección inducida (bajo condiciones experimentales) por vacunas recombinantes y atenuadas se ha comprobado que las vacunas atenuadas confieren mayor protección ante el desafío que las “recombinantes”. En dicho estudio se observó una significativa diferencia en la protección conferida por la vacuna CEO, fundamentalmente en relación con la carga viral en tráquea. Los pollos vacunados con CEO, presentaron una inhibición total de la replicación viral del virus desafío (Vagnozzi et al., 2012). En ese trabajo las vacunas vivas atenuadas fueron administradas a los 14 días de edad por gota en el ojo, mientras que las vacunas vectorizadas fueron aplicadas in ovo y al día de edad (vía sub-cutánea).
También se observó que pollos broilers vacunados tanto con TCO como con LT-HVT no presentaron diferencias significativas en la evaluación clíni-ca después del desafío a los 35 días de edad. Es más, los escores clínicos resultaron bajos (es decir presentaban signos clínicos leves o sin manifesta-ciones clínicas). Sin embargo, cuando se evaluó la carga viral en tráquea, se observó que ninguna de esas vacunas (TCO y LT-HVT) inhibía totalmente la replicación del virus de desafío. En otras palabras, en estos ensayos las vacunas TCO y LT-HVT fueron eficientes para mitigar los signos clínicos de la infección, pero no lo fueron para impedir la multiplicación del virus.
Obviamente, estos han sido ensayos experimentales, con una dosis de de-safío elevada que fue inoculada vía intra-traqueal, condiciones que no nece-sariamente están presentes en infecciones a campo. De todos modos, esos resultados sugieren que en planteles inmunizados con estas vacunas cierta replicación y diseminación viral puede existir en ausencia de signos clínicos. Ello indicaría la dificultad de llevar adelante un plan de erradicación de la enfermedad empleando TCO o LT-HVT. A pesar de esto, se ha postulado que el empleo sistemático de dichas vacunas podría tener un impacto sobre la carga viral en el ambiente, llevando con el uso continuo a la desaparición del ILTV del sistema. Este es una hipótesis muy atractiva que requiere ser testeada.
El otro tipo de vacuna recombinante, es la vectorizada en FPV (LT-FPV. Di-cha vacuna no ha mostrado buenos resultados cuando fue administrada inovo o al día de vida en nacedoras (Vagnozzi et al., 2012). Sin embargo, sehan reportado buenos resultados cuando esta vacuna fue administrada en aves mayores de 4 semanas (Tong et al., 2001).
Luego de enumerar las características de cada vacuna, surge un interrogan-te; ¿cuál es la mejor vacuna de ILTV?.
Debemos decir que no hay forma de responder este interrogante de modo simple. Por ejemplo, si uno basara su respuesta en los estudios de protec-ción, la vacuna CEO es la que mejor protege contra la infección experimen-tal. Se ha reportado que esta vacuna no solo bloquea la aparición de signos clínicos, sino que también inhibe completamente la replicación del virus de-safío (Vagnozzi et al., 2012). Desde este punto de vista uno puede sentirse tentado a afirmar que por ello la CEO es la mejor vacuna, sin embargo, hay una serie de factores que indican la no conveniencia de utilizarla. La vacuna CEO retiene cierta virulencia residual, por ello algunas aves pueden mani-festar cierto distress respiratorio y conjuntivitis luego de la administración.
Además, esta vacuna puede permanecer en las aves en forma de latencia, pudiendo reactivarse posteriormente con la consecuente diseminación viral, de modo que las aves vacunadas pueden convertirse en fuente de virus para aves susceptibles. Dichas aves susceptibles permitirían el pasaje en serie del virus, que conduciría a la reversión y la aparición de nuevos brotes de LT. Esto ha sido bien documentado en varios trabajos de caracterización gené-tica, en los cuales se observó que el ILTV aislado de un porcentaje alto de brotes de LT tuvo un patrón genético idéntico o muy similar al de la vacuna CEO (Oldoni et al., 2007; 2008).
Por otro lado si se afirma que la mejor vacuna es la que ofrece mayor segu-ridad, sin virulencia residual, ni reversión, entonces se podría afirmar que las mejores vacunas son aquellas vectorizadas (recombinantes). Sin embargo, se ha observado en modelos de infección experimental, que aun cuando no se observan signos clínicos después del desafío de aves vacunadas, el virus usado para el desafío replica en forma significativa en la tráquea. En otras palabras, en ciertas condiciones la vacuna vectorizada “protege” contra las manifestaciones clínicas, pero no contra la infección. De este modo es facti-ble que se produzca la infección de un plantel vacunado, que la replicación viral sea significativa (con peligro de trasmisión) pero que no se observen manifestaciones clínicas. Esta situación puede conducir a una sensación de falsa seguridad en la cual se percibe erróneamente que luego de varios ci-clos productivos sin enfermedad el ILTV ha dejado de ser un problema. Ante esta situación se decide dejar de vacunar, pero al hacerlo se corre el riesgo de dejar al plantel susceptible sin haber eliminado al virus del sistema. Así, se dan las condiciones para que la LT aparezca inmediatamente.
Si uno quisiera enumerar las características de una vacuna ideal para LT, estas serían:
1. Equilibrio entre atenuación e inmunogenicidad.
2. Sin virulencia residual (no lesión).
3. Que estimule sistema inmune de modo tal de conferir protección en el tejido adecuado.
4. No latencia.
5. No reversión.
6. Posibilidad de administración masiva.
Por lo mencionado previamente es obvio que no existe una vacuna ideal contra LT, pero si hay una forma ideal de emplear cada vacuna que debe basarse en las características de cada una de ellas y obviamente en la co-rrecta administración.
La mejor vacuna pierde eficacia si es mal administrada. En este aspecto hay que tener presente que deben vacunarse todas las aves, en la dosis reco-mendada, por la vía de aplicación adecuada.
También hay que tener presente, aunque parezca una obviedad, que la vacu-nación tiene como objetivo estimular la respuesta inmune en una población de animales que deben estar sanos, con adecuado estado nutricional y sin infecciones concurrentes. De otro modo, la respuesta a la vacunación no será la buscada.
Consideraciones finales
Factores como poca viabilidad del ILTV en el ambiente, estrecho rango de hospedador y elevada localización de la infección han sugerido que es fac-tible la posibilidad de realizar la erradicación de la enfermedad de los sis-temas productivos mediante vacunación y bioseguridad. Sin embargo, para ello habría que contar con una vacuna que confiera un nivel de inmunidad tal que inhiba la replicación del virus de campo en las aves vacunadas. Si bien, existe una vacuna (atenuada) con esas características (CEO), otros “atributos” de la vacuna como virulencia residual, persistencia en forma de latencia y sobre todo la capacidad de revertir a una forma virulenta, conspi-ran contra la posibilidad de llevar a cabo la erradicación de ILTV empleando dicha vacuna. De hecho, estas características de la CEO han provocado su prohibición de uso en algunos países, por ejemplo la República Argentina.
De todos modos, es factible diseñar planes de control de la enfermedad que involucren tanto el uso de las vacunas disponibles como la toma de medidas de bioseguridad.
Es importante considerar a las vacunas como herramientas cuya función es operar sobre los hospedadores susceptibles para que dejen de serlo (en otras palabras, aumentando la resistencia a la infección), y consecuente-mente que no se conviertan en fuentes de infección. Sin embargo, a pesar de tener una utilidad similar, las vacunas comerciales tienen diferentes ca-racterísticas, atributos que conllevan ventajas y desventajas. Conocer di-chos atributos permitirá un uso más eficiente de las vacunas bajo diferentes condiciones.
En síntesis, el control de la Laringotraqueítis se logra cumpliendo las siguien-tes premisas:
1. Evitar el contacto de ILTV virulento con el hospedador susceptible, mediante medidas de Bioseguridad.
2. Reducir la susceptibilidad del hospedador mediante vacunación.
La vacunación y la bioseguridad deben ser entendidas como medidas com-plementarias si se pretende que la estrategia de control de LT diseñada sea exitosa.
Laringotraqueítis infecciosa : aspectos que deben ser tenidos en cuenta a la hora de diseñar estrategias de prevención y control / Ariel E. Vagnozzi. – Buenos Aires: Ediciones INTA, 2016. 18 p. : il. ISBN Nº 978-987-521-683-9
Referencias
- Bagust, T.J. Laryngotracheitis (Gallid-1) herpesvirus infection in the chic-ken. 4. Latency establishment by wild and vaccine strains of ILT virus. Avian Pathology. 15: 581-595. 1986.
- Bagust, T., y Johnson, M. Avian infectious laryngotrachaitis: virus-host interactions in relation to prospects for eradication. Avian Pathology. 24: 373-391. 1995.
- Bagust, T., Calnek, B., y Fahey, K. GAllid-1 Herpesvirus infection in the chicken. Reinvestigation of the pathogenesis of infectious laryngotrachei-tis in acute and early post-acute respiratory disease. Avian Diseases. 30: 179-190. 1985.
- Crawshaw, G. J., y Boycott, B. Infectious laryngotracheitis in peafowl and pheasants. Avian Diseases. 26: 397–401. 1982.
- Davison, A., Eberle, R., Ehlers, B., Hayward, G., McGeoch, D., Minson, A., Pellett, P, Roizman, B., Studdert, M., Thiry, E. The order Herpesvira-les. Archives of Virology. 154: 171–177. 2009.
- Dufour-Zavala, L. Epizootiology of Infectious Laryngotracheitis and pre-sentation of an industry control program. Avian Diseases. 52: 1-7. 2008.
- Fahey, K., Bagust, T., y York, J. Laryngotracheitis herpes virus infection in the chicken: the role of humoral antibody in immunity to a graded challen-ge infection. Avian Pathology. 12: 505-514. 1983.
- Fahey, K., York, J., y Bagust, T. Laryngotracheitis Herpesvirus infection in the chicken II. The adoptive transfer of resistance with immune spleen cells. Avian Pathology. 13: 265-275. 1984.
- Fulton, R., Schrader, D., y Will. Effect of route of vaccination on the pre-vention of infectious laryngotracheitis in commercial egg-lying chickens. Avian Diseases. 44: 8-16. 2000.
- García, M., Spatz, S., y Guy, S. Infectious Laryngotracheitis Virus. In Y. M. Saif, J. R. Glisson, A. M. Fadly, L. R. McDougald, L. K. Nolan, and D. E. Swayne (Eds.). Diseases of Poultry 13th edn. (pp. 161-179). Wiley-Blackwell Publishing, Hoboken, NJ. 2013.
- Guy, J., Barnes, J., y Smith, L. Increased virulence of modified-live infec-tious laryngotracheitis vaccine virus following bird-to-bird passage. AvianDiseases. 35: 348-355. 1991.
- Oldoni, I, A. Rodríguez-Avila, S. M. Riblet, y M. García. Characteriza-tion of Infectious laryngotracheitis virus (ILTV) Isolates from Commercial Poultry by Polymerase Chain Reaction and Restriction Fragment Length Polymorphism (PCR-RFLP). Avian Diseases. 52: 59-63. 2008.
- Oldoni, I., y Garcia, M. Characterization of infectious laryngotracheitis vi-rus isolates from the United States by polymerase chain reaction and restriction length polymorphism of multiple genome regions. Avian Patho-logy. 36: 167-176. 2007.
- Tong, G., Zhang, S., Wang, L., Qiu, H., Wang, Y., y Wang, M. Protection of chickens from infectious laryngotracheitis with a recombinant fowlpox virus expressing glycoprotein B of infectious laryngotracheitis virus. Avian Pathology. 30:143-8. 2001.
- Vagnozzi, A., García, M., Riblet, S., y Zavala, G. Protection induced by In-fectious laryngotracheitis virus (ILTV) vaccines alone and combined with Newcastle disease virus (NDV) and/or infectious bronchitis virus (IBV) vaccines. Avian Diseases. 54: 1210-1219. 2010.
- Vagnozzi, A., Riblet, S., Williams, S., Zavala, G., y García, M. Infection of Broilers with Two Virulent Strains of Infectious Laryngotracheitis Virus: Criteria for Evaluation of Experimental Infections. Avian Diseases. 59: 394-399. 2015.
- Vagnozzi, A., Zavala, G., Riblet, S., Mundt, A., y Garcia, M. Protection induced by commercially available live-attenuated and recombinant viral-vector vaccines against infectious laryngotracheitis virus in broiler chic-kens. Avian Pathology. 41: 21-31. 2012.
- Williams, R., Bennett, M., Bradbury, J., Gaskell, R., Jones, R., y Jordan, F. Demonstration of sites of latency of infectious laryngotracheitis virus using the polymerase chain reaction. Journal of General Virology. 73: 2415-2420. 1992.
Temas relacionados
Autores:
Referentes que Recomendaron :
Marcelo César RicciÚnete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación19 de mayo de 2021
Que opina de las vacunas vectorizadas cuál de las dos tendría mejor protección las que presentan mareck laringo o viruela laringo en lugares donde la zona es muy caliente por granjas aledañas






