Introducción
Los aditivos alimenticios que interactúan con la respuesta inmune tienen un potencial considerable de reducir la susceptibilidad de las aves a enfermedades infecciosas. En este contexto se ha estudiado la relación entre el aparato inmunocompetente (sistema inmune) y la salud de los animales frente al uso de prebióticos como los oligosacáridos mananos (mananoligosacáridos, MOS). Estos compuestos son derivados de la pared celular de las levaduras Saccharomyces cerevisiae que, cuando se adicionan al alimento de los animales, afectan benéficamente al hospedero por estimular el crecimiento selectivo y/o la actividad de un número limitado de bacterias de la microbiota intestinal (Gibson y Roberfroid, 1995). El estudio de su modo de acción y demás beneficios es de particular interés para la avicultura, toda vez que los MOS no sólo afectan la microbiota intestinal (Fairchild et al., 2001) sino que también tienen propiedades inmunomoduladoras (Savage et al., 1996; Shashidhara y Devegowda, 2003). El objetivo del presente estudio fue cuantificar las células caliciformes y los linfocitos T de la mucosa intestinal de pollos de engorde suplementados con MOS, acompañado de vacuna y desafío con Salmonella Enteritidis (SE).
Material y Métodos
Se utilizaron 45 pollos de engorde Cobb 500 de un día de edad que fueron distribuidos en 3 tratamientos con 15 repeticiones cada uno. Las aves, identificadas con anillos numerados, se pesaron semanalmente y se vacunaron a los 14 y 28 días con una bacterina comercial (vacuna muerta) contra SE.A los 42 días las aves se inocularon con 1 ml de una solución que contenía 105 unidades formadoras de colonias (UFC) de SE por vía oroesofágica. Las dietas utilizadas fueron: testigo, alimento testigo a base de maíz y torta (pasta o harina) de soya (soja); MOS++, ración testigo con un nivel mayor de MOS (2 Kg/Ton de 1 a 21 días y 1 Kg/Ton de 22 a 56 días); MOS+, ración testigo con un nivel menor de MOS (1 Kg/Ton de 1 a 21 días y 0.5 Kg/Ton de 22 a 56 días). A los 7, 37 y 56 días, cinco aves por tratamiento se sacrificaron y se realizó la necropsia para tomar muestras consistentes en fragmentos de ciego. Se realizaron análisis histológicos para la cuantificación de células caliciformes y análisis de inmunohistoquímica para la cuantificación de linfocitos T CD3. Los resultados se sometieron a análisis de varianza (ANOVA) (P<0.05) y las medias diferentes se sometieron a la prueba exacta de Fischer.
Resultados y Discusión
El Cuadro 1 presenta los valores de ganancia de peso en los períodos de 1 a 21 días, de 1 a 42 días, de 1 a 49 días y de 1 a 56 días de vida de las aves. En los períodos de 1 a 21 días y de 1 a 42 días de edad, el grupo MOS++ presentó la menor ganancia de peso en comparación con los otros grupos experimentales, pero no se observó diferencia estadística en otros períodos con respecto a la ganancia de peso.
Cuadro 1. Ganancia de peso de las aves en los diferentes períodos de crecimiento, en los grupos experimentales
Media ± desviación. a, b Letras distintas en una misma columna indican diferencia estadísticamente significativa (P<0.05).
El Cuadro 2 presenta los resultados de los análisis microbiológicos para el conteo de SE. No hubo diferencia estadística entre los grupos experimentales, en los muestreos realizados a los 2 y 7 días posdesafío con SE, pero el grupo MOS+ redujo la excreción fecal de SE a los 14 días posdesafío, en comparación con los otros grupos experimentales.
Cuadro 2. Conteo de Salmonella Enteritidis, Log 10 UFC, en hisopos de cloaca recolectados a los 2, 7 y 14 días posdesafío (PD) en los diferentes grupos experimentales
a,b Letras distintas en una misma columna indican diferencia estadísticamente significativa (P<0.05).
Cuadro 3. Conteo de células CD3+ en el íleon y los ciegos de las aves a los 7, 37 y 56 días de vida en los diferentes grupos experimentales (Inmunohistoquímica, 100X)
Media ± desviación. a, b Letras distintas en una misma columna indican diferencia estadísticamente significativa (P<0.05).
En el presente estudio, el análisis de los resultados de ganancia de peso de 1 a 21 y de 1 a 42 días, en comparación con la cuantificación de células CD3+ proporciona una relación directa entre estos dos parámetros, donde la reducción en la ganancia de peso ocurre simultáneamente al aumento en el número de células CD3+ en el grupo MOS++ (Cuadros 1 y 3). Por lo anterior, se sugiere que ocurrió interferencia del proceso de vacunación en estos resultados de ganancia de peso, pues las dosis de bacterina se aplicaron a los 14 y 28 días de vida de las aves. De acuerdo con Klassing (1998), la respuesta inmune puede aumentar la necesidad de recursos orgánicos en el animal y, por ende, afectar el rendimiento de las aves, cosa que también sugirieron Dibner et al. (1998) y Kogut y Klasing (2009).
El sistema inmune innato de las aves es capaz de reconocer estructuras características de microorganismos patógenos que no están presentes en las células de aves ni mamíferos, como son los lipopolisacáridos y los oligosacáridos mananos (Abbas, 2000). La acción protectora de los derivados de la pared celular de levaduras, ha sido descrito como una inmunomodulación inespecífica, debida a la participación de diferentes vías incluyendo la activación de macrófagos, el estímulo de células T, el estímulo del sistema reticuloendotelial, activación de células "asesinas naturales" (NK), activación de vías complementarias clásicas y alternativas (Zekovic et al., 2005) y aumento en la producción de anticuerpos (Shashidhara y Devegowda, 2003).
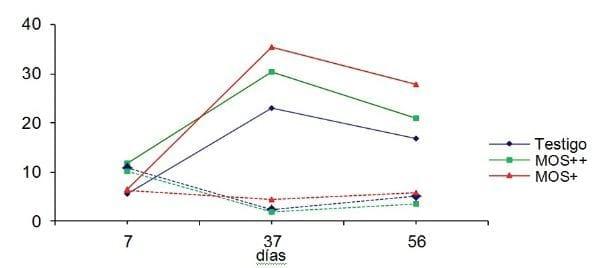
La Figura 1 presenta los valores del conteo de células CD3+ y de la cuantificación de células caliciformes por vellosidad en el ciego de las aves. En ésta podemos observar una relación inversa entre el número de células caliciformes y células CD3+ en la mucosa intestinal, donde después de la aplicación de las dosis de bacterina se produjo un aumento del número de células CD3+ y una reducción del número de células caliciformes. Después de 14 días posdesafío con SE (56 días), la mucosa intestinal presentó un aumento en el número de células caliciformes y reducción de células CD3+, en comparación con los valores observados a los 37 días.
Figura 1. Cuantificación de células CD3+ y células caliciformes en los ciegos de las aves después de 7, 37 y 56 días de vida, en los diferentes grupos experimentales.
En los fragmentos de ciego se observó, en los grupos testigo y MOS++, una reducción en el número de células caliciformes por vellosidad a los vellosidad a los 37 días y un aumento de este número a los 56 días, o sea 44 días posdesafío con SE. El grupo MOS+ no presenta esta tendencia, toda vez que estas aves casi siempre presentaron un mayor número de células caliciformes en comparación con los grupos testigo y MOS++.
Con base en los resultados obtenidos en la cuantificación de células CD3+ del íleon, se sugiere que una mayor cantidad de MOS en el alimento provoca un estímulo inmunológico, mientras que la menor cantidad suplementada en el alimento causa una inmunomodulación. Se observó que existe una relación inversa entre el número de células CD3+ y la expresión de células caliciformes en la mucosa intestinal, pues se presentó un aumento en las células CD3+ y reducción del número de células caliciformes después de la vacunación. En las aves del grupo suplementado con el menor nivel de oligosacáridos mananos (MOS+) esto también ocurrió, pero con poca variabilidad, que puede ser benéfica para el desempeño animal. La capa de moco producida por las células caliciformes, actúa como un medio de protección físico y biológico y también es un componente de la respuesta inmune innata, que es regulada en respuesta a inflamaciones o infecciones (Uni et al., 2003).
Los resultados obtenidos en los grupos suplementados sugiere que un mayor nivel de MOS se relaciona más claramente con los procesos fisiológicos de la mucosa intestinal de los pollos de engorde, mientras que niveles menores de MOS parecen ser más eficientes en el control de la excreción de SE.
La suplementación con MOS desencadenó un efecto dosis-respuesta en el sistema inmunológico de las aves, pues hubo un número mayor de linfocitos T en el íleon del grupo MOS++.
Conclusiones
La suplementación con oligosacáridos mananos (1 Kg/Ton de 1 a 21 días y 0.5 Kg/Ton de 22 a 56 días) en la ración de las aves fue capaz de disminuir la excreción fecal de SE, a los 14 días posdesafío, en comparación con el grupo testigo. Los resultados sugieren una relación inversa entre la presencia de células CD3+ y la expresión de células caliciformes o inmunidad innata.
Bibliografía
Abbas AK. 2000. Innate Immunity. pp. 270-290. In: Cellular and molecular immunology, Abbas AK (ed.).Saunders WB, Philadelphia.
Dibner JJ, Knight CD, Kitchel ML, Atwell CA, Downs AC, Ivey FJ. 1998. Early feeding and development of the immune system in neonatal poultry. J Appli Poult Res. 7:425-436.
Fairchild AS, Grimes JL, Jones FT, Wineland MJ, Edens FW, Sefton, AE. 2001. Effects of hen age, Bio-Mos, and Flavomycin on poultry susceptibility to oral Escherichia coli challenge. Poult Sci. 80:562-571.
Gibson GR & Roberfroid MB. 1995. Dietary modulation of the human colonic microbiota: Introducing the concept of prebiotics. J Nutr. 125:1401-1012.
Klasing KC. 1998. Nutritional modulation of resistance to infectious diseases. Poult Sci 77:1119-1125.
Kogut MH & Klasing K. 2009. An immunologist's perspective on nutrition, immunity, and infectious diseases: Introduction and overview. J Appl Poult Res 18:103-110.
Savage TF, Cotter PF, Zakrzewska EI. 1996. The effect of feeding mannanoligosaccharide on immunoglobulins, plasma IgG and bile IgA of wrolstad MW male turkeys. Poult Sci 75(Suppl. 1):143.
Shashidhara RG & Dewegowda G. 2003. Effect of dietary mannan oligosaccharide on broiler breeder production traits and immunity. Poult Sci. 82:1319-1325.
Uni Z, Smirnov A, Sklan D. 2003. Pre- and Posthatch development of goblet cells in the broiler small intestine: Effect of delayed access to feed. Poult Sci. 82:320-327.
Zekovic DB, Kwiatkowski S, Vrvic MM, Jakovljevic D, Moran CA. 2005. Natural and modified (1/3)-β -D-Glucans in health promotion and disease alleviation. Crit Rev Biotechnol 25:205-230.




.jpg&w=3840&q=75)