Evaluación de la protección conferida por un desinfectante contra la Tifosis Aviar causada por Salmonella gallinarum
Publicado: 12 de junio de 2012
Por: Yosef Huberman y Terzolo Horacio Raúl. INTA. Argentina
Introducción
La Tifosiso Tifoidea Aviar (TA) es una enfermedad específica de las aves, causada por la Salmonella enterica serovariedad Gallinarum biovariedad gallinarum. Salmonella gallinarum (SG) se encuentra sumamente adaptada al huésped (pollos, pavos y faisanes) y no causa enfermedad a otras especies animales distintas de las aves de modo que en condiciones normales no es suele ser susceptible el ser humano. Las aves productivamente exigidas, como aquellas en crecimiento, en reproducción o en postura son las más afectadas. Así puede registrarse una alta mortandad en gallinas ponedoras no inmunes, pues éstas son muy susceptibles debido al estrés que implica la intensa producción de huevos. También son más susceptibles las aves muy jóvenes o las más viejas al final de su ciclo productivo. Todas las causas de estrés agravan la enfermedad.La TA fue erradicada de Australia, América del Norte y la mayoría de los países de Europa mientras que en Asia, África, América Central y América del Sur se describen brotes dela enfermedad. Las pérdidas económicas causadas por TA pueden ser muy altas, no sólo por la pérdida de animales debido a la mortalidad, sino también por los costos veterinarios involucrados, eliminación de las aves muertas, saneamiento de las instalaciones infectadas, etc. La morbilidad y mortalidad debidas a TA dependen de distintas variables: raza, sexo, edad y estado nutricional de las aves, manejo de los lotes e infecciones concurrentes. La vacunación con bacterinas no resultan eficientes para controlar la enfermedad y aunque el uso de vacunas vivas atenuadas basadas en la cepa 9R provee cierta protección, ésta no es suficiente para prevenir la enfermedad o para eliminar a esta bacteria de un lote infectado. Para erradicar la enfermedad de una granja se deben sacrificar todas las aves del lote afectado y aplicar un estricto plan de desinfección antes de alojar nuevas aves libres dela infección. Este plan fue exitosamente instaurado en países como EE.UU., Inglaterra, Gales y otras regiones de Europa.
En los últimos años asistimos a la gradual prohibición del empleo de los antibióticos como aditivos alimentarios. La prohibición del uso de estos antibióticos en aves de corral, deja un importante vacío en el arsenal disponible para tratamientos sanitarios. Se espera que en los próximos años se dictaminen muchas más limitaciones al uso de antibióticos y quimioterápicos, prohibiciones que irán incrementando la lista de drogas de uso proscrito. Por lo tanto, se deben explorar nuevas formas preventivas de control que no sean nocivas, ni para la salud humana ni para el medio ambiente. Entre ellas pueden citarse la aplicación de estrictas medidas de bioseguridad y desinfección para la prevención dela TAy otras enfermedades infecciosas de las aves.
Materiales y Métodos

Animales Experimentales – Se usaron pollitos machos de gallinas ponedoras de color Gy (Great yield) - Brown (La Mendocina, Argentina) libres de Salmonella spp., inmediatamente después de sus nacimientos. Todos los pollitos se criaron en condiciones de alta bioseguridad en cubículos de aislamiento (“isolators”) especiales para ensayos con agentes patógenos, en una sala de desafíos experimentales (FOTO). Además, estas aves fueron periódicamente chequeadas para comprobar que permanecieron libres de Salmonella spp. hasta el momento de la inoculación. En todos los ensayos los animales recibieron alimentos y agua ad libitum.
Cubículos experimentales – Los pollitos fueron alojados en los cubículos de asilamiento o “isolators”, cada grupo en un isolator separado (FOTO). Cada cubículo estaba construido de cemento con puertas frontales de vidrio. La administración de agua se realizó mediante bebederos plásticos y los alimentos fueron administrados desde el exterior mediante un sistema adaptado de comederos. Se suministró aire forzado las 24 horas. El piso contenía rejillas metálicas elevadas para prevenir el contacto de los animales con la materia fecal, la que se eliminó mediante un drenaje específico para materiales infecciosos.

Cepa investigada – Una cepa patógena de Salmonellagallinarum INTA 91/91, previamente aislada en el laboratorio de bacteriología de la estación experimental del INTA, Balcarce, Argentina.
Preparación del inoculo infectivo – Antes del ensayo, se extrajo la cepa de SG, que había sido conservada congelada y se cultivó en placas de agar MacConkey (MC). Una colonia de este cultivo se usó para sembrar caldo Tripticasa-Soja. Después de su incubación durante 18 horas a 37°C con agitación, se realizó un recuento de bacterias viables en el cultivo aplicando el método de gotas en la superficie del agar. En un pre-ensayo se demostró que la dosis letal efectiva es de 109 unidades formadoras de colonias (UFC) por dosis.
Diseño Experimental – Primero se realizó un pre-ensayo, llevado a cabo con 6 lotes de 10 pollitos cada uno, suministrando el desinfectante en el agua de bebida durante 15 días a dosis de 0, 200, 400, 800, 1600 ó 3200 ppm. En el ensayo propiamente dicho se emplearon 390 pollitos de 21 días de edad los cuales fueron divididos en 6 grupos experimentales (A, B, C, D, E y F) de 65 pollitos cada uno. Cada grupo de 30 pollitos fueron inoculados individualmente en el buche (FOTO) con una dosis de 109 UFC de SG por ave. Otros 35 pollitos de cada lote, sin inocular, fueron ubicados y criados en cada uno de los mismos isolators, en estrecho contacto con las aves experimentalmente infectadas, para producir la infección horizontal o contagio de estas aves en cada uno de los grupos. Las aves fueron tratadas con diferentes dosis del desinfectante en el agua de bebida: el Grupo A no recibió ningún tratamiento (control); el Grupo B recibió el desinfectante a razón de 25 ppm; el Grupo C – 50 ppm; el Grupo D – 100 ppm; el Grupo E – 250 ppm; y el Grupo F – 500 ppm. El tratamiento con el desinfectante fue efectuado 24 horas antes realizar la inoculación con SG.
Para evaluar la invasión de SG y el contagio o infección horizontal de los pollitos no-inoculados, 20 pollitos de cada grupo, (10 inoculados y otros 10 no inoculados) fueron sacrificados en el 5º día PI. De cada pollito sacrificado se extrajo una muestra de hígado, para examinar la presencia de SG. De cada muestra de hígado que contenía SG, se realizó un conteo bacteriano en Caldo Tetrationato efectuando 6 diluciones logarítmicas sucesivas (desde 10-1 hasta 10-6). Después de la incubación de cada dilución (48 horas a37°C), se cultivaron 20µl del Caldo Tetrationato en placas de agar MC. Este método de conteo proporciona el logaritmo de la concentración de SG por gramo de hígado.
Los pollitos restantes fueron observados durante tres días más y luego fueron sacrificados. De cada uno de los pollitos no inoculados se extrajo una muestra de hígado para examinar la presencia de SG. Durante los 8 días de observación se registró diariamente la mortandad.

Análisis Estadístico
Los resultados fueron analizados mediante la prueba de Fisher. El valor de P<0.05 se consideró significativo.
Resultados
Todos los pollitos permanecieron libres de infección con Salmonella spp. hasta el momento del desafío por contagio o infección horizontal.
Persistencia
No se encontraron diferencias significativas entre las concentraciones de SG en los hígados examinados. El numero varió entre 104 y 106 UFC/gramo de hígado.
Contagio o infección horizontal – Diez de los 35 pollitos no inoculados de cada grupo fueron sacrificados al 5º día PI. Un hígado del Grupo F (500 ppm) y uno del Grupo A(sin tratamiento) fueron positivos a la presencia de SG. No se encontraron hígados positivos en ninguna de las aves de los otros grupos. Entre los restantes 25 pollitos no inoculados de cada grupo, los cuales se sacrificaron al 8º día PI, se encontraron 3 hígados positivos en el Grupo E (12%), 5 en el Grupo F (20%) y 3 en el Grupo A (12%). Los resultados obtenidos en el Grupo F fueron significativamente mayores en comparación con los Grupos B, C y D en los cuales no se encontró ningún hígado positivo. Los Grupos A y E podrían ser clasificados en un nivel intermedio, que no es estadísticamente diferente de los otros grupos (Figura 1).
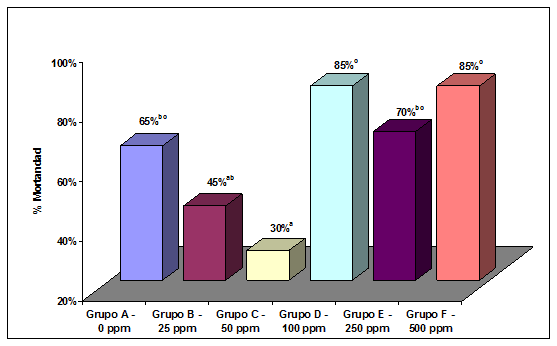
Mortandad – Después de la inoculación se registró la mortandad durante 8 días. En general, solamente murieron los pollitos que habían sido inoculados. De cada uno de esos pollitos se extrajo una muestra de hígado, siendo todas las aves inoculadas positivas a SG. La mortandad comenzó al 5º día PI. En el Grupo B se encontraron 9 pollitos muertos (45%), Grupo C – 6 (30%), Grupo D – 17 (85%), Grupo E – 14 (70%), en el Grupo F – 17 (85%) y en el Grupo A (control) – 13 (65%). Los resultados demuestran que en los Grupos A, D, E y F murieron significativamente (P<0,005) más pollitos que en el Grupo C (50 ppm). La mortandad registrada en el Grupo B (25 ppm) no fue estadísticamente diferente de la registrada en los Grupos A o E, pero fue significativamente menor que la de los Grupos D o F. (Figura 2).
Discusión
En este trabajo se realizó un ensayo para evaluar el efecto del TIMSENTM administrándolo en el agua de bebida para pollitos de 21 días de edad. La dosis recomendada para la aplicación del desinfectante es de 25 ppm y en este ensayo se trató de comprobar si esta dosis es adecuada y, además, conocer si la administración de dosis más altas pudiera haber sido mejor para proteger a los pollitos cuando, por ejemplo, un establecimiento avícola se contamina con SG.
Los resultados obtenidos en el ensayo demuestran que la aplicación del desinfectante en la concentración recomendada por el fabricante de 25 ppm reduce la mortandad y la infección natural de los pollitos, aunque esas diferencias no fueron significativas. Al aumentar la dosis a 50 ppm se incrementó notablemente la eficacia del desinfectante, siendo la mortandad un 35% inferior al grupo control no tratado, diferencias que son altamente significativas (P<0,005). No se registraron diferencias significativas en el número de SG que contenían los hígados provenientes de los pollitos inoculados. En cambio, se encontró que la aplicación del desinfectante en concentraciones de 25, 50 ó 100 ppm (Grupos B, C y D) contribuyó a detener la septicemia de los pollitos expuestos al contagio de sus congéneres inoculados.
Si bien el aumento de la dosis de 25 ppm a 50 ppm es recomendable en el caso de que se presente una infección en las granjas, no se puede aumentar esta dosis en demasía ya que concentraciones muy altas del mismo producen un efecto no deseado pues aumentan la mortandad y la infección natural de los pollitos. Este efecto deletéreo fue fehacientemente demostrado en los ensayos cuando los pollitos recibieron dosis de 250 ó 500 ppm del desinfectante en el agua de bebida. Una explicación posible de este fenómeno sería que el desinfectante afectaría a la flora normal del tracto digestivo de los pollitos. Cuando un pollito se infecta con Salmonella, por ejemplo, este patógeno debe competir con otras bacterias que habitualmente colonizan el intestino. Cuando se administran altas concentraciones del desinfectante, éste se comporta como un bactericida general, eliminando tanto a las bacterias beneficiosas como a las patógenas. Otros investigadores han demostrado que aves carentes de flora beneficiosa se tornan más susceptibles a la inoculación experimental que las aves controles. De este modo,la SG inoculada puede colonizar y penetrar con mayor facilidad y rapidez los órganos de estas aves. Asimismo, al eliminar completamente la flora normal competitiva de los pollitos expuestos a la infección, la mortandad por TA y la infección natural con SG fueron significativamente más altas en los grupos tratados con 100, 250 y 500 ppm del desinfectante (Grupos D, E y F) que en el Grupo A (control).
Conclusiones y recomendaciones
La dosis recomendada de TIMSENTM de 25 ppm es adecuada y disminuyó la mortandad en un 20% e impidió la infección de los pollitos no inoculados pero, sin embargo, estas diferencias no fueron estadísticamente significativas con respecto a las aves del grupo control no tratado. El aumento de la dosis a 50 ppm, disminuyó significativamente la mortandad en un 35% y detuvo el contagio y la infección de los pollitos expuestos pero no inoculados, en comparación con el grupo control que no había recibido el tratamiento.
De acuerdo con estos resultados, es recomendable aumentar la dosis de TIMSENTM en el agua de bebida a 50 ppm en casos de infección con SG. No obstante, es importante enfatizar que no se deben aplicar concentraciones mayores pues estas generan efectos contraproducentes que exacerban la TA.
Agradecimientos
Este trabajo fue realizado en el CERBAS del INTA, EEA Balcarce. Los autores agradecen a Alejandra Méndez, Jorgelina Lomónaco, Laura Méndez, y Rosana Malena por las tareas realizadas en el laboratorio de bacteriología, y a Abel Gulle y Cristian Gulle por los trabajos de crianza de los gallos en las unidades experimentales.
Resumen de un trabajo científico publicado en:
Huberman, Y. D. & Terzolo, H. R. Oral dose assessment of a disinfectant to prevent horizontal infection and mortality in experimental fowl typhoid. XII European Poultry Conference.Verona, Italia. Libro de resúmenes: World Poultry Science Association: 572–573. 2006.
Huberman Y. D. & Terzolo H. R. Fowl typhoid: Assessment of a disinfectant oral dose to reduce horizontal spread and mortality. Avian Diseases Digest 3 (2):e19–e19. 2008.
Huberman Y. D. & Terzolo H. R. Fowl Typhoid: Assessment of a Disinfectant Oral Dose to Reduce Horizontal Spread and Mortality. Avian Diseases 52 (2): 320–323. 2008.
Figura 1
Porcentaje de hígados infectados en los lotes de aves no inoculadas (35 aves en cada lote) que habían sido desafiadas por contagio o infección horizontal al estar en estrecho contacto durante 8 días con otras 30 aves experimentalmente infectadas.
- Las aves de cada Grupo recibieron en el agua de bebida distintas concentraciones del desinfectante (expresados como partes por millón o ppm)
- Los diferentes superíndices (a,b,c) indican valores que son significativamente diferentes (P<0.05)
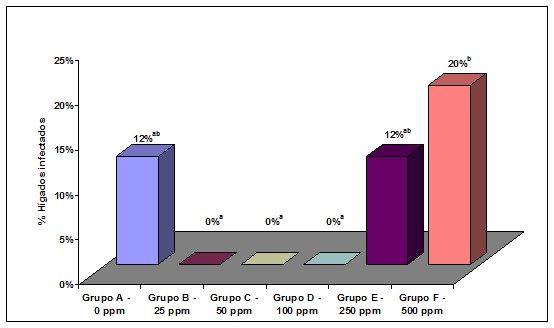
Figura 2
Porcentaje de mortandad por Salmonella gallinarum, registrado hasta el 8° día post-inoculación, en 6 lotes de 30 aves cada uno. Todas estas aves fueron individualmente inoculadas por vía oral.
- Las aves de cada Grupo recibieron en el agua de bebida distintas concentraciones del desinfectante (expresados como partes por millón o ppm)
- Los diferentes superíndices (a,b,c) indican valores que son significativamente diferentes (P<0.05)
Temas relacionados
Autores:
Instituto Nacional de Tecnología Agropecuaria - INTA
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.






.jpg&w=3840&q=75)