Evaluación de un prebiótico y ácido orgánico, en el crecimiento alométrico del sistema digestivo, morfometría de vellosidades y bacterias intestinales en pollos de engorde
Publicado: 12 de septiembre de 2016
Por: Alvaro Hugo Jaramillo Benavides Zoot. MSc.(Instructor y Docente Universitario. Centro de Biotecnología Agropecuario SENA) y Libia Elsy Guzmán. MVZ. PhD (Ex Decana Facultad de Veterinaria y Zootecnia Universidad del Tolima). Colombia
Introducción
La utilización de los antibióticos promotores de crecimiento es una práctica común en la elaboración de concentrados para aves y cerdos en los países de occidente. Sin embargo en la Unión Europea fueron prohibidos hace algunos años en cualquier alimento utilizado para animales, dado que pueden generar resistencia a otros antibióticos, presencia de éstos en el producto final (carne y huevos) y por el principio de precaución.
Por tal motivo desde hace varios años se están realizando trabajos de investigación en los que se encuentran algunos aditivos como sustituto a los Antibióticos promotores de crecimiento (APC), entre los que se encuentran los ácidos orgánicos y prebióticos, logrando obtener parámetros productivos en pollos equiparables a los APC. Se ha encontrado que los ácidos orgánicos por su efecto acidificante a nivel intestinal, mejoran el crecimiento de bacterias benéficas que contribuyen a una mejor sanidad intestinal y por ende un mejor aprovechamiento de los nutrientes del alimento, además de tener efectos antifúngicos y energía extra que puede ser aprovechada por éstos (Waldrop, 1990, López, 2010).
El término "prebiótico" incluye a una serie de compuestos indigestibles por el animal, que mejoran su estado sanitario debido a que estimulan del crecimiento y/o la actividad de determinados microorganismos beneficiosos del tracto digestivo, y que además pueden impedir la adhesión de microorganismos patógenos. Las sustancias más utilizadas son los oligosacáridos, que alcanzan el tracto posterior sin ser digeridos y allí son fermentados por las bacterias intestinales. Con una cuidada selección de los oligosacáridos, se puede favorecer el crecimiento de las bacterias beneficiosas. Por ejemplo, se ha observado que los fructo-oligosacáridos favorecen el crecimiento de Lactobacillus y Bifidobacterium en el ciego de las aves y se ha encontrado una disminución en la población de bacterias E. Coli y Coliformes (Hillman, 2001, Monsan and Paul, 1995; Xu et al.,2003).
El término "prebiótico" incluye a una serie de compuestos indigestibles por el animal, que mejoran su estado sanitario debido a que estimulan del crecimiento y/o la actividad de determinados microorganismos beneficiosos del tracto digestivo, y que además pueden impedir la adhesión de microorganismos patógenos. Las sustancias más utilizadas son los oligosacáridos, que alcanzan el tracto posterior sin ser digeridos y allí son fermentados por las bacterias intestinales. Con una cuidada selección de los oligosacáridos, se puede favorecer el crecimiento de las bacterias beneficiosas. Por ejemplo, se ha observado que los fructo-oligosacáridos favorecen el crecimiento de Lactobacillus y Bifidobacterium en el ciego de las aves y se ha encontrado una disminución en la población de bacterias E. Coli y Coliformes (Hillman, 2001, Monsan and Paul, 1995; Xu et al.,2003).
En otros estudios han utilizado la mezcla de aditivos como los prebióticos con ácidos orgánicos obteniendo un efecto sinérgico el cual contribuye a un mejor aprovechamiento de estos dos ingredientes por el animal a nivel productivo. La utilización de la energía neta por las aves está determinada en buena medida por los requerimientos para el mantenimiento y crecimiento del intestino (Cloct, 1992) y por el área superficial de este órgano. Esto último depende del grado de desarrollo de la macroestructura morfológica del intestino delgado y por su estructura morfométrica, es decir, la altura de las vellosidades y el área superficial del epitelio, en cada uno de estos segmentos (Jin, et al., 1998; Iji, 2001). La cripta puede considerarse como la fábrica de las vellosidades, y una cripta grande indica un rápido cambio de tejido y una alta demanda por un nuevo tejido (Yason CV., 1987).
Diversas investigaciones sustentan que con el uso de los prebióticos pueden producir un incremento de la altura de las vellosidades intestinales, así como de la propia longitud del intestino (Parker, 1974; Fuller, 1989; Goldin, 1998; Sanders, 1999). Yusrizal y Chen (2003) evaluaron los efectos de la inclusión de FOS en el pienso (1 g/kg) sobre las características intestinales de los pollos (42 días de edad), evidenciando que aumenta la longitud tanto del intestino delgado como del grueso y incrementan la densidad de las vellosidades en el yeyuno.
Diversas investigaciones sustentan que con el uso de los prebióticos pueden producir un incremento de la altura de las vellosidades intestinales, así como de la propia longitud del intestino (Parker, 1974; Fuller, 1989; Goldin, 1998; Sanders, 1999). Yusrizal y Chen (2003) evaluaron los efectos de la inclusión de FOS en el pienso (1 g/kg) sobre las características intestinales de los pollos (42 días de edad), evidenciando que aumenta la longitud tanto del intestino delgado como del grueso y incrementan la densidad de las vellosidades en el yeyuno.
El peso de los diferentes órganos digestivos, la longitud y el peso del intestino, hígado, páncreas, molleja y proventrículo aumentan significativamente en la primera semana de vida del pollo, teniendo cada órgano un modelo de crecimiento propio. Páncreas, duodeno y yeyuno se desarrollan en proporción, más rápidamente que el hígado y el íleon. De manera general, el desarrollo del aparato digestivo es mucho más rápido que el resto del organismo. (Nitsan, et al, 1991).
Por consiguiente en este trabajo de investigación se evalúo el efecto de la mezcla del ácido Fumárico industrial a una concentración del 0,5% de la dieta, combinado con un Fructooligosacarido Comercial a una concentración de 0,06%, en comparación con un antibiótico promotor de crecimiento como la Bacitracina de Zn a un nivel del 0,03% de la dieta, analizando el crecimiento alométrico del sistema digestivo, morfometría de vellosidades intestinales, pH intestinal y población de bacterias en el íleon en diferentes edades.
Materiales y métodos
Localización: Este trabajo de investigación se realizó en la granja del Servicio Nacional de Aprendizaje (SENA) finca San Pedro del Centro de Biotecnología Agropecuaria ubicado en el Municipio de Mosquera (Cundinamarca-Colombia), situada a 7 Km. vía Bogotá - Mosquera, temperatura media anual 12º C, Temperatura máxima media anual 20º. Altura sobre el nivel del mar 2.600 m,s.n.m. correspondiente a clima frío.
Instalaciones y equipos: Los pollos fueron alojados en 20 divisiones, dentro de un galpón comercial con piso de concreto. Para mantener la temperatura homogénea durante las primeras semanas se utilizó cuatro criadoras a gas, y cuatro termómetros de máximas y mínimas para determinar las variaciones de temperatura, utilizando plástico tipo túnel. Se utilizaron comederos de bandeja, tolva y bebederos de volteo y campana. Para realizar el pesaje de los pollos y el alimento suministrado se utilizó una balanza digital.
Manejo Sanitario: El alistamiento del galpón se realizó teniendo en cuenta todas las normas de bioseguridad. Se colocaron dos vacunas Newcastle + Bronquitis y dos contra Gumboro, una gota en el ojo y una gota oral respectivamente, de acuerdo a plan establecido en esta granja.
Material Experimental:Se utilizaron 440 pollos machos de la estirpe Hybro, de una incubadora comercial, se tomaron los pesos promedios una vez que fueron recibidos y se escogieron los valores de peso más homogéneos, teniendo en cuenta de descartar pollos con cualquier problema con el fin de buscar la máxima homogeneidad.
Dietas Experimentales:Las dietas se elaboraron en la planta de alimentos del CBA (Centro de Biotecnología Agropecuario), del SENA de Mosquera. Se formularon cinco dietas experimentales, una para iniciación del día 1 al 21 y otra para engorde del día 22 al 42, conformando los siguientes tratamientos:
Tratamiento 1: Control negativo sin la adición de los aditivos experimentales
Tratamiento 2 : Control positivo con la adición de Bacitracina de Zn (15%) como promotor de Crecimiento a un 0,03% de la ración.
Tratamiento 3: Utilización de 0,5% de ácido Fumárico en la ración.
Tratamiento 4: Utilización de 0,06% de Fructooligosacarido FOS en la ración.
Tratamiento 5: Utilización de 0,06% de FOS más 0,5% de ácido Fumárico.
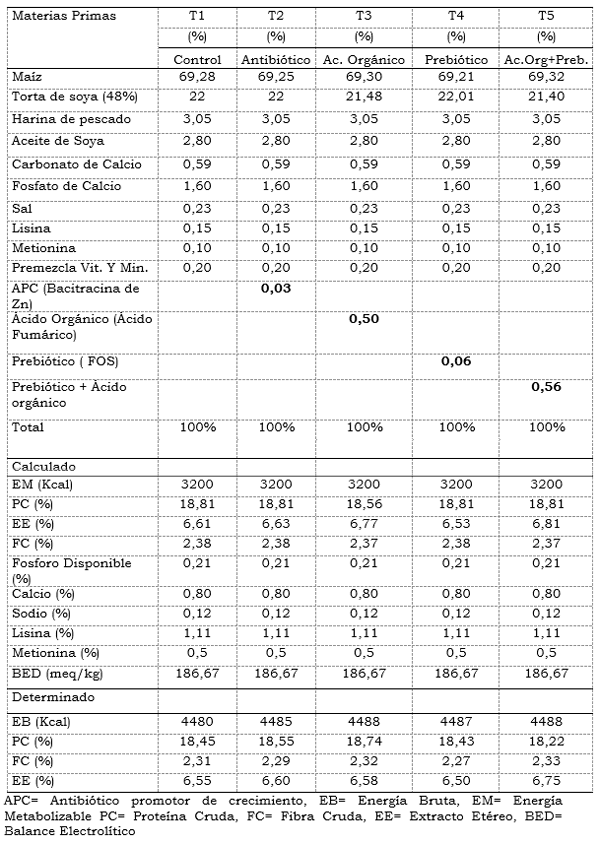
Fabricación de las Dietas: Se elaboraron cinco dietas experimentales en las que se incluía los diferentes tratamientos a base de maíz y torta de soya, una para la fase de iniciación del día 1 al 21 y otra para la fase engorde del día 21 al 42, las cuales se balancearon para que fueran isoenergéticas y isoproteícas, sin adicionar coccidiostato. (Tablas 1 y 2).
Tabla 1. Composición de las dietas experimentales. Dieta Iniciación (Día 1 a 21)
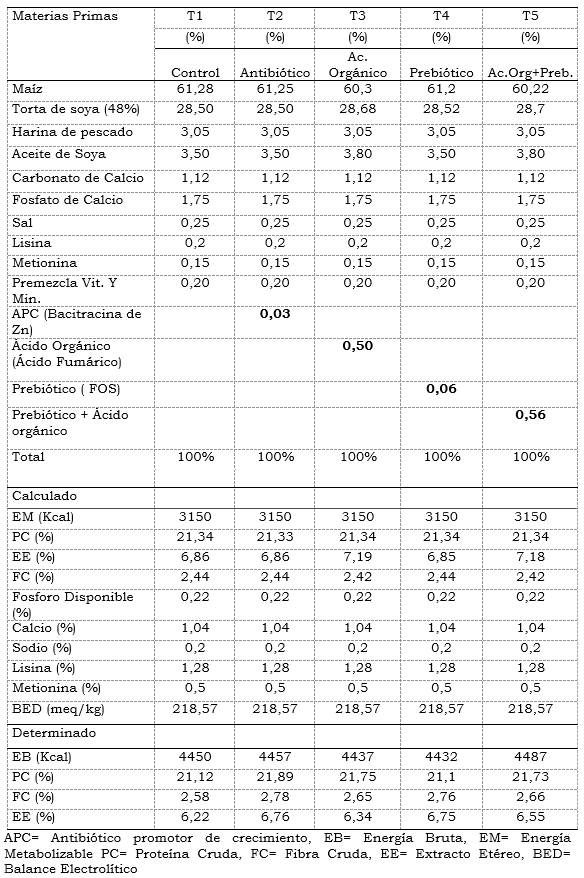
Tabla 2. Composición de las dietas Experimentales. Dieta Engorde (Día 22 a 42)
Análisis Estadístico: Se utilizó un diseño completamente al azar, aplicando un Análisis de Varianza, conformado por cinco tratamientos y cuatro repeticiones cada una conformada de 22 pollos, para un total por tratamiento de 88 pollos y 440 pollos machos para los cinco tratamientos de la línea Hybro. Los pollos fueron asignados aleatoriamente a los diferentes tratamientos una vez llegaron de la incubadora (de un día de edad) y posteriormente se pesaron el mismo día. Para determinar diferencias entre tratamientos se utilizó la prueba de Tukey. Para el análisis estadístico se utilizó el programa InfoStat.
Manejo Experimental: Las aves (machos) se pesaron al momento de la recepción y se adjudicaron aleatoriamente a los tratamientos y repeticiones, cuantificando los pesos semanalmente de forma individual de todos los pollos por réplica utilizando una balanza digital. Se realizó la respectiva necropsia de las aves muertas, analizando principalmente su sistema digestivo e identificando las posibles causas. El período experimental fue de 42 días analizando las diferentes variables durante la fase de iniciación (día 1 a 21) y engorde (día 22 a 42). En cuanto al sistema de iluminación se utilizó luz amarilla durante la noche para la primera semana y el resto de semanas se manejo con oscuridad, para 12 horas de luz por día y se utilizó cama de viruta previamente desinfectada.
Las dietas se balancearon utilizando el programa Wuffda para aves (2002) y posteriormente a cada dieta se le realizó un análisis proximal en el laboratorio de Alimentación del CBA del SENA. Las dietas se suministraron a voluntad en cada replica y tratamiento, pesando el sobrante diariamente evaluando los consumos promedios por ave. Para el balance de las raciones se utilizó los requerimientos nutricionales de la NRC (1995) para aves, y se ajusto los análisis de proteína, fibra cruda y grasa para la torta de soya, harina de pescado y maíz, teniendo en cuenta el análisis proximal determinado en el laboratorio. Este mismo análisis se realizó para las dietas experimentales ya elaboradas. El Ácido Fumárico utilizado se compró en una empresa comercial con su respectiva ficha técnica, el prebiótico (FOS) utilizado fue donado por la empresa industrias del maíz con el nombre registrado de Fortifeed®. Las concentraciones utilizadas de éste prebiótico en la dieta fueron las recomendadas por la industria productora (600 g/T. de alimento).
Análisis Alométrico y pH intestinal: Para la evaluación del crecimiento de órganos digestivos (proventrículo, molleja, duodeno, yeyuno, íleon, ciegos, colon, páncreas, hígado) y corazón, se tomaron dos pollos por repetición y tratamiento durante los días 1, 8, 15 y 22 de edad de los pollos. Los pollos fueron sacrificados por dislocación cervical. Para realizar la división de cada uno de los segmentos intestinales, se procedió de la siguiente manera: duodeno, desde el final de la molleja hasta el final del conducto pancreático y biliar; yeyuno, desde el final del duodeno hasta el divertículo de Meckel y el íleon desde el divertículo de Meckel hasta donde comienza la división de los ciegos (Palo P, et al, 1995). Se extrajo el tejido interno de la molleja y al hígado la vescícula biliar para ser pesados posteriormente teniendo en cuenta que el peso se realizó en forma humedad. Para los diferentes pesajes se utilizó una balanza analítica con cuatro decimales de gramo de precisión.
Para determinar la ontogénesis del crecimiento de los diferentes órganos y su relación con el peso corporal, se utilizó la constante de CA, según la metodología empleada por Fisher (1995), que usa la siguiente ecuación:
CA= (On / Oh) / ( PCn / PCh)
Donde: O= peso del órgano; n= días después del nacimiento; h= peso al nacimiento y PC= peso corporal.
Cuando el órgano crece en la misma proporción al peso corporal, el CA es de uno, si el crecimiento del órgano es menor al peso corporal el CA es menor a uno y cuando el CA es mayor a uno, hay un crecimiento rápido en relación con la ganancia total de peso corporal (Romero, 2004).
Para la determinación del pH intestinal se tomaron 0,2 g de muestra de contenido de duodeno, yeyuno, íleon y ciegos se suspendieron en 2,5 ml de agua destilada desionizada. Esta mezcla se agitó manualmente con agitador de vidrio lavándolo en cada registro con agua destilada, posteriormente se insertó en la mezcla un electrodo de pH y se realizaron las lecturas en un potenciómetro con precisión de tres decimales (Corrier et al., 1990). Una vez que la lectura digital del potenciómetro se detenía se registraba el dato. El pH de la suspensión fue medido dentro de los 45 minutos subsiguientes al sacrificio de las aves siguiendo las recomendaciones de Hinton, et al., (1990).
Análisis Histológicos: Para los análisis histológicos se seleccionó un segmento de 3 centímetros de la parte medía del yeyuno, dos por repetición durante los días 8, 14 y 22. La sección se cortó y se anudó en ambos lados para luego inyectar formaldehido al 10% al interior de la porción intestinal, posteriormente se sumergió de nuevo en formaldehido y se almacenó en un recipiente plástico para someter posteriormente los tejidos a la rutina histológica con la inclusión del material en parafina. Con el uso de un microtomo se realizaron 4 cortes de 7 mm de espesor marcados con hematoxilina y eosina. En estos cortes, con la ayuda de un microscopio óptico Nico tipo 124 acoplado a un sistema analizador de imágenes: Image Analysis Sistem Leco® 2001, versión 2002, se realizaron las observaciones microscópicas de cambios morfométricos en el Laboratorio de Morfofisiología de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia. Se midieron la altura y el ancho de las vellosidades y la profundidad de las criptas en los diferentes segmentos del intestino. Se registró la altura de la vellosidad al inicio del área basal coincidente con la porción superior de la cripta al ápice y el ancho de la vellosidad, se calculó el perímetro aparente de la vellosidad y la relación altura de la vellosidad/cripta. Se realizaron 6 medidas en 4 campos diferentes por tejido por ave, para un total de 720 datos/ variable histológica.
Análisis microbiológicos: Los análisis microbiológicos se realizaron haciendo un corte de 4 cm. de la porción media del íleon (dos aves por repetición), se cortaron y anudaron en sus dos extremidades, teniendo en cuenta de realizarlo con instrumentos previamente esterilizados. Posteriormente se colocaron en bolsas Nasco previamente rotuladas para ser procesadas en un tiempo máximo de una hora en el Laboratorio de Microbiología de la Universidad Nacional de Colombia. La técnica que se utilizó para determinar el recuento de Coliformes Totales, E. Coli y Aerobios Mesófilos, fue por medio de placas Petrifilm® específicas para cada tipo de bacteria. Se realizaron diferentes diluciones 1:10 a 1:1.000.000 para posteriormente inocular y distribuir 1 ml de la muestra sobre la placa Petrifilm®. Se incubo a una temperatura de 32°C durante 48 horas. Finalmente se realizaba el conteo del número de colonias resultantes. Las colonias de color rojo asociadas a gas se identificaban como coliformes y todas las colonias de color azul asociadas a gas como E. coli . Las colonias de Aerobios Mesófilos aparecen de color rojo sin estar asociadas a burbujas de gas;teniendo en cuenta que la interpretación puede variar de acuerdo a la metodología empleada. (Laboratorios 3 M, 2006).
Resultados y discusión
Análisis Alométricos:No se encontraron diferencias estadísticas en el crecimiento alométrico del páncreas, ciego, colon, proventrículo, molleja y corazón.
En el hígado se encontraron diferencias significativas (P<0,05) en el crecimiento alométrico durante los 15 y 22 días de edad de los pollos. Durante los 15 días el que obtuvo el mayor valor fue el tratamiento con prebiótico (0,9421) y al día 22 la mezcla de aditivos (0,8900) con diferencias significativas (P<0,05). Se encontró menores crecimientos alométricos para el control con 0,8504 y 0,7700 respectivamente para los 15 y 22 días de edad en comparación con los tratamientos con aditivos. En cuanto a los aditivos utilizados hubo diferencias estadísticas (P<0,05) entre el control con respecto al ácido orgánico y prebiótico, y semejantes entre la mezcla y antibiótico a los 8 días de edad. Estos resultados coinciden con Romero, (2004) donde encontró un crecimiento alométrico superior en el páncreas comparado con el hígado a los ocho días de edad en pollos en los que evaluaba un suplemento nutricional hidratado. También encontró diferencias estadísticas en el crecimiento alométrico del intestino delgado a los 14 y 21 días de edad de los pollos entre un control que obtuvo el menor crecimiento comparado con diferentes tratamientos a los que se suministraba el suplemento nutricional hidratado.
En el duodeno se presentaron diferencias significativas (P<0,05) en el crecimiento alométrico durante los ocho días y al día 22 de edad de los pollos. Durante los ocho días el mayor valor fue para el tratamiento con antibiótico (1,865) y al día 22 la mezcla de aditivos (1,107) con diferencias significativas (P<0,05). Se encontró menores crecimientos alométricos para el control y ácido orgánico con 1,638 y 1,623 respectivamente para los 8 y 22 días de edad. En el yeyuno la mezcla de aditivos y prebiótico obtuvieron un mayor crecimiento alométrico con respecto al antibiótico y control a los 8, 15 y 22 días de edad mientras que con el ácido orgánico fue a los días 8 y 22. En el Íleon el crecimiento alométrico fue estadísticamente diferente (P< 0,05) al día 8 de edad y al 22, con un menor crecimiento del tratamiento control con respecto a los que se utilizó aditivos. (Tabla 3). Estos resultados mostraron que la adición de los diferentes aditivos tuvo un efecto en el crecimiento intestinal y hepático, que puede estar correlacionado con un mayor crecimiento de la mucosa intestinal especialmente en el número y tamaño de vellosidades intestinales, lo cual se evidencio en los resultados de la altura de las vellosidades y perímetro aparente que fue inferior en los días 15 y 22 en el tratamiento control con respecto a los tratamientos con aditivos. Las diferencias en porcentaje del aumento en el crecimiento alómetrico de los aditivos comparados con el control en lo que respecta al duodeno e íleon, estuvieron muy cercanas a las de Afanador, 2008, donde comparó levaduras nativas con comerciales y un control donde determinó diferencias de 12,03%, 11,12% y 11,09% en el duodeno a los 8, 15 y 22 días de edad de pollos de engorde comparados con el 12,16% obtenido en el duodeno a los 8 días en ésta investigación.
Tabla 3. Efecto de la inclusión de un ácido orgánico y un prebiótico sobre el crecimiento alométrico promedio de órganos del sistema digestivo por tratamiento de pollos de engorde.
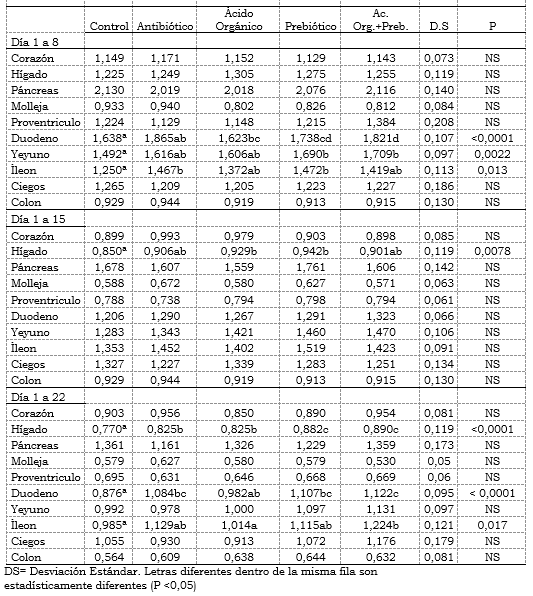
Figura 1. Efecto de la inclusión de un ácido orgánico y un prebiótico sobre la dinámica de crecimiento de la longitud de vellosidades intestinales del yeyuno por tratamiento en pollos de engorde. NS= No significativo. * Diferencias significativas (P<0,05). ** Diferencias altamente significativas P<0,01
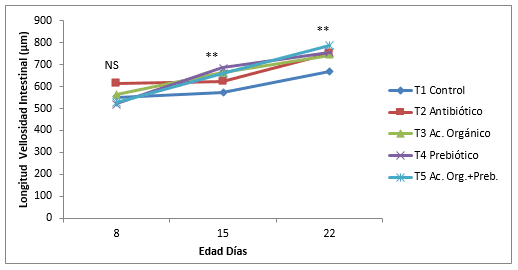
Figura 2. Efecto de la inclusión de un ácido orgánico y un prebiótico sobre la dinámica de crecimiento de la profundidad de criptas del yeyuno por tratamiento en pollos de engorde. n.s.= No significativo. * Diferencias significativas (P<0,05). ** Diferencias altamente significativas (P<0,01)
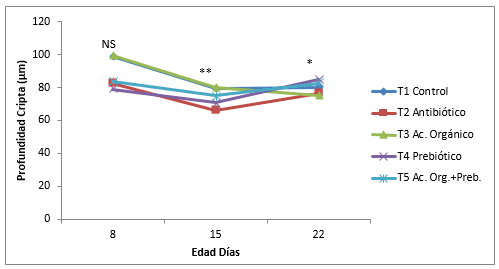
Figura. 3. Efecto de la inclusión de un ácido orgánico y un prebiótico sobre la dinámica de la relación longitud vellosidad:profundidad de la cripta del yeyuno por tratamiento. NS= No significativo. * Diferencias significativas (P<0,05). ** Diferencias altamente significativas P<0,01
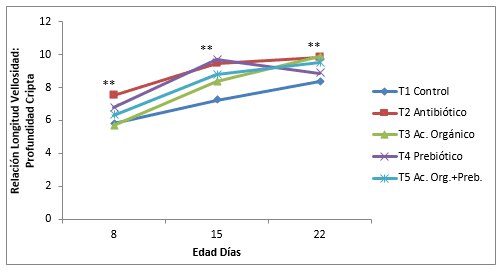
Figura. 4. Efecto de la inclusión de un ácido orgánico y un prebiótico sobre la dinámica del crecimiento del perímetro aparente de vellosidades intestinales del yeyuno en pollos de engorde. NS= No significativo. * Diferencias significativas (P<0,05). ** Diferencias altamente significativas (P<0,01)
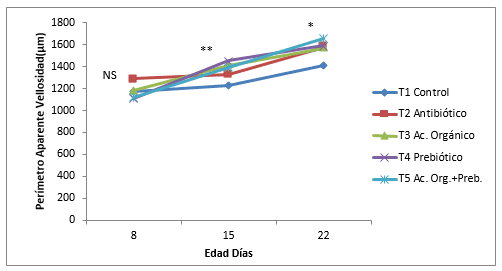
Figura 5. Fotografías de la longitud de las vellosidades intestinales del yeyuno a los 22 días de edad, con objetivo 10X, en los diferentes tratamientos. A: Control, B: Antibiótico, C: Acido orgánico, D: Prebiótico, C: Mezcla de Aditivos (Prebiótico + Acido orgánico)
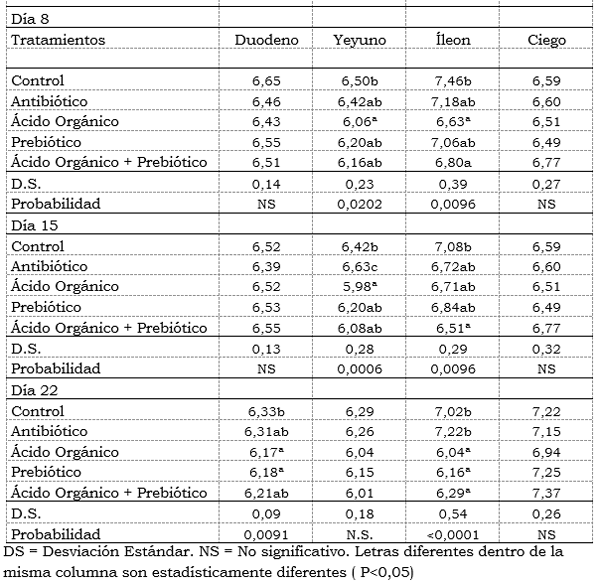
pH intestinal: Al día 8 de edad se encontró diferencias significativas (P<0,05) en el pH del yeyuno, obteniendo el pH más ácido el tratamiento con ácido orgánico con 6,06 y el más alto el control con 6,50. No se encontró diferencias estadísticas entre el antibiótico, prebiótico y la mezcla. La diferencia en porcentaje del pH más alto (control) y el más bajo (ácido orgánico) fue de 6,7%. También se encontró diferencias significativas (P<0,05) en el íleon siguiendo el mismo comportamiento del yeyuno; más bajas en el tratamiento con el ácido orgánico de 6,63 y la mezcla de aditivos con 6,80. El pH más alto fue para el control con 7,46. Se encontró diferencias estadísticas (P<0,05) en el ácido orgánico y mezcla, comparados con el control (Tabla 4). El pH más bajo encontrado en los tratamientos con ácido orgánico demuestra que el ácido Fumárico a la concentración de 0,5% afectó el pH intestinal, éstos resultados coinciden con Muzaffer, et al., (2003) donde encontró diferencias numéricas en los tratamientos en los que comparó un control, con un prebiótico, ácidos orgánicos, mezcla de probiótico y ácido orgánico, antibiótico y antibiótico más ácido orgánico, en éste estudio los tratamientos en los que se incluyó el ácido orgánico tuvieron menores valores de pH a nivel del intestino delgado.
El pH intestinal del duodeno, yeyuno e íleon fueron afectados estadísticamente durante los diferentes días evaluados, teniendo en cuenta que no se encontró diferencias en el pH del ciego. Los valores obtenidos en el pH de las diferentes partes del intestino se encuentran dentro de los valores reportados por Van Derklis y Jansman, 2002. Los valores obtenidos en el ciego se encuentran por encima de los promedios obtenidos por Ewing Cole, (1994) y Morales et al., (2009) los cuales reportan promedios de 5,7 y los encontrados en esta investigación superan los valores de 6,0 de pH en todos los tratamientos y diferentes días evaluados. López, et al., (2009), encontró diferencias estadísticas en el pH del ciego al evaluar diferentes tipos de levaduras en pollos de engorde. Rahmani and Speer, (2005), encontraron pHs más bajos y disminución en las poblaciones de E. Coli en el íleon de pollos de engorde, en el tratamiento que se adicionó antibiótico promotor de crecimiento comparado con otro al que se adicionó Ácido cítrico y un control.
Tabla 4. Efecto de la inclusión de un ácido orgánico y un prebiótico sobre el pH intestinal promedio por tratamiento
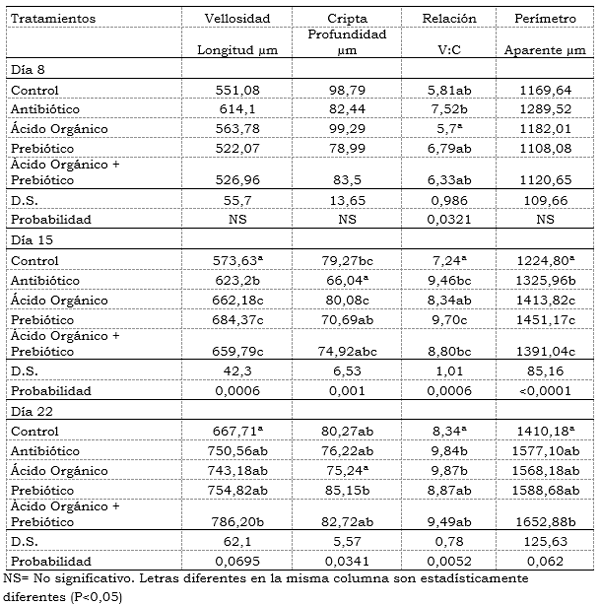
Morfometría de vellosidades intestinales del yeyuno: No se encontró diferencias estadísticas en la longitud, perímetro aparente, profundidad de la cripta y relación V:C a los 8 días de edad de las aves, pero si hubo diferencias significativas a los 15 y 22 días de edad.
Longitud vellosidades: A los 15 días de edad se encontró diferencias significativas (P<0,05) en la altura de las vellosidades, con mayor valor en el tratamiento con prebiótico con 684, 37 µm, seguido del ácido orgánico 662,18 µm y la mezcla 659,79 µm. El tratamiento control obtuvo la longitud más baja (573,63 µm) seguida del antibiótico (623,2 µm) con diferencias estadísticas (P<0,05) con los otros tratamientos. La diferencia en porcentaje del control con respecto al prebiótico fue de 16,18% y con el antibiótico de 8,93%. (Tabla 5). A los 22 días se encontró la mayor longitud de las vellosidades para la mezcla de aditivos con 786,20 µm con diferencias significativas (P<0,05) con el tratamiento control. Una vellosidad corta disminuye la superficie de absorción de nutrientes. Un alargamiento de la vellosidad indica una rápida reconversión del tejido, y una alta demanda por nuevos tejidos (Yason, et al., 1987). Por otra parte, los factores involucrados en la integralidad del intestino, tienen consecuencias importantes para la eficiencia alimenticia, debido a que la capacidad de la absorción de nutrientes de cada segmento del intestino, es proporcional al número de vellosidades presentes, así como del tamaño y área de la superficie disponible para la absorción (Pelicano, et al., 2003).
Nicoletti, et al., (2010), encontró diferencias estadísticas en la altura de las vellosidades del yeyuno a los 14, 21 y 28 días de edad de pollos, a favor de los tratamientos con MOS (Manano-oligosacarido) y MOS más un ácido orgánico comparado con un control. Gil, (2001) encontró una mayor longitud de vellosidades intestinales y menor profundidad de las criptas en pollos a los que se suministro un antibiótico promotor de crecimiento, y un producto comercial a base de ácidos orgánicos y ácido ascórbico comparado con un control negativo. Los resultados obtenidos en esta investigación corresponden a los encontrados por Pelicano, et al, (2005) donde identificó un mayor crecimiento de vellosidades intestinales a los 21 días de edad con la utilización de un prebiótico (MOS) y un ácido orgánico más MOS, comparado con un control en pollos de engorde, pero se encontró resultados contrarios en el duodeno por Dionisio, (2001) quien obtuvo un mayor crecimiento de vellosidades en el duodeno a los 21 días de edad con la adición de Fructo-oligosacaridos, lactosa, manosa y sacarosa como aditivos en pollos de engorde. Xu, et al.,(2003) observaron un incremento en la longitud de las microvellosidades del yeyuno en pollos alimentados con una ración suplementada con 4 g/kg de FOS durante 49 días atribuyéndolo, posiblemente, a la capacidad que tienen los FOS de crear en el intestino un ambiente microbiano más favorable, más que a una acción directa sobre el tejido intestinal.
En la profundidad de la Cripta se encontró diferencias significativas (P<0,05) con una mayor profundidad en el tratamiento con ácido orgánico con 80,08 µm , y la menor en el antibiótico con 66,04 µm a los 15 días de edad con diferencias significativas (P<0,05) con los demás tratamientos. Los otros tratamientos obtuvieron valores intermedios sin ser estadísticamente significativos (Tabla 5). En este sentido se ha observado un incremento de la longitud de las vellosidades en pollos alimentados con pienso suplementado con FOS (1- 4 g/kg) (Sonmez y Eren, 1999; Xu et al., 2003) y MOS (1 g/kg) (Sonmez y Eren, 1999; Iji, 2001; Baurhoo, et al.,2007). Por el contrario, Williams, et al.,(2008) indicaron que la estructura del intestino de los pollos no se modificó con la suplementación de la ración con FOS (0,6 g/kg), en coincidencia con lo hallado por Catala-Gregori et al.,(2007), mientras que Yang, et al.,(2008) encontraron una disminución en la profundidad de las criptas al suplementar 2 g/kg de MOS en la dieta de pollos de engorde.
La relación V:C fue menor en el control durante los 8, 15 y 22 días comparada con los tratamientos con aditivos. Al día 8 fue de 5,7 µm/ µm en el control con diferencias significativas (P<0,05) con el antibiótico 7,52 µm/ µm, al día 15 con 7,24 µm/ µm en el control con diferencias al prebiótico 9,70 µm/ µm y la mezcla 8,80 µm/ µm. Al día 22 de 8,34 µm/ µm del control con diferencias estadísticas (P<0,05) al antibiótico y ácido orgánico. Rebolé, et al.,(2010) observaron un incremento en el cociente longitud de la vellosidad/profundidad de la cripta en pollos alimentados con una ración suplementada con inulina (10 g/kg), en comparación con el grupo control. Por el contrario, Rehman, et al.,(2006) constataron que en los pollos que consumían inulina la longitud de las vellosidades y la profundidad de las criptas de la mucosa del yeyuno aumentaban, pero no se modificaba el cociente longitud de la vellosidad/profundidad de la cripta. Algunos autores han relacionado estos cambios en las vellosidades con variaciones en la concentración de AGCC (Ácidos Grasos de cadena corta) en el intestino. Williams, et al.(2001) señalaron que la formación de AGCC a partir de los carbohidratos fermentables es importante para el mantenimiento de la morfología e integridad funcional del epitelio del colon. Yusrizal y Chen (2003) encontraron que la densidad de las vellosidades es mayor en los pollos alimentados con FOS o inulina (10 g/kg) que en los del grupo control, hecho atribuido al posible efecto trófico de los AGCC y especialmente al ácido butírico.
El perímetro aparente fue superior en el tratamiento con prebiótico 1451,17 µm, seguido del ácido orgánico. El control obtuvo el perímetro aparente más bajo con 1224,80 µm al día 15 de edad de los pollos seguido del antibiótico (1325,96 µm) con diferencias significativas (P<0,05) con el resto de tratamientos. Al día 22 en el tratamiento control se encontró el menor valor (1410,18 µm) con diferencias significativas (P<0,05) con la mezcla de aditivos (1652,88 µm). (Tabla 5). Estos resultados coinciden con la longitud intestinal.
La dínamica del crecimiento de la longitud de la vellosidad, profundidad de la cripta, relación V:C y perímetro aparente se muestran en la Figura 1, 2, 3 y 4. La longitud y perímetro aparente tuvieron el mismo comportamiento, un crecimiento lineal sostenido del día 8 al día 22 de edad, mientras que el control y antibiótico mantuvo el crecimiento, del día 8 al 15 de edad y aumento al día 22. Se encontró diferencias estadísticas (P<0,05) al día 15 y 22 en estas dos variables. La profundidad de la cripta disminuyo en todos los tratamientos del día 8 al 15 y aumento al 22, menos en el ácido orgánico, con diferencias significativas (P<0,05). Muchos investigadores encuentran una estrecha correlación entre la profundidad de la cripta y las tasas de proliferación de células epiteliales ( Jin, et al., 1998; Brunsgaard, 1998). Además, el número de proliferaciones y el recambio celular epitelial tienen un gran impacto sobre los requerimientos de proteína y energía de la mucosa del intestino delgado (Simón, 1989). Sin embargoel tratamiento con ácido orgánico en ésta investigación tuvo una respuesta contraria. Cambios en la morfología intestinal tales como: vellosidades más cortas y criptas más profundas han sido asociados con la presencia de toxinas (Yason, et al., 1987). La relación longitud vellosidad:profundidad de la cripta tuvo un crecimiento lineal en todos los tratamientos del día 8 al 22 de edad con diferencias significativas (P<0,05), teniendo en cuenta que en el prebiótico disminuyo la relación del día 15 al 22. Williams, et al., (2008), no encontraron diferencias estadísticas en la altura de las vellosidades, profundidad cripta y relación V:C en el duodeno de pollos a las tres semanas donde se comparó un Fructo-oligosacarido, un antibiótico (Avilamicina), y un control, sin embargo se presentó diferencias estadísticas (P<0,05) en la superficie de las criptas ( mm²) y relación V:C con un mayor valor en el fructo-oligosacarido, comparado con el antibiótico y un control negativo. El crecimiento de las vellosidades del yeyuno durante los diferentes días evaluados mostró un incremento en todos los tratamientos a medida que aumenta la edad de los pollos, resultados demostrados por varios autores (Miles, et al., 2006; Nicoletti, et al., 2010).En la Figura 5 se muestra las fotografías de la longitud de las vellosidades intestinales; en el tratamiento control las vellosidades se muestran más cortas que los demás tratamientos y la mezcla de aditivos las más largas. El antibiótico, ácido orgánico y prebiótico son similares, sin embargo en el ácido orgánico se observan las vellosidades más parejas y densas.
Tabla 5. Efecto de la inclusión de un ácido orgánico y un prebiótico sobre el Análisis de la morfometría de las vellosidades intestinales del yeyuno durante diferentes edades en pollos de engorde
Análisis Microbiológico: No se encontró diferencias estadísticas durante los días 8 y 15 para la población de E. Coli, Coliformes totales y Mesófilos Aerobios. Hubo diferencias numéricas al día 8 con una menor población de E. Coli para la mezcla de aditivos con 6,57 log UFC/g y ácido orgánico con 6,66 log UFC/g; el antibiótico obtuvo un valor de 7,06 y control 6,93 para ésta población de bacterias. En el día 22 se encontró diferencias significativas (P<0,05) para los tres tipos de población de bacterias. Para las bacterias de E. Coli se encontró la población más baja para el tratamiento con prebiótico con 4,71 log UFC/g seguido del ácido orgánico con 5,03. En el prebiótico se encontró diferencias estadísticas (P<0,05) comparado con la mezcla de aditivos (5,52 log UFC/g), el antibiótico (6,00 log UFC/g) y el control (6,19 log UFC/g).
Para la población de Coliformes totales al día 22 se encontró diferencias significativas (P<0,05) siendo mayores para el tratamiento control con 6,43 log UFC/g seguido del tratamiento con antibiótico con 6,41. El ácido orgánico obtuvo la menor población de Coliformes con 5,01 log UFC/g con diferencias estadísticas (P<0,05) comparado con el control (6,44 log UFC/g), antibiótico (6,42 log UFC/g ) y prebiótico (6,14 log UFC/g ).
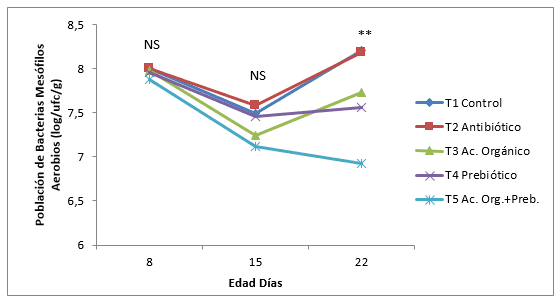
En la Figura 6, 7 y 8 se muestra la dinámica de crecimiento en la población de bacterias E. Coli, Coliformes y Aerobios mesófilos, al día 22 de edad de los pollos, en las tres poblaciones de bacterias. La población de E. Coli disminuyo linealmente en todos los tratamientos hasta el día 22, a excepción del antibiótico y control que aumento del día 15 a 22, este mismo comportamiento se obtuvo con la población total de bacterias Coliformes. Estos resultados no coinciden con Gunal y Yayli, 2006, en los que encontró la menor población de bacterias Gram negativas al adicionar antibiótico (Flavomicina), comparado con un prebiótico, ácidos orgánicos y la mezcla del probiótico con ácidos orgánicos frente a un control en pollos de engorde. Sin embargo en ésta misma investigación, los ácidos orgánicos y la mezcla de ácidos orgánicos más prebiótico obtuvieron una menor población de bacterias Gram negativas comparados al control a los 21 y 42 días de edad; este mismo autor encontró disminuciones más marcadas en la población de E. Coli y mayores Lactobacillus al adicionar 4 g/kg de Fructo-oligosacarido. Catala-Gregori et al., (2007) no encontraron diferencias en la población de bacterias, al adicionar 0,6 g/kg de FOS. El menor efecto del antibiótico en la población de E. Coli y Coliformes encontrados en ésta investigación pueden ser debidos a que la Bacitracina de Zn tiene un mejor efecto en la disminución de bacterias Gram Positivas como Estreptococos, Estafilococos y Clostridium y menos en la población de bacterias Gram negativas como el E. Coli y Coliformes. (Velandia, 2008).
En la población de Aerobios Mesófilos se encontró diferencias significativas (P<0,05) al día 22, con mayores poblaciones para el tratamiento control con 8,21 log UFC/g seguido del antibiótico con 8,18 log UFC/g y la menor la mezcla de aditivos 6,92 log UFC/g. Se encontró diferencias estadísticas (P<0,05) entre la mezcla de aditivos comparado con el control y el antibiótico.(Tabla 6). Resultados contrarios a los obtenidos por Williams, et al., (2008) donde no encontró diferencias estadísticas en la población de Aerobios Mesófilos, Lactobacillus y Coliformes en el íleon de pollos al adicionar FOS, antibiótico (Avilamicina) y control, pero si encontró diferencias en el contenido del ciego, con una menor población de Aerobios Mesófilos en el tratamiento con antibiótico comparado con el FOS y control. Comparando los resultados obtenidos por Williams, et al., (2008) , referente a la población promedio de Aerobios Mesófilos a la tercera semana en el íleon, frente a los datos promedios obtenidos para esta misma variable a la misma edad y órgano intestinal analizado en ésta investigación fueron de 7,45 log UFC/g y 7,72 log UFC/g respectivamente, los cuales son bastante aproximados teniendo en cuenta las posibles variaciones ambientales en que se pudieron realizar estas investigaciones y a las técnicas de laboratorio utilizadas.
Los menores valores de pH encontrados en el intestino delgado coinciden con la menor población de bacterias E. Coli, Coliformes totales y Aerobios Mesófilos, obtenidas a los 22 días de edad, encontrándose diferencias estadísticas (P<0,05) en la población de bacterias en el íleon. De acuerdo a éstos resultados la acidez producida por el ácido orgánico evaluado (Ácido Fumárico), parece ser tuvieron un efecto en un menor crecimiento en la población de Coliformes y E. Coli. El incremento de estas bacterias puede tener incidencia en la presencia de diarreas, disminución en el crecimiento de las vellosidades intestinales y un efecto negativo en el crecimiento de bacterias como Bifidobacterias y Lactobacillus, consideradas como bacterias benéficas para un adecuado crecimiento de los enterocitos y vellosidades los cuales tienen un efecto positivo en la absorción de nutrientes. Xialoun et al., (2004), reportaron un incremento de vellosidades intestinales en intestino delgado, al adicionar una solución de cobre como aditivo, en pollos de engorde probablemente a la menor población de E. Coli y Clostridium. Las poblaciones de Enterobacterias ( Coliformes, E.coli) tienen un mayor crecimiento a un pH alcalino que ácido y por el contrario lo hacen los Lactobacillus, los cuales responden a los resultados obtenidos en ésta investigación. Alp et al., (1999), reportó una disminución en la población de Enterobacterias en íleon de pollos al adicionar antibiótico y ácidos orgánicos y la mezcla de estos comparada con un control. A pesar de que la acidez del pH no fue tan marcada en el tratamiento con prebiótico comparado con los tratamientos en los que se adicionó el ácido orgánico, la población de E. coli fue estadísticamente menor a los 22 días comparada con el resto de tratamientos, este resultado puede indicar que la población de Lactobacillus y Bifidobacterias aumento por el efecto del Fortifeed®, el cual tuvo una incidencia en la menor población de E. coli, explicado por inhibición competitiva. La estructura química del Fortifeed® esta conformada por tres fructosas las cuales sirven de sustrato principalmente a la población de Lactobacillus y Bifidobacterias. Xu et al., 2003 incluyendo 2 g/kg de Fructo-oligosacarido en pollos de engorde encontró un incremento en la población de Lactobacillus y Bifidobacterias y una reducción en el contenido de E. Coli en el intestino delgado. Massias et al., (2006), reportó diferencias estadísticas en la población de bacterias especialmente de Lactobacillus al incorporar 0,6 g/kg de FOS, utilizando técnicas moleculares.
Tabla 6. Efecto de la inclusión de un ácido orgánico y un prebiótico sobre la evaluación de la población de bacterias a nivel de Íleon por tratamiento
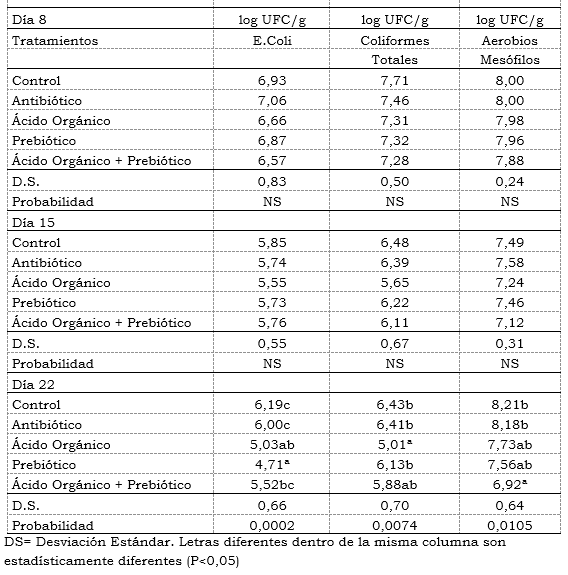
Figura 6. Efecto de la inclusión de un ácido orgánico y un prebiótico sobre la dinámica de crecimiento de la población de bacterias E. Coli en íleon en pollos de engorde. NS= No significativo. * Diferencias significativas (P<0,05). ** Diferencias altamente significativas (P<0,01)
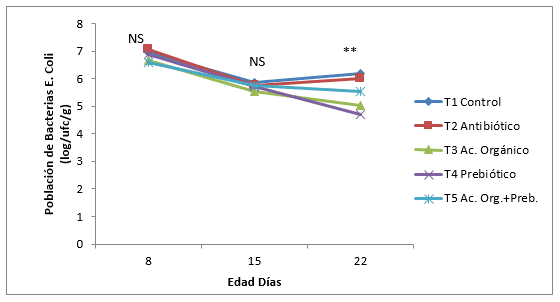
Figura 7. Efecto de la inclusión de un ácido orgánico y un prebiótico sobre la dinámica de crecimiento de la población de bacterias Coliformes en íleon en pollos de engorde. NS= No significativo. * Diferencias significativas (P<0,05). ** Diferencias altamente significativas (P<0,01)
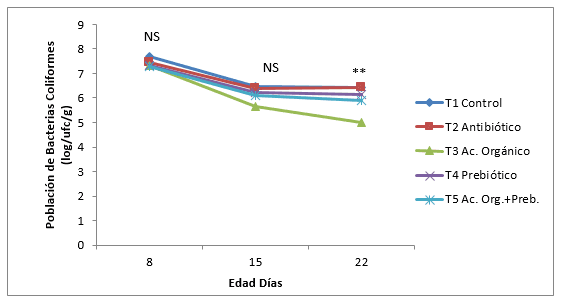
Figura 8. Efecto de la inclusión de un ácido orgánico y un prebiótico sobre la dinámica de crecimiento de la población de bacterias Mesófilos Aerobios en íleon en pollos de engorde. NS= No significativo. * Diferencias significativas (P<0,05). ** Diferencias altamente significativas (P<0,01)
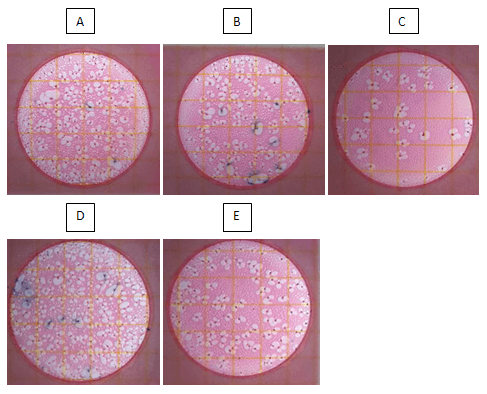
En la Figura 9 y 10 se observan las fotografías de las poblaciones de E.Coli y Coliformes en los diferentes tratamientos, las colonias se tiñen de azul asociadas a una burbuja con la utilización de placas Petrifilm para el E. Coli, y rojas para los Coliformes donde se muestra la menor población de bacterias en el tratamiento con el prebiótico y ácido orgánico.
Figura 9. Fotografías de la Población de Bacterias E. Coli utilizando placas de Petrifilm® en los diferentes tratamientos. (dilución 10?6 ).A. Control. B. Antibiótico. C. Ácido Orgánico. D. Prebiótico E. Mezcla de Aditivos (Ácido Orgánico+Prebiótico), a los 22 días de edad de los pollos.

Figura 10. Fotografías de la Población de Bacterias Coliformes utilizando placas de Petrifilm® en los diferentes tratamientos. A. Control. B. Antibiótico. C. Ácido Orgánico. D. Prebiótico E. Mezcla de Aditivos (Ácido Orgánico+Prebiótico), a los 22 días de edad de los pollos.
Conclusiones
Los resultados obtenidos en ésta investigación mostraron que la adición de aditivos como los APC (Bacitracina de Zn), el ácido orgánico (Fumárico), el prebiótico (Fortifeed®), y la mezcla de aditivos tuvieron un efecto en el mayor crecimiento de las vellosidades intestinales del yeyuno y en una disminución en la población bacterias Coliformes, E. Coli y Aerobios Mesófilos, comparada con el control. Las poblaciones de E. Coli y Coliformes disminuyeron progresivamente durante las semanas evaluadas en la mayoría de los tratamientos.
En los aditivos utilizados se determinó que la mezcla de aditivos tuvo un mayor efecto en el crecimiento y perímetro aparente de las vellosidades del yeyuno, seguido del prebiótico las cuales se correlacionan con un mayor crecimiento alométrico de éste órgano en los respectivos tratamientos. Las dinámicas de crecimiento de las vellosidades intestinales guardan una proporción correspondiente a la reportada por otros trabajos de investigación donde se utilizaron aditivos en la alimentación de pollos. En los tratamientos donde se incluyó el ácido orgánico (Fumárico), disminuyó significativamente el pH intestinal, comparado con el control y numéricamente con el resto de tratamientos, factor que posiblemente influyó en una menor población de bacterias Coliformes.
La mezcla (Ácido orgánico + Prebiótico) y el ácido orgánico obtuvieron la menor población de Coliformes y Aerobios Mesófilos. La menor población de E. Coli en el tratamiento con prebiótico puede ser atribuida a un mayor crecimiento en la población de Lactobacillus y Bifidobacterias debido al efecto de exclusión competitiva por parte de éstas bacterias, dada su composición química como ha sido demostrada en otras investigaciones con prebióticos. En este trabajó también se concluye que el antibiótico Bacitracina de Zn, no tuvo el efecto esperado en la disminución de bacterias Gram negativas, como se ha demostrado en otras investigaciones, posiblemente por la menor acción que tiene el antibiótico por éste tipo de bacterias.
Referencias
- Alp, M., Kahraman, R., Kocabagli. N., Eren, M. & Senel, S.H., 1993. The effects of lactiferm-l5 and some antibiotics on performance, abdominal fat, intestinal tract weight and blood cholesterol levels of broilers. Vet. J. Istanbul Univ. 19, 145-157. (Turkish with English summary).
- Alp, M., N. Kocabagli, R. Kahraman and K. Bostan, 1999. Effects of dietary supplementation with organic acids and zing bacitracin on illeal microflora, pH and performance in broilers. VIV Poultry Yutav’99 Istanbul S: 496-504.
- Baurhoo, B, Phillip, L y Ruiz-Feria, CA. 2007. Effects of purified lignin and mannan oligosaccharides on intestinal integrity and microbial populations in the ceca and litter of broiler chickens. Poult. Sci., 86: 1070-1078.
- Brufau, J. 2003. La prohibición de la Comunidad Económica Europea del Uso de Antibióticos como Promotores de Crecimiento y sus Consecuencias:
- Alternativas Potenciales, [on line].//www.SafAgri-Productinformation.htm. 2003.
- Bozkurt, M.; Küçükyilmaz, K.; Çath, U.; Çinar, M. 2009. Proceedings 15th European Symposium on Poultry Nutrition. Balatonfüred, Hungría, 25-29 de Septiembre de 2005. pp. 288-290.
- Catala-Gregori P, Mallet, S, Travel A y Lesire, M.2007. Un extrait de plantes et un prebiotique sont aussi efficaces que l'avilamycine pour ameliorer les performances du poulet de chair. 7e Journées de la Reserche Avicole, Tours, France, pp. 202-206.
- Choct, M. 1992. Relationship between soluble arabinoxylan and the nutritive value of wheat for broiler chickens. Ed. P.C. and Wiseman, J. In: Proceeding of 13th Western Nutrition Conf. 30 Juny. 41 pp.
- -------------, M. 1999. Soluble non-starch polysaccharides affect net utilisation of energy by chickens. Recent Advances in Animal Nutrition in Australia ; 12:31. 1994.
- Corrier DE, Hinton A, Jr., Ziprin RL, Beiber RC, DeLoach JR. 1990. ffect of dietary lactose on cecal pH, bacteriostatic volatile fatty acids, and Salmonella typhimurium colonization of broiler chicks. Avian Diseases; 34:617-25.
- Ewing et ale, 1994. The Gastro-intestinal Tract. In: The Living Gut. Contex: Trowhrideg Wildsshire UK: 9-28.
- Fuller, R. 1989. Probiotics in man and animals. J. Appl. Bacteriol., 66: 365-378.
- Gauthier, R. 2004. Nuevas alternativas terapeuticas en aves, XVIII Congreso Latinoamericano de Avicultura.
- Gil, O. 2001. Evaluación de Digestor Broiler en dietas de inicio en pollos de engorde. Zamrano. Honduras.
- Goldin, BR. 1998. Health benefits of probiotics. Br. J. Nutr., 80: 203-207.
- Gunal., M. G. Yayli. 2006. The effectcs of antibiotic growth promoter probiotic or organic acid supplementation on performance, intestinal microflora and tissue of broilers. Poultry Science, 5: 149-155.
- Hillman K. 2001. Bacteriological aspects of the use of antibiotics and their alternatives in the feed of non-ruminant animals. In: Recent Advances in Animal Nutrition P.C. pp. 107-134. University Press, Nottingham, UK.
- Hinton A, Jr., Corrier DE, Spates GE, Norman JO, Ziprin RL, Beier RC, DeLoach JR. 1990. Biological control of Salmonella typhimurium in young chickens.; 34(3):626-33.
- Iji PA. 2001. The impact of cereal non-starch polysaccharides on intestinal development and function in broiler chickens. World’s Poultry Science Journal ; 55(4):375-87.
- Jin S, Corless A, Sell JL, Jin SH. 1998. Digestive system development in post-hatch poultry. World’s Poultry Science Journal ; 54:335-45.
- López Hernández1, Germán Afanador Téllez, C. J. Ariza Nieto. 2009. Evaluación de tres levaduras provenientes de ecosistemas colombianos en la alimentación de pollos de engorde. Revista Corpoica – Ciencia y Tecnología Agropecuaria 10(1), 102-114.
- López Coello C. 2010. Efecto del uso de los Ácidos Organicos en la Nutrición De Aves. México. II CongresoNacional de Nutrición Animal.
- Monsan, P. F. and F. Paul. 1995. Oligosacharide feed additives. Pag. 233-245. In Biotecchnology in Animal Feeds and Feddding. R. J. Wallace. New York.
- Oztruck E. and A. Yildirim, 2004. Probiyotiklerin etlik pilrclirin performansy ve bagirsak mikrobiyolojik ozelliklirine etkileri. 1-3 eylul 2004. Cilt 2. Poster Bildiriler 5: 297-303.
- Morales R, Auclair E, García F, Esteve E, Brufau J. 2009. Use of yeast cell walls; beta–1, 3/1, 6–glucans; and mannoproteins in broiler chicken diets. Poult Sci 88:601– 607.
- Muzaffer Denli, Ferda Okan and Kemal Çelik.2003.Effect of Dietary Probiotic, Organic Acid and Antibiotic Supplementation to Diets on Broiler Performance and Carcass Yield.Pakistan Journal of Nutrition 2 (2): 89-91.
- Nicoletti, D; Flores Quintana, C; Terraes, J.; Kuttel, J.2010.Parámetros productivos y morfológicos en pollos parrilleros suplementados con ácidos orgánicos y levadura. Argentina. Rev. Vet. 21: 1, 23–27.
- Nitsan, Z., Ben -Avraham, G., Zoref, Z., and Nir, I. 1991. Growth and development of the digestives organs and some enzymes in broiler chicks after hatching Brithish Poultry Science 32: 515-523.
- Noy, Y., A. Geyra, and D. Sklan. 2001. The effect of early feeding on growth and small intestinal development in the posthatch poult. Poult. Sci. 80:912–919.
- Miles, G. D. Butcher, P. R. Henry, and R. C. Littell. 2006. Effect of Antibiotic Growth Promoters on Broiler Performance, Intestinal Growth Parameters, and Quantitative Morphology. Poultry Science 85:476–485.
- Parker, RB. 1974. Probiotics, the other half of antibiotic story. Anim. Nutr. Health, 29: 4-8.
- Pelicano, ERL, Souza, PA, Souza, HBA, Figueiredo, DF, Biago, MM, Carballo, SR. Y Bordon, VF. 2003. Intestinal mucosa development in broiler chickens fed natural growth promoters. Braz. J. Poult. Sci., 7: 221-229.
- Rebolé, A, Ortiz, LT, Rodríguez, MªL, Alzueta, C, Treviño, J y Velasco, S. 2010. Effects of inulin and enzyme complex, individually or in combination, on growth performance, intestinal microflora, cecal fermentation characteristics, and jejunal histomorphology in broiler chickens fed a wheat-and barley-bassed diet. Poult. Sci., 89: 276-286.
- Rehman, H, Böhm, J y Zentek, J. 2006. Effects of diets with sucrose and inulin on the microbial fermentation in the gastrointestinal tract of broilers. Page 155 in Proc. Soc. Nutr. Physiol., Göttingen, Germany. DLG-Verlag GmbH, Frankfurt, Germany.
- Rahmani H.R.1 and W. Speer. 2005. Natural Additives Influence the Performance and Humoral Immunity of Broilers. International Journal of Poultry Science 4 (9): 713-717.
- Rodriguez y Palenzuela. 2000. Los Ácidos Organicos como agentes antimicrobianos. XVI curso de nutrición FEDNA.
- Romero, T. 2004. Comparación del crecimiento alométrico del sistema digestivo en pollos de engorde restringidos. Tesis MVZ. Universidad Nacional de Colombia.
- Sanders, M. 1999. Probiotics. Food Technol., 53: 67-77.
- Simon, O.A. 2001. Probiotic feed additives effectiveness and expected modes of action. J. Animal Feed Sci. 10: 51-67.
- Sonmez, NW y Eren, M. 1999. Effects of supplementation of zinc bacitracin, mannanoligosaccharides and probiotic into the broiler feeds on morphology of the small intestine.Vet. Fak. Dergisi Uludag Univ., 18: 125-138.
- Sorbara, J.O. 2004. Allometric growth of the gastrointestinal tract of broilers from 1 to 7 days- old. Brasil.
- Topping DL y Clifton MP. 2001. Short chain fatty acids and human colonic functions: Roles of resistant starch and nonstarch polysaccharides. Physiol. Rev., 81: 1031-1064.
- Van der Kills y Jansman. 2002. Salud Intestinal en Aves. Ajuste de Dietas.
- Vale, M. M. Menten. Morais and M.M. A. Brainer, 2004. Mixture of formic and propionic acid as additives in broilers feeds. Scientia Agricola. Picracicaba 61:371- 375.
- Velandia Castellanos, Johana. 2006. Validación del Método Análitico para la Cuantificación de la Bacitracina en el Laboratorio de Control de Calidad de una Industria Farmaceutica Veterinaria. Tesis. Pontificia Universidad Javeriana. Bogotá. Colombia.
- Waldroup, 1990. Effects of different antibiotics on performance, processing characteristics, and parts yield of broiler chickens. Poult. Sci., 69: 1787-1791.
- -----------------, Fritts, C.A. & Fengland. 2003. Utilization of Bio-Mos® mannan oligosaccharide and Bioplex® copper in broiler diets. Int. J. Poult. Sci. 2, 44-52.
- Williams, J, Mallet, S, Leconte, M, Lessire, M y Gabriel, I. 2008. The effects of fructooligosaccharides or whole wheat on the performance and digestive tract of broiler chickens. Br. Poutl. Sci., 49: 329-339.
- Xiaolun S. 2004. Broiler performance and intestinal alterations when fed drug-free diets. Thesis submitted to Faculty of the Virginia Polytechnic Institute and State University in partial fulfillment of the requirements for the degree of Master of Science in Animal and Poultry Sciences, August 10, 2004. Blacksburg, Virginia.
- Yang, Y, Iji, PA, Kocher, A, Thomson, E, Mikkelsen, LL y Choct, 2008. MEffects of mannanoligosaccaride in broiler chicken diets on growth performance, energy utilization, nutrient digestibility and intestinal microflora. Br. Poult. Sci., 49: 186-194.
- Yason CV, Schat KA. 1987. Pathogenesis of rotavirus infection in various age groups of chickens and turkeys: Clinical signs and virology. Am J Vet Res ; 48:977.
- Yusrizal Y y Chen, TC. 2003. Effect of adding chicory fructans in feed on broiler growth performance, serum cholesterol and intestinal length. Int. J. Poult Sci., 2: 214-219.
- Xu, Z.R.C., Hu, M. S., Xia, X. A. Zhan, and M. Q. 2003. Wang Effects of dietary frutooligosaccharide on digestive enzyme activities, intestinal microflora and morphology of male broilers. Poult. Sci. 82:1030–1036.
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicaciónPorfenc SRL
20 de septiembre de 2016
Felicitaciones, muy buen trabajo... En alguna parte del ensayo se midió producción y/o efectos de ácido butirico, partiendo del efecto positivo que se tiene en ciego?
Saludos,
Carlos E. Duque
20 de septiembre de 2016
Saludos Álvaro y Libia...
Felicitarles por el trabajo realizado, por lo que pude revisar en este resumen, los resultados y mediciones se focalizaron más al área microscópica en cuanto a salud intestinal, tal como lo refiere el título.
Mi pregunta iba más por el costado de lo parámetros zootécnicos (ganancia de peso, consumo de alimento, conversión alimenticia y mortalidad).
¿Qué hay con ellos?
¿Cuál fue el comportamiento entre las combinaciones en los diferentes tratamientos?
Por otro lado, en cuanto al perfil de aminoácidos de las dietas en el análisis calculado, por qué se excluye el requerimiento de Metionina + Cistina? Estoy casi seguro que si se lo hubiera considerado, la inclusión de Metionina habría superado a la de Lisina.
Más que cuestionar el excelente trabajo, es una observación en realidad...
Les dejo un saludo y mi abrazo.
Cordialmente,
Ing. Jesús Antonio Zambrano
Quevedo - Los Ríos
ECUADOR
21 de septiembre de 2016
El acido butirico tiene efecto comprobado en el intestino delgado y el tracto digestivo de los animales, el motivo por el cual no es muy popular es debido a su fuerte olor, el recubrimiento reduce un poco el olor pero no se consigue una absorcion importante de acido butirico, la empresa Perstorp desarrollo un acido butirico saponificado o tributirina que no presenta problemas de olor y con concentraciones adecuadas la cual no se pierde en el trayecto al intestino delgado
20 de septiembre de 2016
Muy buen trabajo,me gustaria saber si se publico traducido en ingles y donde puedo encontrarlo.Muchas gracias










.jpg&w=3840&q=75)