Situación actual de la resistencia a plaguicidas y sus consecuencias para la sustentabilidad agrícola.
Publicado: 1 de junio de 2018
Por: Carlos Blanco, PhD. Biology Department, the University of New Mexico
De acuerdo a la Organización de las Naciones Unidas para la Alimentación y la Agricultura (F.A.O.) ‘las prácticas agrícolas sostenibles deben utilizar al máximo la TECNOLOGÍA, la INVESTIGACIÓN y el DESARROLLO’. El manejo de plagas en la producción agrícola, tecnología que puede involucrar desde aspectos rudimentarios hasta técnicas muy sofisticadas, es una labor imprescindible. A pesar de los avances científicos y tecnológicos para disminuir el daño causado por las plagas, a nivel mundial se pierde 11% de la producción por la competencia con las malezas, 10% por el deterioro causado por animales, y otro 10% por patógenos que causan enfermedades en las plantas (Oerke, 2006), por lo que la investigación de nuevas alternativas y/o la mejora en las prácticas ya establecidas es imprescindible. La protección de cultivos es una práctica redituable, ya que por cada peso invertido en la aplicación necesaria de plaguicidas, reditúa en promedio 4 pesos en ganancias en la cosecha (Pimentel et al., 1992). Aunque estas cifras necesiten de ajustes por haberse calculado hace tanto tiempo, piense en el resultado que tendría no proteger nuestros cultivos; al menos una merma o hasta la pérdida total de la cosecha que no necesariamente tiene que ver una acción ‘devastadora’ de las plagas, sino en parte por las demandas de producción de los consumidores y la industria. Los estándares que se piden de que ciertos productos como los vegetales y las frutas tengan una apariencia perfecta, rebasa cualquier lógica de producción sustentable, y obliga al agricultor a emplear cantidades excesivas de insecticidas y fungicidas, principalmente (Blanco, 2005). El mal empleo de los plaguicidas inevitablemente va a llevar a que las plagas evolucionen y se vuelvan resistentes.
No hay una fórmula infalible para que la resistencia no suceda, y los ejemplos de plagas prácticamente ‘inmunes’ a casi cualquier medida de control abundan como ciertas especies de cucarachas en las ciudades, moscas en los establos, pulgones en el campo, etc. Pero la posibilidad de desarrollo de resistencia en las plagas no debe verse como un panorama sombrío al que inevitablemente cada día nos acercamos, sin considerar que el equilibrio susceptibilidadresistencia es muy dinámico. Por ejemplo plaguicidas que se han utilizado en demasía durante muchos años contra una plaga (e.g., malatión para controlar picudo del algodonero, APHIS, 2013) siguen siendo efectivos, mientras que otros de poco uso y recién disponibilidad en el mercado (e.g., tebufenozide para controlar la polilla del manzano, Ioriatti et al., 2007), se reportan como inefectivos en algunos lugares después de pocas generaciones de plagas expuestas a este químico. Lo que es un hecho es que no se puede evitar considerar que el desarrollo de resistencia tiene una alta posibilidad de que ocurra, aunque lo contrario a veces lo hayan afirmado los llamados ‘expertos’ (e.g., la ‘imposibilidad’ –de acuerdo a Monsanto- de que las plantas se hicieran resistentes a glifosato, Gilbert, 2013); como también reconocer que no nos hemos vuelvo certeros en predecir qué eventos que nos pueden llevar a crear plagas resistentes (e.g., el mito del gusano elotero resistente a Bacillus thuringiensis (Bt) en Estados Unidos en el año ~2005; Tabashnik et al., 2008).
Parte de lo que sabemos sobre el manejo de resistencia es que nuevas alternativas de control son cada día más escasas, y se depende más y más de un número relativamente reducido de plaguicidas, lo que en ‘teoría’ acorta el plazo para que las plagas desarrollen resistencia. El descubrimiento, proceso regulatorio de aprobación, y mercadeo de un nuevo ingrediente activo insecticida cuesta en promedio $280 millones de dólares y tarda más de once años para que el agricultor lo pueda usar (McDougall, 2016), lo cual dificulta que hayan más alternativas químicas. Los cultivos genéticamente modificados (transgénicos), de lo más novedoso en las últimas dos décadas, se han basado en la producción de un número muy limitado de proteínas de B. thuringiensis y una secuencia de ácido ribonucleico (ARN) para el control de pocos insectos plaga, así como la tolerancia de cultivos a la aplicación de 1-4 ingredientes activos herbicidas para el control de malezas. Un nuevo modo de acción plaguicida en cada cultivo transgénico le cuesta a la industria (o ‘promovente’) $136 millones de dólares, y tardan en ser aprobados por las agencias regulatorias 13 años en promedio (McDougall, 2011). Otras alternativas como el descubrimiento y producción masiva de agentes de control biológico, su evaluación y aprobación por las autoridades regulatorias, también encuentran toda clase de trabas para su lanzamiento al mercado (Blanco, 2017). El desarrollo de nuevas alternativas de control debe considerar las necesidades y capacidades técnicas y económicas de los agricultores, y más recientemente la percepción del público sobre ‘nuevas’ tecnologías agrícolas. ¿Sabemos cómo enfrentar estos nuevos retos? ¿Hemos informado fidedignamente a la ciudadanía sobre los problemas de producción agrícola y los riesgos que conllevan las medidas fitosanitarias? ¿Logrado o al menos intentado desmentir la desinformación sobre los supuestos peligros de los cultivos genéticamente modificados? ¿Conoce el público que la agricultura orgánica también emplea plaguicidas y no es la producción ‘libre’ de fertilizantes y plaguicidas como el público en general piensa? He visto con tristeza que personas que tal vez nunca hayan estado en el campo, y/o que su formación profesional no haya incluido conceptos básicos de biología o ciencia, son los que (des)informan a la ciudadanía sobre estos aspectos. ¿Conoce usted también algún ejemplo? ¿Qué ha hecho para cambiar las cosas?
Las plagas, tarde o temprano, desarrollan resistencia.
Esto es un hecho, ya que solo es necesario mirar en el sitio red que compila la información de artrópodos plaga desde 19144 para darnos cuenta de que más de quinientas especies se han reportado resistentes a algún insecticida o acaricida en algún lugar o momento (Whalon et al., 2008). Afortunadamente, las plagas pueden recuperar su susceptibilidad a los plaguicidas, ya que la resistencia es un fenómeno que puede ser reversible en muchos casos. Una población sujeta a una presión constante para que se haga resistente (mute), en varias generaciones puede terminar reduciendo a la mayoría –o a todos- los que son susceptibles, y el gen(es) de resistencia se encontrará en tan alta frecuencia, que se puede concluir que se ha ‘implantado’ o que ya es parte de toda la población. Este tipo de situaciones pueden ocurrir en grupos donde el flujo de genes con otras poblaciones no existe o es muy bajo, como en una colonia mantenida en el laboratorio por muchas generaciones sin ‘infusiones’ de genes del exterior. Como consecuencia la población en general será resistente por la gran frecuencia de estos genes. Pero cuando la presión de selección es intensa pero bajo circunstancias que permitan el flujo de genes, como sucede en el campo, la reversión a susceptibilidad puede ocurrir en pocas generaciones. A esto hay que añadirle la posibilidad de que mutaciones al azar, las que provocan resistencia o las que ‘restauran’ la susceptibilidad, suceden en todas las poblaciones, ya sea en el laboratorio o en el campo, y su frecuencia (proporción) es lo que determina para dónde se inclina la balanza: a la resistencia o a la susceptibilidad. Así es como se generan los genes de resistencia y susceptibilidad a plaguicidas, a través de mutaciones que ocurren constantemente en todos los organismos, y la proporción (frecuencia) de genes resistentes o susceptibles en una población es influida por un agente de selección –en este caso un plaguicida- y la frecuencia puede dictar la problemática de control.
Un ejemplo ahora ‘clásico’ de reversión a la susceptibilidad a varios grupos de insecticidas lo demostró un entomólogo mexicano, el doctor Antonio Palemón Terán Vargas. Mi colega Palemón ha sido durante muchos años uno de los expertos del manejo de resistencia en el país, así como gran conocedor del impacto del complejo bellotero (Helicoverpa zea / Heliothis virescens). El gusano tabacalero (H. virescens) es una plaga que ha azotado de cuando en cuando regiones de Tamaulipas al grado de volverse prácticamente incontrolable con todas las herramientas químicas. En 1994-1995 los niveles de resistencia de este gusano sobrepasaban cualquier opción viable para su control, así que los productores de algodón –también disuadidos por el precio tan bajo de la fibra en esos años- prácticamente dejaron de sembrar el cultivo y por lo tanto de aplicar piretroides y organofosforados para el control de esta plaga. En cuestión de 3-5 años, sin la presión de selección de estas clases de insecticida, el gusano tabacalero volvió a ser tan susceptible como los insectos del laboratorio que el doctor Terán usaba como comparación (Terán-Vargas et al., 2005). Cuando los productores volvieron a sembrar algodonero contaban nuevamente con varias alternativas de control; toda la gama de insecticidas químicos registrados contra gusano tabacalero, y con la posibilidad de sembrar el efectivo algodonero transgénico. Desde entonces, H. virescens no ha vuelto a ser un problema en Tamaulipas, lo que obedece a circunstancias que más tienen que ver con aspectos económicos (las tendencias del mercado y demanda de algodón) que con un plan de manejo de resistencia bien pensado y administrado.
Creo que no es necesario llegar a una crisis como las que hemos tenido con tabacalero para tomar cartas en el asunto, pero ¿qué se necesitamos saber y hacer para que la resistencia no ocurra o se revierta? ¿Idear un plan de rotación de plaguicidas? Ya hay varios y se pueden consultar por ejemplo en www.pesticideresistance.org² y otros sitios, pero ¿por qué no se llevan siempre a cabo? ¿Desarrollar programas de manejo racional de los plaguicidas, tales como manejo integrado de plagas (MIP)? Habrá que estudiar bien por qué, por ejemplo, el MIP no se lleva a cabo en el cultivo más importante del país, el maíz (Blanco et al., 2014), y es todo un éxito en la producción de nueces (Tarango, 2014). ¿Qué falta para que alternativas de control más sustentables se adopten/difundan a mayor escala?
¿Cómo podemos saber si las plagas son o se están volviendo resistentes?
Un programa efectivo de manejo de resistencia puede ser proactivo o reactivo. Los programas reactivos sirven para evaluar si un plaguicida fue mal empleado o si alguna población es resistente a cierto químico. Estos resultados que solo nos dan una semblanza de lo que sucede en una muestra de una zona geográfica en determinado momento, tienen su mérito y limitaciones (Roush & Miller, 1986), y su metodología se describe en detalle por ejemplo en Robertson y colaboradores (2007).
Los programas proactivos pretenden detectar brotes de resistencia antes de que el problema sea obvio en el campo, y tal vez evitar que los organismos resistentes se esparzan a todos lados. Para poder detectar resistencia con enfoque proactivo (e.g., E.P.A., 2001), se han propuesto umbrales muy bajos para detectar plagas resistentes. Estos niveles de detección proactiva, con cifras obtenidas de modelos matemáticos, intentan documentar frecuencias de resistencia tan bajas como un alelo resistente en 100 susceptibles (Georghiou & Taylor, 1977). Aunque un alelo resistente en 100 se pueda obtener de tan solo 50 organismos, suponiendo que la plaga es diploide y que la resistencia se herede por ambos sexos, y que los 50 individuos muestreados no están genéticamente relacionados, esta cifra engañosamente baja, podría dar la falsa idea que 50 organismos no sean difíciles de obtener. Desgraciadamente la logística para conducir estas pruebas con el tamaño de muestra apropiado indica lo contrario.
Para ilustrar el problema de la obtención de un tamaño de muestra apropiado usemos como ejemplo a una plaga polífaga de más de 100 plantas (Blanco et al., 2007), el gusano elotero (Helicoverpa zea), que se vigila en México y otros países del continente por la posibilidad5 de volverse resistente a proteínas de B. thuringiensis que producen el maíz y el algodonero transgénicos. El gusano elotero, por motivos metodológicos de los programas proactivos de detección de resistencia a proteínas Bt, se considera de carácter genético casi (funcionalmente) recesivo, y las larvas de la segunda generación (F2) tienen que ser alimentadas con el tóxico para que los resultados de los bioensayos sean válidos (Andow & Alstad 1998, ver más adelante la explicación detallada). Debido a que el insecticida biológico Bt tiene que ser ingerido por las larvas para que sea tóxico (Soberón et al., 2017), es necesario segregar las larvas F2 en sus características genéticas: homocigotas susceptibles (SS), heterocigotas susceptibles (Sr) y homocigotas resistentes (rr). Por lo tanto, obtener 50 larvas F2 de padres provenientes del campo y que no estén relacionados genéticamente unos con otros (‘genéticamente independientes’ evitando muestrear hermanos), puede lograrse 1) capturando hembras copuladas usando redes o atrayéndolas a trampas de luz, o 2) colectando larvas de varias plantas o desenterrando pupas de la tierra. Estos métodos tienen que tomar en cuenta factores inevitables que suceden en el laboratorio cuando las muestras son colectadas, que reducen la cantidad de insectos disponibles en los bioensayos, y por ende la cantidad de alelos en las pruebas. Por ejemplo, 50-60% de larvas/pupas de Helicoverpa zea al ser llevadas del campo (generación P0) al laboratorio mueren por varias causas como el parasitismo y enfermedades, el 50% de las sobrevivientes de la primera generación (F1) también mueren, y siguen teniendo 40-60% de mortalidad en las siguientes generaciones hasta mantenerse entre 10-25% a partir de la décima generación (Burton, 1970; Gore et al., 2003; y comunicación personal con el administrador de la colonia de elotero de mayor reputación en Estados Unidos (Chad Finkenbinder, Benzon Research Inc.), e información de la colonia de elotero de Mississippi State University obtenida del Dr. Frank Davis).
En el supuesto de que hayamos sorteado los obstáculos descritos anteriormente, y que logremos una muestra de al menos 25 hembras y 25 machos F1 que no estén genéticamente relacionados, ahora consideremos que durante ~1 semana las hembras (P0 y F1) producen la mayoría de sus huevos. Noventa-porciento de las hembras de elotero completamente adaptadas a condiciones de laboratorio producen huevos fértiles, pero solo 25% de ellas copulan con machos (P0) provenientes del campo y producen huevos fértiles (Blanco et al., 2010a), y 30% de las hembras H. zea de laboratorio pero que son resistentes a Bt producen huevos fértiles (Anilkumar et al., 2008). La producción total de huevos por hembra de H. zea de colonias de laboratorio es 800 (Callahan, 1958; Blanco et al. 2010a), lo que se espera sea menor ya que especies afines como Heliothis virescens producen 40% menos huevos cuando son resistentes a Bt (Blanco et al., 2009a), y Helicoverpa armigera 20% menos huevos cuando son resistentes (Liang et al., 2008). Además de una menor producción de huevos, las larvas resistentes de H. zea tiene una mortalidad 10% mayor que las susceptibles (Anilkumar et al., 2008). Estos escenarios de mortalidad ‘normal’ bajo condiciones de laboratorio y de una baja frecuencia de copulaciones se puede ilustrar de esta manera:
Cuadro1. Consideraciones para obtener un tamaño mínimo de muestra que resulte en >100 alelos de Helicoverpa zea no genéticamente relacionados.
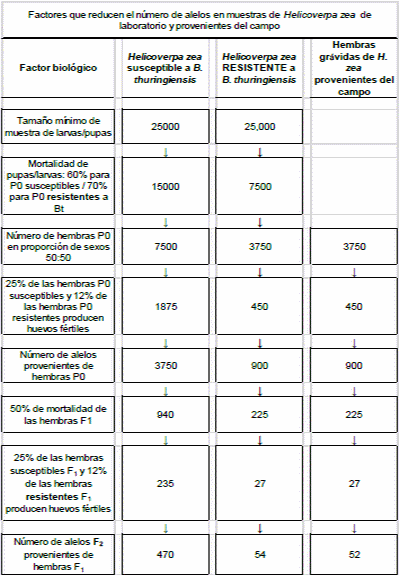
¿Es factible obtener 25,000 larvas de elotero que no sean hermanos y de esa manera hacer pruebas con 100 alelos F2 verdaderamente independientes? De los ~800 huevos que pone una hembra, ¿cuántos de ellos los colocan en la misma planta o en plantas cercanas? ¿Esta conducta va a afectar nuestra muestra de alelos independientes? Por supuesto, y además ¿en cuánto tiempo y con qué esfuerzo se pueden colectar 3,750 hembras preñadas? Eso lo intenté en Mississippi usando 3 trampas de luz, a 3 metros de lotes grandes de maíz-algodonero, en tres lugares diferentes, durante tres años y solo pude capturar una hembra que ni siquiera puso huevos! Cebando las trampas no obtuve mejores resultados, pero mi colega Ryan E. Jackson (Jackson et al., 2006) no tuvo problema para colectar cerca de 2,000 hembras en Carolina del Norte utilizando el mismo tipo de trampa de luz! Como tal vez este método no le funcionen a todo mundo, ¿qué tal colectando larvas? Basado en las poblaciones ‘naturales’ de elotero en algodonero convencional, se necesitaría obtener todas las larvas presentes 25 hectáreas de este cultivo (Scheffler et al., 2012), o destruir/afectar 75,000 elotes (Chilcutt et al. 2007) para obtener la muestra mínima requerida de 25,000 larvas. ¿Vale la pena o es necesario?
Es complicado obtener una buena muestra, ¿cierto? Pues esto no es todo, ya que además otros detalles metodológicos que se practican con mucha frecuencia ‘enturbian’ los resultados. La mayoría de los reportes de resistencia utilizan la técnica de crianza de insectos de apareamiento en masa; esto es juntar en una jaula docenas-cientos de adultos de ambos sexos, dejarlos que se apareen, que produzcan huevos y con ellos elaborar bioensayos. Definitivamente una buena alternativa para obtener cientos-miles de huevos diarios pero ¿qué pasa cuando no sabemos cuántas veces una hembra ha sido copulada por más de un macho? Poliandria en este grupo de plagas (subfamilia Heliothinae) es bastante común y el gusano elotero no es una excepción. Las hembras de H. zea copulan varias veces teniendo la oportunidad, y en densidades de 30 hembras y 30 machos por jaula lo hacen 2.5 veces en 5 días en promedio (Blanco et al., 2010a). No es que sea un declarado voyerista, pero lo que no supe determinar en este estudio fue si las copulaciones fueron con el mismo macho o con diferentes, lo que tiene implicaciones prácticas si consideramos que el primer escenario (monogamia) facilitaría calcular los alelos en una muestra, ya que una pareja de eloteros (una hembra con dos alelos, con un solo macho que proveyera 2 alelos) producirían progenie con 1-4 posibles alelos resistentes, asumiendo que la mutación se encuentra en un solo sitio en un solo gen y sabiendo que H. zea es diploide. Una hembra que ha copulado con diferentes machos puede producir progenie con 1->6 alelos resistentes debido a que la poliandria, al menos en Heliothis virescens, una hembra fecunda a su progenie con diferentes proporciones de los genes de los machos (Blanco et al., 2006, 2008a), fenómeno que tiene relevancia cuando hembras o machos que tienen un alelo resistente (heterocigotos resistentes, Sr), se aparean y su progenie tiene diferentes proporciones de caracteres homocigotos y heterocigotos (Blanco et al. 2010b). Tal vez la ilustración de abajo (Figura 1) ayude a entender por qué es relevante este fenómeno para poder calcular la frecuencia de alelos resistentes.
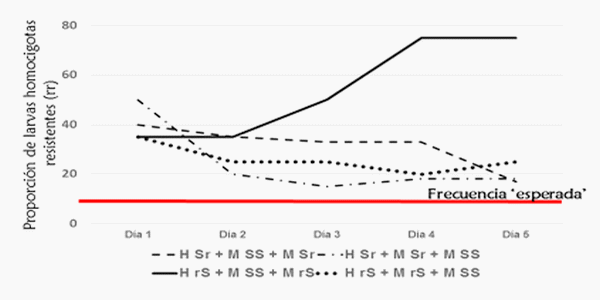
Figura 1. Apareamientos de hembras de Heliothis virescens heterocigotas resistentes a Bacillus thuringiensis (H Sr o H rS) en secuencia con machos H. virescens heterocigotos resistentes (Sr o rS) y homocigotos susceptibles (SS). Adaptado de Blanco et al., 2010b.
Una hembra heterocigota resistente (un alelo susceptible [S] y uno resistente [r]= Sr), al aparearse con un macho heterocigoto resistente (también Sr) tendrá una progenie de acuerdo a la segregación mendeliana, de 25% de hijos SS (homocigotos susceptibles), 50% heterocigotos Sr y 25% de homocigotos resistentes (rr). Si una hembra Sr se aparea con un macho homocigoto susceptible SS, la progenie será 50% SS y 50% Sr. Una hembra Sr, dejando a un lado por el momento muchas circunstancias que pueden alterar esto, al aparearse con dos machos, digamos uno SS y otro Sr, producirá 37% hijos SS, 50% Sr, y 13% rr. La figura 1 ilustra que estos apareamientos, dependiendo del orden como se efectúen, producen diferentes proporciones de progenie homocigota resistente (rr) durante diferentes días, y en todos los casos sobrepasa la proporción de segregación de 13% rr esperada (la línea roja horizontal). Esta posible ventaja de obtener una segregación de progenie rr más alta de la esperada puede influir en la detección de alelos resistentes, y en la respuesta dosis- mortalidad en los bioensayos (Blanco et al. 2008b).
Todas estas consideraciones tienen que ver con la logística de cómo se plantee un programa de monitoreo de resistencia proactivo, en el cual si el nivel de detección al que se aspira es tan bajo como para detectar un solo alelo resistente en 100, entonces se requiere de un tamaño de muestra de insectos del campo muy grande. Si se requiere tanta precisión –lo que todos esperamos- entonces también se necesita cambiar la metodología de apareamientos en masa y efectuar los bioensayos con la segunda (F2) generación. Observa la siguiente figura:
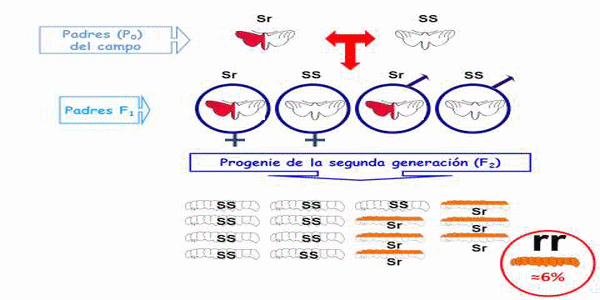
Figura 2. Segregación de UN alelo resistente que lo tiene un padre (P0) heterocigoto (Sr, dibujo bicolor parte superior izquierda) que se aparea con un padre P0 homocigoto susceptible (SS, un solo color) y las diferentes proporciones de progenie SS, Sr y rr en la primera y segunda generación.
Los apareamientos entre un adultos homocigoto susceptibles (SS) y un heterocigoto resistente (Sr) solo van a producir progenie SS y Sr en la primera generación (F1). La respuesta en bioensayos con Heliothines SS y Sr es muy similar a varias toxinas de Bt, pero muy diferente a la de los homocigotos resistentes (rr) (Blanco et al., 2008b), y esto crea un problema para distinguirlos en los bioensayos usando una dosis discriminatoria, o en pruebas dosis-respuesta con múltiples concentraciones. Para distinguir con menor ambigüedad larvas SS y Sr de las homocigotas resistentes (rr) se utiliza una dosis discriminatoria con suficiente toxina para que mate o impida el crecimiento de larvas SS y Sr, pero que no afecte a las rr (Roush & Miller, 1986). Por ejemplo, la concentración de proteína Bt Cry1Ac que impide el desarrollo de tabacaleros SS es 0.2 μg/ml de dieta, y 0.3 a 5 μg/ml de dieta para las Sr, mientras que la misma respuesta de inhibición de crecimiento de larvas rr se obtiene con más de 3,500 μg/ml de dieta (Blanco et al. 2008b). Por ello, una dosis discriminatoria cercana a 2-5 μg/ml no puede separar sin ambigüedad larvas SS de Sr ni Sr de rr, pero una superior a 10 μg/ml si lo puede hacer entre rr y los otros genotipos. Por ello es necesario hacer las pruebas en la segunda generación, en la que se segrega una frecuencia baja (6%) de larvas rr, las que no se ven afectadas por la dosis discriminatoria, y no en la primera generación donde es difícil distinguir SS de Sr con este (y otros) método.
Con la complejidad que demandan los bioensayos en términos de precisión y tamaño de muestra, ¿se puede hacer algo para que estos esfuerzos si produzcan información útil?
Alternativas prácticas para mejorar un programa de monitoreo proactivo.
Un manuscrito que está por ser publicado en la revista Pest Management Science describe aspectos prácticos sobre cómo se logró cuantificar, con bastante precisión, la frecuencia de alelos resistentes en Helicoverpa armigera, una plaga que es de mucha preocupación en Norteamérica (Kriticos et al., 2015). Los investigadores de India después de una docena de años de sembrar algodonero transgénico se dieron a la labor de hacer esta cuantificación. Entre ellos se encontraba el doctor David Andow de la universidad de Minnesota, quien seguramente les habló del método de apareamiento de parejas (Andow & Alstad, 1998). Se colectaron 1,000 y 1,200 larvas por un par de años, y las que llegaron a emerger como adultos (~40%), se pusieron a copular en pares (una hembra con un solo macho en una jaula), y de esta manera formaron ‘isofamilias’, que es la descendencia de un solo par que representan 4 posibles alelos resistentes. La progenie de la primera generación (F1) de cada isofamilia se mantuvo por separado, criando sus larvas en dieta artificial y cuando los hermanos emergieron, se pusieron a copular entre sí, para crear la descendencia F2 como se describe en la figura 2, para exponer a las larvas recién nacidas a una dosis discriminatoria. Con las ~1,100 larvas del campo pudieron formar en promedio 32 isofamilias F1 en cada año las que produjeron suficiente progenie para realizar ensayos en la generación F2., como lo describe teóricamente el artículo de los doctores Andow y Altad de 1998.
El usar el método de Andow y Alstad no es en realidad algo novedoso, ya que se ha llevado a cabo con varias especies para determinar la frecuencia de resistencia. Por ejemplo, el trabajo del equipo del Dr. Blare Siegfried (Siegfried et al. 2000) con el barrenador europeo del tallo (Ostrinia nubilalis) fue uno de los pioneros en usarla. La implementación de este método llamado ‘monitoreo de la F2’ (en inglés F2-screening) se usa con mucho éxito en Australia para vigilar el desarrollo de resistencia en Helicoverpa armigera y H. puntigera (Downes et al., 2010), y se ha utilizado con poca regularidad en Estados Unidos para Heliothis virescens (Gould et al., 1997; Blanco et al., 2009b), Diabrotica virgifera (Siegfried et al., 2005), y para Diatraea saccharalis (Huang et al., 2008). Recientemente, el equipo del Dr. Celso Omoto en Brasil ha usado el monitoreo F2 para determinar la situación de resistencia de gusano cogollero (Spodoptera frugiperda), y han hecho modificaciones que permiten obtener datos aún más precisos (Farias et al., 2016). Entonces ¿por qué no es ‘el caballito de batalla’ de estos programas? En parte tiene que ver con lo detallado y algo caro que puede resultar, y porque demanda mucho más trabajo que las prácticas ‘tradicionales’, aunque estos obstáculos no están bien fundamentados como para no considerar emplearlos.
En mi idea de convencer a la comunidad científica de que el monitoreo F2 es el método de llevar a cabo los bioensayos, se me ocurrió calcular el precio de hacer un bioensayo con cada isofamilia; desde lo que cuesta obtener una muestra (su envío por paquetería, dieta artificial, materiales, etc.), y el costo promedio fue $120 dólares por isofamilia cuando trabajaba en Mississippi (Blanco et al., 2009b). Aclaro que el 90% del costo se fue en salarios de un equipo muy grande (6-8 personas) que trabajaban en mi laboratorio. Pero por ejemplo, el Dr. Siegfried con la ayuda de un técnico y un estudiante es capaz de llevar a cabo un trabajo similar –o mejor- que el que yo hacía. Lo mismo hace Sharon Downes en Australia; trabaja con solo dos personas. Dejando a un lado el costo de la mano de obra por un momento, un bioensayo de una isofamilia involocra $5.00 dólares de dieta artificial para las generaciones P0 y F1, unos pocos envases de plástico que no son muy caros y reciclables, y espacio en el laboratorio equivalente a un closet o de preferencia una cámara de crecimiento, es de los más costoso para llevarlo a cabo. Es mi percepción y experiencia de que el método de monitoreo F2 no es bien visto por los investigadores que nunca lo han intentado, tal vez debido al temor de incurrir en más trabajo. Tal vez esta percepción sea similar en los colegas reguladores y de la industria que ven estos posibles cambios como más y más esfuerzo y costo para todos. En realidad tiene razón, al menos en parte. Detalles muy generales sobre las limitaciones y costos los han planteado precisamente el Dr. Siegfried (Siegfreid et al., 2007), el Dr. Fangreng Huang (Huang, 2006); quienes tiene basta experiencia en este método.
El trabajo del equipo de India con H. armigera me ha llamado la atención por varias razones. Si ~35 isofamilias al parecer son necesarias para tener una idea clara de la frecuencia de alelos resistentes, ¿qué tan caro puede resultar? Pero lo más importante de estos resultados es que treinta por ciento (30%) de las familias de H. armigera en India contenían al menos un alelo resistente, y con esta altísima frecuencia de resistencia, los investigadores relatan que NO han visto problemas de control en el algodonero Bt. Entonces, ¿necesitamos tratar de encontrar un alelo resistente en 100 para tomar una decisión? ¿Estamos pidiendo ‘imposibles’ basados en un umbral que no entendemos o es relevante para todas las plagas? Estos resultados en India indican que 30% de alelos resistentes no es un problema en el campo. Sin embargo, otro trabajo que hice con cogollero en Puerto Rico mostró que con ~5% de alelos resistentes los problemas en el campo pueden ser muy evidentes a simple vista (Blanco et al., 2009b).
Finalmente, ¿qué necesitamos saber y cómo podemos aplicar los resultados de un programa de monitoreo? ¿Qué consecuencias tiene invertir en este esfuerzo que arroja resultados producidos con técnicas que no son las correctas? ¿Qué consecuencia trae para el agricultor o a la industria el que se detecte resistencia? ¿Con qué velocidad, fidelidad, y difusión se pueden hacer llegar estos resultados al agricultor o al público? ¿Qué tan enterados están estos actores, y el sistema regulatorio, de los resultados y consecuencias de la detección de resistencia de insecticidas? Creo que lo que se necesita es un diálogo entre todos, para que los esfuerzos se enfoquen de mejor manera, y los planteamientos nos lleven a entender y tomas las acciones apropiadas.
Referencias
- Andow, D. A., & D. N. Alstad. (1998). F2 screen for rare resistant alleles. Journal of Economic Entomology 91, 572-578.
- Anilkumar, K. J., M. Pusztai-Carey, & W. J. Moar. (2008). Fitness costs associated with Cry1Acresistant Helicoverpa zea (Lepidoptera: Noctuidae): a factor countering selection for resistance to Bt cotton? Journal of Economic Entomology, 101, 1421-1431.
- APHIS. Animal and Plant Health Inspection Service, U.S. Department of Agriculture (2013).
- Blanco, C. A. 2005. “A la hora de comer ¿qué nos preocupa? Fondo de Cultura Económica. México. ISBN 9786071603265.
- Blanco, C. A., D. Sumerford, J. D. Lopez, & G. Hernandez. (2006). Mating incidence of feral Heliothis virescens (Lepidoptera: Noctuidae) males confined with laboratory-reared females. Journal of Cotton Science, 10, 105-113.
- Blanco, C. A., A. P. Teran-Vargas, J. D. Lopez, Jr., J. V. Kauffman and X. Wei. (2007). Densities of Heliothis virescens and Helicoverpa zea (Lepidoptera: Noctuidae) in three plant hosts. FloridaEntomologist 90, 742-750.
- Blanco, C. A., O. P. Perera, A. Groot, G. Hernández, & A. P. Terán-Vargas. (2008a). Paternity allocation in a mutant Heliothis virescens colony. Southwestern Entomologist, 33, 253-263.
- Blanco, C. A., O. P. Perera, F. Gould, D. V. Sumerford, G. Hernández, C. A. Abel & D. A. Andow. (2008b). An empirical test of the F2 screen for detection of Bacillus thuringiensis-resistance alleles in tobacco budworm (Lepidoptera: Noctuidae). Journal of Economic Entomology, 101, 1406-1414.
- Blanco, C. A., D. Sumerford, J. D. López, Jr., & G. Hernández. (2009a). Mating incidence of feral Heliothis virescens (Lepidoptera: Noctuidae) males confined with laboratory-reared females. The Journal of Cotton Science, 10, 105–113.
- Blanco, C. A., D. A. Andow, C. A. Abel, D. V. Sumerford, G. Hernández, J. D. López, L. Adams, A. Groot, R. Leonard, R. Parker, G. Payne, O. P. Perera, A. P. Terán-Vargas, & A. Azuara- Domínguez. (2009b). Bacillus thuringiensis Cry1Ac resistance frequency in tobacco budworm (Lepidoptera: Noctuidae). Journal of Economic Entomology, 102, 381-387.
- Blanco, C. A., D. Sumerford, J. D. López, Jr., G. Hernández, & C. Abel. (2010a). Mating behavior of wild Helicoverpa zea (Lepidoptera: Noctuidae) males with laboratory females. The Journal of Cotton Science, 14, 119-126.
- Blanco, C. A., F. Gould, A. T. Groot, C. A. Abel, G. Hernández, O. P. Perera, & A. P. Terán- Vargas. (2010b). Offspring from sequential matings between Bacillus thuringiensis-resistant and Bacillus thuringiensis-susceptible Heliothis virescens (Lepidoptera: Noctuidae). Journal of Economic Entomology, 103: 861-868.
- Blanco, C. A., Portilla, M., Jurat-Fuentes, J. L., Sánchez, J. F., Viteri, D., Vega-Aquino, P., Terán- Vargas, A. P., Azuara-Domínguez, A., López, Jr., J. D., Arias, R., Zhu, Y.-C., Lugo-Barrera, D., & Jackson, R. (2010). Susceptibility of isofamilies of Spodoptera frugiperda (Lepidoptera: Noctuidae) to Cry1Ac and Cry1Fa proteins of Bacillus thuringiensis. Southwestern Entomologist, 35, 409-415.
- Blanco, C. A., Pellegaud, J. G., Nava-Camberos, U., Lugo-Barrera, D., Vega-Aquino, P., Coello, J., Terán-Vargas, A. P., &, Vargas-Camplis, J. (2014). Maize pests in Mexico and challenges for the adoption of integrated pest management programs. Journal of Integrated Pest Management, 5, DOI: http://dx.doi.org/10.1603/IPM14006.
- Blanco, C. A. (2017). La hormiga de fuego invicta. Fondo de Cultura Económica, La Ciencia para Todos 245. ISBN 978-968-16-6601-9.
- Burd, A. D., F. Gould, J. R. Bradley, J. W. van Dwyn, & W. J. Moar (2003). Estimated frequency of nonrecessive Bt resistance genes in bollworm, Helicoverpa zea (Boddie) (Lepidoptera: Noctuidae) in eastern North Carolina. Journal of Economic Entomology, 96, 137-142.
- Burton, R. L. (1970). A low-cost artificial diet for the corn earworm. Journal of Economic Entomology 63, 1969-1970.
- Callahan, P. S. (1958). Behavior of the imago of the corn earworm, Heliothis zea (Boddie), with special reference to emergence and reproduction. Annals of the Entomological Society of America, 51, 271-283.
- Chilcutt, C. F., G. N. Odvody, J. C. Correa, & J. Remmers. (2007). Effects of Bacillus thuringiensis transgenic corn on corn earworm and fall armyworm (Lepidoptera: Noctuidae) densities. Journal of Economic Entomology, 100, 327-334.
- Downes, S., R. J. Mahon, L. Rossiter, G. Kauter, T. Leven, G. Fitt, & G. Baker. (2010). Adaptive management of pest resistance by Helicoverpa species (Noctuidae) in Australia to the Cry2Ab Bt toxin in Bollgard II cotton. Evolutionary Applications, 3, 574-584.
- E.P.A. (2001). U.S. Environmental Protection Agency, Insect Resistance Management.
- Dively, G. P., P. D. Venugopal, & C. Finkenbinder. (2016). Field-evolved resistance in corn earworm to Cry proteins expressed by transgenic sweet corn. PLoS ONE, 11, e0169115. doi:10.1371/ journal.pone.0169115
- Farias, J. R., D. A. Andow, R. J Horikoshi, D. Bernardi, R. da S Ribeiro, A RB do Nascimento, A. C dos Santos, & C. Omoto. (2016). Frequency of Cry1F resistance alleles in Spodoptera frugiperda (Lepidoptera: Noctuidae) in Brazil. Pest Management Science 72, 2295–2302.
- F.A.O. United Nations Food and Agricultural Organization. Agricultura sostenible.
- Georghiou, G. P., & C. E. Taylor. (1977). Operational influences in the operation of insecticide resistance. Journal of Economic Entomology 70, 653-658.
- Gilbert, N. (2013). A hard look at 3 myths about genetically modified crops. Scientific American,
- Gore, J., B. R. Leonard, & R. H. Jones. (2003). Influence of agronomic hosts on the susceptibility of Helicoverpa zea (Boddie) (Lepidoptera: Noctuidae) to genetically engineered and nonengineered cottons. Environmental Entomology, 103-110.
- Gould, F., A. Anderson, A. Jones, D. Sumerford, D. G. Heckel, J. Lopez, S. Micinski, R. Leonard, & M. Laster. (1997). Initial frequency of alleles for resistance to Bacillus thuringiensis toxins in field populations of Heliothis virescens. Proceedings of the National Academies of Sciences, USA, 94, 3519-3523.
- Huang, F. (2006). Detection and monitoring of insect resistance to transgenic Bt crops. Insect Science, 13, 73-84.
- Huang, F., B. R. Leonard, S. H. Moore, D. R. Cook, J. Baldwin, K. V. Tindall, & D. R. Lee. (2008). Allele frequency of resistance to Bacillus thuringiensis Cry1Ab corn in Louisiana populations of sugarcane borer (Lepidoptera: Crambidae). Journal of Economic Entomology, 101, 492-498.
- Ioriatti, C., M. Tasin, P. J. Charmillot, M. Reyes, & B. Sauphanor. (2007). Early detection of resistance to tebufenozide in field populations of Cydia pomonella L.: methods and mechanisms. Journal of Applied Entomology, 131, 453–459.
- Jackson, R. E., F. Gould, J. R. Bradley, & J. W. Van duyn. (2006). Genetic variation for resistance to Bacillus thuringiensis toxins in Helicoverpa zea (Lepidoptera: Noctuidae) in Eastern North Carolina. Journal of Economic Entomology, 99: 1790-1797.
- Kriticos, D. J., N. Ota, W. D. Hutchison, J. Beddow, T. Walsh, W. Tek, D. M. Borchert, S. V. Paula- Moreas, C. Czepak, & M. P. Zalucki. (2015). The potential distribution of invading Helicoverpa armigera in North America: Is it just a matter of time? PLoS ONE 10, e0119618. doi:10.1371/journal.pone.0119618
- Liang, G.-M., K.-M. Wu, H.-K. Yu, K.-K. Li, X. Feng, and Y.-Y. Guo. (2008). Changes of inheritance mode and fitness in Helicoverpa armigera (Hübner) (Lepidoptera: Noctuidae) along with its resistance evolution to Cry1Ac toxin. Journal of Invertebrate Pathology, 97, 142–149.
- McDougall, P. (2011). The cost and time involved in the discovery, development and authorisation of a new plant biotechnology derived trait.
- McDougall, P. (2016). The cost of new agrochemical product discovery, development and registration in 1995, 2000, 2005-8 and 2010 to 2014.
- Oerke, E. C. (2006). Crop losses to pests. Journal of Agricultural Science, 144, 31–43. Pimentel, D., H. Acquay, M. Biltonen, P. Rice, M. Silva, J. Nelson, V. Lipner, S. Giordano, A. Horowitz & M. D'Amore. (1992). Environmental and economic costs of pesticide use BioScience, 42, 750-760.
- Robertson, J. L., R. M. Russell, H. K. Preisler, & N. E. Savin. (2007). Bioassays with Arthropods, second edition. CRC Press, Boca Raton, FL.
- Roush, R. T., & G. L. Miller. (1986). Consideration for design of insecticide resistance monitoring programs. Journal of Economic Entomology, 78, 293-298.
- Scheffler, J. A., G. B. Romano, & C. A. Blanco. (2012). Evaluating host plant resistance in cotton (Gossypium hirsutum L.) with varying gland densities to tobacco budworm (Heliothis virescens F.) and bollworm (Helicoverpa zea Boddie) in the field and laboratory. Agricultural Sciences, 3, 14- 23.
- Siegfried, B. D., T. Spencer, & J. Nearman. (2000). Baseline susceptibility of the corn earworm (Lepidoptera: Noctuidae) to the Cry1Ab toxin from Bacillus thuringiensis. Journal of Economic Entomology, 93, 1265-1268.
- Siegfried, B. D., T. T. Vaughn, & T. Spencer. (2005). Baseline susceptibility of Western corn rootworm (Coleoptera: Crysomelidae) to Cry3Bb1 Bacillus thuringiensis toxin. Journal of Economic Entomology, 98, 1320-1324.
- Siegfried, B. D., T. Spencer, A. L. Crespo, N. P. Storer, G. P. Head, E. D. Owens, & D. Guyer. (2007). Ten years of Bt resistance monitoring in the European corn borer: What we know, what we don’t know, and what we can do better. American Entomologist, Winter 2007, 208-214.
- Soberón, M., A. Bravo, & C. A. Blanco. (2017). Strategies to reduce insecticide use in agriculture production. The Food Science Reference Module, Elsevier, en prensa.
- Tabashnik, B. E., A. J. Gassmann, D. W. Crowder & Y. Carrière. (2008). Insect resistance to Bt crops: evidence versus theory. Nature Biotechnology, 26, 199-202.
- Tarango, S. H. (2014). Manejo Integrado de Plagas en Nogal Pecanero. SAGARPA. ISBN 978- 607-37-0289-8.
- Terán-Vargas, A. P., J. C. Rodriguez, C. A. Blanco, J. L. Martinez-Carrillo, J. Cibrian-Tovar, H. Sanchez-Arroyo, L. A. Rodríguez-del-Bosque and D. Stanley. 2005. Bollgard cotton and resistance of the tobacco budworm (Lepidoptera: Noctuidae) to conventional insecticides in southern Tamaulipas, Mexico. Journal of Economic Entomology, 98, 2203-2209.
- Whalon, M. E., D. Mota-Sanchez, and R. M. Hollingworth. (2008). Global Pesticide Resistance in Arthropods. CABI, Cambridge, MA.
Contenido del evento:
Temas relacionados:
Autores:
Referentes que Recomendaron :
Carlos C. De La Hoz C.Recomendar
Comentar
Compartir
Instituto Nacional de Tecnología Agropecuaria - INTA
10 de julio de 2018
excelente trabajo. Muy interesante
Recomendar
Responder
Buck Semillas
10 de julio de 2018
MUY INTERESANTE EL ARTICULO. SE DEBE TOMAR CONCIENCIA EN EL USO ADECUADO DE PLAGUICIDAS.
EXCELENTE
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.



