Nodulación de plantas de soja
Uso de un protector Bacteriano sobre la nodulación de plantas de soja
Publicado: 16 de mayo de 2006
Por: Montero FA (Rizobacter Argentina SA) y Sagardoy MA (Dpto. de Agronomía, Univ. Nac. del Sur)
Debe ser considerado el mejoramiento de la compatibilidad entre los productos químicos y el inoculante que se aplican a la semilla de soja. El objetivo de este ensayo fue evaluar el efecto que tiene el uso de un protector bacteriano, en la práctica de inoculación, sobre la nodulación de plantas de soja desarrolladas en cámara de crecimiento, cuyas semillas fueron tratadas con inoculante líquido y productos químicos.
Se evaluaron tres insecticidas (teflutrina 19%, imidacloprid 60% y clorpirifos 48%), un fungicida (thiram 10%+carbendazim 10%) y un fertilizante de micronutrientes (Mo 13%+Co 1,3%). La presencia del protector bacteriano incrementó significativamente (p< 0,05) la masa seca de nódulos en los tratamientos con insecticidas, y el número de nódulos en el tratamiento con micronutrientes. Los resultados mostraron la tendencia positiva del protector bacteriano sobre la nodulación de soja tratada con inoculante líquido y productos químicos de distinta composición y objetivos diferentes.
Se evaluaron tres insecticidas (teflutrina 19%, imidacloprid 60% y clorpirifos 48%), un fungicida (thiram 10%+carbendazim 10%) y un fertilizante de micronutrientes (Mo 13%+Co 1,3%). La presencia del protector bacteriano incrementó significativamente (p< 0,05) la masa seca de nódulos en los tratamientos con insecticidas, y el número de nódulos en el tratamiento con micronutrientes. Los resultados mostraron la tendencia positiva del protector bacteriano sobre la nodulación de soja tratada con inoculante líquido y productos químicos de distinta composición y objetivos diferentes.
PALABRAS CLAVE: Bradyrhizobium japonicum, nodulación, soja, protector bacteriano, insecticidas, fungicida, micronutrientes.
INTRODUCCION
La semilla de soja [Glycine max (L.) Merr.] frecuentemente se trata con productos de aplicación directa tales como insecticidas o fungicidas para prevenir daños por plagas o enfermedades, y en ciertos casos fertilizantes a base de micronutrientes para proporcionar elementos minerales en suelos deficientes. Asimismo, la aplicación de inoculantes formulados con Bradyrhizobium japonicum es una práctica común realizada para asegurar una efectiva nodulación y subsiguiente fijación de N2. En ciertos casos, entre otros factores, existe incompatibilidad entre el producto químico y el inoculante, lo cual se traduce en una reducción en la nodulación de la leguminosa (Marenco et al. 1993; Kyei-Boahen et al. 2001). En consecuencia, para los sistemas agrícolas actuales fuertemente basados en el cultivo de soja, debe ser considerado el mejoramiento de la compatibilidad entre el inoculante y los productos químicos aplicados a la semilla de soja. Después de la inoculación se ha observado que, la mortalidad de B. japonicum sobre la semilla de soja es muy alta, sobreviviendo a las 24 h menos del 10% de las bacterias incorporadas con la inoculación (Streeter 2003). Un protector bacteriano de aplicación conjunta con el inoculante es un agente de protección del microsimbionte ante condiciones adversas tales como la desecación celular (Curley, Burton 1975) y el efecto tóxico de productos químicos que están presentes sobre la semilla y que interactúan con el inoculante (Thompson 1960). El objetivo de este ensayo fue evaluar el efecto que tiene el uso de un protector bacteriano, en la práctica de inoculación, sobre la nodulación de plantas de soja cuyas semillas fueron tratadas con un inoculante líquido y distintas alternativas de productos químicos (tres insecticidas, un fungicida y un fertilizante mineral).
MATERIALES Y METODOS
Los tratamientos de este estudio fueron evaluados en dos Experimentos y se detallan en las Tablas 1 y 2.




Los inoculantes usados eran líquidos y pertenecían a partidas comerciales de RIZO-LIQ y RIZO-PAC los cuales contenían 1010 ufc/mL y fueron utilizados en los Experimentos 1 y 2, respectivamente. El protector bacteriano fue PREMAX y el fungicida RITIRAM CARB (thiram 10% m/v + carbendazim 10% m/v). Como fertilizante de micronutrientes se utilizó RIZO-MICRO (Mo 13% m/m + Co 1,3% m/m).
Todos estos productos pertenecen a Rizobacter Argentina SA, mientras que las formulaciones comerciales de insecticidas usadas corresponden a otras empresas y se expresaron en función de sus principios activos.
Cada tratamiento se aplicó a 500 g de semilla, usando las dosis indicadas para sus productos comerciales:
Experimento 1: teflutrina 19,5%: 0,5 mL; imidacloprid 60%: 0,3 mL; clorpirifos 48 %: 0,75 mL. El procedimiento de inoculación posterior al tratamiento con insecticidas consistió en la aplicación de 3,7 mL de una mezcla de 25 g de PREMAX + 25 mL de agua + 25 mL de RIZO-LIQ, para el caso del uso del protector, y de 1,35 mL de RIZO-LIQ para el caso de la aplicación de inoculante sin protector.
Experimento 2: RIZO-PAC: 0,42 mL; RIZO-MICRO: 1,5 mL; RITIRAM CARB: 3,9 mL; PREMAX: 1,25 g; agua: 1,9 mL (componente usado junto a PREMAX). En el caso de las mezclas de componentes, éstas se prepararon para 1,6 kg de semilla y seguidamente se realizó el tratamiento con la alícuota correspondiente.
La semilla de soja pertenecía a la variedad Don Mario 4800 RR. Los insecticidas (Experimento 1) se aplicaron mediante el método secuencial, es decir en forma previa (1 h) al tratamiento con inoculante. El fungicida y el fertilizante a base de micronutrientes (Experimento 2) se aplicaron mediante el método simultáneo, es decir todos los componentes de cada tratamiento de inoculación se mezclaron y seguidamente se trató la semilla. Después de 45 min de realizada la inoculación se procedió a la siembra en soporte de vermiculita estéril contenido en vasos de 250 mL. Las plantas desarrollaron bajo condiciones controladas de temperatura (25-30ºC), humedad de soporte (próximo a CC) y aire (60-70 % HR), y luz (5000 lux); el riego se realizó en forma alternada con agua destilada estéril y solución de Jensen sin N. Simultáneamente, se realizó un control sin tratar para determinar una posible contaminación con inóculo. A los 24 días desde la siembra se procesaron las plantas y se realizó el lavado de raíces y determinación de los parámetros de nodulación. La masa seca de nódulos fue determinada después de 48 h de secado en estufa a 65ºC.
Para cada experimento se usó un diseño Completamente Aleatorizado, con 5 repeticiones. El análisis estadístico se realizó con el programa InfoStat/Profesional versión 2004p.1 (InfoStat 2003); las comparaciones de medias fueron determinadas con la prueba LSD al 5%. El control sin tratamientos no se incluyó en estos análisis debido a su varianza poblacional significativamente diferente a la de los tratamientos inoculados.
Todos estos productos pertenecen a Rizobacter Argentina SA, mientras que las formulaciones comerciales de insecticidas usadas corresponden a otras empresas y se expresaron en función de sus principios activos.
Cada tratamiento se aplicó a 500 g de semilla, usando las dosis indicadas para sus productos comerciales:
Experimento 1: teflutrina 19,5%: 0,5 mL; imidacloprid 60%: 0,3 mL; clorpirifos 48 %: 0,75 mL. El procedimiento de inoculación posterior al tratamiento con insecticidas consistió en la aplicación de 3,7 mL de una mezcla de 25 g de PREMAX + 25 mL de agua + 25 mL de RIZO-LIQ, para el caso del uso del protector, y de 1,35 mL de RIZO-LIQ para el caso de la aplicación de inoculante sin protector.
Experimento 2: RIZO-PAC: 0,42 mL; RIZO-MICRO: 1,5 mL; RITIRAM CARB: 3,9 mL; PREMAX: 1,25 g; agua: 1,9 mL (componente usado junto a PREMAX). En el caso de las mezclas de componentes, éstas se prepararon para 1,6 kg de semilla y seguidamente se realizó el tratamiento con la alícuota correspondiente.
La semilla de soja pertenecía a la variedad Don Mario 4800 RR. Los insecticidas (Experimento 1) se aplicaron mediante el método secuencial, es decir en forma previa (1 h) al tratamiento con inoculante. El fungicida y el fertilizante a base de micronutrientes (Experimento 2) se aplicaron mediante el método simultáneo, es decir todos los componentes de cada tratamiento de inoculación se mezclaron y seguidamente se trató la semilla. Después de 45 min de realizada la inoculación se procedió a la siembra en soporte de vermiculita estéril contenido en vasos de 250 mL. Las plantas desarrollaron bajo condiciones controladas de temperatura (25-30ºC), humedad de soporte (próximo a CC) y aire (60-70 % HR), y luz (5000 lux); el riego se realizó en forma alternada con agua destilada estéril y solución de Jensen sin N. Simultáneamente, se realizó un control sin tratar para determinar una posible contaminación con inóculo. A los 24 días desde la siembra se procesaron las plantas y se realizó el lavado de raíces y determinación de los parámetros de nodulación. La masa seca de nódulos fue determinada después de 48 h de secado en estufa a 65ºC.
Para cada experimento se usó un diseño Completamente Aleatorizado, con 5 repeticiones. El análisis estadístico se realizó con el programa InfoStat/Profesional versión 2004p.1 (InfoStat 2003); las comparaciones de medias fueron determinadas con la prueba LSD al 5%. El control sin tratamientos no se incluyó en estos análisis debido a su varianza poblacional significativamente diferente a la de los tratamientos inoculados.
RESULTADOS Y DISCUSION
Experimento 1
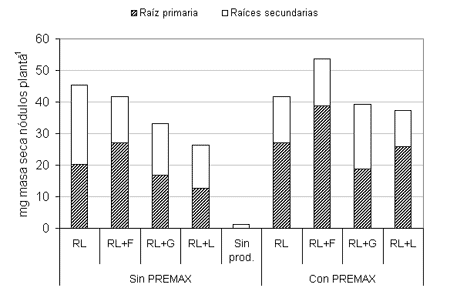
Las Figuras 1 y 2 muestran el número y masa seca de nódulos por planta, respectivamente, de soja tratada con inoculante, protector e insecticidas.
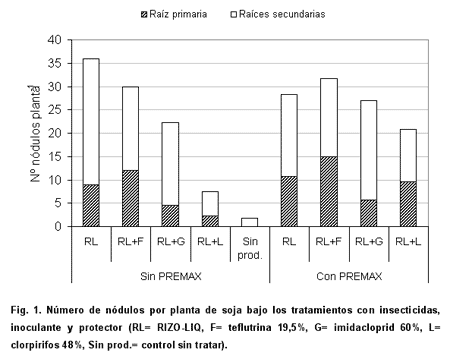

El número y la masa seca de nódulos totales por planta para los tratamientos inoculados oscilaron entre 7 y 36 nódulos y entre 26 y 54 mg, respectivamente. Tanto para el número como para la masa seca de nódulos, no fue detectada una interacción significativa Inoculación*PREMAX (p> 0,10 y 0,20, respectivamente). Esto indica que la adición de protector tuvo el mismo grado de influencia sobre todos los tratamientos inoculados.
En promedio, la presencia de PREMAX incrementó, aunque en forma no significativa, un 12,6 % el número de nódulos y, con significación estadística, un 17,4 % la masa seca nodular (Tabla 3). Una mayor nodulación puede ser el resultado de la existencia de un mayor número de B. japonicum por semilla en el momento de la infección radicular. Es probable que el protector bacteriano usado haya atenuado la desecación, aunque su modo de acción no se conoce exactamente (Deaker et al. 2002).
En promedio, la presencia de PREMAX incrementó, aunque en forma no significativa, un 12,6 % el número de nódulos y, con significación estadística, un 17,4 % la masa seca nodular (Tabla 3). Una mayor nodulación puede ser el resultado de la existencia de un mayor número de B. japonicum por semilla en el momento de la infección radicular. Es probable que el protector bacteriano usado haya atenuado la desecación, aunque su modo de acción no se conoce exactamente (Deaker et al. 2002).

Fig. 2. Masa seca de nódulos por planta de soja bajo los tratamientos con insecticidas, inoculante y protector (RL= RIZO-LIQ, F= teflutrina 19,5%, G= imidacloprid 60%, L= clorpirifos 48%, Sin prod.= control sin tratar).

Tabla 3. Significación estadística del número y la masa seca de nódulos por planta en promedio para los distintos tratamientos inoculados [Distintas letras dentro de una columna indican diferencias significativas (p< 0,05, LSD). Cada valor es la media de 17-19 réplicas].
Analizando el efecto de los insecticidas, no hubo diferencias significativas del número de nódulos por planta para los tratamientos RL, RL+F y RL+G; en cambio, RL+L mostró valores significativamente inferiores. En cuanto a la masa seca nodular, se destacaron los tratamientos RL+F y RL (en promedio para los niveles de PREMAX, 47,7 y 43,6 mg/planta, respectivamente), los cuales se diferenciaron significativamente de RL+L (31,7 mg/planta) (Tabla 4). Se ha reportado que la aplicación de teflutrina al suelo no tuvo efectos sobre la mayoría de variables microbianas evaluadas (Devare et al. 2004). Por otra parte, la baja compatibilidad con clorpirifos observada en este estudio no coincidió con lo determinado por Revellin et al. (1992) quienes concluyeron que la nodulación no fue afectada con este insecticida.

Tabla 4. Significación estadística del número y masa seca de nódulos por planta en promedio para los tratamientos con y sin PREMAX [Distintas letras dentro de una columna indican diferencias significativas (p< 0,05, LSD). Cada valor es la media de 9 réplicas. 1RL= RIZO-LIQ, F= teflutrina 19,5%, G= imdacloprid 60%, L= clorpirifos 48%].
Experimento 2
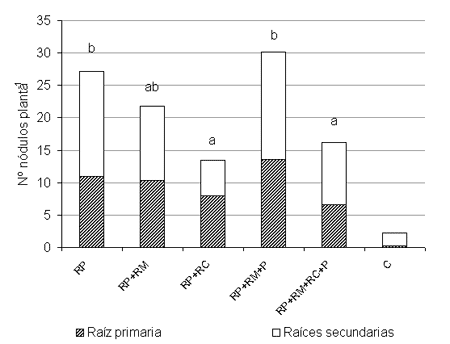
Las Figuras 3 y 4 muestran el número y masa seca de nódulos por planta, respectivamente, de soja tratada con fungicida y micronutrientes.
El número de nódulos por planta para los tratamientos inoculados osciló entre 13 y 30. Los tratamientos RP y RP+RM+P superaron significativamente a RP+RC y RP+RM+RC+P. RP+RM no fue estadísticamente diferente al resto de los tratamientos inoculados. Estos resultados indicaron que a partir de RP, la inclusión de RM tiende a decrecer el número nodular aunque no significativamente; si RM va acompañado de P se revierte ese resultado y se logra un comportamiento similar a RP solo. Este resultado demostró nuevamente el efecto protector de PREMAX ante la presencia de un producto químico como en este caso una formulación de micronutrientes.
En cambio, el agregado de RC a los tratamientos RP o RP+RM+P disminuyó significativamente esta variable. El principio activo thiram ha sido reportado como perjudicial en algunos estudios y menos agresivo en otros con respecto a la supervivencia de B. japonicum y la nodulación de soja, y los resultados pueden diferir si el thiram está asociado a otros principios activos (Revellin et al. 1993) como es el caso de este estudio donde la formulación de RC también posee carbendazim. Aunque el thiram puede producir una fuerte inhibición de la nodulación en la zona del cuello de la planta (Andrés et al. 1997), en este ensayo la presencia de RC no produjo cambios marcados en la distribución de nódulos con respecto a los otros tratamientos sin RC.
El número de nódulos por planta para los tratamientos inoculados osciló entre 13 y 30. Los tratamientos RP y RP+RM+P superaron significativamente a RP+RC y RP+RM+RC+P. RP+RM no fue estadísticamente diferente al resto de los tratamientos inoculados. Estos resultados indicaron que a partir de RP, la inclusión de RM tiende a decrecer el número nodular aunque no significativamente; si RM va acompañado de P se revierte ese resultado y se logra un comportamiento similar a RP solo. Este resultado demostró nuevamente el efecto protector de PREMAX ante la presencia de un producto químico como en este caso una formulación de micronutrientes.
En cambio, el agregado de RC a los tratamientos RP o RP+RM+P disminuyó significativamente esta variable. El principio activo thiram ha sido reportado como perjudicial en algunos estudios y menos agresivo en otros con respecto a la supervivencia de B. japonicum y la nodulación de soja, y los resultados pueden diferir si el thiram está asociado a otros principios activos (Revellin et al. 1993) como es el caso de este estudio donde la formulación de RC también posee carbendazim. Aunque el thiram puede producir una fuerte inhibición de la nodulación en la zona del cuello de la planta (Andrés et al. 1997), en este ensayo la presencia de RC no produjo cambios marcados en la distribución de nódulos con respecto a los otros tratamientos sin RC.

Fig. 3. Número de nódulos por planta de soja bajo los tratamientos con micronutrientes, fungicida, inoculante y protector [RP= RIZO-PAC, RM= RIZO-MICRO, RC= RITIRAM CARB, P= PREMAX, C= Control sin tratar. Distintas letras indican diferencias significativas del número total de nódulos por planta (p< 0,05, LSD); C no se incluyó en el ANOVA].
En cuanto a la masa seca de nódulos no fueron detectadas diferencias significativas entre los tratamientos inoculados, aunque de forma similar al número de nódulos, existieron tendencias de mayor respuesta con los tratamientos RP y RP+RM+P.


Fig. 4. Masa seca de nódulos por planta de soja bajo los tratamientos con micronutrientes, fungicida, inoculante y protector [RP= RIZO-PAC, RM= RIZO-MICRO, RC= RITIRAM CARB, P= PREMAX, C= Control sin tratar. Distintas letras indican diferencias significativas del número total de nódulos por planta (p< 0,05, LSD); C no se incluyó en el ANOVA].
Bajo las condiciones de este ensayo, se observó una alta compatibilidad del inoculante RIZO-LIQ con la formulación de insecticida teflutrina 19,5%, y una media y baja compatibilidad con imidacloprid 60% y clorpirifos 48%, respectivamente. La presencia del protector PREMAX incrementó significativamente la masa seca de nódulos.
Asimismo, se observó una alta compatibilidad del inoculante RIZO-PAC con la formulación de micronutrientes RIZO-MICRO también en presencia del protector PREMAX; la respuesta de nodulación decreció cuando la semilla fue tratada con los productos anteriores más el agregado del fungicida RITIRAM CARB.
En conclusión, los datos muestran la tendencia positiva de PREMAX sobre la nodulación de soja, cuando es incorporado a la semilla inoculada junto con productos químicos de distinta composición y con objetivos diferentes. El mecanismo de acción de PREMAX, donde disminuye el efecto antibacteriano de esos productos, es motivo de nuevos estudios.
Asimismo, se observó una alta compatibilidad del inoculante RIZO-PAC con la formulación de micronutrientes RIZO-MICRO también en presencia del protector PREMAX; la respuesta de nodulación decreció cuando la semilla fue tratada con los productos anteriores más el agregado del fungicida RITIRAM CARB.
En conclusión, los datos muestran la tendencia positiva de PREMAX sobre la nodulación de soja, cuando es incorporado a la semilla inoculada junto con productos químicos de distinta composición y con objetivos diferentes. El mecanismo de acción de PREMAX, donde disminuye el efecto antibacteriano de esos productos, es motivo de nuevos estudios.
BIBLIOGRAFIA
Andrés JA, Correa NS, Rosas SB. 1997. Survival and symbiotic properties of Bradyrhizobium japonicum in the presence of thiram: isolation of fungicide resistant strains. Biology and Fertility of Soils 26:141-145
Curley T, Burton JC. 1975. Compatibility of Rhizobium japonicum with chemical seed protectants. Agronomy Journal 67:807-808
Deaker RJ, Roughley RJ, Kennedy IR. 2002. A review of developments in legume-seed inoculation. 13th Australian Nitrogen Fixation Conference, Adelaide
Devare MH, Jones CM, Thies JE. 2004. Effect of Cry3Bb transgenic corn and tefluthrin on the soil microbial community. Journal of Environmental Quality 33:837-843
InfoStat. 2003. InfoStat version 1.5. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina, 232 p
Kyei-Boahen S, Slinkard AE, Walley FL. 2001. Rhizobial survival and nodulation of chickpea as influenced by fungicide seed treatment. Canadian Journal of Microbiology 47:585-589
Marenco RA, Fernandes Lopes N, Mosquim PR. 1993. Nodulation and nitrogen fixation in soybeans treated with herbicides. Revista Brasileira de Fisiologia Vegetal 5:121-126
Revellin C, Canson B, Catroux G. 1992. Effect of a mixture of clorpyrifos and lindane on the symbiosis of Bradyrhizobium japonicum and soybean (Glycine max (L.) Merril). Pesticide Science 36:69-74
Revellin C, Leterme P, Catroux G. 1993. Effect of some fungicide seed treatments on the survival of Bradyrhizobium japonicum and on the nodulation and yield of soybean [Glycine max. (L) Merr.]. Biology and Fertility of Soils 16:211-214
Streeter JG. 2003. Effect of trehalose on survival of Bradyrhizobium japonicum during desiccation. Journal of Applied Microbiology 95:481-491
Thompson JA. 1960. Inhibition of nodule bacteria by an antibiotic from legume seed coats. Nature London 187:619-620
Curley T, Burton JC. 1975. Compatibility of Rhizobium japonicum with chemical seed protectants. Agronomy Journal 67:807-808
Deaker RJ, Roughley RJ, Kennedy IR. 2002. A review of developments in legume-seed inoculation. 13th Australian Nitrogen Fixation Conference, Adelaide
Devare MH, Jones CM, Thies JE. 2004. Effect of Cry3Bb transgenic corn and tefluthrin on the soil microbial community. Journal of Environmental Quality 33:837-843
InfoStat. 2003. InfoStat version 1.5. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina, 232 p
Kyei-Boahen S, Slinkard AE, Walley FL. 2001. Rhizobial survival and nodulation of chickpea as influenced by fungicide seed treatment. Canadian Journal of Microbiology 47:585-589
Marenco RA, Fernandes Lopes N, Mosquim PR. 1993. Nodulation and nitrogen fixation in soybeans treated with herbicides. Revista Brasileira de Fisiologia Vegetal 5:121-126
Revellin C, Canson B, Catroux G. 1992. Effect of a mixture of clorpyrifos and lindane on the symbiosis of Bradyrhizobium japonicum and soybean (Glycine max (L.) Merril). Pesticide Science 36:69-74
Revellin C, Leterme P, Catroux G. 1993. Effect of some fungicide seed treatments on the survival of Bradyrhizobium japonicum and on the nodulation and yield of soybean [Glycine max. (L) Merr.]. Biology and Fertility of Soils 16:211-214
Streeter JG. 2003. Effect of trehalose on survival of Bradyrhizobium japonicum during desiccation. Journal of Applied Microbiology 95:481-491
Thompson JA. 1960. Inhibition of nodule bacteria by an antibiotic from legume seed coats. Nature London 187:619-620
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicaciónRizobacter SA
21 de abril de 2014
Estimado Sr. Guillermo Arango Sereno, le comento que el protector Premax fue diseñado especialmente para actuar con bacterias rizobios, en especial Bradyrhizobium, aunque se ha demostrado que también posee efectos positivos en otros grupos de bacterias y ciertos hongos. Pero no se ha estudiado con micorrizas por lo tanto no le puedo expresar resultados propios de su uso con ese tipo de hongos.
Muchas gracias por consultar, saludos cordiales.

19 de abril de 2014
Estimados doctores
Montero FA (Rizobacter Argentina SA) y Sagardoy MA (Dpto. de Agronomía, Univ. Nac. del Sur)
Felicitaciones por tan importante aporte.
Quisiera saber si existe estudio con el protector PREMAX, con la Bacteria y Los hongos micorrizogenos o sea Micorrizas vesiculo arbuscular MVA.
Ya que existen evidencias de mejorar la capacidad de la asociación planta -bacteria cuando hay colonización con MVA.
CIAT : Sieverding E. y Bradley R. y otros ( en los 80).
GUILLERMO ARANGO S. BIOLOGO COLOMBIANO
Rizobacter SA
21 de marzo de 2014
Hola Ivanna, le comento que en inoculantes de garbanzo se puede utilizar este tipo de protector bacteriano con muy buenos resultados. Los efectos de la protección se observan de forma similar al caso de inoculantes de soja. Se aumenta la supervivencia bacteriana sobre semilla y la tolerancia al contacto con productos químicos que se aplican conjuntamente durante el proceso de inoculación. El mecanismo de acción se produce a nivel de envoltura celular, protegiendo la célula de los factores adversos del ambiente. Saludos cordiales.
21 de marzo de 2014
Exelente su trabajo Sr. Fabio. Yo soy estudiante de Biotecnologia y estoy trabajando con garbanzo de forma similar. Tienen antecedentes en este cultivo, en relacion al uso de protectores bacterianos junto con inoculantes?. Muchas gracias por su aporte.

9 de junio de 2008
Puedes pedir asesoria con algún agente del Programa Mundial de Alimentos (PMA) o el mismo distribuidor de la semilla de Soja.
La bacteria no es una micorriza si no una bacteria nitrificante noduladora de la raíz de las leguminosas. esta bacteria se encuentra en su estado natural en el suelo pero da excelentes resultados hacer esta inoculación, por que ademas te queda un terreno apto para sembrar soya en posteriores ciclos de cultivo.
8 de junio de 2008
Hola a todos los foristas:
Una pregunta estas bacterias son la mismas “E.M” o son “MICORRISAS” y si no lo son donde las puedo conseguir en Colombia o como es su propagación.
Gracias por su atención y respuesta.
Centro Regional de Investigaciones Basicas y Aplicadas de Bahia Blanca CRIBA
12 de enero de 2007
Como coautor del trabajo me gustaría conocer la opinión de colegas, técnicos y productores que tengan experiencia sobre el tema tratado en el artículo. Gracias.


