Introducción
El suelo es uno de los recursos naturales más indispensables para el ser humano y la biocenosis terrestre; su conformación articula aspectos químicos, físicos, y biológicos, los cuales interaccionan de manera natural, azarosa y gradual durante la edafogénesis; dicho proceso puede ser continuo o interrumpirse en el caso de suelos agrícolas alejados de un criterio de manejo sostenible (Decaens et al., 2003; Doran & Zeiss, 2000; Instituto Geográfico Agustín Codazzi, 1995; Elliott & Lynch, 1994; Lal, 1998; Matson et al., 1997).
La fase biológica del suelo, tal vez la más sensible y dinámica en lo referente a producción y conservación (Goede & Brussaard, 2002), incluye a los insectos y otros macroinvertebrados edáficos, multitud de pequeños invertebrados que incluye insectos y otros múltiples artrópodos, lombrices, etc., todos ellos organismos de gran protagonismo trófico y en gran parte responsables de la salud del recurso y de su potencial productivo (Brada Da Silva et al., 1994; Eltiti e Ipach, 1989; Schëu, 2002). Son muchos sus aportes en los procesos físicos del suelo al romper, transportar, mezclar y horadar el sustrato edáfico construyendo estructuras biogénicas (Hole, 1981; Villani et al., 1999). También interfieren en las dinámicas químicas de manera directa (por incorporación y redistribución de materiales orgánicos e inorgánicos (Ausmus, 1977; Vitousek & Sanford, 1986) o indirecta por efectos selectivos sobre plantas, animales, comunidades microbiales, foresis o transporte de propágulos, reducción de viabilidad, entre otros (Fitter et al., 1985; Reichle, 1977; Schëu, 2002).
Por lo anterior, existe un creciente interés por la fase biológica de los suelos ya que su estudio, además, ofrece alertas tempranas sobre la salubridad y funcionalidad del recurso (Anderson & Ingram, 2001; Ciau-Villanueva et al., 2003; Primavesi, 1979). Esta situación se hace especialmente notable en el caso de los otrora fértiles suelos del Valle del Cauca, destacados entre otras por su condición de molisoles -la oferta edáfica más escaza y deseable en los trópicos- los cuales llevan décadas inmersos en paquetes tecnológicos, aparentemente ajenos al concepto de sostenibilidad, lo cual se pone en evidencia, entre otras, con una tendencia perniciosa, de deterioro edáfico que ya tornó casi el 28% de sus tierras (85000 ha) en terrenos afectados por salinidad y mal drenaje (CVC, 2012), situación agroambiental que tiene gran incidencia en el futuro agroindustrial y socioeconómico del departamento, toda vez que la mayor parte de las mejores tierras están cautivas en un contexto de agricultura industrializada (azúcar, alcohol carburante), en franco detrimento de una producción más social, enfocada a una diversificada oferta de alimenticios.
Dada la abundante evidencia ecológica sobre su rol como parámetro biológico para estudiar la salubridad del recurso edáfico (Adis, 1976, 1977; Paoletti et al., 1991; Righi, 1995; Jiménez & Thomas, 2001; Lal, 1988; Lavelle, 1986; Instituto Geográfico Agustín Codazzi, 1995; Veloso-Silva, 2003; Benson & Harada, 1988; Bandeira & Harada, 1998; Decaens et al., 2006; Gómez, 1992; Oliveira et al., 2003) y la necesidad de enfocarse a planes de manejo sostenibles (CVC, 2012), esta investigación se planteó determinar la fluctuación de los atributos poblacionales (densidad y biomasa) de las comunidades de macroinvertebrados edafícolas en cuatro usos del terreno en las planicies aluviales del alto río Cauca en Cerrito, Valle en los hábitats caña convencional,caña manejo ecológico, potrero silvopastoril y bosque.
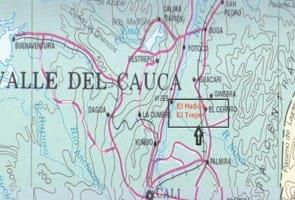
Área de estudio: La investigación se realizó en las fincas El Hatico y la Hacienda El Trejo (aproximadamente a 3° 27´ N y 76° 32´ O), ubicadas en el Municipio de El Cerrito, Valle del Cauca, Colombia (Fig. 1).
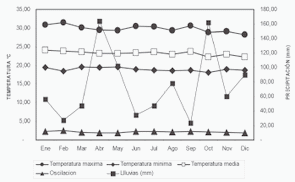
Esta región corresponde a la zona de vida bosque seco tropical, Bs-T, caracterizada por clima cálido, seco, con dos períodos lluviosos (abril-mayo y octubre-noviembre) intercalados con meses secos (enero a marzo y julio-agosto); la altitud varía entre 980-990 msnm, la precipitación oscila entre 800 y 1.050 mm al año, la temperatura media varía entre los 21,8 y 26,2 º C y la humedad relativa entre el 78,9 y 85,4%, por su ubicación, cerca de la porción central del valle geográfico, el brillo solar es intenso y la evapotranspiración ronda los 1600 mm/anuales (Fig. 2), creando un notable déficit de humedad (IGAC, 1988, 1995, 2003).
Suelos: El área de estudio se encuentra en la llanura aluvial de la cuenca alta del río Cauca, la cual presenta pendientes 0-1% (Sadeghian, 1998; Gómez & Romero, 2003; Fig. 3) y una gran evaporación, que opera como el principal proceso edafogénico, originando vertisoles, alcalinos (pH 7,5 a 9,1) con altos niveles de capacidad de intercambio catiónico y saturación de bases totales (calcio, carbonato de calcio, potasio y magnesio) situaciones que se observan matizadas por las complejidades derivadas de la dinámica del carbono, materia orgánica y la relación carbono/nitrógeno en los usos del suelo. Son suelos evolucionados con horizontes tipo A-B-C. El horizonte A, entre 44 y 75 cm, es de color negro, gris muy oscuro o pardo muy oscuro; el B de 25 a 86 cm formado por varios subhorizontes, entre ellos el cálcico, además presenta frecuentes concreciones de carbonatos; presentan textura franco arcillo limosa, arcillo limosa y arcillosa, de bloques angulares y subangulares; el horizonte C que llega hasta los 160 cm, con espesores que superan los 40 cm, es de color pardo amarillento, oliva o gris oliva y de texturas moderadamente finas.
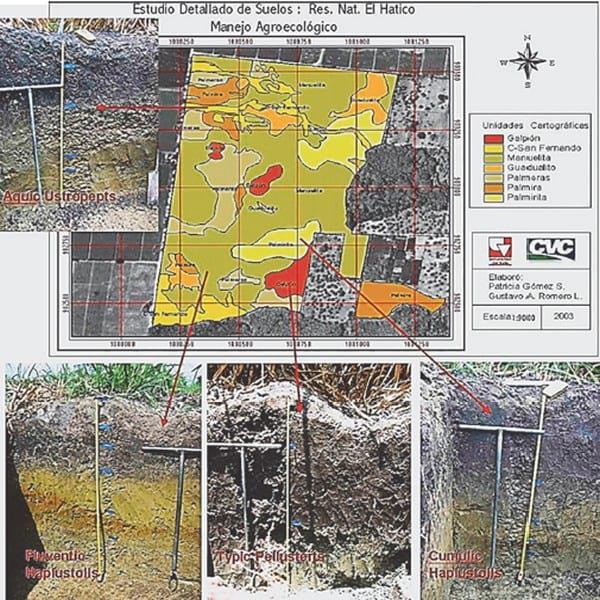
Fig. 3. Detalles e ilustración de algunos perfiles de los suelos de la finca ‘El Hatico’ (Fotografías y diseños tomados desde Gómez & Romero, 2003).
Desde el punto de vista físico se describen como suelos de textura franco arcillosa, formados por sedimentos aluviales, bien drenados, en los que el cuadro químico propicia condiciones histeréticas o pérdida de la estructura en punto de saturación; la densidad real es baja mientras que la aparente es alta; la permeabilidad varía de lenta a moderadamente lenta en profundidad y la retención de humedad es alta (IGAC, 1995; Molina-Castro et al., 2012).
Hábitats evaluados:
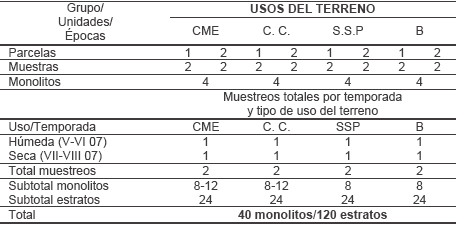
Esta investigación abordó los hábitats caña manejo ecológico, caña convencional, potrero silvopastoril y bosque (Tabla I y Anexo I)
Tabla I. Diseño y época de muestreo (abreviaturas: CME caña manejo ecológico, Abreviaturas: C.M.E.; caña manejo ecológico, C.C caña convencional, S.S.P sistema silvopastoril intensivo, B bosque.
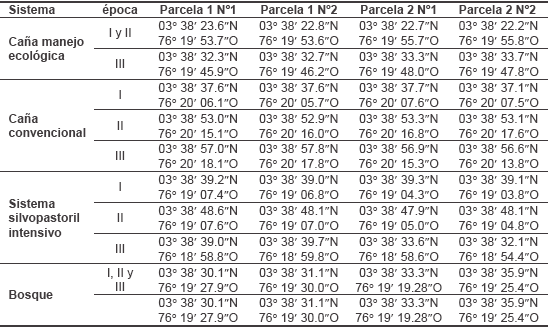
Anexo I. Coordenadas de las parcelas de muestreo para entomofauna edáfica y otros macroinvertebrados en el Cerrito, Valle, Colombia.
Hábitat Caña de manejo ecológico (CME), se podría resumir con el uso de semilla orgánica certificada, variedad CC 8592, con riego por gravedad en las dos calles libres de hojarasca (66% de la superficie del cultivo), abonos (mezcla de estiércol de bovino, ovino y equino), incorporación de abonos verdes en floración (soya, crotalaria, caupí), control combinado de malezas (prácticas manuales, mecánicas) y dos o tres ovinos de pelo por hectárea de cultivo (en callejones, acequias regadoras, recibidoras y drenajes). La cosecha se hace en verde, encalle 2:1 dejando 40 a 60 toneladas de biomasa fresca por hectárea de cultivo, cambiando de calle cada año (Molina-Castro et al., 2012), este hábitat se estudió en la finca “El Hatico”.
Hábitat Caña convencional (CC), se observó en el predio vecino, la ‘Hacienda El Trejo’, en una suerte sembrada con la variedad CC 8592, e igual fase fenológica de crecimiento; no usa semilla orgánica, aplica mecanización intensa para el manejo de suelo y la cosecha, usa insumos químicos para fertilizar, madurar el cultivo y controlar malezas, además, como práctica convencional, quema el follaje de la caña antes de la cosecha.
Hábitat Silvopastoril (SSP), se trata de un modelo pecuario multiestratificado, con el estrato arbóreo conformado por grandes árboles, adecuadamente podados para permitir el ingreso de luz, estrato arbustivo conformado por la Leucaena leucocephala, con densidades altas (8000 a 12000 plantas por hectárea y el estrato herbáceo conformado por pasto estrella (tres toneladas de estolones por hectárea) y guinea (6 a 7 kilos de semilla sexual); en este modelo se pastorean vacunos, rotando los potreros, usando al final búfalos para aprovechar el forraje rústico, dejado por los vacunos (Molina- Castro et al., 2012).
Hábitat Bosque, conformado por un singular fragmento de bosque seco tropical de la zona plana del plan aluvial del Río Cauca; ecológicamente, se definiría como un relicto forestal antiguo, de más de 200 años, intervenido con entresacas esporádicas, afectado por insularidad ecológica, pero que nunca perdió su condición forestal, razón por la cual ha sido ampliamente investigado en su biodiversidad (Cárdenas, 1998; Ramírez et al., 2006) y suelos (Sadeghian, 1998). Presenta un dosel de 25 a 35 metros de altura, conformado por una veintena de árboles de gran porte, entre ellos el caracolí (Anacardium excelsum), higuerón (Ficus isipida), palma real (Roystonea regia), ceiba (Ceiba pentandra), jigua negro o laurel amarillo (Nectandra sp.), etc., sobre los cuales se encuentran epífitas que cubren parcialmente los troncos de los árboles, como la bromeliácea Aechmea sp.,plantas trepadoras (Monstera adansonii, Dieffenbachia sp., Syngonium sp.) y lianas (Trichostigma octandra, Aristolochia cf. ringens); así mismo arbustivas y herbáceas (Heliconia platystachys, H. latispatha, Calathea altissima, y Carludovica palmata) (Pardo-Locarno, 2009).
Muestreo. Se basó en los criterios expuestos por la TSBF (Anderson & Ingram, 1993; Coleman & Crossley, 1995; FAO, 2001), que enfoca los atributos densidad y biomasa de los macroinvertebrados en medios tropicales (Lavelle et al. 1994; Swift & Bignell, 2001). El trabajo de campo acogió a la teoría del muestreo (Tabla I), con arreglo de parcelas y algunas réplicas (Wiens, 1989). En cada uno de los hábitats estudiados, se establecieron dos parcelas (aproximadamente 3.500 m2), seleccionadas como áreas representativas, separadas por aproximadamente 200 metros lineales; en cada una fueron seleccionados al azar puntos para la extracción de los monolitos para la colecta (Anexo I). En tal sentido la unidad de muestreo fue el monolito del suelo (25 x 25 x 30 cm de profundidad), dividido en cuatro estratos sucesivos: hojarasca, 0- 10 cm, 10-20 cm y 20-30 cm (Anderson & Ingram, 1993; Norma ISO 23611-1); esta metodología solo fue modificada uniendo al estrato hojarasca con el estrato cero a 10 cm (Pardo- Locarno et al., 2006).
Herramientas y desarrollos metodológicos. Dado que el estudio de organismos del suelo requiere mucho esfuerzo de trabajo para implementar la técnica del muestreo (Swift & Bignell, 2001; Jiménez & Thomas, 2001; Marín & Feijoo, 2003; Pardo-Locarno et al. 2006; Sevilla et al. 2002; Unigarro et al. 2005), durante estas investigación se diseñaron herramientas como molde para monolito (Fig. 4), molde de corte del estrato 20-30, otro molde para corte de los estratos 0-10 y 10-20 (Fig. 4), lo cual impactó positivamente la eficacia, en el manejo del tiempo y la precisión del muestreo (Pardo- Locarno, 2009); los estratos recolectados fueron almacenados en bolsas de plástico resistente, previamente codificadas en un costado según el orden de los hábitats, parcelas, muestras, estratos etc., de acuerdo a las siguientes abreviaturas y convenciones: P1: CME= parcela caña manejo ecológico, P2: PCC= parcela caña convencional, M1=muestra 1, P3: PSSP=Parcela silvopastoril, M2=muestra 2, P4: PB=Bosque, E1=temporada seca, P1=Parcela 1, E2=temporada de lluvias, E1: Estrato 1 0-10cm, E2: Estrato 2 10-20 cm, etc.

Fig. 4. Herramientas de trabajo desarrolladas. a) Todas las herramientas y materiales, detallando en A medida para cuadrante y B plástico para rodear el molde para molito; b): Molde para molito; c) Molde para corte de estratos de 0-10cm; y d) Molde para corte de estrato de 10-20 cm y 20-30 (Modificado desde Pardo-Locarno, 2009).
Manejo de los ejemplares. El uso de una pequeña bandeja de muestras con tapa y papel toalla hidratado, permitió recrear un ambiente de saturación que limitara o disminuyera la pérdida de líquidos en los ejemplares. La metodología de fijación de macroinvertebrados recomendada por Decaëns et al. (1994) de uso diferencial de soluciones de alcohol y formol, según cuerpo duro o blando, respectivamente, indica la corrección de los valores de biomasa así: 19% para lombrices, 9% hormigas, 11% escarabajos, 6% arañas y 13% para el resto de macroinvertebrados; para obviar ajustes y homogenizar el proceso de intercambio de humedad de las muestras, esta investigación empleó una solución general, conformada por 5 partes de formol, 5 de alcohol y 90 partes en volumen de agua, lo cual disminuye la pérdida de fluidos por la higroscopia de los preservantes y fijadores (Pardo-Locarno et al., 2006). En cada estrato se cuantificó la biomasa (g/m-2) y densidad (individuos m-2). El pesaje se realizó con una balanza Ohaus, con precisión de diezmilésima de gramo.
Identificación de taxones. Se consultó a: Borror & White (1970), Borror et al. (1992), Brues & Melander (1932), Costa Lima (1938), Coronado & Márquez (1986), Harde & Severa (1984), McGavin (2002), Meglistsch (1981), Nieto & Mier (1985), Ross (1982), Stehr (1987, 1991), Peterson (1977; 1979), Zahradnik & Chvala (1990), Zahradnik & Severa (1981). La biología y ecología, fueron consultadas en: Borror & White (1970), Grasse (1968; 1949), Meglistsch (1981), Peterson (1977; 1979), Ross (1982), Stehr (1987, 1991), Wigglesworth (1974), Zahradnik & Chvala (1990), Zahradnik & Severa (1981) y Morón (2004). Muestras entomológicas fueron depositados en la colección del museo de suelos Ciro molina Garcés de la Universidad Nacional sede Palmira y una pequeña muestra de los mismos fue depositada en la Colección Familia Pardo-Locarno CFPL-COL, así mismo una muestra de la mirmecofauna (hormigas) fue depositada en la colección de Insectos de la Facultad de Biología de la Universidad del Valle y otra en la CFPL-COL.
Análisis estadístico. Las características poblacionales de los macroinvertebrados (biomasa, densidad por parcelas y submuestras) se evaluaron y compararon estadísticamente, mediante análisis de varianza (ANOVA), complementados con post – Anovas (Zar, 1996; Statistica 98 Edition, Kernel Release 5.1M).
Resultados y discusión
Generalidades. Los grupos de macroinvertebrados colectados se mencionan a continuación, anotando como superíndice el hábito alimenticio consultado, el cual se menciona al final del párrafo: lombrices1 (Annelida: Oligochaeta: Terrícolas), caracoles2 y babosas2 (Mollusca: Gasteropoda: Pulmonados), ciempiés3 (Miriapoda: Chilopoda: Geophilimorpha, Scolopendromorpha), milpiés1 (Miriapoda: Diplopoda: Polydesmida, Spirobolidae y Polixenidae), cochinillas1 (Crustácea: Isopoda: Oniscoidea), arañas3 (Arácnida-Araneidos), seudoescorpiones3 (Arachanida-Scorpionida) e insectos de los grupos dipluros3 (Diplura: Japygidae), cucarrones1,2,3, escarabajos2 y chisas1,2 (Coleoptera), hormigas3 (Hymenoptera: Formicidae), chinches2 (Hemiptera: Heteroptera), cucarachas1 (Dictyoptera: Blattidae), adultos y cocones de avispas4 parásitas (Hymenopera: Scoliidae), tijeretas3 (Dermaptera: Forficulidae, Labiduridae), larvas de moscas1 (Diptera), larvas2 y pupas de polillas (Lepidoptera: Noctuidae), ninfas de grillos1,2 comunes (Orthoptera: Grillidae), termitas1 (Isoptera posible Kalotermitidae) y trips2 (Thysanoptera). La mayoría de los grupos se comportó como saprófagos1, en menor proporción se observó a fitófagos2, depredadores3 y parásitos4, proporción trófica que coincide con lo planteado por otros autores (Lavelle, 1997; Neher, 1999).
En total se colectaron 14611 ejemplares en 40 monolitos (0,75 m3). El análisis global de datos no extrapolados (36 monolitos, equivalente a un volumen de 0,675 m3), utilizados para comparación estadística, tuvo una base de 13.907 ejemplares (Tabla II). Dicha base, evidenció mayor densidad de ejemplares durante la época seca (10385); en cuanto a usos las mayores cifras de densidad se observaron en caña convencional (4740) seguido de bosque (4295), caña ecológica (4195) y sistema silvopastoril (667); el estrato 0-10 cm presentó la mayor abundancia de organismos (7321), situación que coincide con estudios realizados en otros suelos vertisoles en la cercana Palmira (Marín & Feijoo, 2003), tendencia general que se asemeja a lo observado en suelos montañosos del norte del Cauca (Sevilla et al., 2002) y de los cerros tutelares de Cali (Pardo-Locarno et al., 2006); los macroinvertebrados más abundantes en los cuatro usos del suelo fueron hormigas (11447), diplópodos (782), lombrices (698) y coleópteros (172) (Tabla II).
Tabla II. Densidad y biomasa de organismos edáficos en 36 monolitos (0,675 m3) de cuatro usos del suelo en El Cerrito, Valle durante las temporadas húmeda y seca(Abreviaturas: CME caña manejo ecológico, CC. caña convencional, SSP sistema silvopastoril, B bosque).
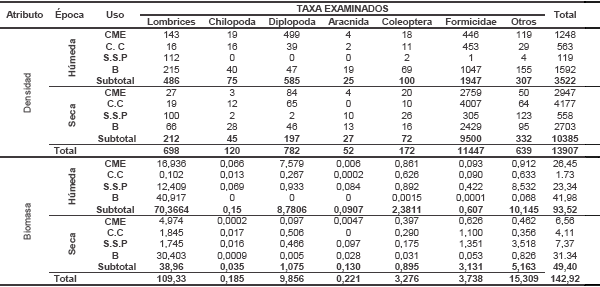
Densidad. La base de 13907 ejemplares; presentó variaciones significativas en la abundancia de macroinvertebrados entre las dos épocas (F: 10,466; P: 0,001), siendo mayor la densidad durante la temporada seca (10385 ejemplares; media por estrato: 216) que en la húmeda (3522 ejemplares; media 73). Este resultado, se sustentó significativamente por la densidad de hormigas (F= 8,7089; P= 0,0043), que representaron el 75% de la población, con una media que varió inversamente desde 40 ejemplares/estrato en época húmeda a 190 en época seca y, en menor grado, a otros grupos como diplópodos, lombrices y coleópteros, lo cual, al menos para el grupo dominante, coincidió con un hábitat cercano y similar en la granja granja del Instituto Colombiano Agropecuario (ICA) en Palmira, que presenta suelos vertisoles del plan aluvial del RíoCauca, estudiados por Marín & Feijoo (2003).
Sobre este grupo en la finca El Hatico se han registrado 97 especies de hormigas, con variaciones desde 10 a casi 50 especies por muestreo (Ramírez et al., 2004; 2012), de las cuales 20 correspondieron a Pheidole spp.; observaciones realizadas en la cuenca del Río Cauca, mostraron que una especie no determinada de Pheidole elaboraba nidos hipógeos, que podían ocupar un m3, conteniendo colonias muy numerosas de hasta 10 o 20 mil individuos, de dieta especialmente carnívora, aunque también consumían sustancias harinosas o azucaradas; la población mostró variación temporal y durante dos épocas al año presentaron individuos sexados; se calculó que la reina pondría entre 20 y 150 huevos diarios, dependiendo de la disponibilidad de alimento (Castaño, 1981); finalmente, el autor estableció que Pheidole sp. depredaba sobre varios grupos edafícolas entre ellos Formicidae (27%), Hymenoptera aculeata (31%), Gryllinae (7,9%), Arachnida (7,9%), Hemiptera (5,3%) Lepidoptera (2,6%), Coleoptera (2,6%) y mantenía relaciones antagónicas y de competencia con especies de Iridomyrmex y Solenopsis (Castaño, 1981); otros aspectos ecológicos sobre hormigas en esta investigación fueron registrados por Ramírez et al. (2012).
No obstante el poco conocimiento biológico sobre la mirmecofauna de la región, los resultados logrados, permitirían inferir, que la variación de la densidad de hormigas podría expresar una respuesta de recuperación poblacional lenta, a consecuencia de la época lluviosa (Bandeira & Harada, 1998; Harada & Bandeira, 1994; Tauber et al., 1998), asociada, presumiblemente, a la recuperación poblacional general de sus presas, los otros macroinvertebrados, que presentan ciclos reproductivos sincronizados con la temporada de lluvias; igualmente, la diversidad y densidad de mirmecofauna, así como otros depredadores, detectada en esta investigación, podría coincidir con suelos cuyos niveles de perturbación son equivalentes a labranza mínima (House & Alzugaray, 1989). El predominio de hormigas en vertisoles cultivados del Valle del Cauca fue interpretado por Marín & Feijoo (2003) como “un grupo importante para la recuperación de la calidad de los suelos y para predecir sistemas que se encuentran en proceso de agotamiento biológico o de regeneración”.
Aunque no fueron significativas estadísticamente, si fueron interesantes las variaciones poblacionales en otros grupos; en el caso de lombrices (F=2,82; P: 0,097) la cifra absoluta varió notablemente (Tabla II) y la media también varió desde 10 a 4 ejemplares en la transición de húmedo a seco; situación presumiblemente explicada en que las poblaciones podrían ser similares en ambas épocas, pero declinan en la lectura del monolito, ya que la profundidad del mismo es superada por la reacción natural de las lombrices y otros macroinvertebrados a migrar verticalmente y encapsularse para soportar la época seca (Bandeira & Harada, 1998; Jiménez & Decaens, 2000; Tauber et al., 1998). En diplópodos la declinación poblacional se observó en la época seca, algo explicado en la desecación del alimento y pérdida de su calidad momentáneamente para el grupo (Bueno-Villegas, 2003; Tapia-Coral et al., 1999), coincidente con ello, durante la época húmeda se observaron abundantes y dinámicos, algo notable en las poblaciones de Spirobolidae y Polixenidae; en coleópteros se observó incremento promedio de 2 a 9 ejemplares, lo cual podría parcialmente explicarse por el hecho de que muchas especies se reproducen en la época húmeda (Pardo-Locarno et al., 1991) y sus poblaciones de inmaduros son altas al inicio de la época seca y declinan progresivamente hacía la época húmeda.
Respecto a los usos, la densidad fue mayor en caña convencional (4740 ejemplares, Tabla III) y la cifra menor se observó en potrero silvopastoril (677 ejemplares), siendo hormigas en caña convencional el grupo que más jalonó los datos a favor de este uso y uno de los grupos de macroinvertebrados que más declinó en bosque y sistema potrero silvopastoril; esta situación fue señalada por Fajardo et al. (2006), quienes al comparar aves, hormigas y vegetación, en ecosistemas del río La Vieja, Cordillera Central, encontraron que, entre 12 ecosistemas evaluados, el silvopastoril intensivo registró la menor diversidad de hormigas (S=32) y la menor población (N=1.514), comparado con aquellos marginales como cerca viva sin manejo (S=49, N=2172) o cultivo homogéneo de frutales (S=56 , N=5169); igualmente, por Ramírez et al. (2006), quienes registraron 23 especies de hormigas para sistema silvopastoril y más de 35 para cultivos intensivos como pastizales y caña orgánica (Tabla III).
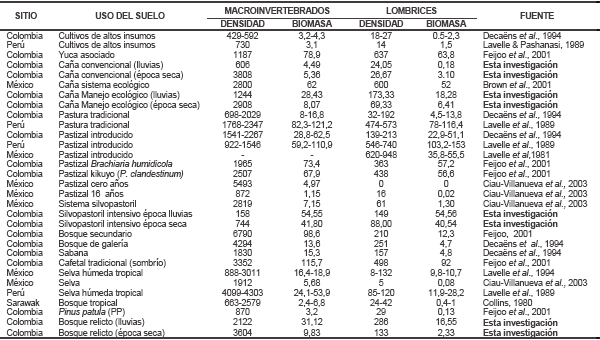
Tabla III. Marco referencial de la densidad (individuos m-2) y biomasa (g m-2) de organismos edáficos en diferentes localidades y usos del suelo(ampliado desde Brown et al., 2001; 2003; Feijoo et al., 2001; Pardo-Locarno, 2009))
Al comparar los cuatro usos del suelo, se detectaron diferencias estadísticas significativas en cuanto a la variación de la densidad total de macroinvertebrados (F=6,704; P:0,0003), explicadas por el valor muy bajo alcanzado por el tratamiento potrero silvopastoril, cuya media fue 1,07 por estrato, la cifra de densidad más baja observada; los demás usos del suelo no presentaron variación significativa en sus medias (de 1,60 a 1,88). Al examinar los grupos se obtuvieron diferencias signi ficativas en la variación de la densidad de lombrices y usos del suelo (F=7,9768; P: 0,0001), específicamente entre cultivos de caña (manejo ecológico y convencional) contra sistema silvopastoril y bosque, aclarando que los mayores valores de densidad para este grupo se observaron en el tratamiento bosque (media: 0,89), seguido por el sistema silvopastoril (media: 0.85); este último caso podría sustentarse, además de las abundantes adiciones de materia orgánica propias del SSP, a la condición multiestratificada del agroecosistema que, presumiblemente, propicia humedad y condiciones de temperatura más favorables al grupo (Lagerlof et al., 2000); de otro lado la carencia de labranza y, por lo mismo, mayor estabilidad del ecosistema, podría proveer beneficios a la abundancia de lombrices (Edwards & Lofty, 1982).
Si se encontraron diferencias altamente significativas entre la densidad total de macroinvertebrados por estratos de monolitos (F= 13,194; P:0,0000), sustentadas por la diferencia entre la medias de densidad de macroinvertebrados del estrato 0-10 (M=2,0) y los demás estratos (10-20= 1,4; 20- 30= 1,2); se observaron diferencias estadísticas significativas en la media de densidad de los principales grupos de macroinvertebrados, cuya media más alta para la mayoría de los grupos se obtuvo en el estrato 0-10 cm, decreciendo hacía los estratos inferiores, correspondiendo a la condición natural de ubicación de la hojarasca, algo ya señalado por estudios cercanos en el bosque seco tropical en Palmira (Marín, 2000), de montaña a 1400-1500 msnm (Pardo-Locarno et al., 2006a), en andisoles de alta montaña en Nariño (Unigarro, 2005) y otros medios neotropicales (Bandeira & Harada, 1998; Harada & Bandeira, 1994).
Análisis de la densidad en todos los usos excluyendo hormigas.
Al excluir a las hormigas del análisis estadístico se encontró que no hubo diferencias significativas entre épocas (F= 0,0010; P:0,9745), por usos del suelo (F= 2,1991; P: 0,0937), por parcelas (F= 1,2919; P: 0,2586) o monolitos (F= 0,8471; P: 0,3597); pero si se observaron diferencias estadísticas significativas para estratos (F=33,4366; P <0,0001), consolidándose el estrato superior con la media de densidad de macroinvertebrados edafícolas más alta (M=1,53) superando a las medias de los estratos inferiores (M=0,98 y 0,64 respectivamente); además emergieron los diplópodos (25%), con el mayor protagonismo en el estrato 0-10 cm (95%) y con el mayor pico poblacional logrado en el encalle de caña cosecha en verde (66%); dicha situación expone claramente una tendencia general señalada en otros medios edáficos, la cual ubica a hojarasca y estrato superior como la condición edáfica más poblada, en la mayoría de los medios tropicales evaluados (Bandeira & Harada, 1998; Sevilla et al., 2002), algo que evidencia el valor ecológico de los medios multiestratificados por sus aportes energéticos (hojarasca, ramas) y su capacidad de intervenir el microclima local (sombra, humedad) y así afectar la dinámica e impacto de los organismosedáficos (Decaens et al., 2003).
Esta situación evidencia, que la variación poblacional de la mayoría de los grupos fue menor en cuanto a temporadas y usos del suelo, excepto por coleópteros y diplópodos cuyas relaciones fueron diferentes; la variación poblacional por uso fue poca, fluctuando desde caña manejo ecológico (4195 ejemplares), caña convencional, con quema (4740), bosque (4295) y silvopastoril (677); esta situación que deja interrogantes a resolver en posteriores estudios, por ahora anticipa en el caso del monocultivo caña, el impacto ecológico de la disponibilidad artificial de riego, algo infaltable en estos hábitats y que hipotéticamente podría atenuar el pico de estrés hídrico de la época seca; de otro lado, en el caso del hábitat silvopastoril, el menos poblado, evidenciaría el estrés biótico ocasionado por el daño físico de los suelos, ocasionado por el pisoteo del ganado (Fajardo et al., 2006).
Biomasa. Como resultado general podría decirse que los 13910 ejemplares de macroinvertebrados colectados en 40 monolitos (volumen total: 0,75 m3 de suelo), en los cuatro hábitats, totalizaron 141,9 gramos. Al examinar los datos del análisis global (Tabla II ), se observó que la mayor cifra de biomasa se registró durante la época húmeda (93,52 g); en cuanto a usos las mayores cifras de biomasa se observaron en bosque (73,32 g) seguido de CME (33,01 g), sistema silvopastoril (30,71 g) y CC (5,84 g); el estrato 0-10 cm presentó la mayor biomasa (79,92 g), superando cuatro veces a la del estrato inferior (20-30 cm), situación que, al igual que la densidad, también coincide con estudios realizado en suelos sometidos a diferentes sistemas de labranza en Palmira (Marín & Feijoo, 2003), parcialmente con los realizados en regiones montañosas del norte del Cauca (Sevilla et al., 2002).
Análisis estadístico Biomasa. En cuanto a épocas, la mayor biomasa se colectó en la temporada húmeda, 486 gramos, no obstante, no se encontraron diferencias estadísticas significativas en la variación de la biomasa entre las dos temporadas (F=2,990; P: 0,087). La variación general de media para las temporadas fue 1928 para época húmeda y 1029 para época seca; en el examen por grupos el análisis de varianza encontró diferencias estadísticas significativas para la variación de la biomasa de hormigas entre las dos temporadas (F=7,39; P=0,008), cuya media aumentó de 0,013 en época húmeda a 0,056 en la época, situación que coincide con el aumento poblacional que registró el grupo para la época seca y que, presumiblemente, podría interpretarse como una respuesta directamente relacionada con el aumento en la disponibilidad de presas. No se encontraron diferencias estadísticas significativas en la biomasa de macroinvertebrados entre parcelas (F=4,5381; P=0,0357), ni entre monolitos (F=2,0114; P= 0,1594); sin embargo, al analizar el comportamiento por grupos se observó una variación estadística en coleópteros entre parcelas (F=1,5421; P=0,2172), cuya media varió desde 0,034 a 0,044.
Se encontraron diferencias estadísticas significativas para la variación total de la biomasa de macroinvertebrados entre estratos (F= 5,3607; P= 0,0062), siendo el estrato superficial el más abundante en coincidencia con lo anotado para densidad, situación que, excepto pocos casos, fue la norma en el muestreo; el comportamiento por grupos también exhibió variación estadística significativa en chilópodos (F=4,4583; P=0,0141), cuyas medias variaron significativamente entre el estrato superior (M=0,049) y los estratos medio (M=0,0024) e inferior (M=0,00056); similar situación se presentó en arañas (M= 0,0687) y en el grupo otros macroinvertebrados, presentados así por ser los de menor frecuencia (M= 0,4347).
En cuanto a biomasa, los grupos más importantes en los cuatro usos del suelo fueron: lombrices (77%, 109,33 g), seguidas lejanamente por Diplopoda (9,85 g) y, por último, Coleóptera (3,27 g). La importancia alcanzada por lombrices, en cuanto a biomasa, coincide con otros estudios, especialmente con Marín & Feijoo (2003) en menor grado con paisajes andinos como los estudiados por Sevilla et al. (2002). Marín & Feijoo (2003), encontraron que cuatro especies de lombrices registradas para agroecosistemas de Palmira (Pontoscolex corethrurus, Polypheretima elongata, Amynthas gracilis y Dichogaster annae) expresaron niveles de biomasa en cacaotal y sistemas agrícolas sin labranza, de 2,8 g/ 0,01875m3 (= 44,8 g/m2 ) y 4,9 g/0,01875m3 (=78,4 g/m2), respectivamente, lo cual representó el 90 y 83,4% de la biomasa total; mientras que en los otros tratamientos de labranza declinó; tal contexto permite afirmar que el comportamiento, en cuanto a biomasa, de las lombrices muestreadas en El Cerrito fue moderada, al menos cuando se comparan ecosistemas similares, (bosque= 31,12 g/m2 en época húmeda y 9,83 g/m2 en época seca; sistema silvopastoril intensivo= 54,65 y 41,80 g/m2, respectivamente, para época húmeda y seca).
Diplopoda con 9,8 g, fue muy inferior, pero sus cifras tienen grandes repercusiones en términos de la funcionalidad ecológica y la visión de sostenibilidad. Estos son organismos detritófagos, degradadores de fitomasa descompuesta, aunque también existen especies con otros hábitos alimenticios, son longevos, estacionales, sus poblaciones crecen y declinan abruptamente con la temporada lluviosa, son susceptibles a la desecación, razón por la cual la mayoría de especies son nocturnas (Bueno-Villegas, 2003). Junto a termitas y lombrices conforman el grupo dominante en la degradación de la hojarasca; el impacto edáfico de los Diplopoda es muy grande ya que impactan los procesos físicos al horadar y romper el suelo, propiciando porosidad, retención de humedad y transporte de nutrientes, resaltando su reconocida capacidad para elaborar estructuras biogénicas, diseños edáficos en forma de macroporos, conformados por pequeñas cámaras de postura, muda o estados quiescentes; en lo referente a la parte química del suelo actúan en la degradación de la materia orgánica, metabolizando nutrientes, aportando sustancias nitrogenadas, las cuales excretan, favoreciendo con ello la actividad microbiana, responsable del 90% del trabajo químico en la descomposición de carbohidratos y otros productos del metabolismo vegetal, incluidos los metabolitos secundarios (Bueno- Villegas, 2003).
Estos organismos consumen anualmente hasta el 30,6 % del mantillo vegetal y existen casos, como el de bosques de encinares, en los que han consumido hasta el 100% de la hojarasca (Bueno-Villegas & Fernández, 1991); Diplopoda, totalizó 782 ejemplares, de los cuales 95% estuvo conformado por Spirobolida, el grupo de mayor impacto ecológico, presumiblemente responsable, junto a lombrices y escarabajos, de gran parte del ciclo degradativo, acelerado, de los residuos de cosecha de caña de azúcar (Pardo-Locarno, 2014)
Coleoptera fue importante en cuanto a biomasa, totalizó 172 ejemplares y 3,27 g; estuvo representado por múltiples especies, entre las cuales se destacó el grupo de los depredadores Staphylinidae (principalmente Aleocharinae), Carabidae (Selenophorus, Calleida y Aspidoglossa), Cicindelidae (Cicindela sp.), Cantharidae (especie cercana a Chauliognathus sp.) y Lampyridae (larvas de Photinus, Photurius y Aspisoma (Pardo-Locarno et al., 1991; Penny et al., 1978; Traugott, 2000), anotando que desde el punto de vista de la biomasa, el impacto más importante lo representaron ocasionales capturas de larvas de Podischnus agenor Olivier y Strategus aloeus L (Oliveira et al., 2003; Pardo-Locarno, 2014).
Análisis de biomasa en suelos excluyendo a lombrices. Con esta omisión, se determinó que la biomasa de macroinvertebrados no varió significativamente para épocas, tampoco lo hizo para parcelas o monolitos, pero si se expresó variación estadística significativa para variación de la biomasa respecto a uso (F=3,40; P=0,0217), sustentado parcialmente en Diplopoda, que exhibió notables explosiones de biomasa en la época húmeda (hasta 7,57 g); también se observaron diferencias estadísticas significativas respecto a estratos (F=17,20; P=0,000), consolidándose el estrato superior como el más abundante en biomasa.
Discusión General por hábitats. Con el objetivo de generar un contexto más universal de los datos obtenidos en los cuatro usos del suelo se presentan en la Tabla III, datos de biomasa y densidad de macroinvertebrados obtenidos en usos similares, en el continente americano. En primer lugar, como rasgo principal, compartido con otros estudios, resalta la mayor biomasa y densidad en el estrato superior (Brown et al., 2001), igualmente la hegemonía que para el atributo biomasa tiene el grupo lombrices, cuya participación representó el 77% del atributo, consecuentemente, este factor fue el que jalonó la cifra de biomasa de algunos hábitats como bosque, caña ecológica y sistemas silvopastoril (Pardo-Locarno, 2009; Molina-Castro et al., 2012).
En ese sentido puede observarse que el cultivo de caña manejo ecológico y convencional presenta rasgos algo cercanos a los datos obtenidos en México, pero se aleja mucho de las cifras registradas para cultivo de yuca cuya biomasa fue muy superior.
En el caso del sistema silvopastoril se observan cifras muy disímiles, que registran datos por encima de varios estudios en Colombia, Perú y México, pero que están por debajo de pastura tradicional (82-121 g m-2) y de pastos introducidos (59-110 g m-2) en Perú. Algo un poco más preocupante puede anotarse para el caso de densidad de macroinvertebrados de este sistema, la cual se apartó del marco hipotético planteado en esta investigación, el cual recogiendo los datos halagadores de la diversidad epigea en cuanto a aves, mariposas y hormigas (Tabla III), vaticinaba o esperaba una gran expresión de diversidad subterránea o edáfica, que si presentó picos de biomasa representados en lombrices (Molina et at., 2012; Pardo-Locarno, 2009) pero muy poca presencia de otros macroinvertebrados edáficos y, en especial, de escarabajos fitófagos (Tabla III); Ello no descarta a este tipo de manejos agroecológicos como una alternativa deseable, pero resulta indiscutible la necesidad de más investigaciones que procuren el preciado equilibrio ecológico subterráneo y el enfoque sostenible (Ciau-Villanueva et al., 2003; Oliveira et al., 2003; Stork et al., 1992; Wardel et al., 2004); objetivo que resulta, por decirlo menos difícil ya que desde hace muchos años se ha estudiado que potreros y explotaciones ganaderas, han sido señalados por su alto impacto a la biodiversidad y, en especial, por el deterioro de los suelos, cuya biología es impactada por el pisoteo del ganado (Agüero & Alvarado, 1983; Alvarado & Forsythe, 2005), el cual afecta las condiciones fisicoquímicas del suelo, reduciendo ostensiblemente la fauna edáfica; en concordancia con lo anterior Brown et al. (2001), expresaron que “a pesar de la baja abundancia total de organismos, la alta biomasa encontrada en el cultivo de cacao, los cítricos y los pastos (léase potreros), se debe a la contribución de las lombrices de tierra (81-96% del total)”
No obstante la condición de insularidad ecológica, con un entorno monocultivado desde hace décadas, el hábitat bosque (finca El Hatico), cuyo rango de densidad de macroinvertebrados fue 2122 a 3604 individuos m-2, ocupó el tercer lugar entre 10 sistemas forestales evaluados, que van desde selva, bosque secundario, plantaciones de café con sombrío y bosque de pino, de los cuales bosque secundario con 6790 y bosque de galería con 4294 individuos m-2, ambos de Colombia, tuvieron los mayores picos de densidad; de manera similar en cuanto a la biomasa el bosque de El Hatico, medió entre los 9,83 a 31,12 g/m-2 ocupando un lugar intermedio por debajo de bosque secundario y cafetal con sombrío, ambos de Colombia y selva húmeda tropical de Perú (Tabla II). El comportamiento de la densidad de lombrices en el bosque varió desde 133 a 286 individuos m-2, cifra alta que solo fue superada por cafetal tradicional con sombrío, en Colombia (498 individuos m-2); igualmente la biomasa de lombrices del bosque de El Hatico varió desde 2,33 a 16,55 g/m-2 rango que solo fue superado por cafetal tradicional con sombrío de Colombia y selva húmeda tropical de Perú (Tabla II y III).
Las cifras de densidad y biomasa observadas en bosques naturales son altas, pero, además, según Brown et al. (2001), “en vegetación original (bosques) se observó la distribución más equilibrada de la abundancia total entre los diferentes organismos presentes” además indicó que el cambio de bosque a cultivo generalmente implica “la pérdida total o parcial de la capa de hojarasca, así como cambios micro-climáticos en el suelo y en sus características físicas y químicas (debido a una mayor foto-oxidación, lixiviación de los nutrientes y erosión, entre otras modificaciones). Estos cambios hacen desaparecer principalmente a los organismos dependientes de la hojarasca para su supervivencia, dejando paso al desarrollo de organismos oportunistas invasores, como lo son algunas lombrices de tierra geófagas exóticas (ej. Pontoscolex corethrurus) o plagas invasoras como termes y hormigas”.
Conlusiones y recomendaciones
A pesar de la complejidad ecológica y la extensión de la temática abordada, por ahora se plantea que la simplificación ecológica (expresada en la declinación de la diversidad y la pérdida de la estructura ecológica natural), la inestabilidad ambiental del medio (evidenciada en ciclos fenológicos cortos de los cultivos) y prácticas de manejo agrícola (como la cosecha con quema, mecanización para preparación del suelo, pisoteo del ganado, uso de insumos químicos), pueden afectar significativamente a la presencia y abundancia de la vida en el suelo y, particularmente, la de los insectos y otros macroinvertebrados edáficos, cuya densidad y biomasa varió respecto a épocas, usos y estratos.
Por primera vez, se destaca la importancia agroecológica de los diplópodos en un monocultivo agrícola, por prestar un valioso servicio ambiental, consistente en la descomposición de más de 20 ton/ha de residuos de la cosecha de la caña manejo ecológico-CME, situación que representa un gran impacto para la dinámica de la materia orgánica y del carbono o reserva energética del suelo (Gómez & Romero, 2003), el combustible metabólico de la vida en el suelo y la biocenosis global, ello originado en un modelo de manejo, que no obstante lidiar con un monocultivo, en un contexto agroindustrial, articula un plan de manejo ambientalmente amigable, que plantea un singular mosaico agroecológico de áreas silvestres para conservación, corredores biológicos, cercas vivas, entre otros y que promueve aspectos fitotécnicos de mucho valor ecológico, como el corte de cosecha en verde, incorporación de residuos orgánicos, mecanización moderada y otras prácticas ecológicamente loables, lo que se constituye en un modelo alternativo a la caña convencional.
No obstante ser un proceso en construcción, el sistema silvopastoril intensivo, lleva a conclusiones y recomendaciones claras, pues este, inicialmente promovido por datos alentadores de la biodiversidad aérea o epigea (Molina et al., 2012; Ramírez et at., 2004, 2006), al contrario, en lo referente a la diversidad subterránea plantea resultados preocupantes, evidenciados en la declinación de la densidad de macroinvertebrados, que fue dominada por lombrices, lo que permite concluir que en este hábitat la biología edáfica no escapa al carácter pernicioso de la compactación ocasionada por el pisoteo del ganado; en este caso y en el de la agricultura intensiva mecanizada, se prevé que circunstancias ambientales como la porosidad (disponibilidad de oxígeno, humedad (agua líquida) y densidad del suelo (facilidad de movilidad subterránea), así como disponibilidad de alimento (diversidad y accesibilidad) y su relación con prácticas agrícolas, deben ser consideradas detenida y particularmente, en términos de evaluar y mitigar los impactos que se pudieran ocasionar a largo plazo, en la física, química y biología de los suelos, en esta última, menguando o removiendo especies edafogénicas localmente y, con ello, afectar la viabilidad del manejo sostenible del suelo como lo propusieron Decaens et al. (2003) y Matson et al. (1997). La declinación de diversidad y abundancia de la entomofauna edáfica aquí expresada para potrero silvopastoril coincide y ratifica los datos expuestos sobre escarabajo fitófagos en los mismos hábitats y biotopos (Pardo-Locarno, 2014).
Dada la poca información existente, en un área agrícola de más de 300.000 ha del plan del Valle del Cauca y, reconociendo el valor de los grupos estudiados, como parámetro ecológico, para evaluar la integralidad de la salud del recurso edáfico, se recomiendan nuevos estudios que permitan analizar finamente otros aspectos de estos organismos, extender las conclusiones y alarmas ecológicas a otros agroecosistemas, como sustento para rediseñar planes de manejo enfocados a la sostenibilidad
Agradecimiento
Los autores lamentan el reciente fallecimiento del maestro y coautor Edgar Amézquita, exfuncionario CIAT e instructor del doctorado del primer autor, con quien se planeaban otros eventos investigativos; Los autores agradecen especialmente el apoyo académico de James Montoya-Lerma, Ranulfo González y demás docentes de la Universidad del Valle; muy valiosos fueron los aportes bibliográficos y sugerencias del grupo de suelos del Instituto de Ecología de México, en especial de Carlos Fragoso, Isabel Valois, Simoneta Negrete Yanquelevich, Patricia Rojas, Julián Bueno y Miguel Ángel Morón; a los propietarios de predios Carlos Hernando Molina Durán (Reserva Natural El Hatico) y Josefina Barona (Finca El Trejo), al grupo académico Enrique Murgueitio (Director Fundación CIPAV), Román Stechauner y María Cristina Gallego (Universidad del Cauca), Heymar Quintero (Universidad Nacional); también a los auxiliares de campo Heriberto Mueces, Medardo Ramírez y Luis Aníbal Arango; agradecimientos al grupo de laboratorio: Elena Gómez, y Mónica Martínez; el primer autor agradece el respaldo afectivo familiar, en especial a Velia Yolanda Locarno. Agradecimientos a Pablo López Insuasty (CRES) por el apoyo ofrecido al primer autor (Proyecto código CI-CRES 02-16) durante la fase de edición final de investigación y su nombramiento como director del Centro de Investigaciones de la CRES.
Bibliografía
- ADIS, J. 1976. Programa mínimo para análises de ecossistemas: artrópodos terrestres em florestas inundáveis da Amazônia Central. Acta Amazónica, 7(2): 223-229.
- ADIS, J. 1977. Estratégias de sobrevivéncia de invertebrados terrestres em florestas inundáveis da Amazônia central: uma resposta a inundaçao de longo período. Acta Amazónica, 27(1): 43-54.
- AGÜERO J.M. & A. ALVARADO 1983. Compactación y compactibilidad de suelos agrícolas y ganaderos de Guanacaste, Costa Rica. Agronomía Costarricense, 7(1/2): 23-27.
- ALVARADO A. & W. FORSYTHE 2005. Variación de la densidad aparente en órdenes de suelos de Costa Rica. Agronomía Costarricense, 29(1): 85-94.
- ALZUGARAY, R., A. RIBEIRO & M. S. ZERBINO 1998. Situación de los insectos del suelo en Uruguay. En: Avances en el estudio de la diversidad, importancia y manejo de los Coleópteros edafícolas americanos. Morón, M. A. y Aragón, A. (Eds). Publicación especial de la Benemérita Universidad Autónoma de Puebla y la Sociedad Mexicana de Entomología. Puebla, México Pp: 151- 164.
- ANDERSON, J. M. E & INGRAM, J. S. I. 1993. Tropical Soil Biology and Fertility. A Handbook of Methods. 2 Ed. Oxford: CAB.
- AUSMUS, B. S. 1977. Regulation of wood decomposition rates by arthropod and annelid populations. Ecology Bulletin, 25: 180-192.
- BANDEIRA, A. G. & A. HARADA 1998. Densidade e distribuição vertical de macroinvertebrados em solos argilosos e arenosos na Amazônia Central. Acta Amazónica, 28(2): 191-204.
- BENSON, W. & A. HARADA 1988. Local diversity of tropical and temperatura ant faunas (Hymenoptera, Formicidae). Acta Amazónica, 18(3-4): 275-289.
- BRADA DA SILVA, M. T., A. D. GRUTZMACHER, J. RUEDELL, D. LINK & E. CORREA COSTA 1994. Influência de sistemas de manejo de solos e de culturas sobre insetos subterrâneos. Ciencia Rural, Santa María, 24(2): 247-251.
- BORROR D. J. & R. WHITE 1970. A field guide to the insects of America North of Mexico. Houghton Mifflin Company. USA.
- BORROR D. J., C. A. TRIPLENHORN & N. F. JOHNSON 1992. An Introduction to the Study of Insects. Sixth Edition. Harcourt Brace College Publishers. USA.
- BUENO-VILLEGAS, J. 2003. Los Diplópodos del suelo en la selva alta de los Tuxtlas. p 226-236. En: Alvárez Sanchez, J. & Naranjo- Garcia, E. (eds) Ecología del suelo en la selva húmeda de México. Instituto de Ecología A. C., Instituto de Biología y Facultad de Ciencias, UNAM, Xalapa, México. 316 pp.
- BUENO, J. & P. ROJAS-FERNÁNDEZ 1999. Fauna de milpies edáficos de una selva alta de los Tuxtlas, Veracruz, México. Acta Zoológica Mexicana (n. s), 76: 59-83.
- BROWN, G., C. FRAGOSO, I. BAROIS, P. ROJAS, J. PATRÓN, J. BUENO, A. G. MORENO, P. LAVELLE, V. ORDAZ & C. RODRÍGUEZ 2001. Diversidad y rol funcional de la macrofauna edáfica en los ecosistemas tropicales mexicanos. Acta Zoologica Mexicana (n. s) número especial, 1: 79-110
- BRUES, C. T. & A. L. MELANDER 1932. Classification of insects. A key of the known families of insects and other terrestrial arthropods. Bull. Mus. Comp. Zool., 83: 1-672.
- CÁRDENAS, G. 1998. Comparación de la composición y estructura de la avifauna en diferentes sistemas de producción. Universidad del Valle, Facultad de Ciencias, Departamento de Biología, Cali, Colombia.
- CASTAÑO, F. 1981. Etología en hormigas en la Orinoquia Colombiana. Cespedesia, 10(37-38): 165-180.
- CIAU-VILLANUEVA, M., F. BAUTISTA-ZUÑIGA, V. PARRA-TABLA & G. BROWN 2003. Diversidad de macroinvertebrados del suelo en sistemas de producción de forraje. En: Anais do Workshop o Uso da Macrofauna Edáfica na Agricultura do Século XXI: a Importãncia dos Engenheiros do Solo. Londrina: Embrapa Soja: Instituto de Ecologia. Pp: 87-116.
- COSTA LIMA, A. DA 1938. Insectos do Brasil. 1er Tomo. Escola Nacional de Agronomía, Río de Janeiro.
- COSTA, C., S. A. VANIN & S. A. CASARI-CHEN 1988. Larvas de Coleoptera do Brasil. Museo de Zoologia, Universidade de Sao Paulo, Sao Paulo.
- CORONADO, R. & A. MÁRQUEZ 1986. Introducción a la Entomología. Morfología y Taxonomía de los Insectos. Editorial Limusa 282 pp.
- CORPORACIÓN AUTÓNOMA REGIONAL DEL VALLE DEL CAUCA-CVC. 2012. Plan de Acción 2012-2015. Subdirección de Planeación. Santiago de Cali. 136 pp.
- DECAËNS T., P. LAVELLE, J. J. JIMENEZ, G. ESCOBAR & G. RIPPSTEIN 1994. Impact of land management on soil macrofauna in the Oriental Llanos of Colombia. European Journal of Soil Biology, 30(4): 157-168.
- DECAËNS, T., J.H. GALVIS & E. AMÉZQUITA-COLLAZOS 2003. Propiedades de las estructuras construidas por los ingenieros del ecosistema en la superficie del suelo de una sabana colombiana. In: Jiménez Jaén, Juan José; Thomas, Richard J. (eds.). El arado natural: Las comunidades de macroinvertebrados del suelo en las sabanas neotropicales de Colombia. Centro Internacional de Agricultura Tropical (CIAT), Cali, CO. p. 171-197. (Publicación CIAT no. 336)
- DECAËNS, T., J.J. JIMÉNEZ, C. GIOIA, G.J. MEASEY & P. LAVELLE 2006. The values of soil animals for conservation biology. Eur. J. Soil Biol. V. E: http://dx.doi.org./10.1016/j.esobi. 2006.07.001
- DORAN, J. W. & M. R. ZEISS 2000. Soil health and sustainability: managing the biotic component of soil quality. Applied Soil Ecology, 15: 3-11.
- EDWARDS, C.A. & J. R. LOFTY 1982. The effect of direct drilling and minimal cultivation on earthworn populations. Journal of Applied Ecology, 19: 723-734.
- ELTITI, A. & U. IPACH 1989. Soil fauna in sustainable agriculture: results of an integrated farming system at Lautenbach, F.R.G. Agriculture, Ecosystems and Environment, 27: 551-572.
- ELLIOTT, L. F. & J. M. LYNCH 1994. Biodiverstiy and soil resilience. En Soil resilience and sustainable land use. Eds: D. J. Greenland & I. Szabolces. CAB International Wallingford.
- FAJARDO, D., R. JHONSTON, I. AMRBRECHT, L.RIVERA, L.E. MENDEZ, L. PIEDRAHITA & Z. CALLE 2006. El papel de las aves, flora nativa, y hormigas en ganadria basada en sistemas silvopastoriles en el Río La Vieja. Tomo I. p 406-408. En Chavez, M. E. & Santamaria, M. (Eds). Uso sostenible de la biodiversidad en ecosistemas y habitats transformados. Informe Nacional sobre avance en el conocimiento y la información de la biodiversidad. 1998-2004. Instituto de Investigaciones Biológicas Alexander von Humboldt. Bogotá D.C. Colombia. 2 Tomos.
- FAO 2001. Indicadores de la calidad de la tierra y su uso para la agricultura sostewnible y el desarrollo rural. Boletín de tierras y aguas de la FAO # 5: 1-20 Roma, Italia. (v. e: http://www. fao.org).
- FEIJOO, A., E.B. KNAPP, P. LAVELLE & A. MORENO 1999. Quantifying soil macrofauna in a Colombian watershed. Pedobiologia, 43: 513-517.
- FITTER, A. H., D. ATKINSON, D.J. READ & M.B. USHER 1985. Ecological interactions in soil: plants microbes and animals. Special publication # 4 British Ecological Society, 407-427.
- FRAGOSO, C., P. REYES-CASTILLO & P. ROJAS 2001. Diversidad y rol funcional de la macrofauna edáfica en los ecosistemas tropicales mexicanos. Acta Zoologica Mexicana (n. s), nº especial 1: 1-10
- GOEDE, R. & L. BRUSSAARD 2002. Soil zoology: an indispensable component of integrated ecosystem studies. Eur. J. Soil Biol., 38: 1-6.
- GÓMEZ, J. M. 1992. Abundancia e distribuição vertical de coleópteros do solo em capoeira de terra firme ina região de Manaus-AM, Brasil. Acta Amazónica, 2(3): 323-333.
- GÓMEZ, P. & G. A. ROMERO 2003. Evaluación de la reserva energética del suelo en tres sistemas del cultivo de caña de azúcar en El Cerrito, Valle del Cauca. Tesis Ingeniería Agrícola. Universidad del Valle. Cali. Noviembre 2003. 252 pp.
- GRASSE, P. P. 1949. Traite de Zoologie; Anatomie, Sistematique, Biologie. Tome IX. Francia. 1117 pp.
- GRASSE, P. P. 1968. La vida de los animales; La población de la tierra. Editorial Planeta S.A. Barcelona. 415 pp.
- HARADA, A. Y. & A. G. BANDEIRA 1994. Estratificacao e densidade de invertebrados em solo arenoso sob floresta primaria e plantios arboreos na Amazónia central durante a estação seca. Acta Amazónica, 24(1/2): 103-118.
- HARDE, K. W. & F. SEVERA 1984. Guía de Campo de los Coleópteros de Europa. Ediciones Omega.
- HOLE, F. 1981. Effects of animal on soil. Geoderma, 25: 75-112.
- HOUSE, G. J. & M. DEL R. ALZUGARAY 1989. Influence of cover cropping and no-tillage practices on community composition of soil arthropods in a North Carolina agroecosystem. Agroecosystem Environment Entomology, 18(2): 302-307.
- INSTITUTO GEOGRÁFICO AGUSTÍN CODAZZI 1988. Suelos y bosques de Colombia. Subdirección Agrológica. Bogotá.
- INSTITUTO GEOGRÁFICO AGUSTÍN CODAZZI 1995. Suelos de Colombia origen, evolución, clasificación, distribución y uso. Subdirección de Agrología. Bogotá. 632 pp.
- INSTITUTO GEOGRÁFICO AGUSTÍN CODAZZI 2003. Atlas de Colombia. Quinta Edición. Imprenta Nacional. Bogotá. 342 pp.
- JIMÉNEZ, J. J. & T. DECAËNS 2000. Vertical distribution of earthworms in grassland soils of the Colombian Llanos. Biol. Fertil. Soils., 32: 463-473
- JIMÉNEZ, J. J. & R. J. THOMAS (EDS). 2001. Nature´s plow: soil macroinvertebrate communities in the neotropical savannas of Colombia. Centro Internacional de Agricultura Tropical. Cali.
- LAAKSO, J., H. SETÄLÄ & A. PALOJÄRVI 2000. Influence of decomposer food web structure and nitrogen availability on plant growth. Plant and Soil, 225: 153-165.
- LAL, R. 1988. Effects of macrofauna on soil properties in tropical ecosystems. Agriculture, Ecosystems and Environment, 24: 101-116.
- LAVELLE, P. 1986. Assessing the abundance and role of invertebrate communities in tropical soil: Aims and methods. In: Ghabbourt, S. I. & Daris, R. C. (Eds). Proceedings of the seminar on resources of soil fauna in Egypt and Africa Cairo. Revue Zool. Afr-J., 102: 275-283.
- LAVELLE, P. 1997. Faunal activities and soil proceses: adaptative strategies that determine ecosystems function. Advances in Ecological Research, 27: 93-132.
- LAVELLE, P., C. GILLOT, C. FRAGOSO & B. PASHANASI 1994. Soil fauna and sustainable land use in the humid tropics. In: Greeland, D. J. and Szabolcs, I (Eds). Soil Resilence and Sustainable Land Use. CAB International. 291-305 pp.
- LAGERLÖF, J., B. GOFFRE & C. VINCENT 2002. The importance of field boundaries for earthworms (Lumbricidae) in the Swedish agricultural landscape. Agriculture, Ecosystems and Environment, 89: 91-103.
- LUDWING, J. A. & J. F. REYNOLDS 1988. Statistical Ecology. A primer on methods and computing. A Wiley Interscience Publication. John Wiley & Sons. EEUU. 337 pp.
- MCGAVIN, G. C. 2002. Insects, spiders and others terrestrial arthropods. Smithsonian handbooks. New York.
- MARAUN, M., H. MARTENS, S. MIGGE, A. THEENHAUS & S. SCHEU 2003. Adding to “the enigma of soil animal diversity”: fungal feeders and saprophagous soil invertebrates prefer similar food substrates. European Journal of Soil Biology, 39: 85-95.
- MARIN, E. & A. FEIJOO 2003. Evaluación del impacto de la labranza en suelos vertisoles sobre los macroinvertebrados de un área de Colombia. En: Anais do Workshop o Uso da Macrofauna Edáfica na Agricultura do Século XXI: a Importãncia dos Engenheiros do Solo. Londrina: Embrapa Soja: Instituto de Ecologia. Pp: 55-75.
- MATSON, P. A., W. J. PARTON, A. G. POWER & M. J. SWIFT 1997. Agricultural intensification and ecosystem properties. Science, 277: 504-509
- MEGLITSCH, P. A. 1981. Zoología de Invertebrados. H. Blume Ediciones. Madrid. 906 pp.
- MOLINA-CASTRO, C.H., C.H. MOLINA-DURÁN, E.J. MOLINA-DURÁN & J.J. MOLINA 2012. Manejo agroecológico de caña de azúcar y sistemas silvopastoriles intensivos Alternativas sostenibles para el valle geográfico del río Cauca, Reserva Natural El Hatico. Revista Tecnicaña, 29: 28-35.
- NEHER, D. A. 1999. Soil community and ecosystem proceses; comparing agricultural ecosystems with natural ecosystems. Agroforesty Systems, 45: 159-185.
- NIETO J. M. & M. P. MIER 1985. Tratado de Entomología. Ediciones Omega Barcelona. 599 pp.
- OLIVEIRA, L., G. BROWN & J. SALVADOR 2003. Corós como pragas e engenheiros do solo em agroecossistemas. En: Anais do Workshop o Uso da Macrofauna Edãfica na Agricultura do Século XXI: a importãncia dos Engenheiros do Solo. Londrina: Embrapa Soja: Instituto de Ecologia. Pp: 77-86
- PAOLETTI, M. G., M. A. FAVRETTPL, R. STINNER, F. F. PURRINTON & J. E. BATER 1991. Invertebrates as bioindicators of soil use. Agriculture, Ecosystems and Environment, 34: 341-362.
- PAQUIN, P. & D. CODERRE 1997. Deforestation and fire impact on edaphic insect larvae and other macroarthropods. Entomological Society of America, 26(1): 21-30
- PARDO-LOCARNO, L. C. 2013. Escarabajos (Coleoptera: Melolonthidae) del plan aluvial del Río Cauca, Colombia I. Ensamblaje, fichas bioecológicas, extinciones locales y clave para adultos. Dugesiana 20(1): 1-15.
- PARDO-LOCARNO L.C. 2009. Macroinvertebrados edafícolas en agroecosistemas del municipio del Cerrito (Valle), con énfasis en la comunidad de escarabajos Melolonthidae (Coleoptera: Sacarabaeoidea). Ph.D. Tesis. Universidad del Valle, Cali, Colombia.
- PARDO LOCARNO, L. C., L. M. PUERTA & J. I. PULIDO 1991. Coleópteros de la Zona Plana del Valle del Cauca. Registros Taxonómicos, Observaciones Ecológicas y Económicas Generales. Agricultura Tropical, 28(3): 93-108.
- PARDO LOCARNO, L. C., J. MONTOYA-LERMA & A. SCHOONHOVEN 2003. Abundancia de chisas rizofagas (Coleoptera: Melolonthidae) en agroecosistemas de Caldono y Buenos Aires, Cauca, Colombia. Revista Colombiana de Entomología, 29(2): 177-184.
- PARDO-LOCARNO, L. C., C. P. VÉLEZ, F. SEVILLA & O. MADRID 2006. Abundancia y biomasa de macroinvertebrados edáficos en la temporada lluviosa, en tres usos de la tierra, en los Andes colombianos. Acta Agronómica (Colombia), 55(1): 43-54.
- PENNY, N. A., J. R. ARIAS & H. O. R. SCHUBART 1978. Tendéncias populacionais da fauna de coleópteros do solo sob floresta de terra firme na Amazónia. Acta Amazónica, 8(2): 259-265.
- PETERSON, A. 1977. Larvae of Insects. An Introduction to Neartic Species (Part I, Lepidoptera and Hymenoptera). Columbus, Ohio. Sixth Edition March.
- PETERSON, A. 1979. Larvae of Insects. An Introduction to Neartic Species (Part II, Coleoptera, Diptera, Neuroptera, Siphonaptera, Mecoptera, Trichoptera). Columbus, Ohio.
- PRIMAVESI, A. 1979. Manejo Ecologico do Solo: a Agricultura en regioes tropicais. Sao Paulo, Livraria Nobel. 549 pp.
- RAMÍREZ, M., J. CHARÁ, L .C. PARDO-LOCARNO, J. MONTOYA-LERMA, I. ARMBRECHT, C.H. MOLINA & E.J. MOLINA 2012. Biodiversidad de hormigas hipógeas (Hymenoptera: Formicidae) en agroecosistemas del Cerrito, Valle del Cauca. Livestock Research for Rural Development. Volume 24, Article # 15. Retrieved January 29, 2012 (http: //www.lrrd. org/lrrd24/ 1/rami24015.htm).
- RAMÍREZ, M., M.L.ENRIQUES, I. AMRBRECHT, C.H. MOLINA & E.J MOLINA 2006. Estudio de Caso: Caña orgánica y sistemas silvopastoriles como refugios de biodiversidad del bosque seco tropical del alto Cauca: p 412-413. Tomo I. En: Chaves, M. E. & Santamaría, M. (Eds). 2006. Informe sobre el avance en el conocimiento y la información de la biodiversidad 1998-2004. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá D.C.
- RAMÍREZ, M., I. AMRBRECHT & M.L. ENRIQUES 2004. Importancia del manejo agrícola de la biodiversidad: caso de las hormigas en caña de azúcar. Revista Colombiana de Entomología, 30(1): 115-123.
- REICHLE, D. E. 1977. The role of soil invertebrates in nutrient cycling. Ecology Bulletin (Stockholm), 25: 145-156
- RIGHI, G. 1995. Colombian earthworms. En: La Cordillera Central Colombiana transecto parque Los Nevados: Tercera parte. T. van der Hammmen & Dos Santos, A. G. (Eds). Berlin-Stuttgart. Pp: 485-607.
- ROSS, H. H. 1982. Introducción a la entomología general y aplicada. 5ta Edición. Ediciones Omega, Barcelona.
- SCHÄDLER, M., J. ALPHEI, S. SCHEU, R. BRANDL & H. AUGE 2004. Resource dynamics in an early-successional plant community are influence by insect exclusion. Soil Biology & Biochemistry, 36: 1817-1826.
- SCHAUERMANN, J. 1977. Energy metabolism of rhizophagous insects and their role in ecosystems. Ecology Bulletin, 25: 310-319.
- SCHEU, S. 2002. The soil food web: structure and perspectives. Eur. Journal of Soil Biology, 38: 11-20.
- SEEBER, J., G.U.H. SEEBER, W. KÖSSLER, R. LANGEL, S. SCHEU & E. MEYER 2005. Abundance and trophic structure of macro decomposers on alpine pastureland (Central Alps, Tyrol): effects of abandonment of pasturing. Pedobiologia, 49: 221-228.
- SEVILLA, F., T. OBERTHÜR, H. USMA, G. ESCOBAR, L. C. PARDO LOCARNO & G. C. NARVÁEZ 2002. Exploración de la presencia y abundancia de la coleopterofauna edáfica en diferentes usos de la tierra en una microcuenca del Departamento del Cauca. En: XXXVII Congreso Nacional de Ciencias Biológicas. Ponencias. San Juan de Pasto. Universidad de Nariño. 274 pp.
- STEHR, F. W. 1987. Immature Insects. Kendall/Hunt Publishing Company. USA.
- STEHR, F. W. 1991. Immature Insects. Volume 2. Kendall/Hunt Publishing Company. USA.
- STORK, N. E. & P. EGGLETON 1992. Invertebrates as determinants and indicator of soil quality. American Journal. Alternative Agriculture, 7: 38-55.
- SADEGHIAN, S. 1998. Estudio comparativo de algunas características de suelos bajo cultivos de caña de azúcar Saccharum officinarum L. con y sin quema y un Bosque Secundario. Tesis posgrado Universidad Nacional de Colombia. Escuela de Posgrados. Palmira. 1998. 92 pp.
- SWIFT, M. & D. BIGNELL 2001. Standard methods for assessment of soil biodiversity and land use practice. En: International Center for Research in Agroforestry. Lecture Note 6b. Bagor, Indonesia. Pp 34.
- TAPIA-CORAL, S. C., F. J. LUIZAO & E. V. WANDELL 1999. Macrofauna da liteira em sistemas agroflorestais sobre pastagens abandonadas na Amazónia central. Acta Amazonica, 29(3): 477-495.
- TAUBER M. J., C. TAUBER, J. P. NYROP & M. VILLANI 1998. Moisture, a vital but neglected factor in the seasonal ecology of insects: Hypotheses and test of mechanisms. Environmental Entomology, 27(3): 523-530.
- TRAUGOTT, M. 2000. Morphological distinction of the larvae of Cantharis fusca (L) and C. livida (L) (Coleoptera: Cantharidae) and notes on their biology. Entomologische Blätter, 96: 46-56.
- UNIGARRO, A. E., O. BURBANO & M. SÁNCHEZ DE PRAGER 2005. Evaluación de la calidad de suelos Dystric Cryandept en el Santuario de Flora y Fauna Galeras, Nariño. Acta Agronómica (Colombia), 54(4): 7-12.
- VELOSO SILVA, J. F. 2003. Apresentação. En: Anais do Workshop o Uso da Macrofauna Edáfica na Agricultura do Século XXI: a Importãncia dos Engenheiros do Solo. Londrina: Embrapa Soja: Instituto de Ecologia.
- VILLANI, M. G., L. L. ALLEE, A. DIAZ & P. S. ROBBINS 1999. Adaptive strategies of edaphic arthropods. Annual Review Entomology, 44: 233-256.
- VITOUSEK, P. M & R. L. SANFORD JR. 1986. Nutrient cycling in moist tropical forest. Ann. Rev. Ecol. Syst., 17: 137-167.
- WARDLE, D. A., R. D BARDGETT, J. N. KLIRONOMOS, H. SETALA, W. H. VAN DER PUTTEN & D. H. WALL 2004. Ecological linkages between aboveground and belowground biota. Science, 304: 1629- 1633.
- WIENS, J. A. 1989. Spatial scaling in ecology. Functional Ecology, 3: 385-397.
- WIGGLESWORTH, V. B. 1974. La vida de los insectos. Talleres Gráficos A. Núñez, Barcelona.
- ZAR, J. H. 1996. Biostatistical Analysis. Prentice Hall Inc. New Jersey.
- ZAHRADNIK, J. & M. CHVALA 1990. La gran enciclopedia de los insectos. Susaeta Ediciones S.A. Checoslovaquia.
- ZAHRADNIK, J. & F. SEVERA 1981. Guía Básica de los Insectos de Europa. Ediciones Omega S. A. Barcelona.