Introducción
Sporisorium cruentum (Kühn.) (=Shacelotheca cruenta) es el agente causal de enfermedades en distintas especies del género Sorghum incluyendo Sorghum halepense (L) Pers., aunque ciertas variedades o híbridos de sorgo son inmunes o altamente resistentes a este carbón. El sorgo Sudangrass no es generalmente afectado por este patógeno. S. cruentum es el carbón que tiene menor incidencia como enfermedad en el género Sorghum (Hirschhorn 1986).
S. cruentum se caracteriza por ser, como en la mayoría de las especies del Orden de las Ustilaginales, un parásito biotrófico del “tipo metabiotrófico”. Estos patógenos poseen la característica de poder desarrollarse como saprófitos en medio de cultivo artificial. Esto se debe a que tienen un estado esporidial que les permite multiplicarse por brotación “tipo levadura” y otro parásito “tipo micelial” en el huésped, completando de esta forma el ciclo de vida (Luttrell 1974).
La infección de S. cruentum se inicia cuando las esporas están en contacto con las plantas en el suelo y por el efecto de la interacción entre hospedante-patógeno se induce la germinación de las mismas. Las teliosporas producen hifas infectivas que penetran en la epidermis de las plantas jóvenes y comienzan a colonizar los tejidos de los brotes y los vástagos de los rizomas. Este patógeno tiene la característica de difundirse internamente por el meristema apical hasta alcanzar las inflorescencias donde se forma un “soro”, el cual se desarrolla a expensas del ovario. Generalmente todas las semillas en la panoja son carbonosas y la destrucción parcial es poco común. Algunas panojas pueden ser transformadas en panojas estériles o formar filodios cuando escapan a la infección. Las panojas carbonosas aparecen anticipadamente en el cultivo. También tienen la característica que se abren antes que las panojas sanas. Las semillas son reemplazadas individualmente por un “soro” que mide 2,5 cm o más de largo, y termina en forma de punta cónica. Esta estructura normalmente se encuentra rodeada por una membrana frágil (peridio) que se rompe rápidamente, y paralelamente se produce la formación de una pequeña columela curvada recubierta de teliosporas (Fischer & Holton 1953, Vánky 1985, Duran 1987).
Sorghum halepense (=Johnsongrass, sorgo de alepo) es una gramínea que pertenece a la familia Poáceae y es una de las diez especies de malezas perennes más importantes del mundo (Holm et al. 1977). En Argentina esta especie ocupa más de 7 millones de has (Mitidieri 1984) y su lugar de origen fue situado en un área abarcada por el mar Mediterráneo, Asia menor (Irán y Turquía) y sudoeste de Europa (Piper 1928). De Wet y Huckaby (1967) posteriormente determinan un ecotipo tropical ubicado en el sur de India y en el oeste de Pakistán. Este último es reemplazado por un ecotipo mediterráneo distribuido en Asia menor, sudoeste de Europa y norte de África. Estos autores afirman que el ecotipo mediterráneo fue posteriormente introducido en América y Australia. Sorghum halepense se reproduce por semillas y por rizomas. Una planta de esta especie puede producir 80.000 semillas, y 62.5 m de rizomas, con 8000 g de peso, en una estación de crecimiento (Mc Whorter 1961, Anderson 1996).La capacidad de perpetuación del sorgo de alepo es por medio de las semillas y brotación de rizomas. Luego de los 40-50 días de la emergencia, es muy difícil establecer si la estructura aérea ha sido generada por rizomas o por semillas. Desde el punto de vista biológico, poblacional y de manejo, no existen diferencias entre plantas adultas generadas por una semilla o un rizoma. En el caso de las semillas de sorgo de alepo, estas le brindan a la especie la posibilidad de ser la fuente principal de dispersión a distancia, además proporcionan variabilidad genética que le permite la adaptación de la población a los diferentes ambientes que afectan a la actividad humana (Ghersa & Satorre 1981, Satorre et al. 1981, Mendez Fernández et al. 1983, Leguizamón 2012). En los campos destinados a la agricultura, y especialmente en los cultivos en los que existe superposición de ciclos con el sorgo de alepo, los perjuicios ocasionados por esta especie son a través de los mecanismos de competencia por nutrientes y por acción de sustancias inhibitorias producidas por las raíces. Estas últimas afectan la germinación de semillas de otras especies cultivadas y este efecto alcanza una gran importancia en las áreas productivas (Satorre et al. 1981). Se han determinado diferentes fitopatógenos afectando a S. halepense: Pseudomonas spp., Xanthomonas holcicol, Helmintosporium spp., Spacelotheca holci, Mycosphaerella sp., Phoma sp., Puccinia purpurea, P. graminis, diferentes virosis (Templeton 1982, Holm et al. 1977; Vánky 1985, Masion & Lindow 1986; Millhollon 2000) y Bipolaris sorghicola (van Dyke & Winder 1985, Winder & van Dyke 1990). También el sorgo de alepo es considerado un hospdante alternativo de transmisión de varias enfermedades en las áreas de producción agrícola. En la Argentina se identificaron varios patógenos tales como S. cruentum (Hirschhorn 1986); Alternaria spp, Drechlera spp., Curvularia spp., Phyllosticta spp., Phoma spp. (Verdejo et al. 1995) y Bipolaris sorghicola (Acciaresi & Mónaco 1999). Estos patógenos afectan al desarrollo vegetativo, pero tienen en algunos casos escasa influencia en la etapa reproductiva. En el caso de S. cruentum evita la formación de las semillas porque son reemplazadas por las teliosporas del carbón y a su vez son dispersadas por el viento para reinfectar otras plantas.
En este capítulo se presentan los resultados de la investigación llevada a cabo para estudiar la implicancia que tiene el patógeno S. cruentum a través de su desarrollo y evolución en los tejidos del hospedante (S. halepense), y su efecto en el crecimiento vegetativo de los rizomas.
Hipotesis
- Sporisorium cruentum produce distintas alteraciones histopatológicas en los tejidos vegetativos y reproductivos de plantas de Sorghum halepense.
Objetivo
- Evaluar los efectos y alteraciones ocasionados por Sporisorium cruentum a nivel celular en los tejidos vegetativos y reproductivos de las plantas de Sorghum halepense.
Materiales y métodos
La metodología utilizada en esta investigación fue adaptada y modificada en base a técnicas utilizadas para el estudio de otras especies de Ustilaginales, como lo ha mencionado Fernández et al. (1978), Matyac (1985), Craig & Frederiksen (1992) y Moharam et al. (2012).
Preparación de los rizomas
Se realizaron dos ensayos en invernadero. Se utilizaron rizomas de S. halepenese susceptible al carbón, extraídos de un clon cuyas panojas presentaban ataques de carbón procedente de infecciones naturales. Las muestras fueron seleccionadas del campo experimental del Instituto Fitotécnico de Sta. Catalina, situado en la Localidad de Llavallol, provincia de Buenos Aires. Los rizomas se trozaron dejando dos yemas/rizoma, que luego se lavaron bajo una corriente de agua durante 2 horas. Posteriormente, se desinfectaron con una solución de hipoclorito de sodio al 30% durante 20 min y se realizaron tres lavados con agua destilada estéril para realizar las diferentes experiencias.
Preparación del inóculo
Se tomaron las muestras de las panojas de plantas infectadas naturalmente a campo y luego se observaron con microscopio estereoscópico para determinar y confirmar la especie de carbón. Las teliosporas fueron extraídas de las inflorescencias para su determinación taxonómica:
1.- Se montaron en lactofenol para su visualización con microscopio óptico (MO)
2.- Se montaron en platina y se metalizaron con una capa de oro paladio para su observación bajo microscopio electrónico de barrido (MEB) (D’Ambrogio Argüeso 1986).
Las panojas infectadas fueron trituradas con mortero para obtener una abundante masa carbonosa y homogenizar la muestra. Luego el material se desinfectó en solución de hipoclorito de sodio al 3% durante dos minutos, mientras se centrifugaba a 3000 rpm, para evitar posibles contaminantes. Posteriormente, se realizaron tres lavados en agua destilada estéril. Este procedimiento se realizó tanto para el tratamiento de suspensión de las teliosporas como en la obtención de los cultivos axénicos. Para la preparación de los cultivos esporidiales se tomaron alícuotas de 0,1 ml de suspensión de esporas desinfectadas y se sembraron en placas de Petri que contenían papa-dextrosa- agar al 2% (PDA). Luego fueron incubadas en estufa a 25ºC ?2ºC y en oscuridad. A partir de las 12 h se comenzó a observar la germinación de las teliosporas hasta la formación de las colonias. Las cepas se aislaron en tubos en pico de flauta con medio de PDA y se guardaron en heladera a 5ºC para luego ser utilizadas en los ensayos.
Para la caracterización morfo-cultural (crecimiento, forma, color) se sembró un disco de 6 mm diámetro en el centro de una placa de Petri de 6 cm y se la incubó en estufa a 25ºC ?2ºC. Para la preparación del inóculo con los cultivos esporidiales de las cepas aisladas fueron transferidas al medio de cultivo líquido de caldo-papa-dextrosa al 2% (PD) y se llevaron a incubar a 25ºC ? 2ºC en oscuridad. El inóculo fue mantenido en agitación continua, utilizando un agitador rotativo hasta que la densidad del inóculo alcanzó una concentración de 106-8esporidias/ml, luego de 4 días de incubación. (Astiz Gassó et al. 2001).
Cuando se obtuvieron los materiales, se programaron dos ensayos sobre los rizomas:
Tratamiento 1: Inoculación de plántulas de sorgo con aguja hipodérmica.
Tratamientos 2-3: Inoculación de yemas al vacío (suspensión de teliosporas y cultivos líquidos de esporidias).
Inoculación de plántulas de sorgo con aguja hipodérmica
Los rizomas se sembraron en bandejas plásticas (10 x 13 x 15 cm) que contenían arena estéril y se regaron con agua destilada estéril. Las bandejas se llevaron a una cámara en condiciones ambientales para favorecer el desarrollo de las plantas a una temperatura de 20ºC ± 2ºC, humedad relativa de 80-90% y ciclos de 16 h luz/8 h oscuridad. Cuando emergieron las plántulas y presentaron un buen desarrollo vegetativo (3-4 hojas) se inocularon con una suspensión de cultivos esporidiales (concentración de 106-8 esporidias/ml), utilizando una jeringa y aguja hipodérmica por debajo del meristema apical (Edmunds 1963). En este ensayo se trataron 30 plantas y un número igual de plantas blanco como testigo. A partir del tercer día, se comenzó la extracción de 5 plantas por cada estado vegetativo hasta completar el ciclo biológico del sorgo de alepo o hasta la aparición de síntomas visibles del patógeno.
Las muestras fueron fijadas en FAA (alcohol etílico, formol, ácido acético glacial) y posteriormente, fueron procesadas en el laboratorio utilizando diferentes técnicas histológicas.
En este ensayo se evalúo la presencia del micelio en las estructuras vegetativas y reproductivas del sorgo de alepo (yema apical, hoja, tallo e inflorescencia).
Inoculación de rizomas con teliosporas y cultivos esporidiales al vacío
Este ensayo se realizó con dos tipos de inóculo, pero aplicando la misma técnica de inoculación:
Tratamiento T1: inmersión de rizomas en PD blanco.
Tratamiento T2: inmersión de rizomas en suspensión en cultivo líquido (PD) + teliosporas (10–6-8 esporas/ml) aplicando vacío de 0.1 MPa durante 5 min.
Tratamiento T3: inmersión de rizomas en cultivo líquido (PD) con esporidias (106-8 esporidias/ml) aplicando vacío de 0.1 MPa durante 5 min (Mónaco et al 2001; Astiz Gassó et al 2001).
Los materiales inoculados se sembraron en bandejas plásticas (10x13x15 cm) que contenían arena estéril y se regaron con agua destilada. Luego éstas se llevaron a cámara en condiciones ambientales faborables para el desarrollo de las plantas y el inóculo del patógeno (temperatura 20ºC ± 2ºC, humedad relativa 40-60% y ciclos de 16h luz/8h oscuridad. Cuando las plántulas tuvieron 2-3 hojas fueron transplantadas en macetas de cuatro litros de capacidad que contenían tierra negra desinfectada, para evitar la contaminación con otros microorganismos, a razón de 2 plántulas/maceta en un total de 20 macetas. Luego fueron trasladadas al invernadero para que completen el ciclo vegetativo. Se utilizó un diseño completamente aleatorizado con tres repeticiones, sembrándose 2 plántulas/maceta en 20 macetas/tratamiento y controles.
Técnicas histológicas en laboratorio
Para este ensayo se extrajeron periódicamente muestras de las plantas inoculadas en las que se observó el desarrollo de síntomas del patógeno (clorosis, alteraciones morfológicas, etc.) y de los testigos sin tratar. Las muestras de hojas infectadas (1mm x 1mm del área afectada), las de hojas sanas y de los primordios de yemas vegetativas y florales, se fijaron en glutaraldehído para posteriormente realizar las inclusiones con resinas sintéticas Spurr de baja viscosidad. Para la realización de los cortes se usó un micrótomo Sorvall MT 2-13 con cuchilla de vidrio para obtener secciones semifinas de 1?m de espesor y luego fueron teñidas con azul de toluidina. Las muestras de tallos, yemas apicales, espiguillas de panojas infectadas y controles se fijaron en FAA y posteriormente se pre-trataron con ácido fluorhídrico al 10% durante 7 días, para la eliminación del sílice presente en la epidermis de la familia Poáceas. La inclusión se realizó en parafina para los cortes transversales y longitudinales de aproximadamente 10-12 μm de espesor usando un micrótomo tipo Minot. Para la observación microscópica se realizó la coloración doble de safranina-fast-green y se montaron en DePex. Los preparados fueron observados en microscopio óptico (Bracegirdle & Miles 1975, D’Ambrogío Argüeso 1986).
Evaluación de las inoculaciones al vacío
En este ensayo se extrajeron muestras de hojas que presentaban manchas y se observaron utilizando técnicas de tinción con montanje en azul de trypan en lactofenol. Se observó con microscopio óptico, para confirmar la presencia del patógeno en el tejido. Para evaluar la evolución de S. cruentum y la relación hospedante-patógeno en sorgo de alepo, se extrajeron muestras de meristemas apicales antes de la elongación de los tallos, de espiguillas antes de emerger las inflorescencias de la hoja bandera, y de panojas carbonosas. Al finalizar el ciclo vegetativo del sorgo de alepo se contabilizaron el número de plantas infectadas y no infectadas con el carbón, para calcular el porcentaje de infección sobre el total de plantas. También se extrajeron 5 plantas completas de sorgo de alepo al azar por repetición y testigos para los tratamientos T2 y T3. Al finalizar el ciclo de crecimiento de la maleza, se procedió a separar la parte aérea de la subterránea para determinar las variables: materia seca aérea (MSA, g.pl-1) y materia seca de rizomas (MSR, g. macetas-1). Para estas determinaciones se colocó el material en estufa y se mantuvo hasta peso constante durante 48 h de acuerdo a la metodología propuesta por Ward et al. (1978) y se obtuvo el peso seco de las muestras tratadas y testigo. Para el análisis estadístico de los datos, se analizaron las medias de los tratamientos y se compararon mediante el método de las diferencias mínimas significativas (LSD) (p< 0.05%) utilizando el método estadístico SAS 6.03 (SAS, 1989).
Resultados
Determinación taxonómica de Sporisorium cruentum
Las observaciones macroscópicas confirmaron que los soros corresponden a los típicos de la especie S. cruentum, que presentan un peridio frágil y columela curvada (Fig. 1A). Las teliosporas tienen forma redondeada a subglobosa; episporio equinulado; tamaño de 6-8?m de diámetro y color marrón oscuro, tal como se comprobó en los preparados de microscopio electrónico de barrido (MET) como óptico (Fig. 1 B, C). Las teliosporas germinaron in vitro y emitieron metabasidios (=promicelios) tabicados con 4 células y formación de basidiosporas (=esporidias) laterales. La multiplicación es por brotación, lo que generó una cantidad abundante de nuevas esporidias (Figura 1 D). Las esporidias rápidamente formaron colonias del tipo levadura de color marrón claro al ocre en PDA y presentaron un crecimiento del tipo radial que a los 20 días cubrió la caja de Petri de 6 cm de diámetro (Fig. 1 E).
Evaluación del método de inoculación con jeringa hipodérmica
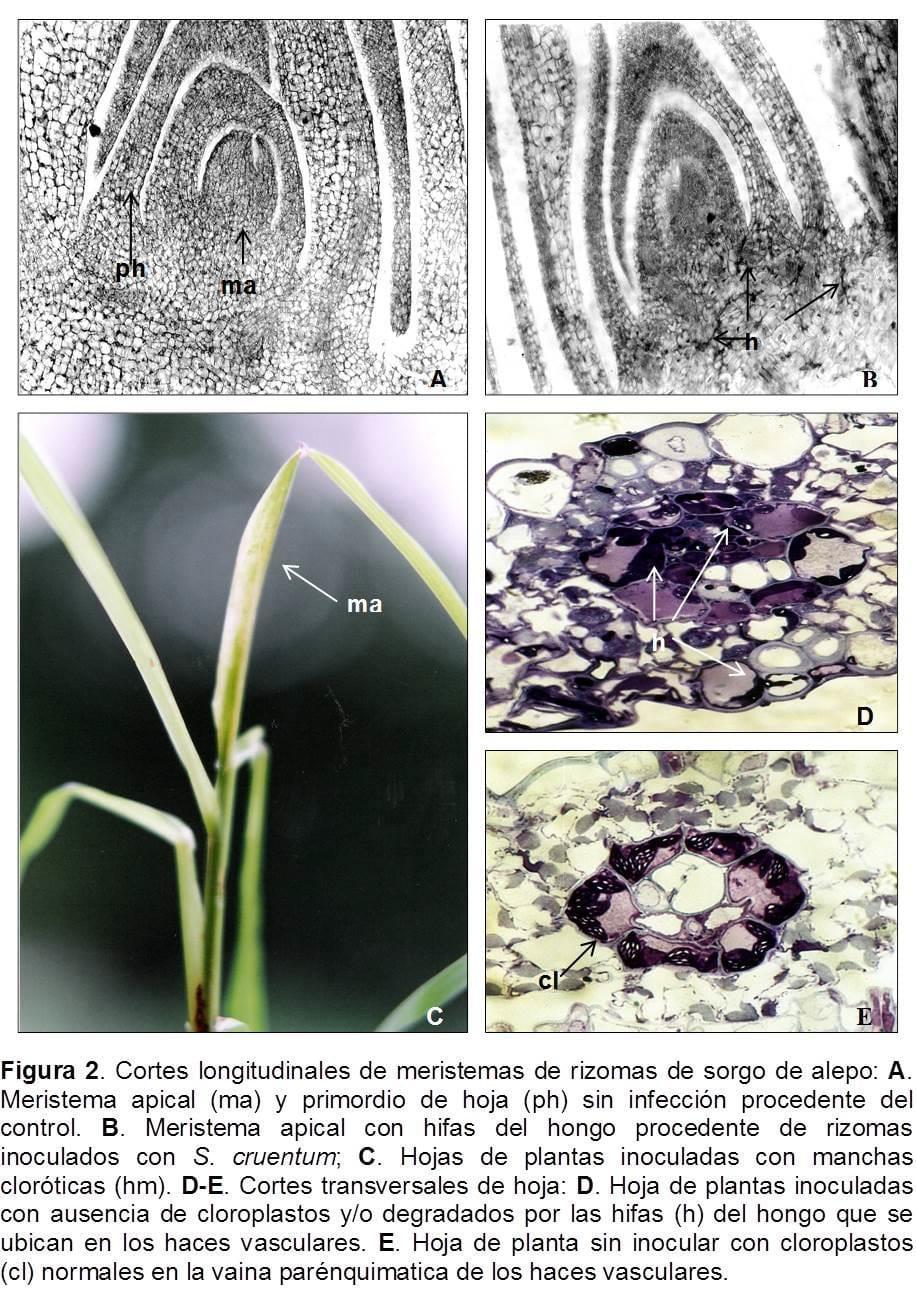
Las plantas provenientes de rizomas con 4 a 6 hojas desarrolladas fueron inoculadas con las esporidias. A partir del tercer día, se tomaron muestras de los meristemas apicales y de las hojas de las plantas tratadas y testigos para realizar los cortes longitudinales. Los provenientes de las plantas sanas no presentaron infección del patógeno (Figura 2 A), a diferencia de las plantas que fueron tratadas en las que se observó el desarrollo inter e intracelular de las hifas del hongo (Figura 2 B). Entre los 10 a 15 días posteriores a la inoculación se registró en 4 plantas, síntomas del tipo hipoplásico con clorosis leves a marcadas (Figura 2 C) y del tipo metaplásico con producción de pigmentos antociánicos. También se produjo pérdida de hojas por necrosis vascular. En cortes transversales de la vaina parenquimática de los haces vasculares se observó, en los preparados semifinos para MET, la ausencia de cloroplastos o parte de ellos degradados cuando el hongo penetra dentro de la vaina (Figura 2 D). En el testigo, en la misma zona, se visualizó la normal ubicación de los cloroplastos, como se registra en las plantas C4 (Figura 2 E). En las plantas dónde la clorosis fue marcada, se observó un menor vigor en el crecimiento sin inducir a la muerte de las mismas. Estas observaciones fueron confirmadas a nivel ultraestructural con microscopía electrónica de transmisión. Las hojas sanas mostraron cloroplastos normales en el clorénquima del mesófilo y de la vaina parenquimática de los haces vasculares. También se observó un desarrollo normal de las estructuras presentes en el citoplasma, tales como glóbulos lipídicos, retículo endoplasmático rugoso, mitocondrias, y vesículas (Figura 3 A, B). A diferencia de las hojas de las plantas tratadas que presentaron una desorganización de sus células por la presencia de las hifas del patógeno. (Figura 3 C, D).
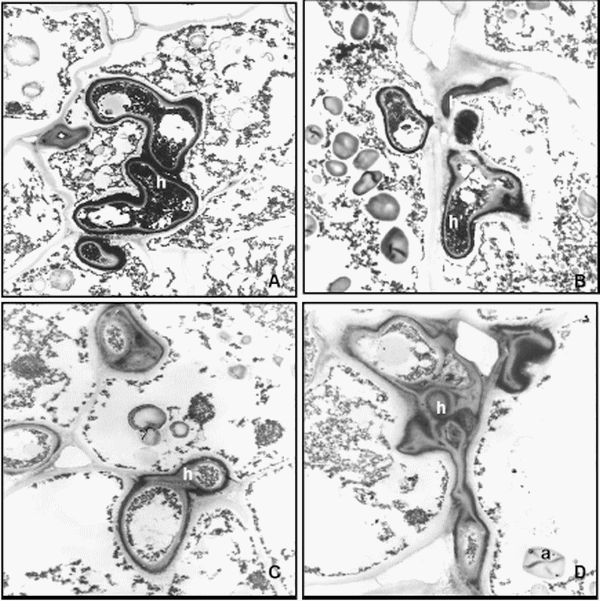
A partir de los 18-25 días de inoculadas se produjo la elongación del tallo del estadio reproductivo y se observó en los nudos superiores la inducción de la formación yemas múltiples entre 3 a 7 yemas que se originaban en un nudo común, este tipo de anormalidad es típica de la especie S. cruentum. Posteriormente, se visualizó la emergencia de pequeñas panojas infectadas o la formación de panojas estériles o filodios o pequeños vástagos (Figura 4 A). No se observaron estas anormalidades en el testigo. Cuando se realizaron los cortes histológicos de los pequeños vástagos, se visualizó en tres de ellos la formación de yemas: una vegetativa y otra reproductiva, protegidas por la formación de primordios foliares (Figura 4 B). Las hifas del hongo se observaron con microscopio óptico en la base del meristema del vástago (Figura 4 C, D) y se confirmó en detalle con MET (Figura 6 A, B).
En los cortes longitudinales y transversales realizados en los tallos, no se observó la presencia del patógeno en las plantas tratadas y no tratadas siendo el órgano reproductivo infectado por el patógeno.
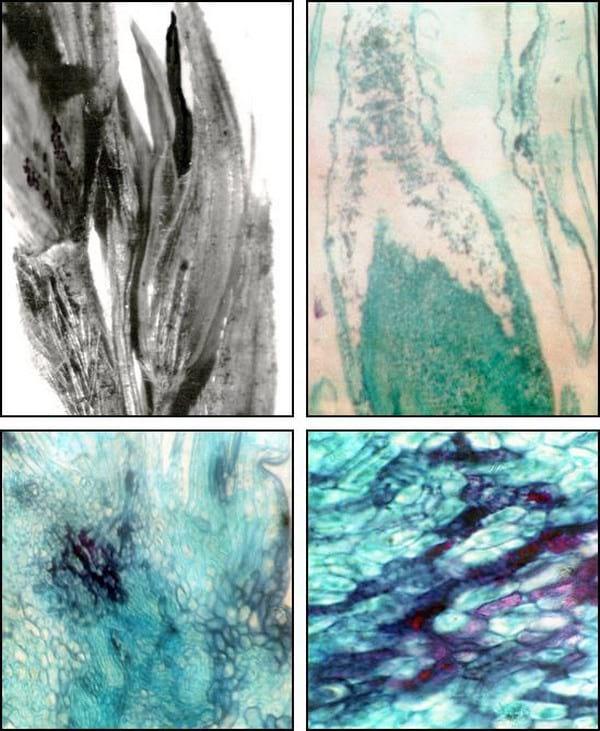
También se determinó que el patógeno no proliferó hasta que el gineceo estuvo totalmente desarrollado dentro de la espiguilla. De esta manera la invasión del hongo comenzó en primer término por el gineceo, donde se observó que la hifa se fragmenta y produjo la espermogénesis con la formación de teliosporas. El proceso de esporulación continuó por las anteras hasta producir la desintegración total de los tejidos que las componen. Los granos fueron sustituidos por los soros que median 2,5 cm o más rodeados por una membrana delgada de color gris. Esta membrana se rompió al emerger la panoja y las teliosporas de color marrón a negras se desprendiron dejando una estructura larga, negra y puntiaguda, de forma cónica y/o curvada (columela). Las glumas y las glumelas se conservan intactas para proteger el soro (Figura 5 A, B). Cuando se extrajeron las espiguillas en formación, se observó en los cinco especímenes analizados la presencia de las hifas del hongo en la base de los primordios florales. En un estadio más avanzado se observó en los cortes histológicos de las espiguillas basales que las hifas del hongo se encontraban ubicadas en los tejidos de conducción y en el parénquima medular del pedicelo floral (Figura 5 C, D). Esto pudo observarse con mayor detalle en microfotografías realizadas con MET (Figura 6 C, D).
Inoculación al vacío con teliosporas
En este ensayo se registró similitud con el método de la jeringa hipodérmica en cuanto al desarrollo del micelio vegetativo y reproductivo del S. cruentum como en el caso anterior. También se examinaron 10 brotes de la base en las plantas inoculadas de 3-4 semanas de edad. En los brotes inactivos se vio solamente trozos de hifas en el tejido meristemático, mientras que en algunos ápices de brotes desarrollados fueron completamente colonizados en estadios relativamente tempranos del desarrollo. En otros casos se observó plantas con síntomas del tipo metaplásico en las hojas, pero no tan marcados como en el caso de la infección con aguja hipodérmica. No se determinó presencia de hifas del hongo en los tallos.
Inoculación al vacío con esporidias
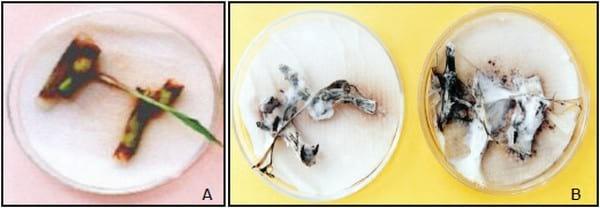
En este ensayo se examinaron 80 rizomas inoculados con esporidias del hongo y se observó sobre los mismos, la formación de un micelio de color blanco que rápidamente colonizó la superficie y además no permitió el desarrollo de las plántulas. Como consecuencia del ataque del patógeno se registraron las siguientes alteraciones: inhibición de la brotación de las yemas, deshidratación parcial o total y necrosis hasta producir la muerte del rizoma a diferencia del testigo donde las plantas se desarrollaron normalmente. Para verificar si el problema era producido por un defecto de la desinfección, contaminantes u otras causas, se sembraron rizomas inoculados al vacío con esporidias (T3) en cajas de Petri sobre papel humedecido con agua destilada estéril y para confirmar la presencia de S. cruentum por el re-aislamiento del hongo (Figura 7 A, B).
También en este caso se visualizó que el micelio se desarrollaba de manera intercelular y también se hallaron hifas del patógeno en la base del meristema apical y la región de los nudos. No se observó en los tejidos la fusión entre esporidias, pero sí la formación de hifas intracelulares. En otras plantas se evidenciaron síntomas de clorosis en las hojas, que fue confirmada por medio de cortes histológicos por la presencia de la hifa del hongo. También en este caso se observó la presencia de hijuelos aéreos en los nudos, yemas múltiples y panojas estériles inducidas por el patógeno. A diferencia del testigo que produjo un desarrollo normal de las plantas.
Masa seca área
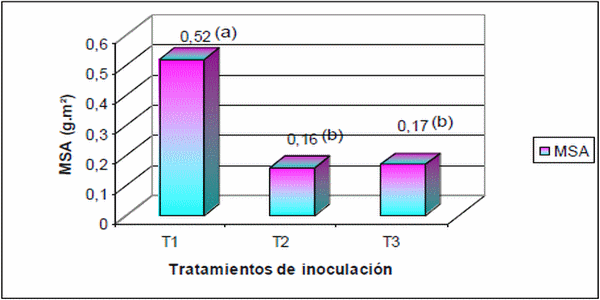
Respecto a la MSA, no hubo diferencias significativas entre los tratamientos con inoculación al vacío con teliosporas (T2) 0,16 g.pl-1 y con inoculación con esporidias (T3) 0,17 g.pl-1, pero ambos fueron altamente significativos LSD (p?0,05) comparados con el testigo 0,52 g.pl-1, este comportamiento se puede visualizar en la Figura 8.
Las plantas presentaron en ambos casos un acortamiento de los entrenudos y disminución en la altura en comparación al testigo (Figura 10 A, B). También se evidenció una floración anticipada en las plantas que presentaron carbón a diferencia de los testigos.
Masa seca de rizomas
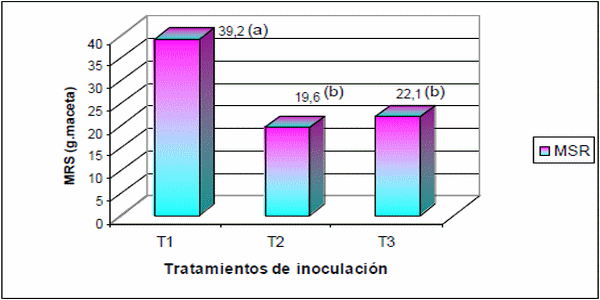
Respecto a la MSR, se obtuvo un comportamiento similar a la MSA. Los tratamientos T2 y T3 afectaron significativamente LSD (p? 0,05) la producción de rizomas obteniéndose una merma promedio de 19,60 g en T2 y 22,10 g en T3, respecto a la producción de rizomas alcanzada por el testigo que fue de 39,2 g.pl-1 (Figura 9). Este comportamiento se puede visualizar en la (Figura. 10 A-C), donde se observa la menor producción de rizomas debido a la infección con S. cruentum respecto al testigo.
Discusión
Varios aspectos asociados con la infección de los rizomas y las plántulas de sorgo de alepo se detectaron durante nuestros ensayos. Las inoculaciones con el método hipodérmico resultaron más agresivas porque se observó una mayor cantidad de plantas con hojas con manchas cloróticas o la producción de pigmentos antociánicos Hanna (1929). Se observó la formación de antocianinas en hojas infectadas que fueron producidos por el hospedante como resultado de la acumulación de este pigmento en las células de la epidermis. De acuerdo con los resultados, el micelio fue observado en el tejido parénquimatico y en el área nodal. Esta distribución dispersa del micelio probablemente se debió al método de inoculación utilizado, ya que las esporidias fueron forzadas a penetrar el tejido vegetal. El micelio, por lo general, no invade el meristema apical o tejido vascular de los brotes. Trabajos realizados por otros investigadores, indican la presencia de manchas cloróticas conteniendo hifas desarrolladas y ramificadas sobre las hojas emergidas de plántulas de maíz y sorgo inoculadas con S. reilianum. Además encontraron correlación entre los ensayos de campo e invernáculo. Dichos trabajos indicaron que este método de inoculación auxilia a la evaluación de diferentes genotipos resistentes o susceptibles al carbón de sorgo granifero. También se determinó que el método fue eficiente para reemplazar los ensayos a campo en los screening de mejoramiento (Wilson & Frederiksen 1970, Matyac 1985, Matyac & Kommedahal 1985; Craig & Frederiksen 1992; Snetselaar & Mims 1994). De acuerdo a nuestras observaciones realizadas en los cortes transversales de hojas, las hifas del hongo degradaron los cloroplastos y los haces vasculares fueron invadidos por las hifas. Posteriormente, se colapsaron las células provocando una necrosis generalizada. En varios casos estas hojas se marchitaron, pero la planta siguió su desarrollo hasta completar su ciclo, y la planta presentó el signo característico de la enfermedad cuando la panoja emergió carbonosa. Snetselaar & Mims (1994) y Martinez et al. (1999), observaron después de la inoculación de S. reilianum, que las plantas jóvenes fueron ligeramente cloróticas y que contenían esparcidas hifas del hongo. Estas últimas, se desarrollaron en las células epidérmicas, paránquimaticas y vasculares, pero no en los espacios intercelulares. Las hifas ramificadas fueron frecuentemente observadas como una infección en progreso.
Según nuestros resultados, las cepas de S. cruentum aisladas, fueron agresivas porque se observó la inducción de yemas múltiples que a su vez originaron vástagos vegetativos y reproductivos encerrados entre hoja. Alteraciones morfológicas similares fueron reportadas en otro carbón, U. scitaminea Sydow (carbón de la caña de azúcar) en los que se observó modificaciones morfológicas en tallos, hojas e inflorescencias tales como la formación de látigos convolutos que emergían de yemas laterales de los tallos y producía la deformación de los mismos (Sharma 1956; Byther & Steiner 1974). En otros trabajos sobre este carbón describen la formación de látigos simples o múltiples en inflorescencia y la formación de látigos múltiples que emergían de un mismo punto del ápice del tallo. Además se observó disminución en el crecimiento de las plantas y un acortamiento de los entrenudos (Nasr 1976, Astiz Gassó 1988). Una hipótesis que explicaría este tipo de alteraciones sería la producción excesiva de hormonas que estimulan la elongación de los tallos, el acortamiento de los entrenudos, la formación de filodios y la inducción de cambios de los primordios vegetativos a reproductivos anticipando la floración. Este estadio de la planta es fundamental para que el hongo pueda infectar las inflorescencias y producir rápidamente la fragmentación del micelio y como consecuencia la esporogénesis del carbón. En experiencias realizadas por Matheussen et al (1990), sobre la implicancia de las giberelinas en S. reilianum, observaron que el hongo producía esta hormona en los primeros días de la infección, y además cuando la cultivaron in vitro, las cepas eran productoras de giberelinas. En el caso de S. cruentum sería necesario realizar otros estudios complementarios para confirmar sí produce esta hormona u otras que induzcan esta anormalidad. De acuerdo con los resultados obtenidos en el presente trabajo, en los cortes longitudinales de ápices vegetativos, se observó en algunos casos la presencia de hifas entrecortadas, pero no se visualizó la fusión de esporidias. Resultados similares fueron registrados en S. reilianum en inoculaciones artificiales en Sorghum bicolor (Wilson & Frederiksen 1970, Osorio & Frederiksen 1998). Ademas, visualizamos hifas intracelulares y ramificadas por debajo del ápice vegetativo como en estado de latencia hasta que se produjo la diferenciación de los primordios florales y se inició la movilización del micelio a las espiguillas de las inflorescencias. Estas fueron infectadas a nivel del suelo antes de la elongación de los tallos. Respecto a las técnicas histopatológicas empleadas en este trabajo, es importante destacar que las mismas fueron previamente empleadas con éxito en estudios de carbones que afectan otras especies vegetales. Tales como los trabajos de Millhollon (2000) que en sus experiencias, utilizó el método de cortes histológicos de los segmentos nodales de plántulas de S. halepense para confirmar la efectividad de las inoculaciones a campo con suspensiones de teliosporas y esporidias de S. cruentum. Así mismo, en las investigaciones realizadas por Sinha et al. (1982) se empleó la técnica histológica de montaje con tinción simple de azul de tripan en lactofenol, para detectar la presencia del micelio de U. scitaminea a partir de nodos, que fueron confirmados en la parte basal del meristema apical. De acuerdo a nuestros resultados, se determinó que la infección se produce en el primordio floral y no cuando la panoja está completamente diferenciada y sin emerger de la hoja bandera. En relación a la infección de las espiguillas de la panoja, también observamos que la misma debe estar completamente formada, porque existe una dependencia por los compuestos nutricionales. Tales elementos fueron aportados por el gineceo, los estambres y el estigma floral para inducir a la fragmentación de las hifas seguida de la esporulación y maduración de las teliosporas. No hemos encontrado otros reportes sobre en S. cruentum, por lo tanto consideramos que es importante realizar nuevos estudios para dilucidar este proceso.
De acuerdo a los resultados, es importante considerar el efecto que el patógeno ha causado sobre la materia seca de los rizomas, dado que aparece disminuyendo la biomasa subterránea en un momento en que la maleza registra un incremento de la producción de rizomas al finalizar el ciclo del cultivo. Por otra parte, estos resultados resultan ser interesantes dada la preponderancia que posee la reproducción vegetativa respecto de la reproducción por semilla de la maleza. Así, Williams & Ingber (1977) demostraron que ante la ausencia de competencia y en condiciones no limitantes de recursos hídricos y nutricionales, S. halepense destinó un 27% de la materia seca hacia los rizomas y sólo un 4% hacia la producción de semillas. Estos autores establecen que ante la presencia de competencia intraespecífica, la maleza retarda la formación de rizomas. Por otra parte, Smith & Holt (1997) establecieron que el empleo de medidas adicionales de control de malezas y el control biológico no son antagonistas, pero existen efectos sinérgicos (donde los efectos combinados son más que aditivos) que dependen de la tasa reproductiva de la maleza y la densidad a la cual crece. También se observó que la MSA se redujo porque las plantas enfermas tenían menor altura comparadas con los testigos. Los reportes realizados por Luttrell et al. (1964) y Millhollon (2000) sobre esta especie mencionan las diferencias de crecimiento de las plantas tratadas con el carbón. De acuerdo a los resultados obtenidos en todos los casos se registró una alta infección con los métodos de inoculación utilizados y bajo las condiciones ambientales en las cuales se ejecutaron los experimentos. Además, se visualizaron cambios en la morfología estructural del hospedante similares a los registrados en investigaciones realizados por otros autores en S. reilianum (Craig & Frederiksen 1992, Martinez et al. 1999). Del mismo modo, se estableció que S. cruentum fue quien produjo los cambios morfológicos estructurales en el hospedante, y que los mismos, no fueron inducidos por los métodos aplicados (Astiz Gassó et al. 2001). El sorgo de alepo, como en todas las Poaceae, en el estado vegetativo tienen el tallo verdadero reducido a un disco basal con los nudos y entrenudos muy comprimidos que se elongan en el estado reproductivo, de acuerdo a lo descripto por Maddaloni & Ferrari (2001). Por esta forma de crecimiento de la planta, podemos decir que de acuerdo a las observaciones realizadas el patógeno migra hacia la inflorescencia localizada en la base de la yema apical produciendo la enfermedad. El método más efectivo para el control de esta maleza es causando la disminución en la producción de rizomas, ya que esta cumple con un rol importante en la dinámica reproductiva de la maleza (Willians & Ingber 1977). Tal como lo demuestran nuestros resultados de la reducción marcada de rizomas (MRS) producidas por el hongo.
En investigaciones realizadas para el control integrado de malezas, se estudió la posibilidad del uso como biocontroladores de hongos del Orden Ustilaginales que fueron eficaces en el control de las mismas. Tales como el uso de U. sp. para el control de Paspalum virgatum (Arévalo et al. 2000). Otro ejemplo es U. bullata que fue utilizado como biocontrolador de la maleza Bromus tectorum donde se redujo la producción de semillas por ser reemplazadas por la masa carbonosa del hongo y se establecieron las condiciones ambientales óptimas tales como la temperatura y el momento de mayor eficacia del hongo para producir infecciones en las plantas (Meyer et al. 2001, Astiz Gassó et al. 2002, Boguena 2003, Boguena et al. 2007). Por lo tanto, de este modo sólo dentro de un marco integrado de alternativas se podría establecer fehacientemente la factibilidad del control biológico empleando S. cruentum.
Por otra parte, será necesario establecer las posibles interacciones entre la implementación del control biológico con otras alternativas de manejo en el sorgo de alepo, tales como el uso de herbicidas en dosis reducidas y el uso de la habilidad competitiva de los cultivos que compitan con la maleza.
Es importante destacar que deben ser vencidas las barreras estructurales, tales como las yemas que se encuentran protegidas por catáfilas que dificultan la penetración del hongo, la baja viabilidad de las teliosporas en el suelo porque no persiste en el suelo más de 12 meses, y las condiciones ambientales, para producir la enfermedad.
De acuerdo a los resultados obtenidos, sería necesario considerar la realización de nuevas investigaciones para dilucidar la inoculación del patógeno en la maleza bajo condiciones de campo, dado el efecto de la alta eficiencia de S. cruentum para producir infecciones en el sorgo de alepo.
Ciclo biológico de Sporisorium cruetum sobre Sorghum halenpese
En la Figura 11 se describe el ciclo biológico: En plantas con panojas infectadas el patógeno se disemina por dos vías: las esporas son llevadas por el viento, y las semillas infestadas llevan teliosporas adheridas (Figura 11 1). Las teliosporas en reposo son n+n (Figura 11 2) y en presencia del hospedante se induce a la maduración que luego al fusionarse se transforman en 2n (Figura 11 3). A continuación se forman las basiodiosporas haploides (n) y la fusión de células compatibles para generar la hifa infectiva (n+n). La infección del patógeno se produce cuando la hifa infectiva forma el apresorio y penetra al tejido por ablandamiento de paredes celulares (Figura 11 4) tanto en plántulas originadas desde semillas como por brotación de las yemas de los rizomas. El hongo coloniza meristema vegetativo. Posteriormente, la infección se produce en el primordio floral en cual el hongo induce la fragmentación de las hifas seguida de la esporulación y maduración de las teliosporas que son liberadas (Figura 11 1).
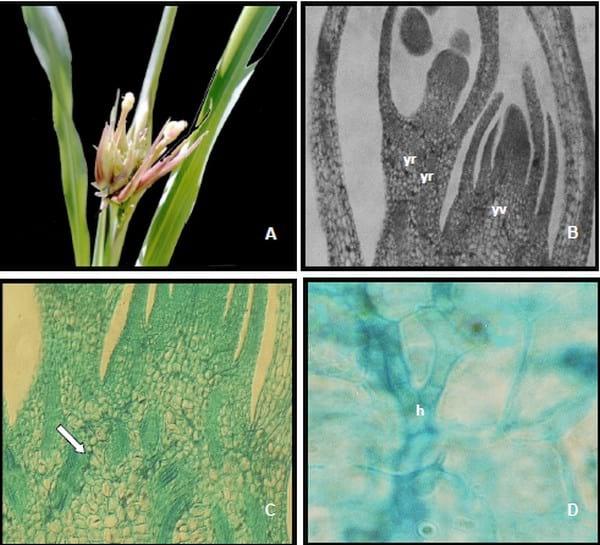
Figura 1. Observación macroscópica y microscópica de S. cruentum: A. Panoja con carbón. B.
Microfotografía de Teliosporas con episporio equinulado observadas en microscopio electrónico de barrido (MEB). C. Microfotografía de Teliosporas observadas en microscopio óptico (MO). D. Germinación in vitro de teliosporas tipo esporidial en PDA. E. Colonia desarrollada en medio de PDA.
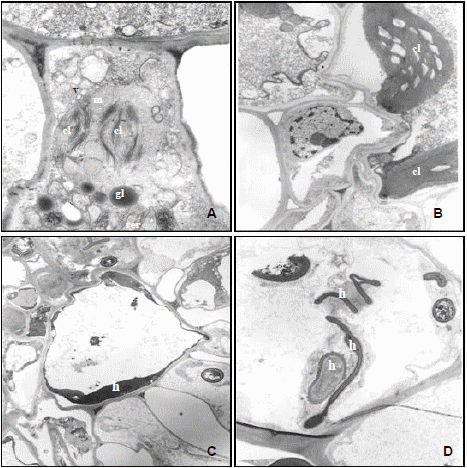
Figura 3. A-D. Microfotografías de microscopía electrónica de transmisión (MET) en Sorghum halepense. A-B. Ultraestructura de las células del mesófilo de la hoja sana del hospedante. A. Célula del clorénquima sano conteniendo cloroplastos (cl), glóbulos lipídicos, mitocondrias (m), retículo endoplámico rugoso (rer) y vesículas (v) en el citoplasma. B. Célula de la vaina parenquimática de los haces vasculares con cloroplastos normales. C-D. Células de la vaina parenquimática infectadas con la hifa (h) de Sporisorium cruentum. Escalas: A = 0,5 μ; B = 1μ; C-D = 2 μ.
Figura 4. Alteraciones morfológicas producidas por S. cruentum. A. Yemas múltiples que originan pequeñas panojas infectadas con el hongo. B–C. Corte longitudinal de una yema múltiple. Yema vegetativa (yv) y reproductiva (yr). C. Base de la yema con presencia de la hifa del hongo (flecha). D. Detalle de las hifas ramificadas intracelulares.
Figura 5. Cortes histológicos de espiguilla con colaración doble de safranina-fast-green A. Espiguillas infectadas con carbón, con soro formado por una columela curvada. B. Corte longitudinal de la espiguilla con el gineceo curvado y con presencia de teliosporas. C-D. Detalle de la base de la espiguilla infectada por el hongo.
Figura 6. Microfotografías de microscopía electrónica de transmisión (MET) en S. halepense. A-B. Ultraestructura del meristema vegetativo. A. Célula infectada por la hifa del hongo (h). B. Citoplasma de la célula infectada conteniendo sustancias de reserva como gránulos de almidón simple (a). C-D. Células de la base de la espiguilla infectadas con Sporisorium cruentum. Escalas: A, B = 2 μ; C-D = 1 μ.
Figura 7. Brotes de rizomas del sorgo de alepo en placas de petri. A. Testigo sano. B. Rizomas y brotes necrosados por el hongo y desarrollo de micelios blanquecinos.
Figura 8. Materia seca aérea (MSA) de plantas de sorgo de alepo al final del ciclo del cultivo: T1, tratamiento control; T2, inmersión de rizomas en suspensión en cultivo líquido + teliosporas; T3, inmersión de rizomas en medio líquido + esporidias. LSD (<0.05)
Figura 9. Materia seca de raíz (MSR) de plantas de sorgo de alepo al final del ciclo del cultivo: T1, tratamiento control; T2, inmersión de rizomas en suspensión en cultivo líquido + teliosporas; T3, inmersión de rizomas en medio líquido + esporidias. LSD (<0.05)
Figura 10. Experimento en invernadero con S. cruentum sobre .rizomas de sorgo de alepo. A-B. Plantas sanas y enfermas con S. cruentum procedentes de los ensayos en invernadero. C–D. Rizomas procedentes de plantas sanas y enfermas. C. Rizomas sanos procedentes de campos naturales. D. Rizomas de plantas testigos y plantas tratadas con el patógeno infectadas en condiciones ambientales de invernadero
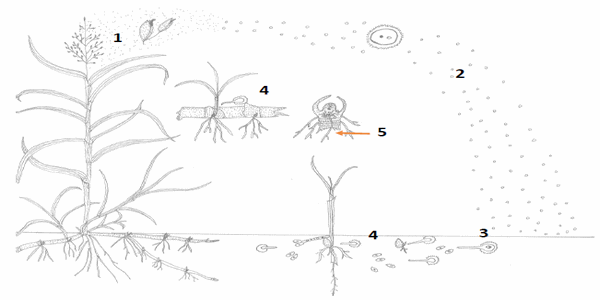
Figura 11. Ciclo de vida de Sporisorium cruentum: 1. En plantas con panojas infectadas el patógeno se disemina por dos vías: las esporas son llevadas por el viento, y las semillas infestadas llevan teliosporas adheridas. 2. Las teliosporas en reposo son n+n. 3. En presencia del hospedante se induce a la maduración que luego al fusionarse se transforman en 2n. A continuación se forman las basiodiosporas haploides (n) y la fusión de células compatibles para generar la hifa infectiva (n+n). 4. La infección del patógeno se produce cuando la hifa infectiva forma el apresorio y penetra al tejido por ablandamiento de paredes celulares tanto en plántulas originadas desde semillas como por brotación de las yemas de los rizomas. 5. El hongo coloniza el meristema vegetativo. Posteriormente, la infección se produce en el primordio floral en cual el hongo induce la fragmentación de las hifas seguida de la esporulación y maduración de las teliosporas que son liberadas.
Conclusiones
1. Se establecieron las condiciones ambientales óptimas y el momento de mayor eficacia del hongo para producir infecciones en las plantas de sorgo de alepo. Por lo tanto, de este modo, sólo dentro de un marco integrado de alternativas, se podría establecer fehacientemente la factibilidad del control biológico empleando S. cruentum.
2. Sería importante establecer las posibles interacciones entre la implementación del control biológico con otras alternativas de manejo en el sorgo de alepo, tales como el uso de herbicidas en dosis reducidas y el uso de la habilidad competitiva de los cultivos que compitan con la maleza.
Bibliografía
- Acciaresi H.A., Mónaco C. 1999. First report of Bipolaris sorghicola on johnsongrass in Argentina. Plant Disease 83:965.
- Arévalo E., Cabezas O., Zúñiga L., Chávez M. 2000. Evaluación preliminar sobre el potencial de control del hongo Ustilago sp. sobre la Maleza Paspalum virgatum. Abstract XV Congreso Peruano de Fitopatología. Revista de Fitopatología Latinoamericana 35:11.
- Astiz Gassó M.M. 1988. Efectos del carbón (Ustilago scitaminea Syd) sobre Saccharum offinarum. Fitopatología 23:37-39.
- Astiz Gassó M.M., Monaco C., Acciaresi H. 2001. Efectividad de tres métodos de inoculaciones de Sporisorium cruentum en sorgo de alepo. Brazilian Phytopathogy 26:466.
- Astiz Gassó M.M., Mónaco C., Acciaresi H. 2002. Evaluacion de Sporisorium cruentum como agente de control biológico en Sorghum halepense” Revista Mexicana de Fitopatología 20:141-145.
- Boguena T. 2003. Epidemiology of Ustilago bullata Berk on Bromus tectorum L. and implications for biological control. Ph dissertation. Brigham Young University Provo UT. 102 pp.
- Boguena T., Meyer S.E., Nelson D.L. 2007. Low temperature during infection limits Ustilago bullata (Ustilaginaceae, Ustilaginales) disease incidence on Bromus tectorum (Poaceae, Cyperales). Biocontrol Science and Technolog, 17:33-52.
- Bracegirdle B., Miles P. 1975. Atlas de Estructuras Vegetales. Editorial Paraninfo 125 pp.
- Byther R.S., Steiner G.W. 1974. Unusual smut symptoms on sugarcane in Hawaii. Plant Disease Report 58:401-405.
- Craig J., Frederiksen R.A. 1992. Comparison of Sorghum seedling reactions to Sporisorium reilianum in retation to Sorghum head smut resistance classes. Plant Disease 7:314-318.
- D’Ambrogío Argüeso A. 1986. Manual de Técnicas en Histología Vegetal. Editorial Hemisferio Sur 83 pp.
- De Wet J.M.J., Huckaby J.P. 1967. The origin of Sorghum bicolor. II. Distribution and domestication. Evolution 21:787-802.
- Duran R. 1987. Ustilaginales of México: Taxonomy, Symptomatology, Spore Germination, and Basidial Cytology. Copyright by Rubén Durán 331 pp.
- Edmunds L.K. 1963. Use of sporidial hypodermic infection to test sorghum for head smut resistance. Plant Disease Rep., 47:903-913.
- Fernández J.A., Durán R., Schafer J.F. 1978. Histological aspects of dwarf bunt resistance in wheat. Phytopathology 68:1417–1421.
- Fischer G.W., Holton T.C. 1953. Manual of the North American smut fungi. The Ronald Company, New 343 pp.
- Ghareeb H., Becker T.I., Feussner I., Schirawski J. 2011. Sporisorium reilianum infection changes inflorescence and branching architectures of maize. Plant Physiology 156:2037-2052.
- Ghersa C.M., Satorre E.H. 1981. La dinámica de la población de rizomas de sorgo de alepo en relación con los sistemas de control más frecuentes. Revista Facultad de Agronomía 2:133-138.
- Hanna W.F. 1929. Studies in the physiologic and cytology of Ustilago zeae and Sporisorium reilianum. Phythopathology 19:415-444.
- Hirschhorn E. 1986. Las Ustilaginales de la flora Argentina. C.I.C. Ed. Comisión de Investigaciones Científicas de la Provincia de Buenos Aires 530 pp.
- Holm L.G., Plucknett D.L, Pancho J.V., Herberger, J.P. 1977. The world´s worst weeds, distribution and biology. pp. 54-61. University of Hawaii. Honolulu, Hawaii, USA.
- Kosiada T. 2011. In Vitro influence of selected fungicides on Sphacelotheca reiliana and Ustilago maydis. Journal of Plant Protection Research 51(4): 342-348.
- Luttrell E.S., Graigmiles J.P., Harris B.H. 1964. Effect of lose kernel smut on vegetative growth of Johnson grass and Sorghum. Phythopathology 54:612.
- Maddaloni J., Ferrari L. 2001. Forrajeras y pasturas del ecosistema templado húmedo de la Argentina. Editado por Universidad de Lomas de Zamora Argentina 520 pp.
- Martinez C., Roux C., Dargen R. 1999. Biotrophic development of Sporisorium reilianum f. sp. Zea in vegetative shoot apex of maize. Phytopathology 89:247-253.
- Martinez C., Roux, Ch., Jaunean D.R. 2002. The biological cycle of Sporisorium reilianum f. sp. zea: an overview using microscopy. Mycología 95:05-514.
- Matheussen A.M., Morgan P.W., Frederiksen R.A. 1990. Implication of gibberellins in head smut (Sporisorium reilianum) of Sorghum bicolour. Plant Physiology 96: 537-544.
- Matyac C.A. 1985. Histological development of Sphacaloteca reiliana on Zea maydis. Phytopathology 75:924-929.
- Matyac C.A., Kommedahal T. 1985. Ocurrence of clorotic spots on corn seedlings infected with Sphacelotheca reiliana and their use in evaluation of head smut resistance. Plant Disease 69:251-254.
- Méndez Fernández H., Ghersa C.M., Satorre E.H. 1983. El comportamiento de las semillas de Sorghum halepense (L.)Pers. En relación con la población de rizomas. Revista de la Facultad de Agronomía 3:227-231.
- Meyer S.E., Nelson D.L., Clement S.E. 2001. Evidence for resistance in the Bromus tectorum-Ustilago bullata pathosystem: implications for control. Can. J. Plant Pathology 23:19-27.
- Millhollon R. 2000. Loose kernel smut for biocontrol of Sorghum halepense in Saccharum sp. hybrids. Weed Science 48:645-652.
- Mitidieri A. 1984. Sorgo de Alepo: importancia, biología y aspectos básicos para su control. Biokemia 4:25-36.
- Moharam M.H.A., Leclerque A., Koch E. 2012. Cultural Characteristics of Sporisorium sorghi and detection of the pathogen in plant tissue by microscopy and polymererase chain reaction. Phytoparasitica 40: 475-483.
- Nasr I.A. 1976. Association of unusual symptoms with smut of sugarcane in the Sudan. Sugarcane Pathology Nº 15.
- O'Brien T.P., Mc Cully M.E. 1981. The study of plant structure (principles and selected methods). Melbourne: Termarcarphi Pty Ltd., Australia 357 pp.
- Osorio J.A., Frederiksen R.A. 1998. Development of an infection assay for Sporisorium reilianum, the head smut pathogen on sorghum. Plant Disease 82:1232-1236.
- Piper C.V. 1928. Cultivated grasses of secondary importance. U.S. Department of Agriculture Farmers Bulletin 1433.
- Reynolds E.S. 1963. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. Journals Cell Biology 55:541-552.
- SAS. 1989. SAS User’s guide-release 6.03. SAS Institute Inc. (Cary, USA).
- Satorre E.H., Ghersa C.M., Soriano A. 1981. Dinámica de la población de rizomas de sorgo de alepo. Efecto del cultivo de avena y del corte. Revista de la Facultad de Agronomía 2:115-123.
- Sharma R.L. 1956. Morphological modifications in sugarcane plant by systemic infection of smut (Ustilago scitaminea Syd.) Int. Soc. Sugar Technol. 9:1134-1168.
- Sinha O.K., Singh K., Misra, S.R. 1982. Stain technique for detection of smut hyphae in nodal buds of sugarcane. Plan Disease 66:932-933.
- Smith M.C., Holt J. 1997. Analytical models of weed biocontrol with sterilizing fungi: the consequences of differences in weed and pathogen life histories. Plant Pathology 46:306-319.
- Snetselaar K.I.M., Mims Ch.W. 1994. Light and electron microscopy of Ustilago maydis hyphae in maize. Mycological Research 98:347-355.
- Spurr A.R. 1969. A low-viscosity epoxy resin-embedding medium for electron microscopy. Journal Ultrastruct Research 26:31-43.
- Vánky K. 1985. Carpathian Ustilaginales. Usppsala, Almqvist & Wiksell International Stockholm-New York 309 pp.
- Verdejo J., Della Penna A., Madia M. 1995. Agentes fúngicos identificados en plantas de malezas. Proceed. XII Congreso Latinoamericano de Malezas. Uruguay. Resumen 113-115.
- Ward, K.J., Klepper B., Rickman R.W., Allmaras R.R. 1978. Quantitative estimation of living wheat-root lengths in soil cores. Agronomy Journal 70:675-677
- Wilson J.M., Frederiksen R.A. 1970. Histopatology of resistance in the Sorghum bicolor-Sphacelotheca reiliana interaction. Phytopathology 60:828-932.
- Williams R.D., Igber B.F. 1977. The effect of intraspecific competition on the growth and development of johnsongrass under greenhouse conditions. Weed Science 25:477-481.