INTRODUCCIÓN
Hortalizas como el pimentón y la lechuga son productos de alto valor económico a nivel mundial con alta demanda en la población por ser de los cultivos de mayor consumo por el hombre, lo que incrementa la necesidad de asegurar su producción y disponibilidad para fortalecer la seguridad alimentaria y nutricional en las diferentes naciones (FAO, 2014).
En los últimos años, en Venezuela, se ha hecho limitante la adquisición de semillas certificadas de hortalizas para la producción, lo que ha orientado hacia la búsqueda de alternativas para aprovechar mejor los recursos y evitar pérdidas en la producción. Ante esta situación los agricultores se han planteado la posibilidad de trasplantar desde plántulas y no sembrar directamente desde semillas, para de esta manera asegurar esta fase en el ciclo de producción de los cultivos frente al encarecimiento de las labores de campo.
Los microorganismos promotores del crecimiento vegetal (MPCV) son definidos por Vessey (2003) como una amplia variedad de bacterias y hongos que crecen asociados a raíces de plantas hospedadoras y en los micro hábitats de la rizósfera produciendo una estimulación del crecimiento de las plantas mediante distintos mecanismos de acción. Estos microorganismos interactúan positivamente entre la rizósfera y las plantas a través de efectos directos e indirectos como la producción de fitohormonas, fijación de N2, disolución de fosfatos, producción de sideróforos, control biológico (Rosas y Correa, 2003; Cisneros et al., 2016; Alcedo y Reyes, 2018), y la intervención en la toma de los nutrientes por las raíces de las plantas (Olmedo, 2003). Algunos géneros de estas bacterias que promueven el crecimiento de las plantas han sido Enterobacter sp. (Reyes et al., 2006), Bacillus sp. y Pseudomonas sp. (Tripura et al., 2007), Rhizobium sp. (Reyes et al., 2008), Pantoea sp. (Xiao et al., 2010) y Azospirillum sp. (Marquina et al., 2018), mientras que un género de hongos con el mismo efecto ha sido Penicillium sp. (Reyes et al. 1999).
Los representantes del género Rhizobium sp. han sido objeto de intensos estudios por su efecto como fijadores de N2 en la simbiosis Rhizobiumleguminosa; pero además de su modalidad de vida como simbiontes también pueden permanecer en el suelo viviendo como saprófitos o incluso como bacterias endofíticas colonizando plantas no leguminosas promoviendo así su crecimiento (Wang et al., 2001). Incluso, se han descrito algunas actividades biorremediadoras en rizobios (Blanco et al., 2013). Estas asociaciones entre rizobios y plantas no leguminosas pueden mejorar el crecimiento de las plantas en diferentes especies vegetales por los mecanismos ya mencionados (García et al., 2012; Vazallo et al., 2013; Marquina et al., 2018). Por esta razón planteamos la alternativa de disminuir las pérdidas en campo con plántulas inoculadas con rizobios promotores del crecimiento vegetal por ser más vigorosas y producidas en condiciones de umbráculo, que representen un éxito en el trasplante y por ende en la producción en campo.
El objetivo de este trabajo fue determinar el potencial promotor de crecimiento que presentan rizobios autóctonos sobre la supervivencia y vigor de plántulas de pimentón y lechuga, y realizar su identificación molecular, para proponerlos como biofertilizantes promisorios.
MATERIALES Y MÉTODOS
Crecimiento bacteriano y preparación de los inóculos. Diez cepas rizobiales identificadas como ME01, Nod2rojo, Leu2A, ES1, RmBorbollón, CP, Alf, Med, EV1 y YE1, y pertenecientes al cepario del Laboratorio de Fitobiotecnología-ULA, fueron aisladas de nódulos de plantas leguminosas de diferentes zonas del estado Mérida, Venezuela. Algunas de estas cepas se caracterizaron previamente como fijadoras de nitrógeno, disolventes de fosfatos y productoras de ácido indol acético (Marquina et al., 2018). Estos rizobios crecieron en medio agarizado extracto de levadura-manitol YMA modificado con 0,5 g.L-1 K2HPO4, 0,2 g·L -1 MgSO4·7H2O, 0,1 g·L -1 NaCl, 0,5 g·L -1 extracto de levadura, 2,5 g·L -1 manitol, 7,5 g·L -1 sacarosa, 2,5 mg·mL-1 rojo congo pH 6,7-6,8 (Vincent, 1975) a 29 ºC.
El período de incubación de los rizobios se realizó según la dinámica de crecimiento de cada aislado rizobiano, hasta su fase exponencialestacionaria (24-36 h) utilizando como modelo la curva de crecimiento para rizobios determinada por Blanco et al. (2013) en este medio de crecimiento. Los inóculos se prepararon de forma individual con el cultivo de cada aislado mediante el conteo celular con una cámara de Neubauer a una concentración 1x108 cel·mL-1 en solución salina 0,89 % NaCl. Se preparó un control solo con la solución salina. Seguidamente los inóculos se mantuvieron durante 20 minutos a 90 rpm en una agitadora a temperatura ambiente (22 °C).
Efecto de los rizobios sobre la germinación de pimentón y lechuga.Se utilizaron semillas de pimentón híbrido Quetzal y semillas de lechuga variedad Great Lakes. Las semillas de pimentón se desinfectaron mediante un lavado con una solución jabonosa al 1 % (jabón azul) durante 5 min, seguido de 5 enjuagues con agua destilada estéril. Luego se desinfectaron con cloro al 1,5% por 2 min y se lavaron 6 veces con agua destilada estéril. Las semillas de lechuga se desinfectaron solo con la solución jabonosa (dado que poseen una testa débil) durante 5 min seguido de 5 enjuagues con agua destilada estéril. Estos protocolos se estandarizaron previamente en el laboratorio. Las semillas desinfectadas se agregaron a los inóculos de cada aislado preparados previamente en matraces de 25 mL y se colocaron en un agitador orbicular marca Boeco OS-20 a 90 rpm durante 1 h.
El tratamiento control consistió en semillas añadidas a la solución salina libre de células (sin inóculo). Las semillas se sembraron en bandejas de aluminio provistas con papel absorbente humedecidas con agua destilada estéril y se taparon con una película transparente (envoplast), con mínimas perforaciones para el intercambio gaseoso de las plántulas. Las bandejas se mantuvieron cubiertas con papel de color beige, fotoperíodo de 16/8 horas a temperatura ambiente (22 °C), y se determinó la dinámica de germinación a partir de las 24 h de iniciado el experimento hasta que no se observó más germinación para cada especie vegetal. Se utilizaron 100 semillas por cada tratamiento con tres repeticiones cada uno.
Efecto promotor del crecimiento en fase de semillero.Un total de 20 plántulas germinadas de cada especie por tratamiento se trasplantó a bandejas de propagación provistas de un sustrato comercial inerte (pH de 5,8 y conductividad eléctrica de 0,127 dS·m-1 en suspensión 1:5) esterilizado por tindalización (calentamiento discontinuo del material), con capacidad de 50 celdas para C. annuum y de 160 celdas para L. sativa. A los 2 días del trasplante, se reinoculó con 1 mL de inóculo 1x108 cel·mL-1 preparado como se describió anteriormente.
Las plantas se mantuvieron en condiciones de umbráculo (Temp 28 °C, HR 59 %, luz 132 μmol·m -2 ·s -1 ) y se regaron diariamente o de acuerdo a las condiciones del tiempo. Las plantas se fertilizaron cada dos días con solución Hoagland (Taiz y Zeiger, 2010) al 1 /10 de su potencia desde el día 10 al día 15 del trasplante, luego con 1/5 de su potencia desde el día 15 al día 25 del trasplante, y desde el día 26 al día 30 del trasplante a ¼ de su potencia para la lechuga, y para el pimentón se regó hasta el día 60. Transcurrido ese tiempo (60 y 30 días para pimentón y lechuga, respectivamente) y solo al final del experimento se determinó el número de hojas, el diámetro de la base del tallo, la longitud (manualmente con una regla milimetrada), y el peso seco tanto de raíces como de la parte aérea. Se usó n=14 para pimentón y n=11 para lechuga.
Amplificación por PCR y secuenciamiento del ARNr 16S. El ADN genómico (ADNg) de los diez rizobios se aisló mediante el protocolo de extracción propuesto por He (2011). El ADNg fue usado como molde para amplificar mediante PCR el gen 16S ribosomal con los oligos universales fD1 y rP2 (Weisburg et al., 1991). Las condiciones de la mezcla de reacción fueron: buffer 1X, Mg2+ 1,5 mM, dNTPs 0,2 mM, oligos 0,3 µM, Taq Polimerasa: 0,1 U/µL, ADN molde diluído 1/10 1 µL en un volumen final 15 µL.
La amplificación se llevó a cabo con 30 ciclos de las siguientes condiciones: 95 ºC por 15 s, 57 ºC por 15 s, 72 ºC por 45 s. La cantidad y calidad del ADNg se verificó mediante electroforesis en gel de agarosa al 1 %. Los productos obtenidos se purificaron con el Kit PCR AccuPrep (Bioneer) antes de ser enviados a la compañía Macrogen (Corea del Sur) para su secuenciación.
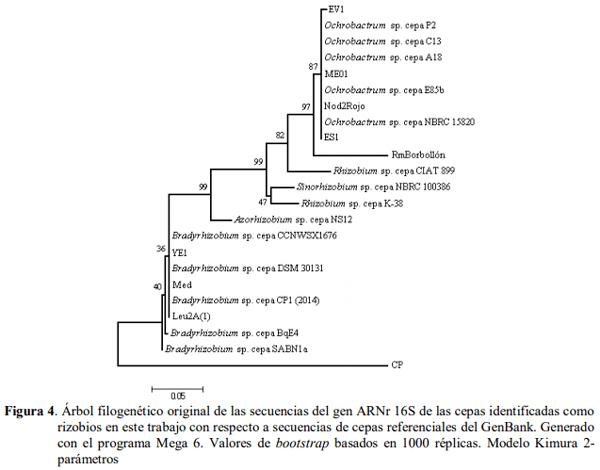
Análisis de las secuencias del ARNr 16S.El análisis filogenético de las secuencias nucleotídicas de las bacterias se realizó mediante programas bioinformáticos. Las secuencias se editaron con el programa Bioedit (Hall, 2005) y se compararon con las secuencias depositadas en el GenBank de la NCBI usando el programa BlastN (Altschul et al., 1997). Las secuencias se alinearon con el programa Clustal W (Thompson et al., 1994) y por último se realizó un árbol filogenético de las secuencias del gen 16S de las cepas identificadas como rizobios con respecto a secuencias de cepas referenciales del GenBank. Para ello, se utilizó la prueba de Neighbor-Joining (Saitou y Nei, 1987) y la prueba de filogenia con el modelo de sustitución Kimura 2-parámetros, 1000 réplicas, método bootstrap (Kimura, 1980) usando el programa Mega 6 (Tamura et al., 2013).
Análisis estadístico. Los resultados obtenidos de las pruebas realizadas se analizaron mediante un Anova y comparaciones contra el tratamiento control mediante la prueba de Dunnett utilizando el programa estadístico SPSS 20. Los análisis que no cumplieron con los supuestos de normalidad y homogeneidad de las varianzas se sometieron a la prueba Kruskall-Wallis con el programa estadístico Infostat.
RESULTADOS Y DISCUSIÓN
Efecto de los rizobios sobre la germinación de pimentón y lechuga.
El efecto promotor de la germinación se observó en el cuarto día para las semillas de pimentón con las cepas RmBorbollón y ME01 con 47 y 44 % de germinación. Considerando que la germinación en el control (no inoculado) fue de 25 %, el incremento con respecto a éste fue de 88 y 76 %, respectivamente (Figura 1). Se observa también que, con excepción de RmBorbollón, todos los tratamientos mostraron el pico de germinación a los cinco días.
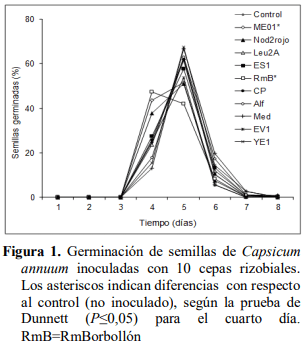
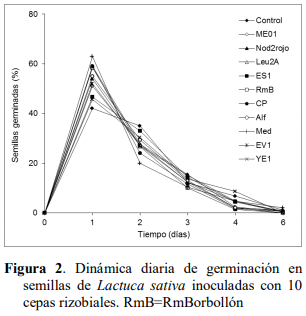
Un resultado similar obtuvieron Marquina et al. (2018) con el uso de algunas de estas mismas cepas pero con la variedad Cacique gigante de C. annuum, al acelerar la germinación en un día con respecto al control. Esta aceleración significativa de la germinación de las semillas de pimentón podría indicar un menor tiempo requerido para el establecimiento del semillero en condiciones de invernadero, implicando así una producción mayor a corto plazo a nivel comercial que podría darle mayor competitividad en el mercado de producción de plántulas con el uso de estas rizobacterias. Sin embargo, para la lechuga las cepas no mostraron efecto promotor de la germinación de las semillas en ningún día del experimento, puesto que no hubo diferencias significativas (P>0,05) de estos tratamientos con relación al control no inoculado (Figura 2).
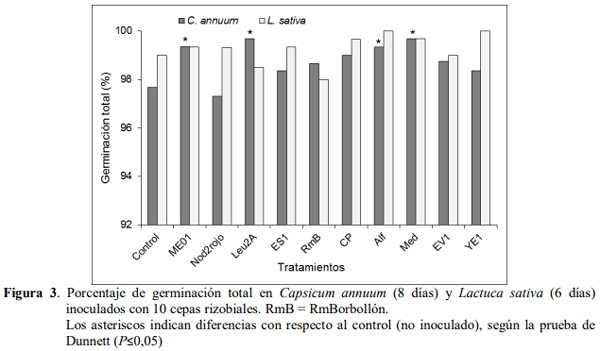
En la germinación total para el pimentón se encontró que con las cepas Alf, ME01, Leu2A y Med hubo una germinación en el último día (día 8) de 99,3; 99,3; 99,6 y 99,6 % respectivamente. Esto representó un incremento de 1,74 a 2,03 % con respecto al control cuya germinación total fue 97,6 % (Figura 3).
Resultados similares fueron reportados por Reyes et al. (2008), quienes obtuvieron incrementos en la germinación del pimentón entre 5 y 11 % con aislados rizobacterianos, especialmente el mayor incremento con la cepa 25 de Rhizobium sp, mientras que estas mismas cepas no incrementaron la germinación de maíz, sino que éste fue sensible a la inoculación con otras cepas como la 23 de Azospirillum sp. En contraste con estos resultados, la lechuga continuó con la tendencia ya señalada y las cepas utilizadas no incrementaron su germinación total con respecto al control no inoculado.
Efecto promotor del crecimiento en fase de semillero.Para la especie C. annuum las cepas que incrementaron significativamente al menos tres de las variables evaluadas entre el número de hojas, diámetro de la base del vástago, longitud aérea y longitud de raíz con respecto al control fueron ME01, Leu2A, ES1, CP, Alf, Med, EV1 y YE1. Dentro de ellas destacan las cepas ME01 y Med por ser las únicas que incrementaron el peso seco de la raíz con respecto al control no inoculado en 24,5 y 37,2 %, respectivamente.
Resultados favorables para pimentón también se han reportado por Reyes et al. (2008) en cuanto al incremento en el número de hojas, longitud de la raíz y el peso seco radical con bacterias de los géneros Azotobacter sp., Azospirillum sp. y Rhizobium sp. Asimismo, se encontró que la inoculación con Rhizobium etli tuvo un efecto positivo sobre el crecimiento de pimentón y la lechuga a los 20 días en condiciones de semillero al incrementar el peso seco de la raíz y el aéreo y la longitud de la hoja con respecto al control no inoculado (Soriano y González, 2012).
Particularmente, las variables peso seco raíz y peso seco aéreo se afectaron negativamente con las cepas EV1 y RmBorbollón (Cuadro 1), una respuesta que podría estar asociada al grado de hidratación de las plantas, ya que la disminución del peso seco se produjo en aquellas que mostraron un incremento en el diámetro y/o longitud del vástago y la raíz. En este sentido, Valery y Reyes (2013) proponen que la variedad de respuestas que se obtienen con los inoculantes puede depender de varios factores, entre ellos la naturaleza de la planta hospedadora, y los microorganismos inoculados, los cuales establecen competencia entre ellos por los exudados radicales de la planta, y los nutrientes del suelo. En la interrelación plantamicroorganismo, algunos microelementos podrían potenciar el efecto rizosférico (Cuperus, 2016) activando la maquinaria enzimática en la producción de metabolitos secundarios y fitohormonas, que en este caso podrían presentarse en cantidades inhibitorias para el crecimiento de esta especie vegetal. Boiero et al. (2007) reportaron la producción de ácido abscísico por cepas rizobiales; así, quizás la producción de ácido abscísico sería una de las razones del efecto negativo que ejercieron estas cepas sobre el crecimiento del pimentón, pues éste podría inducir el cierre estomático disminuyendo la incorporación de CO2 para la producción de fotoasimilados y la ganancia de biomasa en las plántulas (Taiz y Zeiger, 2010).
Por su parte, la especie L. sativa se mostró menos sensible a la acción de estos rizobios, pues solo tres cepas (ME01, Nod2rojo y Med) de las diez evaluadas mostraron algún efecto promotor de crecimiento sobre esta planta. Las cepas ME01 y Med incrementaron al menos dos variables de crecimiento y la primera de ellas se destacó adicionalmente por su efecto promotor del incremento del peso seco aéreo de la lechuga en 69,2 % con relación al control no inoculado (Cuadro 1).
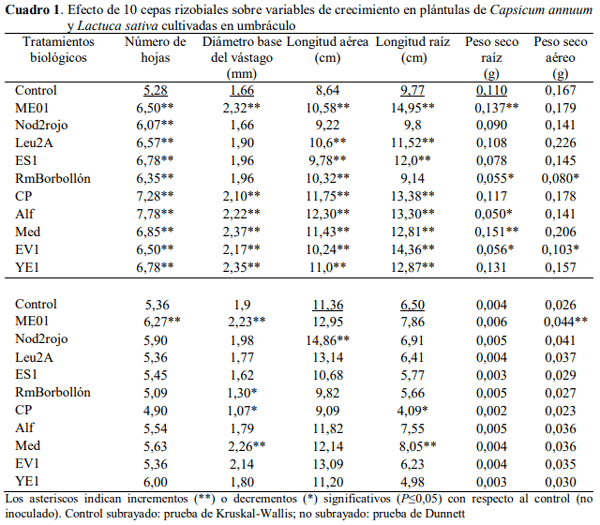
Un resultado similar pero menor fue reportado por Peña y Reyes (2007) quienes obtuvieron un incremento significativo del peso seco de las plantas de lechuga en condiciones de semillero a los 30 días, en 32,33 % por el aislado 33, un posible rizobio productor de AIA. Vale mencionar que el efecto que produjo la cepa CP sobre el crecimiento de la lechuga desfavoreció parámetros como el diámetro del vástago y la longitud de la raíz, por debajo del control no inoculado. No obstante, esta cepa sí se comportó como promisoria para el pimentón, lo que indica que puede haber una especificidad de acción entre los microorganismos y las especies vegetales.
Asimismo, la cepa Alf afectó favorablemente la germinación y hasta cuatro variables de crecimiento del pimentón pero ninguna variable en la lechuga. Este tipo de respuesta ha sido señalado por Reyes et al. (2006) quienes obtuvieron diferentes poblaciones microbianas en las mismas muestras de suelo pero con plantas hospedadoras disímiles las cuales difirieron en la cantidad de microorganismos asociados a los exudados rizosféricos, así como por Reyes y Valery (2007) quienes también encontraron que una misma especie vegetal cultivada en suelos con características fisico-químicas diferentes puede diferir en su población microbiana.
Las cepas que fueron promisorias para las variables de crecimiento, tanto en pimentón como lechuga, fueron ME01 y Med (Cuadro 1), lo que permitiría tomar en cuenta estas cepas rizobianas con alto potencial para la preparación de biofertilizantes funcionales para ambos cultivos.
La determinación de estos parámetros permitió establecer la vigorosidad de las plantas para tener un mayor éxito al momento del trasplante a campo, lo que reduciría pérdidas económicas para los agricultores y sería una ventaja en la producción. Ya se ha reportado la producción de AIA por cepas del género Rhizobium sp. (Wang et al., 1982). Ésta, junto a algunas características microbianas como la fijación de nitrógeno y disolución de fosfatos, que fueron determinadas previamente en el laboratorio son consideradas en la promoción del crecimiento de las plantas para la selección de bioinoculantes (Vessey, 2003).
Nuestro estudio permitió determinar el potencial biofertilizante de un conjunto de rizobios sobre dos especies vegetales en cuanto a la promoción del crecimiento de las plantas, encontrando que no se debe generalizar la aplicación de los inoculantes y que deben ser rigurosamente evaluados sobre diversas especies para observar su efecto benéfico o no benéfico antes de recomendar su aplicación para determinados cultivos agrícolas, pues también pueden tener un efecto adverso. Se debe estudiar la compatibilidad cepas-cultivo y su especificidad para ese cultivo y así asegurar su éxito porque cada cepa rizobacteriana puede expresar una interacción microbiana distinta de acuerdo a la relación bioquímica y ecológica que establezca con la planta, por la variedad de exudados radicales.
Trabajos anteriores han demostrado que el efecto promotor de una cepa en forma individual sobre una especie vegetal puede ser aun mejorado con la aplicación de consorcios microbianos de inóculos rizobacterianos en lechuga (Peña y Reyes, 2007; Blanco, 2014), como también, que el efecto puede ser benéfico solo de forma individual en maní forrajero y maíz (Anzuay et al., 2017). Por lo tanto, se recomienda la evaluación de estas cepas en forma de consorcio para determinar si existe o no un efecto sinérgico entre ellas en condiciones de umbráculo y de campo y de esta manera proponer un biofertilizante completo.
Identificación molecular de los rizobios. En el Cuadro 2 y la Figura 4 se muestran los resultados obtenidos para la identificación molecular de las cepas utilizadas. Se obtuvieron cinco cepas del género Ochrobactrum sp., cuatro cepas del género Bradyrhizobium sp., y una cepa del género Pseudomonas sp. Los géneros Ochrobactrum sp. y Bradyrhizobium sp. pertenecen al orden Rhizobiales (Kämpfer et al., 2014; Marcondes de Souza et al., 2014) como era lo esperado en este trabajo, pues las cepas provienen de aislamientos de nódulos de leguminosas.
En particular, se ha demostrado que el género Ochrobactrum, perteneciente a la familia Brucellaceae, está muy relacionado genéticamente con simbiontes de plantas y patógenos como Rhizobium, Mesorhizobium y Agrobacterium.
No es común aislar cepas del género Ochrobactrum a partir de nódulos de leguminosas. No obstante, este género es descrito como bacterias oportunistas que pueden vivir en el suelo y en el rizoplano (Kämpfer et al., 2014). Sin embargo, se obtuvo una cepa del género Pseudomonas sp., un género perteneciente al orden Pseudomonadales (Prescott, 2002) que no está descrito como bacteria nodulante. Marquina et al. (2011), identificaron un aislado de nódulo también perteneciente al género Pseudomonas sp., a lo que refiere una transferencia horizontal de genes en el suelo que ha permitido a lo largo de la evolución que otras bacterias que no son rizobios hayan adquirido la capacidad de nodular y de fijar nitrógeno en asociación con las plantas leguminosas. Por otra parte, esta identificación permitió corroborar los géneros obtenidos por Marquina et al. (2011) con RFLP para cuatro de estas cepas, aunque en nuestro estudio no obtuvimos los mismos géneros identificados por ellos. No obstante, una identificación adicional realizada utilizando los genes específicos nodC y nifH (Laguerre et al., 2001), arrojó que con nodC los porcentajes de identidad fueron de 99 y 94 con Bradyrhizobium japonicum para las cepas Leu2A y Nod2rojo, respectivamente, y 84 con Bradyrhizobium sp. para la cepa YE1. Así mismo, la identificación con el gen nifH, permitió identificar las cepas Leu2A en un 94 % de identidad con Bradyrhizobium japonicum y YE1 con un porcentaje de identidad de 100 con Bradyrhizobium sp., mientras que la cepa Alf se logró identificar con una identidad de 93 % con Pseudomonas fluorescens (datos no mostrados).
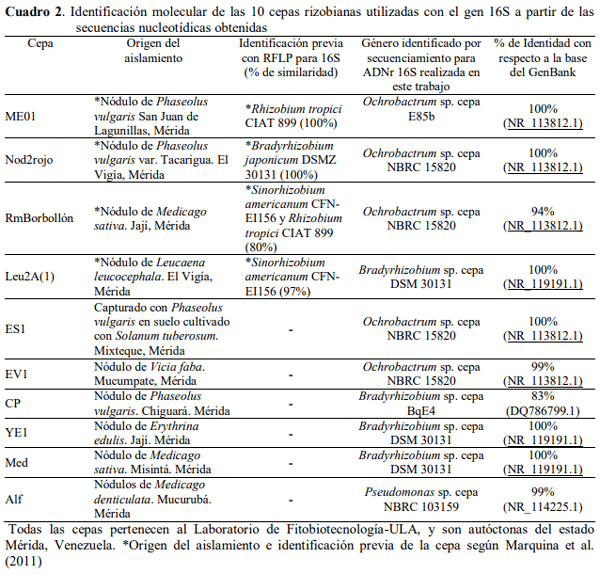
Estos resultados indicaron la importancia de la identificación molecular a nivel de género con genes más específicos que el 16S, pues con éste, por ser más general, se puede identificar con seguridad hasta el orden taxonómico al que pertenece una cepa, pero no tener la confianza de que pertenezca a determinado género. Sin embargo, para efectos prácticos de nuestra identificación y por las discrepancias y similitudes observadas en el Cuadro 2 y en la Figura 4, preferimos definir a las cepas ME01, Nod2rojo y RmBorbollón con la identificación realizada por Marquina et al. (2011). No obstante, consideramos que el porcentaje de identidad obtenido en este trabajo para las cepas RmBorbollón y CP es bajo para determinar el género, por lo que recomendamos resecuenciar para confirmarlo ya que, inclusive, pudiera tratarse de nuevas especies.
CONCLUSIONES
La producción de plántulas inoculadas se presenta como una alternativa agrícola sostenible y de impacto en la agroindustria venezolana. Los rizobios presentaron amplio potencial como biofertilizantes debido a que aceleraron e incrementaron la germinación del pimentón, aunque no la de lechuga. Mientras que su efecto sobre las dos especies vegetales fue diferencial con las cepas evaluadas, mostrando que existe una especificidad en su acción, así como un efecto benéfico o inhibitorio y que no debe generalizarse la aplicación de los inoculantes formulados. La mayoría de cepas pertenecieron al orden rizobial como era de esperarse para aislados de nódulos de leguminosas.
AGRADECIMIENTO
Al CDCHTA-ULA por el financiamiento de los proyectos C-1890-14-01-C y C-1928-15-01- B. Al Programa de Intercambio CientíficoULA por el financiamiento del Plan V. A la profesora Luz Thais Castro por la orientación bioinformática en la identificación molecular de las cepas, a los profesores Carle Valecillos y Benito Briceño, y al Sr. William Saavedra del Laboratorio de Fitobiotecnología-ULA por su colaboración. Y a Jordan Guillén de la UNESUR.