INTRODUCCIÓN.
La tendencia actual de los consumidores, apunta a ingerir alimentos que además de los beneficios originales que éste aportar le ayude en el mantenimiento de su salud y en la prevención de enfermedades; en algunos países se está cambiado el concepto de nutrición, pasando del papel de la dieta de aportar los nutrientes necesarios a la idea de que ésta puede contener alimentos que, además de nutrir, promuevan específicamente la salud. Pensando en ello, surgió el concepto de alimento funcional (AF), como una alternativa de suplir ambas necesidades, la idea se convirtió en una de mucho interés para las grandes compañías alimenticias, así como para la investigación agroindustrial. (Vasconcelos, 2009).
Los beneficios adicionales para la salud aportados por las bifidobacterias apuntan hacia un balance normal de la microflora especialmente en infantes y ancianos; mejora la tolerancia a la lactosa y en la digestibilidad de los productos lácteos; reducción en los niveles de colesterol del suero, síntesis del complejo de Vitamina B y absorción de calcio, efecto antidiarreico, entre otras ( Shah, 2007). Para que esto ocurra los alimentos deben contener un mínimo de 1.0 x 106 ufc/g del cultivo en el producto al momento de consumo (Sanz, 2000).
Existe una amplia lista de alimentos que aportan probióticos, encabezada principalmente por los lácteos, los cuales han sido investigados ampliamente (Kaur et al 2002; Doleyres y Lacroix 2005) pero no existe estudios orientados hacia los productos derivados de frutas tropicales, para diversificar el renglón; en este caso particular se desea evaluar la supervivencia de BB en un néctar de mango “bocado” planteando como parámetro de objetabilidad, la pérdida de funcionabilidad del producto (1.0 x 106 ufc/g). Los objetivos específicos orientados en esta investigación fueron: graficar los cambios de los valores de la absorbancia en el tiempo por efecto del BB en caldo MRS; para establecer el tiempo de inoculación del microorganismo en el néctar, y analizar los cambios que ocurren durante 21 días de almacenamiento a 4ºC, los recuentos de aerobios mesófilos, BB y mohos y levaduras así como las variables físicas pH y acidez titulable en el néctar de mango, esto con el fin de establecer la variable critica y estimar la vida útil del producto aplicando metodología cinética.
MATERIALES Y MÉTODOS.
Material Vegetal. Los frutos de Mangifera indica var. bocado, se recolectaron en sector Caño Hondo del Municipio Ricaurte, estado Cojedes, Venezuela (pertenecientes a la cosecha mayo 2009). Se muestrearon de acuerdo a sugerencias COVENIN (1981). Los frutos fueron lavados con agua para consumo con el fin de eliminar la flora epifita contenida en los mangos provenientes del campo. Diseño de la investigación.
El diseño de la investigación es seriado en el tiempo, donde los datos obtenidos fueron utilizados para obtener modelos que estimen el comportamiento microbiológico (aerobios mesófilos, mohos y levaduras y BB), variaciones de acidez titulable y pH. Obtención de la pulpa.
Los mangos fueron transportados, una vez clasificados por tamaño y grado de madurez en cestas plásticas de capacidad de 25 Kg y fueron llevadas al Laboratorio de Ingeniería y Tecnología de los Alimentos (LITA), de la UNELLEZ- Cojedes donde se hizo una selección y luego se lavaron por inmersión en agua clorada a temperatura ambiente (35ºC), con el fin de eliminar residuos de suciedad, impurezas y flora microbiana externa, luego se hizo un escaldado en cocina de vapor a 85ºC/5 min. para ablandarlos y aumentar el rendimiento de extracción, así como también inactivar enzimas encargadas de causar pardeamiento enzimatico como la polifenol oxidasa, luego se enfrió con agua a temperatura ambiente, se les eliminó la piel (epicarpio), se cortó en trozos, para luego despulpar a través de un tamiz de 0,20 pulg. y separar las semillas de la pulpa. La misma se calentó en una marmita hasta 85 ºC, y se enfrió a temperatura ambiente.
Activación del microorganismo probiótico liofilizado.
Se utilizó una cepa comercial en forma de cultivo puro liofilizado de la cual se activó un gramo, mediante su rehidratación en 99 ml caldo MRS modificado (Man Rogosa y Sharpe), suplementado con 0,05 % (p/v) de L – Cisteína (este aminoácido es una fuente esencial de nitrógeno para BB y tiene una función adicional de reducir el potencial de oxido – reducción del medio, lo cual mejora las condiciones anaeróbicas estrictas como lo son estas) y 5 % (p/v) de lactosa e incubando en condiciones anaeróbicas a 37 °C durante 24 horas. Una vez culminado el tiempo de incubación ya está reconstituido el microorganismo y se incorporó nuevamente en 900 ml del mismo medio recién preparado, distribuido e incubado bajo las mismas condiciones antes descritas.
Se realizó una curva de crecimiento empleando la técnica de medición de densidad celular en el espectrofotómetro, a una longitud de onda de 600 nm en el Spectronic 20. Para tal fin se partió de un cultivo previamente rehidratado en caldo MRS modificado como ya se ha descrito. Seguidamente este cultivo fue incorporado al 5 % (v/v) en el mismo medio recién preparado, distribuido en tubos de ensayo con tapa de rosca e incubado bajo las misma condiciones cuando fue rehidratado, y después de transcurrir cada hora se tomó un tubo con la muestra incubada y le se midió la absorbancia, hasta lograr establecer, el tiempo en se alcanza la fase estacionaria, siendo está de 26 horas.
Obtención del título de la Bífidobacteria
Una vez transferido e incubado en 900 ml de medio de cultivo incubado a 37ºC por 24 horas, se procedió a realizar las diluciones respectivas y la siembra en profundidad en agar MRS, suplementado de la misma forma que el caldo de cultivo utilizado para hacer crecer el microorganismo, de acuerdo al procedimiento descrito en la figura 3, agregando una sobrecapa de agar para mejorar las condiciones anaeróbicas y luego incubarlas en frascos de anaerobiosis a 37ºC por 72 horas para hacer el recuento en placa y obtener el número de células viables.
Elaboración del néctar. El néctar fue elaborado bajo la formulación propuesta por Gámez y García (2010). La pulpa de mango fue descongelada en baño de maría hasta temperatura ambiente y se homogeneizó en una batidora por 10 min, luego se diluyó al 20 %, con agua potable; fue ajustado su pH a 6 y se le corrigió los sólidos solubles a 12 °Brix; después se pasteurizó la mezcla; sometiendola a calor hasta alcanzar los 85°C seguidamente se envasaron las muestras en caliente en los tubos de ensayo de 10 ml respectivos, para luego se dejar enfriar a temperatura ambiente (20 a 30°C).
Una vez obtenido y enfriado el néctar, se procedió a inocular el BB de acuerdo al protocolo establecido.
Inoculación del néctar de mango con BB.
A partir del cultivo de BB previamente estandarizado y en fase estacionaria de crecimiento se llevó a cabo una centrifugación del mismo a una velocidad de 10.000 rpm durante 20 minutos. Una vez culminada la centrifugación el sobrenadante fue descartado y el sedimento se pesó e incorporó al 10 % en el néctar de mango, a temperatura ambiente comprendida entre 25 a 30 °C y previamente pasteurizado, manteniéndose bajo condiciones asépticas y anaeróbicas, este se homogenizó y se almacenó a una temperatura de refrigeración (4º C). de acuerdo a Medina et al, (2007) efectuándose un recuento de BB, cada 3 días, obteniéndose ocho mediciones experimentales en el tiempo.
Técnicas de recolección de datos. Análisis microbiológicos Para la caracterización microbiológica se utilizaron los siguientes pasos.
Recolección de muestras
Para recolectar los datos de los ensayos para la caracterización microbiológica, se tomó una alícuota de 10 ml muestra en 100 ml de agua peptonada al 0,1 % (COVENIN 1989). Seguidamente se realizaron diluciones seriadas y se procedió a sembrar los siguientes microorganismos: AM, ML y BB
El Recuentos de Aerobios mesófilos (AM): según COVENIN (1978), recuentos de Mohos y Levaduras (ML), según COVENIN (1990)
Recuentos de BB
Para el recuentos de BB, se realizó una siembra por profundidad en placas de petri desechables, a partir de las diluciones 10-5 , 10-6 y 10-7 preparados con agua peptonada al 0,1 %. En cada placa de aplicó una sobrecapa de agar para garantizar las condiciones anaeróbicas, además de adicionarle a dicha cubierta un agente antibiótico denominado Polimixina B al 0,005 % (p/v), luego las placas se incubaron en condiciones anaeróbicas del sistema de frascos de anaerobiosis a 37 °C durante 72 horas, quedando así determinado el número de células viables (Medina et al, 2007).
Análisis fisicoquímicos Para recolectar los datos de las características fisicoquímicas se utilizaron los siguientes métodos.
El pH según COVENIN (1979) y acidez titulable según la norma COVENIN (1986).
Técnicas de análisis de datos. Se utilizo regresión lineal para determinar el ajuste de los modelos de las variables microbiológicas y fisicoquímicas. Para la determinación de vida útil, los datos fueron analizados siguiendo las recomendaciones de Fernández y Garcia (2010).
RESULTADOS Y ANÁLISIS.
Análisis de las variables físicas (pH y AT) y microbiológicas (AM, ML y BB).
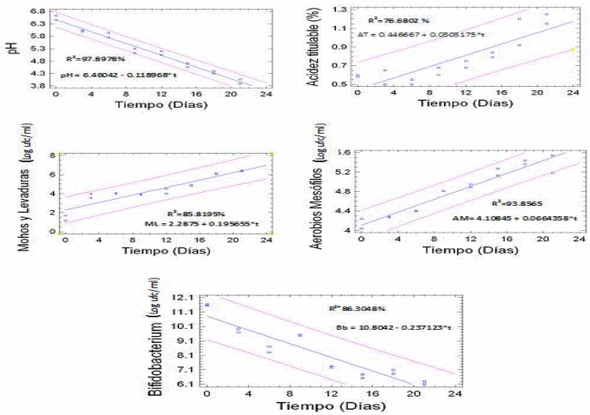
En la figura 1, se muestran los cambios físicos y microbiológicos que ocurren en el néctar de mango durante el tiempo de almacenamiento, en esta figura se visualiza que a medida que transcurre el tiempo de almacenamiento ensayado, ocurre un incremento lineal en las respuestas como se van presentando, AM y ML. Contrario comportamiento es el mostrado en los valores de pH, y recuento de BB, donde los valores tienden a disminuir en el tiempo de manera lineal.
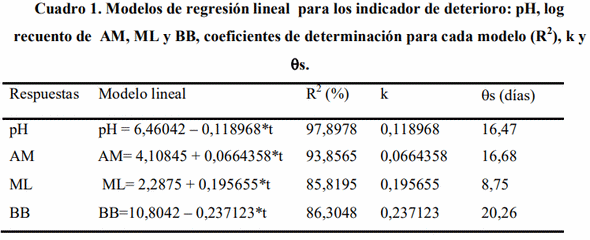
Los valores para los coeficientes de determinación (R2 ) para cada modelo son: 93,8565%, 85,8195%, 97,8978%, 86,3048%, 76,6802%, respectivamente, los cuales son indicadores de buena predicción de estos, ya que los mismos se hallan en un rango de 80 a 100% según (Chacín, 2000). El modelo de regresión lineal no se ajustó para la respuesta acidez titulable. En el cuadro 1 se presenta a manera de resumen los modelos de regresión lineal para los indicadores de deterioro, y los coeficientes de determinación para cada modelo (R2 ).
El R2 de los modelos, esta dentro del rango de buena predicción (80-100%). en el caso del log recuento de bifidobacterium sp (RB), para la disminución del recuento de bifidus en el tiempo, La pendiente (k) negativa, indica el decrecimiento del indicador de calidad. Siendo lógico los resultados ya que Labuza (1982); Roa (1999); Fernández et al. (2007); manifiestan que la disminución del recuento o muerte del microorganismo presenta pendiente negativa. Con el pH ocurre algo similar; decrece con el tiempo.
Figura 1. Comportamiento de las variable: fisicoquímicas (pH y acidez titulable total) y microbiológicas (aerobios mesófilos, mohos y levaduras, y BB) durante los 21 días de almacenamiento del néctar.
Estimación de la vida útil del producto
El valor de k y la vida de útil estimada (?s) se visualizan en el cuadro 1. Se considera como límite crítico el valor de log 6 para la funcionabilidad del producto, la cual dura 20 días, resultado superior al obtenido por Tapia (2007) en recubrimiento de alginato y gelano, que encontró un tiempo de 10 días a 4ºC como satisfactorio ya que sus valores permanecieron entre 6 y 7 Log ufc/g. Para las otras variables microbiológicas los límites críticos se tomaron de acuerdo a COVENIN (1993), la cual indica que convertidos a forma logarítmica log serían los siguientes: Aerobios mesófilos (3); Mohos (2) y Levaduras (2); para pH el criterio usado es 4,5 Kailasapathy et al. (2008) como valor crítico, mientras que para la acidez titulable el valor critico establecido es 0,7 % (COVENIN, 1973).
Al estudiar los valores de pH y acidez titulable total, estos se ubican en cifras de un producto de baja acidez respecto al tiempo, lo cual representa un obstáculo significativo, en la viabilidad y supervivencia de los bífidos, ya que estos de acuerdo a Payne et al (1999) el óptimo pH está en el rango de 6,8 – 7. Aunque Kailasapathy et al. (2008) demostró alta viabilidad del Bifidobacterium animalis ssp a pH entre 4,4 – 4,5, igualmente Capela et al. (2006) encontró en muestras de yogurt liofilizado con pH cercanos a 4,5; que a medida que disminuye el pH (< 4,5) declina significativamente la viabilidad del organismos probióticos. Esto explica el rápido deterioro de la calidad funcional que presenta el néctar ya que estos valores de pH estresan radicalmente al BB inoculado.
Comparando los resultados de vida útil por cada indicador, se afirma, que para este caso el indicador de deterioro es mohos y levaduras, ya que en el calculo de vida útil, este arrojó el menor valor, en consecuencia se estima la vida útil en 9 días aproximadamente. Los mohos y levaduras son los indicadores críticos de deterioro críticos para néctares (Gámez y García, 2009).
CONCLUSIONES
- El pico de crecimiento de la cepa de BB utilizada ocurre a las 28 horas de reconstituido el microorganismo.
- El pH tendió a disminuir linealmente con respecto al tiempo
- La acidez no aumentó de manera lineal.
- El indicador de funcionabilidad para el logaritmo del recuento del Bifidobacterium, estimado según el modelo, en 20 días aproximados.
- El indicador de deterioro resulto ser la respuesta mohos y levaduras, ya que la vida útil se estimó de acuerdo a este parámetro, en 9 días aproximadamente