Efecto del ácido giberélico en la propagación in vitro de Stevia rebaudiana (Bertoni) Bertoni, “estevia”
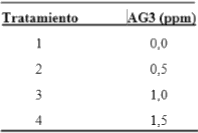
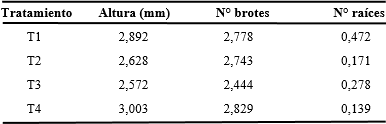
Stevia rebaudiana (Bertoni) Bertoni (Asteraceae), conocida como “estevia”, es una planta herbácea originaria del suroeste de Brasil y Paraguay y cultivada en muchos países del mundo debido a que contiene un esteviósido utilizado como edulcorante, el cual no se metaboliza en nuestro organismo, por tanto, no eleva el nivel de glucosa en la sangre. Se propaga vegetativamente por esquejes, método sencillo pero no suficiente para implementar sistemas de propagación masiva ya que su propagación por semillas solo se hace con fines de investigación, motivo por el cual nos proponemos implementar el método de micropropagación in vitro aplicando diferentes concentraciones de ácido giberélico y así lograr mediante esta tecnología un sistema de propagación masiva de alta calidad genética y fitosanitaria, a bajos costos y en cantidades suficientes para abastecer las necesidades. Las plantas madres utilizadas procedieron del Laboratorio de Biotecnología del Instituto de la Papa y Cultivos Andinos de la Universidad Nacional de Trujillo. Se utilizaron segmentos nodales con una yema y se cultivaron en M & S, 1962 suplementado con 0,00; 0,50 y 1,00 ppm de ácido giberélico, los cuales constituyeron los tratamientos. Se analizó el efecto de estas concentraciones en los parámetros altura de plántula, número de raíces y raíz más desarrollada. El análisis de varianza aplicado no encontró diferencias significativas entre estos tratamientos y para los parámetros analizados, concluyendo que, a las concentraciones trabajadas, el ácido giberélico no ejerce ningún efecto, pudiéndose micropropagar S. rebaudiana por segmentos nodales sin la presencia de este fitrorregulador.
Palabras clave: Stevia rebaudiana, micropropagación, acido giberélico.


A. L.: Recolección de datos, redacción, análisis e interpretación de los mismos.
A. D. l. C.: Análisis, interpretación de los datos, revisión crítica del texto.
Los autores declaran no tener conflictos de intereses.
- Alvarenga, S. & T. Salazar. 2015. Micropropagación masiva de Stevia rebaudiana Bertoni en sistemas de inmersión temporal. Cultivos Tropicales, 36 (3): 50-57
- Barceló, J.; G. Rodrigo; B. Sabater & R. Sánchez. 1992. Fisiología Vegetal. 6ta. Edición. Edit. Pirámi- de. Madrid, España.
- Durán, S.; M. Rodríguez; K. Cordón & J. Record. 2012. Estevia (Stevia rebaudiana), edulcorante na- tural y no calórico. Rev. Chil. Nutr., 39 (4): 203-206. versión On-line ISSN 0717-7518 http://dx.doi. org/10.4067/S0717-75182012000400015.
- Jarma, A. 2010. Adaptación de dos clones de estevia (Stevia rebaudiana Bert.) a tres ambientes del Ca- ribe Colombiano. Tesis de doctorado. Universidad Nacional de Colombia.
- Jeria D. & A. Pozo. 2011. Estudio del secado convec- tivo de hojas de Stevia rebaudiana y factibilidad técnico-económica de una planta elaboradora de edulcorante a base de stevia. Tesis de Grado. Uni- versidad de Chile.
- Herrera, F.; R. Gómez & C. González. 2012. El cultivo de Stevia (Stevia rebaudiana) Bertoni en condicio- nes agroambientales de Nayarit, México. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Folleto Técnico número 19, Primera Edición. ISBN: 978-607-425-819-6. México. 43 pp.
- Landázuri, P. & J. Tigrero. 2009. Stevia rebaudiana Bertoni, una planta medicinal. Bol. Téc. Edición Es- pecial. ESPE. Ecuador.
- Lee, H.; J. Cruz & B. García. 2003. Proliferación de Brotes Múltiples y Aclimatación de Anturio (Anthu- rium andreanum L.) ‘Midori’ Y ‘Kalapana’ cultiva- dos in vitro. Rev. Fitotec. Mex., 26 (4): 301 – 307.
- López, E.; E. Gil & A. López. 2016. Enraizamiento de esquejes de Stevia rebaudiana Bertoni (Astera- ceae) “estevia”, aplicando dosis creciente de ácido indolbutírico. Arnaldoa 23 (2): 569 – 576
- Martínez, M. 2015. Stevia rebaudiana (Bert.) Bertoni. Una revisión. Cultrop. 36(1): 5-15. La Habana. versión On-line ISSN 1819-4087. Disponible en http://scieloprueba.sld.cu/scielo.php?script=sci_ arttext&pid=S0258- 9362015000500001&lng=e s&tlng=es. Acceso; 25 de julio del 2017.
- Martínez, D.; A. Urrea; E. Jiménez & L. Atehortua. 2016. Estrategia para la propagación in vitro de Stevia rebaudiana Bertoni. Rev. Biotec. Veg., 16 (3): 131 – 142.
- Meienberg F.; L. Sommer; T. Lebrecht; M. Lovera; S. Gonzalez; B. Luig; V. Bremen; K. Steiner; M. Glauser & U. Kienle. 2015. El sabor agridulce de la stevia. Publicación de la Declaración de Berna, CEIDRA, Misereor, Pro Stevia Suiza, SUNU, Uni- versidad de Hohenheim (Alemania), Universidad Católica Nuestra Sra. de la Asunción.
- Ortega, L., J. Ocampo, C. Martínez, A. Pérez y J. Sán- chez. 2013. Efecto de las giberelinas sobre el creci- miento y calidad de plántulas de tomate. Revista de Ciencias Biológicas y de la Salud www.biotecnia. uson.mx Universidad de Sonora. 15(3): 56 - 60.
- Oviedo, D.; S. Alvarenga, S. Evangelista, G. Sepúlve- da & M. Rodríguez. 2015. Micropropagación de Stevia rebaudiana Bertoni, un Cultivo Promisorio para México. Bio Tecnología. 19 (2): 14-27.
- Quezada, F. 2011. Propagación por esquejes de stevia (Stevia rebaudiana Bert) en tres sustratos y dos do- sis de hormona de enraizamiento bajo invernadero en el Cantón Santa Isabel. Tesis de Grado. Universi- dad de Cuenca. Ecuador.
- Randall, C.; D. Flores, L. Alvarado, A. Schmidt, C.Alvarado. 2014. Cultivo in vitro del tomate de árbol (Cyphomandra betacea (Cav.) Sendt. (Feno- tipo naranja) proveniente de Costa Rica. Tecnología en Marcha. Revista VI Encuentro de Investigación. 45-55.
- Salazar T. 2014. Caracterización de los sitios de cultivo potenciales en Costa Rica para la especie Stevia rebaudiana Bertoni. Tesis de Maestría. Instituto Tecnológico de Costa Rica.
- Salvador, R.; M. Sotelo & L. Paucar. 2014. Estudio de la Stevia (Stevia rebaudiana Bertoni) como edulcorante natural y su uso en beneficio de la salud. Scientia Agropecuaria 5 (3): versión impre- sa ISSN 2077-9917.
- Steel H. & J. Torrie. 1989. Bioestadística. McGraw-Hill Co. México.
- Suarez, I. & I. Quintero. 2014. Micropropagación de Stevia rebaudiana Bertoni, un endulzante natural a través de explantes con meristemos pre-existentes. Rev. Colomb. Biotecnol., 16 (1): 29-33.
- Taiariol, D. & N. Molina. 2010. Alternativas Producti- vas. Producción de Stevia rebaudiana Bertoni (Ka’a He’ê) en Bella Vista (Corrientes). Análisis técnico y económico de una alternativa sustentable. EEA INTA Bella Vista, Argentina. Publicación Técnica Nº 37 ISSN 1515-9299. 17 pp.
- Thiers, B. 2017. Index Herbariorum: A global directory of public herbaria and associated staff. New York Botanical Garden’s Virtual Herbarium. Disponible: http://sweetgum.nybg.org/science/ih/. Acceso: 28 agosto 2017.
- Torres, A.; L. Styer & J. Amauri. 1991. Cultura de te- cidos e transfromacao Genética de Plantas. Vol II. Servico de producao de informacao-SPI. Brasilia. DF.
- Vázquez L. 2012. Cultivo in vitro de Stevia rebaudiana Bertoni. Tesis de Maestria. Colegio de Postgradua- dos. México.
- Vázquez, L.; A. Robledo; A. Muratalla & V. Conde. 2014. Micropropagación de Stevia rebaudiana Bertoni y detección de steviósidos. Bioagro 26(1): 49-56.
