Cultivos Genéticamente Modificados
Impacto Ambiental de los Cultivos Genéticamente Modificados: El caso del Maíz Bt
Publicado: 7 de junio de 2007
Por: PERMINGEAT, Hugo; MARGARIT, Ezequiel. Centro de Estudios Fotosintéticos y Bioquímicos. Cátedra Química Biológica. UNR. Argentina
En el año 2004 fueron cultivadas en el mundo 272 millones de hectáreas, de las cuales 81 millones (29,7 %) correspondieron a cultivos transgénicos. Veintiún países hicieron adopción de organismos vegetales genéticamente modificados (OVGM), 6 de los cuales sembraron el 99 % de la superficie mencionada: Estados Unidos, Argentina, Canadá, Brasil, China y Sudáfrica (James, 2004).
La tecnología Bt combinada con la ingeniería genética de cultivos ha sido una de las aplicaciones más adoptadas (15,6 millones de has, 19 % de las 81 millones de has) en 2 cultivos mayores: maíz y algodón (James, 2004). Esta tecnología se basa en la expresión en plantas de genes provenientes de Bacillus thuringiensis (Berliner) (Bt), los cuales codifican proteínas de control de insectos. Estas proteínas se caracterizan por una elevada especificidad sobre el insecto blanco, y en base a esta especificidad, a la caracterización molecular e inmunológica se clasifican las más de 100 versiones de genes Cry y Cyt aislados y estudiados (Para una revisión, ver de Maagd et al, 2001).
Si bien Bacillus thuringiensis (B.) ha sido utilizado como insecticida biológico desde mediados del siglo pasado, el éxito de la expresión en plantas se ha logrado cuando la transformación genética involucró la inserción de versiones sintéticas de estos genes, adaptando las secuencias nucleotídicas a los marcos de lectura de las plantas receptoras (mayor contenido de C y G, eliminación de secuencias responsables de la inestabilidad y procesamiento del mRNA, eliminación de secuencias ATTTA responsables de la poliadenilación temprana del mensajero, etc.). Así se generaron y autorizaron para la comercialización (hasta el momento) 3 eventos independientes de maíz transgénico Bt y 1 evento de algodón transgénico Bt (AGBIOS, 2004). Estos eventos, además de diferir en la secuencia codificante de la región truncada de la delta-endotoxina CryIA(b) de Bacillus thuringiensis (B.) para controlar insectos lepidópteros, responden a distintas construcciones génicas, promotores y regiones codificantes (Figura 1). En todos los casos, el modo de acción de las proteínas Bt se basa en la formación de poros líticos en las membranas de las células del epitelio del intestino medio de los insectos blanco (Schnepf et al, 1998), donde la toxina se une específicamente a glicolípidos receptores presentes en éstos y en nematodes y ausentes en vertebrados (Griffitts et al, 2005).
Figura 1: Estructuras de los genes introducidos en los eventos transgénicas Bt de maíz (MON180, E176, Bt11) y algodón (MON531) presentes en mercado.

REFERENCIAS:p35S: Promotor CaMV35S; En35S: estimulador transcripcional del CaMV35S; In hsp70: intrón de la proteína de shock térmico 70 de maíz; CryIA..syn: gen sintético de la delta-endotoxina de Bacillus thuringiensis (B.); pPEPC: promotor de la PEPCarboxilasa de maíz; pCDPK: promotor de una proteín-cinasa dependiente de calcio de polen de maíz; In9PEPC: intrón 9 de la PEPCarboxilasa de maíz; T35S: señal de poliadenilación del CaMV35S; In IVS6: intrón 6 de la IVS alcohol deshidrogenasa de maíz; T nos: señal de poliadenilación de la nopalina sintetasa de Agrobacterium tumefaciens (Smith and Townsend); T-ß-C: señal 3´de poliadenilación del gen de la ß-conglicina de soja
(Fuente: AGBIOS, 2004).
Ventajas de la tecnología Bt
La alta adopción de los cultivos Bt se debe a las ventajas de los mismos respecto de los biocidas aplicados normalmente y de los productos derivados de Bacillus thuringiensis (B.). Entre esas ventajas está la expresión constante de las proteínas Cry que, comparada con la aplicación de plaguicidas y de productos derivados de B. thuringiensis (B.), no estaría sujeta a distintos condicionamientos como el momento de la aplicación, el lavado del producto por precipitaciones y la inactivación del mismo por exposición a la luz solar (en el caso de los productos derivados de B. thuringiensis -B.-).
Otra de las ventajas está constituida por la presencia de proteínas Cry en partes de la planta donde los plaguicidas químicos y biológicos no son capaces de llegar, otorgando así un control más efectivo.
Además, la especificidad de las toxinas presentes tanto en los productos de B. thuringiensis (B.) como en las plantas transgénicas, permite el control específico de plagas que afectan el cultivo sin mostrar toxicidad hacia otros integrantes del ecosistema (Betz et al, 2000).
Otro de los beneficios de la aplicación de esta tecnología es la disminución de algunas micotoxinas en los granos (en el caso del maíz Bt), sustancias producidas por hongos con propiedades tóxicas para el hombre y animales. Como resultado del daño que causan los insectos (especialmente el barrenador del tallo y la isoca de la espiga) al atacar el cultivo, las esporas de diferentes hongos tienen acceso a los tejidos jóvenes del grano y la espiga, donde proliferan y producen micotoxinas, siendo las más comunes la fumonisina y la aflatoxina. En la defensa contra insectos, las plantas transgénicas no ofrecen heridas como puertas de infección de los hongos, y por lo tanto la cantidad de fumonisina presente en los granos de los híbridos Bt es hasta 10 veces inferior que el mismo genotipo no transgénico (Masoero et al, 1999; Munkvold et al, 1997, 1999; Clements et al, 2003). Asociado a este beneficio, se observó una mayor tasa de conversión de alimento a carne en pollos parrilleros cuando la dieta contuvo granos de maíz transgénico Bt en comparación con otra equivalente constituida por maíz no transgénico, criados ambos lotes de pollos bajo las mismas condiciones ambientales (Brake y Vlachos , 1998).
Impacto ambiental de la tecnología Bt
Desde la aparición de las primeras plantas transgénicas conteniendo genes de interés comercial surgió la necesidad de medir el impacto ambiental de las mismas en los sistemas de cultivo y en el ecosistema.
Internacionalmente se desarrollaron estrategias regulatorias según las cuales cada evento transgénico en estudio ó comercialmente disponible debe primero superar una etapa de evaluación de riesgo ambiental antes de ser desregulado, creándose distintos organismos evaluadores del riesgo que los OVGMs generan (Jaffe, 2004).
En este contexto, uno de los casos mejor estudiados lo constituye la tecnología Bt, especialmente para dos cultivos muy importantes, como el maíz y el algodón. Entre los aspectos que involucran estos estudios enmarcados en el impacto ambiental sobresalen los siguientes: Invasividad de los cultivos genéticamente modificados.
La introducción de nuevas características a los cultivos podría brindarle a los mismos mejores cualidades para la supervivencia en el medio ambiente, convirtiéndolos así en potenciales malezas de otros cultivos (Dale et al, 2002). En un estudio realizado en un período de 10 años por Crawley et al (2001), se evaluaron las capacidades de distintos eventos transgénicos (dentro de ellos cultivos Bt) para convertirse en malezas de los cultivos ó invasoras de hábitats naturales. En ellos no se encontraron plantas que poseyeran tales características, considerándose que la capacidad de una planta para convertirse en maleza no estaría regida únicamente por un solo gen, sino que sería regida por al menos una docena de ellos (Luby and McNichol, 1995). Así, para los maíces y el algodón BT, no se ha detectado que la introducción de estos genes provea de capacidad a la planta de convertirse en maleza (AGBIOS, 2004).
Dispersión génica.
Ésta puede ocurrir a través del polen desde un cultivo modificado (por técnicas convencionales ó de ingeniería genética) hacia otras plantas ó especies presentes en el ecosistema. Es necesario tener en cuenta que en el proceso de dispersión hacen falta que se cumplan distintos requisitos como: migración del polen desde el cultivo transgénico, influenciada por la longevidad del polen y su forma de dispersión (viento, insectos polinizadores, etc.); la sincronización de la floración entre la planta dadora y la receptora del polen; la compatibilidad sexual entre las plantas participantes del proceso y la ecología de la especie receptora (Dale et al, 2002; Stewart et al, 2003). Se han encontrado muchos casos de transferencia génica desde cultivos de valor agronómico desarrollados por técnicas convencionales hacia malezas relacionadas (Dale et al, 2002), mostrándose de esta manera la factibilidad de ocurrencia de este fenómeno en condiciones naturales.
Cabe destacar que las plantas transgénicas no se diferencian, salvo en los caracteres introducidos, respecto de plantas provenientes de prácticas de mejoramiento convencionales introducidas en el ambiente (Hokanson et al, 1999) y que posibles casos de transferencia génica entre cultivos genéticamente modificados y malezas serían factibles.
En el caso del maíz Bt, la resistencia a lepidópteros podría pasar de éstos a parientes naturales (como el Teosinte ó individuos del género Tripsacum) si son cultivados en regiones donde se encuentran presentes los mismos. Con el objetivo de preservar las variedades naturales, el cultivo de híbridos GM se encuentra prohibido en los centros de origen de México desde 1998. Hacia finales del año 2001, Quist y Chapella alertaron sobre la presencia e introgresión de ADN proveniente de maíces transgénicos en razas nativas de México. Si bien posteriormente se descartó la hipótesis de la introgresión, no se desconocieron casos de contaminación génica en esas regiones (Metz y Fütterer, 2002; Kaplinsky et al, 2002). En el caso del algodón, la transferencia génica de Gossypium hirsutum (Linnaeus). a G. barbadense (Linnaeus) es posible, pero este riesgo es bajo debido a la distribución relativamente aislada de las especies de Gossypium y a los distintos sistemas de fitomejoramiento. Respecto de otras especies de Gossypium, la incompatibilidad genómica recobra mayor importancia, tal es el caso con G. tomentosum (Nutt) (AGBIOS, 2004).
Otra forma de dispersión génica es la liberación de ADN de las plantas a partir de material vegetal (hojas, polen, frutos) en descomposición que se va depositando en el suelo, ó de las raíces a partir de la descamación de las mismas durante todo el ciclo de vida de la planta (Tepfer et al, 2003). A pesar de contribuir en baja proporción respecto del ADN total presente en el suelo, el ADN liberado por estos procesos puede permanecer por largos períodos dependiendo de la capacidad que posea el mismo para estabilizarlo por unión a ácidos húmicos, arcillas ó partículas de arena (Creccio y Stotzky, 1998), del pH, de la concentración de iones divalentes (Smalla et al, 2000) y de las cantidades de nucleasas presentes (Creccio y Stotzky, 1998) producidas por distintos organismos. Se ha comprobado que la mayoría del ADN liberado es degradado en un período corto de tiempo, pudiendo ser utilizado como fuente de energía por bacterias presentes en el suelo (Tepfer et al, 2003), y que sólo pequeñas cantidades permanecen en el mismo (Widmer et al, 1996 y 1997, Gebhard y Smalla, 1999; Ceccherini et al, 2003), llegando a detectarse fragmentos de ADN pertenecientes a plantas transgénicas hasta dos años después de su cultivo (Gebhard y Smalla, 1999). Si bien se informó que el ADN liberado podría ser tomado del suelo ó de los tejidos en descomposición por bacterias e incorporado a sus genomas por recombinación homóloga (de Vries y Wackernagel, 1998; Gebhard y Smalla, 1998; Kay et al, 2002; Tepfer et al, 2003), esos estudios provienen de laboratorios con condiciones propicias para su ocurrencia (cepas bacterianas competentes y plásmidos conteniendo secuencias homólogas al ADN de la planta). Cuando se realizaron estudios de transformación en suelo, las frecuencias observadas fueron muy bajas (Gebhard y Smalla, 1999; Nielsen et al, 2000; Kay et al, 2002), concluyéndose que los procesos de transferencia de ADN en suelo serían muy poco probables en la naturaleza debido a la rápida degradación del ADN o al bajo número de organismos competentes para la transformación (Tepfer et al, 2003).
Expresión de la proteína Cry1A en plantas y su relación con el medio ambiente.
Los cultivos Bt son utilizados para el control específico de artrópodos pertenecientes a tres órdenes distintos: lepidópteros, dípteros y coleópteros. En el caso de los maíces y el algodón Bt, la expresión de la proteína Cry1A les confiere resistencia a lepidópteros como Diatraea saccharalis (Fabricius), Heliothis virescens (Fabricius), Helicoverpa zea (Boddie), Platyedra gossypiella (Sound), etc.
En un agro-ecosistema, además de los insectos blanco de la toxina expresada, se presenta toda una red trófica que incluye a artrópodos pertenecientes ó no a los órdenes antes mencionados y que están en contacto con los cultivos. Dentro de la red existen interacciones (competencia, predación, parasitismo) entre estos organismos, que pueden modificarse en respuesta a alteraciones del agro-ecosistema al cual pertenecen (Groot y Dicke, 2002). Una de las posibles alteraciones es la presencia de plantas Bt, las cuales podrían introducir las proteínas Cry en distintos niveles, lo que está en función de la capacidad de cada evento transgénico de producir la delta-endotoxina en diferentes tejidos (Tabla 1).
Tabla 1: Expresión de proteína CryIA en distintos tejidos, según los eventos transgénicos.
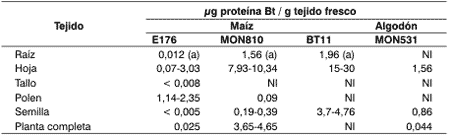
Fuente: AGBIOS (2004), a excepción de (a) que corresponde a Margarit et al. (2005, enviado a publicación).
La adquisición de resistencia a las proteínas Cry por los artrópodos blanco es probable debido a la exposición continua a la que están sometidos en los cultivos Bt. Esta presión selectiva llevaría a seleccionar aquellos individuos en los cuales se presenten mutaciones (recesivas) que afecten la acción de la toxina (eliminación del sitio de unión de la misma) (Perefoen, 1997; de Maagd et al, 1999). Por tal motivo se han desarrollado estrategias para el retardo de la aparición de individuos resistentes por medio de alta dosis de proteína Cry expresada en las plantas y la aplicación de un refugio consistente en un área lindante al cultivo transgénico en la cual se cultiva el mismo híbrido, pero en este caso no transgénico (Alstad y Andow, 1995; Rousch y Shelton, 1997). De esta manera, con la implementación de refugios, se crea una región donde individuos sensibles pueden sobrevivir y cruzarse con individuos que hayan adquirido la resistencia al estar expuestos a las plantas transgénicas, y así generar individuos heterocigotas que puedan ser controlados por las cantidades de proteínas Cry expresadas (Alstad y Andow, 1995). Si bien en ensayos de laboratorio se observaron casos de generación de resistencias (Shelton et al, 2002), Fox (2003) destacó la ausencia de informes de resistencias para las proteínas Cry expresadas en plantas transgénicas en condiciones de campo, salvo el correspondiente a Plutella xylostella (Linnaeus) (Tabashnik, 1994). Estos datos sugieren que bajo condiciones naturales, la efectividad de las estrategias de manejo de resistencias es alta y que las predicciones basadas en ensayos de laboratorio en espacios confinados y con cruzamientos dentro de una población genéticamente aislada no son las más adecuadas.
Dentro de los artrópodos que no son blanco de la toxina, se encuentran lepidópteros que pueden ser afectados por la misma, otros insectos herbívoros, polinizadores, predadores y parasitoides (Groot y Dicke, 2002). En el caso de los Lepidópteros no blanco, éstos podrían ser afectados por la toxina si consumieran distintos tejidos de las plantas transgénicas. Uno de los casos más conocidos de lepidópteros afectados, fue el informado por Losey et al (1999), quienes observaron un menor peso y una mayor mortandad en larvas de la mariposa monarca (Danaus plexippus Linnaeus) alimentadas con plantas de Asclepias curassavica (Linnaeus) (su alimento en la naturaleza) contaminadas con polen derivado plantas transgénicas de maíz del evento BT11, respecto de larvas alimentadas con polen de las isolíneas no transgénicas. Posteriormente a estas observaciones, varios grupos informaron sobre la dinámica de dispersión del polen en maíz y su deposición sobre A. curassiva (L.) (Pleasants et al, 2001; Stanley-Horn et al, 2001), las cantidades de polen requeridas para cada uno de los eventos transgénicos de maíz para lograr un efecto tóxico en larvas de D. plexippus (L.) (Hellmich et al, 2001; Zangerl et al, 2001) y los hábitos alimentarios de D. plexippus (L.) (Oberhauser et al, 2001). Todos estos estudios mostraron que en los experimentos originales de Losey et al (1999) no se habían tenido en cuenta factores como la cantidad depositada de polen sobre las hojas, la dinámica de alimentación de las larvas de D. plexippus (L.) y los niveles de expresión de la proteína Cry1Ab en cada uno de los eventos. Se concluyó que para dos de los eventos transgénicos de maíz (BT11 y MON810) los efectos del polen sobre las larvas de D. plexippus (L.) serían casi inexistentes, en tanto que en el evento 176 se observó incidencia en el desarrollo y supervivencia de las larvas de D. plexippus (L.) debido a la alta expresión de la toxina en polen (Hellmich et al, 2001; Stanley-Horn et al, 2001). Se observaron también efectos similares del evento 176 en otro insecto lepidóptero, Papilio polyxenes (Fabricius), el cual presentó altas tasas de mortandad al ser expuesto a polen de este evento y no así de los otros dos (BT11 y MON810) (Zangerl et al, 2001). A pesar de que el evento 176 presentó toxicidad para distintos lepidópteros, se cree que la incidencia del mismo en el ecosistema rural sería baja debido a la escasa utilización del mismo (Shelton et al, 2002).
Además de los lepidópteros, coleópteros y dípteros presentes, en el agroecosistema se encuentran otros artrópodos herbívoros (Homópteros, Hemípteros, Tisanópteros y ácaros). La mayoría de ellos entraría en contacto con la proteína Cry al consumir partes de la planta, pudiendo quedar expuestos a la acción tóxica a pesar de que la proteína expresada posee una alta especificidad respecto de insectos lepidópteros y de que se desconoce de la presencia del receptor en sus aparatos digestivos (Groot y Dicke, 2002).
En estudios sobre polinizadores, especialmente en el caso de Apis melífera (Linnaeus), no se detectaron efectos tóxicos de la proteína Cry producida por el maíz Bt tanto en el caso de individuos adultos (Groot y Dicke, 2002) como de larvas (Hanley et al, 2003) alimentadas con polen derivado de estas plantas.
Para el caso de los parasitoides y predadores, los cuales consumen varios herbívoros, no se observaron modificaciones significativas en poblaciones de éstos al compararse las mismas entre cultivos transgénicos y no transgénicos (Orr y Landis, 1997; Pilcher et al, 997). Cuando se estudió el efecto de larvas de Ostrinia nubilalis (Hübner) ó de Spodoptera litoralis (Boisduval) alimentadas con maíces transgénicos sobre un insecto predador de éstas (Chrysoperla carnea Stephens), se observó un menor peso y una mortandad mayor. A su vez, larvas de C. carnea (S.) alimentadas con una dieta conteniendo proteína Cry purificada también mostraron efectos negativos sobre el desarrollo y la supervivencia (Hilbeck et al, 1998). A pesar de mostrarse efectos negativos de la proteína Cry sobre este organismo, éstos experimentos fueron realizados en laboratorios, sin tener en cuenta que las dosis utilizadas de proteína eran 30 veces mayores a las alcanzadas en las plantas, que el predador elige libremente las larvas que va a predar y que, debido a que la alimentación de las larvas de O. nubilalis (H.) se da en el interior de las plantas, los individuos intoxicados con proteínas Cry1Ab no estarían disponibles para el consumo por C. carnea (S.) (Dale et al, 2002).
Incorporación y persistencia de las proteínas Bt en el suelo.
La liberación de proteínas a partir de las plantas al suelo puede ocurrir de dos formas. La primera de ellas tiene que ver con la deposición y descomposición (propiciada por una serie de organismos) de material vegetal en el suelo, que llevaría a la liberación gradual de proteínas hacia el mismo (Tapp y Stotzky, 1998; Losey et al, 1999; Zwahlen et al, 2003).
La otra forma de incorporación de proteínas al suelo tiene que ver con el proceso de exudación radicular de una serie de compuestos que le sirve a la planta para muchos procesos (defensa, comunicación con microorganismos, solubilización de metales, entre otros), entre los que se encuentran las proteínas (Walker et al, 2003).
Los residuos de los cultivos (Tapp y Stotzky, 1998; Zwahlen et al, 2003), el polen (Losey et al, 1999) y los exudados de las raíces (Saxena et al, 1999, 2000, 2004; Margarit et al, 2005), son fuentes de incorporación de proteína Cry1Ab en el suelo. Saxena et al (1999) mostraron que plantas transgénicas de maíz expresando el gen Cry1Ab eran capaces de exudar la proteína de Bt hacia la rizosfera en un proceso continuo durante el ciclo de vida de la planta. La cantidad de esta proteína rizosecretada varía con los eventos transgénicos, en función del promotor que integra las construcciones génicas introducidas en los mismos. Así, mientras el evento MON810 exuda alrededor de 300 pg de proteína Bt / planta durante las 5 primeras semanas, el evento E176 no registra valores de exudación Cry en el mismo período (Margarit et al, 2005).
La permanencia de la proteína Bt en el suelo parece depender de una serie de factores entre los que se destacan la composición física del suelo, la actividad microbiológica del mismo y factores abióticos como temperatura y lluvias. Así, se ha observado proteína Cry1Ab en el suelo por un período de 180 días luego de la liberación por exudación (Saxena et al, 2001a), y por un período de 350 días luego de la deposición del material vegetal sobre suelo reconstituido y en condiciones de laboratorio (Saxena et al, 2002). Zwahlen et al (2003) observaron la presencia de proteínas Cry1Ab por al menos 200 días desde la incorporación de material vegetal derivado de plantas de maíz transgénicas en suelos cubiertos de nieve durante el invierno suizo, determinándose que la vida media de las mismas era de 35 a 45 días. Estos valores se diferencian de los observados por Sims y Berberich (1996), quienes estimaron la vida media de las mismas en 1,5 días. Herman et al (2001) y Head et al (2002) informaron también una rápida degradación de la proteína Bt en muestras de suelo obtenidas de campos cultivados con algodón Bt. Margarit et al (2005) detectaron bajos niveles de proteína Bt en muestras de suelo cultivados tanto con maíces transgénicos como no transgénicos, asignando el origen de la misma al Bacillus thuringiensis (B.) habitante común del suelo más que al cultivo transgénico. La prolongada persistencia de la proteína Cry se debería a la capacidad de las mismas de adsorberse sobre partículas con superficies activas como los ácidos húmicos y arcillas (Tapp et al, 1994; Koskella et al, 1997; Saxena et al, 2002), volviéndolas de esta manera estables frente a la acción bacteriana. Koskella y Stotzky (1997) estudiaron la estabilidad de la toxinas (purificadas a partir del producto comercial ® Dipel ) cuando eran sometidas, tanto en solución como unidas a partículas de suelo, a la acción de un cultivo bacteriano mixto conteniendo Proteus vulgaris (Hauser) y Enterobacter aerogenes (Hormaeche and Edwards), observando que en solución las toxinas eran degradadas y utilizadas por los mismos rápidamente como fuente de carbono, en tanto que las toxinas unidas a las partículas de suelo eran capaces de resistir la acción microbiana y de mantener su actividad tóxica en bioensayos con larvas de Manduca sexta (Linnaeus) (Ream et al, 1992). Sin embargo, las condiciones de experimentación con muestras extraídas de lotes de producción parecen indicar que la actividad microbiana es mayor, y como consecuencia la estabilidad de la proteína Bt se reduce sensiblemente (Margarit et al, 2005).
Debido a que la proteína Cry debe ser ingerida por el insecto para ejercer su acción tóxica, sólo aquellos organismos que ingieran tierra conteniéndola estarían expuestos a la misma. Así, Saxena et al (2001b) realizaron estudios de impacto de la proteína liberada desde las raíces (exudación) ó de restos vegetales sobre lombrices de tierra (Lumbricus terrestres Linnaeus). A pesar de observarse la presencia de la proteína Cry en el tracto digestivo y en deyecciones de las mismas, no se observó descenso en el peso ó aumento en las tasas de mortandad de las lombrices. Tampoco se observaron efectos de las proteínas Cry presentes en tejidos incorporados al suelo sobre otros organismos como el insecto descomponedor Porcellio scaber (Latreille) ú otros microorganismos descomponedores (Escher et al, 2000). Saxena et al (2001b) realizaron estudios de impacto sobre nemátodos, protozoos, bacterias y hongos, sin observarse cambios significativos en las poblaciones. Donegan et al (1996) no observaron efectos significativos en las poblaciones microbianas y fúngicas presentes en cultivos de papas que expresaban una proteína Cry derivada de B. thuringiensis ssp. tenebrionis, en tanto que Stotzky (2001) no observó cambios en las poblaciones de bacterias (gram positivas y negativas), hongos (levaduras y hongos filamentosos, incluyendo Zygomycetes, Ascomycetes y Deuteromycetes) y algas (verdes y diatomeas).
La tecnología Bt combinada con la ingeniería genética de cultivos ha sido una de las aplicaciones más adoptadas (15,6 millones de has, 19 % de las 81 millones de has) en 2 cultivos mayores: maíz y algodón (James, 2004). Esta tecnología se basa en la expresión en plantas de genes provenientes de Bacillus thuringiensis (Berliner) (Bt), los cuales codifican proteínas de control de insectos. Estas proteínas se caracterizan por una elevada especificidad sobre el insecto blanco, y en base a esta especificidad, a la caracterización molecular e inmunológica se clasifican las más de 100 versiones de genes Cry y Cyt aislados y estudiados (Para una revisión, ver de Maagd et al, 2001).
Si bien Bacillus thuringiensis (B.) ha sido utilizado como insecticida biológico desde mediados del siglo pasado, el éxito de la expresión en plantas se ha logrado cuando la transformación genética involucró la inserción de versiones sintéticas de estos genes, adaptando las secuencias nucleotídicas a los marcos de lectura de las plantas receptoras (mayor contenido de C y G, eliminación de secuencias responsables de la inestabilidad y procesamiento del mRNA, eliminación de secuencias ATTTA responsables de la poliadenilación temprana del mensajero, etc.). Así se generaron y autorizaron para la comercialización (hasta el momento) 3 eventos independientes de maíz transgénico Bt y 1 evento de algodón transgénico Bt (AGBIOS, 2004). Estos eventos, además de diferir en la secuencia codificante de la región truncada de la delta-endotoxina CryIA(b) de Bacillus thuringiensis (B.) para controlar insectos lepidópteros, responden a distintas construcciones génicas, promotores y regiones codificantes (Figura 1). En todos los casos, el modo de acción de las proteínas Bt se basa en la formación de poros líticos en las membranas de las células del epitelio del intestino medio de los insectos blanco (Schnepf et al, 1998), donde la toxina se une específicamente a glicolípidos receptores presentes en éstos y en nematodes y ausentes en vertebrados (Griffitts et al, 2005).
Figura 1: Estructuras de los genes introducidos en los eventos transgénicas Bt de maíz (MON180, E176, Bt11) y algodón (MON531) presentes en mercado.

REFERENCIAS:p35S: Promotor CaMV35S; En35S: estimulador transcripcional del CaMV35S; In hsp70: intrón de la proteína de shock térmico 70 de maíz; CryIA..syn: gen sintético de la delta-endotoxina de Bacillus thuringiensis (B.); pPEPC: promotor de la PEPCarboxilasa de maíz; pCDPK: promotor de una proteín-cinasa dependiente de calcio de polen de maíz; In9PEPC: intrón 9 de la PEPCarboxilasa de maíz; T35S: señal de poliadenilación del CaMV35S; In IVS6: intrón 6 de la IVS alcohol deshidrogenasa de maíz; T nos: señal de poliadenilación de la nopalina sintetasa de Agrobacterium tumefaciens (Smith and Townsend); T-ß-C: señal 3´de poliadenilación del gen de la ß-conglicina de soja
(Fuente: AGBIOS, 2004).
Ventajas de la tecnología Bt
La alta adopción de los cultivos Bt se debe a las ventajas de los mismos respecto de los biocidas aplicados normalmente y de los productos derivados de Bacillus thuringiensis (B.). Entre esas ventajas está la expresión constante de las proteínas Cry que, comparada con la aplicación de plaguicidas y de productos derivados de B. thuringiensis (B.), no estaría sujeta a distintos condicionamientos como el momento de la aplicación, el lavado del producto por precipitaciones y la inactivación del mismo por exposición a la luz solar (en el caso de los productos derivados de B. thuringiensis -B.-).
Otra de las ventajas está constituida por la presencia de proteínas Cry en partes de la planta donde los plaguicidas químicos y biológicos no son capaces de llegar, otorgando así un control más efectivo.
Además, la especificidad de las toxinas presentes tanto en los productos de B. thuringiensis (B.) como en las plantas transgénicas, permite el control específico de plagas que afectan el cultivo sin mostrar toxicidad hacia otros integrantes del ecosistema (Betz et al, 2000).
Otro de los beneficios de la aplicación de esta tecnología es la disminución de algunas micotoxinas en los granos (en el caso del maíz Bt), sustancias producidas por hongos con propiedades tóxicas para el hombre y animales. Como resultado del daño que causan los insectos (especialmente el barrenador del tallo y la isoca de la espiga) al atacar el cultivo, las esporas de diferentes hongos tienen acceso a los tejidos jóvenes del grano y la espiga, donde proliferan y producen micotoxinas, siendo las más comunes la fumonisina y la aflatoxina. En la defensa contra insectos, las plantas transgénicas no ofrecen heridas como puertas de infección de los hongos, y por lo tanto la cantidad de fumonisina presente en los granos de los híbridos Bt es hasta 10 veces inferior que el mismo genotipo no transgénico (Masoero et al, 1999; Munkvold et al, 1997, 1999; Clements et al, 2003). Asociado a este beneficio, se observó una mayor tasa de conversión de alimento a carne en pollos parrilleros cuando la dieta contuvo granos de maíz transgénico Bt en comparación con otra equivalente constituida por maíz no transgénico, criados ambos lotes de pollos bajo las mismas condiciones ambientales (Brake y Vlachos , 1998).
Impacto ambiental de la tecnología Bt
Desde la aparición de las primeras plantas transgénicas conteniendo genes de interés comercial surgió la necesidad de medir el impacto ambiental de las mismas en los sistemas de cultivo y en el ecosistema.
Internacionalmente se desarrollaron estrategias regulatorias según las cuales cada evento transgénico en estudio ó comercialmente disponible debe primero superar una etapa de evaluación de riesgo ambiental antes de ser desregulado, creándose distintos organismos evaluadores del riesgo que los OVGMs generan (Jaffe, 2004).
En este contexto, uno de los casos mejor estudiados lo constituye la tecnología Bt, especialmente para dos cultivos muy importantes, como el maíz y el algodón. Entre los aspectos que involucran estos estudios enmarcados en el impacto ambiental sobresalen los siguientes: Invasividad de los cultivos genéticamente modificados.
La introducción de nuevas características a los cultivos podría brindarle a los mismos mejores cualidades para la supervivencia en el medio ambiente, convirtiéndolos así en potenciales malezas de otros cultivos (Dale et al, 2002). En un estudio realizado en un período de 10 años por Crawley et al (2001), se evaluaron las capacidades de distintos eventos transgénicos (dentro de ellos cultivos Bt) para convertirse en malezas de los cultivos ó invasoras de hábitats naturales. En ellos no se encontraron plantas que poseyeran tales características, considerándose que la capacidad de una planta para convertirse en maleza no estaría regida únicamente por un solo gen, sino que sería regida por al menos una docena de ellos (Luby and McNichol, 1995). Así, para los maíces y el algodón BT, no se ha detectado que la introducción de estos genes provea de capacidad a la planta de convertirse en maleza (AGBIOS, 2004).
Dispersión génica.
Ésta puede ocurrir a través del polen desde un cultivo modificado (por técnicas convencionales ó de ingeniería genética) hacia otras plantas ó especies presentes en el ecosistema. Es necesario tener en cuenta que en el proceso de dispersión hacen falta que se cumplan distintos requisitos como: migración del polen desde el cultivo transgénico, influenciada por la longevidad del polen y su forma de dispersión (viento, insectos polinizadores, etc.); la sincronización de la floración entre la planta dadora y la receptora del polen; la compatibilidad sexual entre las plantas participantes del proceso y la ecología de la especie receptora (Dale et al, 2002; Stewart et al, 2003). Se han encontrado muchos casos de transferencia génica desde cultivos de valor agronómico desarrollados por técnicas convencionales hacia malezas relacionadas (Dale et al, 2002), mostrándose de esta manera la factibilidad de ocurrencia de este fenómeno en condiciones naturales.
Cabe destacar que las plantas transgénicas no se diferencian, salvo en los caracteres introducidos, respecto de plantas provenientes de prácticas de mejoramiento convencionales introducidas en el ambiente (Hokanson et al, 1999) y que posibles casos de transferencia génica entre cultivos genéticamente modificados y malezas serían factibles.
En el caso del maíz Bt, la resistencia a lepidópteros podría pasar de éstos a parientes naturales (como el Teosinte ó individuos del género Tripsacum) si son cultivados en regiones donde se encuentran presentes los mismos. Con el objetivo de preservar las variedades naturales, el cultivo de híbridos GM se encuentra prohibido en los centros de origen de México desde 1998. Hacia finales del año 2001, Quist y Chapella alertaron sobre la presencia e introgresión de ADN proveniente de maíces transgénicos en razas nativas de México. Si bien posteriormente se descartó la hipótesis de la introgresión, no se desconocieron casos de contaminación génica en esas regiones (Metz y Fütterer, 2002; Kaplinsky et al, 2002). En el caso del algodón, la transferencia génica de Gossypium hirsutum (Linnaeus). a G. barbadense (Linnaeus) es posible, pero este riesgo es bajo debido a la distribución relativamente aislada de las especies de Gossypium y a los distintos sistemas de fitomejoramiento. Respecto de otras especies de Gossypium, la incompatibilidad genómica recobra mayor importancia, tal es el caso con G. tomentosum (Nutt) (AGBIOS, 2004).
Otra forma de dispersión génica es la liberación de ADN de las plantas a partir de material vegetal (hojas, polen, frutos) en descomposición que se va depositando en el suelo, ó de las raíces a partir de la descamación de las mismas durante todo el ciclo de vida de la planta (Tepfer et al, 2003). A pesar de contribuir en baja proporción respecto del ADN total presente en el suelo, el ADN liberado por estos procesos puede permanecer por largos períodos dependiendo de la capacidad que posea el mismo para estabilizarlo por unión a ácidos húmicos, arcillas ó partículas de arena (Creccio y Stotzky, 1998), del pH, de la concentración de iones divalentes (Smalla et al, 2000) y de las cantidades de nucleasas presentes (Creccio y Stotzky, 1998) producidas por distintos organismos. Se ha comprobado que la mayoría del ADN liberado es degradado en un período corto de tiempo, pudiendo ser utilizado como fuente de energía por bacterias presentes en el suelo (Tepfer et al, 2003), y que sólo pequeñas cantidades permanecen en el mismo (Widmer et al, 1996 y 1997, Gebhard y Smalla, 1999; Ceccherini et al, 2003), llegando a detectarse fragmentos de ADN pertenecientes a plantas transgénicas hasta dos años después de su cultivo (Gebhard y Smalla, 1999). Si bien se informó que el ADN liberado podría ser tomado del suelo ó de los tejidos en descomposición por bacterias e incorporado a sus genomas por recombinación homóloga (de Vries y Wackernagel, 1998; Gebhard y Smalla, 1998; Kay et al, 2002; Tepfer et al, 2003), esos estudios provienen de laboratorios con condiciones propicias para su ocurrencia (cepas bacterianas competentes y plásmidos conteniendo secuencias homólogas al ADN de la planta). Cuando se realizaron estudios de transformación en suelo, las frecuencias observadas fueron muy bajas (Gebhard y Smalla, 1999; Nielsen et al, 2000; Kay et al, 2002), concluyéndose que los procesos de transferencia de ADN en suelo serían muy poco probables en la naturaleza debido a la rápida degradación del ADN o al bajo número de organismos competentes para la transformación (Tepfer et al, 2003).
Expresión de la proteína Cry1A en plantas y su relación con el medio ambiente.
Los cultivos Bt son utilizados para el control específico de artrópodos pertenecientes a tres órdenes distintos: lepidópteros, dípteros y coleópteros. En el caso de los maíces y el algodón Bt, la expresión de la proteína Cry1A les confiere resistencia a lepidópteros como Diatraea saccharalis (Fabricius), Heliothis virescens (Fabricius), Helicoverpa zea (Boddie), Platyedra gossypiella (Sound), etc.
En un agro-ecosistema, además de los insectos blanco de la toxina expresada, se presenta toda una red trófica que incluye a artrópodos pertenecientes ó no a los órdenes antes mencionados y que están en contacto con los cultivos. Dentro de la red existen interacciones (competencia, predación, parasitismo) entre estos organismos, que pueden modificarse en respuesta a alteraciones del agro-ecosistema al cual pertenecen (Groot y Dicke, 2002). Una de las posibles alteraciones es la presencia de plantas Bt, las cuales podrían introducir las proteínas Cry en distintos niveles, lo que está en función de la capacidad de cada evento transgénico de producir la delta-endotoxina en diferentes tejidos (Tabla 1).
Tabla 1: Expresión de proteína CryIA en distintos tejidos, según los eventos transgénicos.

Fuente: AGBIOS (2004), a excepción de (a) que corresponde a Margarit et al. (2005, enviado a publicación).
La adquisición de resistencia a las proteínas Cry por los artrópodos blanco es probable debido a la exposición continua a la que están sometidos en los cultivos Bt. Esta presión selectiva llevaría a seleccionar aquellos individuos en los cuales se presenten mutaciones (recesivas) que afecten la acción de la toxina (eliminación del sitio de unión de la misma) (Perefoen, 1997; de Maagd et al, 1999). Por tal motivo se han desarrollado estrategias para el retardo de la aparición de individuos resistentes por medio de alta dosis de proteína Cry expresada en las plantas y la aplicación de un refugio consistente en un área lindante al cultivo transgénico en la cual se cultiva el mismo híbrido, pero en este caso no transgénico (Alstad y Andow, 1995; Rousch y Shelton, 1997). De esta manera, con la implementación de refugios, se crea una región donde individuos sensibles pueden sobrevivir y cruzarse con individuos que hayan adquirido la resistencia al estar expuestos a las plantas transgénicas, y así generar individuos heterocigotas que puedan ser controlados por las cantidades de proteínas Cry expresadas (Alstad y Andow, 1995). Si bien en ensayos de laboratorio se observaron casos de generación de resistencias (Shelton et al, 2002), Fox (2003) destacó la ausencia de informes de resistencias para las proteínas Cry expresadas en plantas transgénicas en condiciones de campo, salvo el correspondiente a Plutella xylostella (Linnaeus) (Tabashnik, 1994). Estos datos sugieren que bajo condiciones naturales, la efectividad de las estrategias de manejo de resistencias es alta y que las predicciones basadas en ensayos de laboratorio en espacios confinados y con cruzamientos dentro de una población genéticamente aislada no son las más adecuadas.
Dentro de los artrópodos que no son blanco de la toxina, se encuentran lepidópteros que pueden ser afectados por la misma, otros insectos herbívoros, polinizadores, predadores y parasitoides (Groot y Dicke, 2002). En el caso de los Lepidópteros no blanco, éstos podrían ser afectados por la toxina si consumieran distintos tejidos de las plantas transgénicas. Uno de los casos más conocidos de lepidópteros afectados, fue el informado por Losey et al (1999), quienes observaron un menor peso y una mayor mortandad en larvas de la mariposa monarca (Danaus plexippus Linnaeus) alimentadas con plantas de Asclepias curassavica (Linnaeus) (su alimento en la naturaleza) contaminadas con polen derivado plantas transgénicas de maíz del evento BT11, respecto de larvas alimentadas con polen de las isolíneas no transgénicas. Posteriormente a estas observaciones, varios grupos informaron sobre la dinámica de dispersión del polen en maíz y su deposición sobre A. curassiva (L.) (Pleasants et al, 2001; Stanley-Horn et al, 2001), las cantidades de polen requeridas para cada uno de los eventos transgénicos de maíz para lograr un efecto tóxico en larvas de D. plexippus (L.) (Hellmich et al, 2001; Zangerl et al, 2001) y los hábitos alimentarios de D. plexippus (L.) (Oberhauser et al, 2001). Todos estos estudios mostraron que en los experimentos originales de Losey et al (1999) no se habían tenido en cuenta factores como la cantidad depositada de polen sobre las hojas, la dinámica de alimentación de las larvas de D. plexippus (L.) y los niveles de expresión de la proteína Cry1Ab en cada uno de los eventos. Se concluyó que para dos de los eventos transgénicos de maíz (BT11 y MON810) los efectos del polen sobre las larvas de D. plexippus (L.) serían casi inexistentes, en tanto que en el evento 176 se observó incidencia en el desarrollo y supervivencia de las larvas de D. plexippus (L.) debido a la alta expresión de la toxina en polen (Hellmich et al, 2001; Stanley-Horn et al, 2001). Se observaron también efectos similares del evento 176 en otro insecto lepidóptero, Papilio polyxenes (Fabricius), el cual presentó altas tasas de mortandad al ser expuesto a polen de este evento y no así de los otros dos (BT11 y MON810) (Zangerl et al, 2001). A pesar de que el evento 176 presentó toxicidad para distintos lepidópteros, se cree que la incidencia del mismo en el ecosistema rural sería baja debido a la escasa utilización del mismo (Shelton et al, 2002).
Además de los lepidópteros, coleópteros y dípteros presentes, en el agroecosistema se encuentran otros artrópodos herbívoros (Homópteros, Hemípteros, Tisanópteros y ácaros). La mayoría de ellos entraría en contacto con la proteína Cry al consumir partes de la planta, pudiendo quedar expuestos a la acción tóxica a pesar de que la proteína expresada posee una alta especificidad respecto de insectos lepidópteros y de que se desconoce de la presencia del receptor en sus aparatos digestivos (Groot y Dicke, 2002).
En estudios sobre polinizadores, especialmente en el caso de Apis melífera (Linnaeus), no se detectaron efectos tóxicos de la proteína Cry producida por el maíz Bt tanto en el caso de individuos adultos (Groot y Dicke, 2002) como de larvas (Hanley et al, 2003) alimentadas con polen derivado de estas plantas.
Para el caso de los parasitoides y predadores, los cuales consumen varios herbívoros, no se observaron modificaciones significativas en poblaciones de éstos al compararse las mismas entre cultivos transgénicos y no transgénicos (Orr y Landis, 1997; Pilcher et al, 997). Cuando se estudió el efecto de larvas de Ostrinia nubilalis (Hübner) ó de Spodoptera litoralis (Boisduval) alimentadas con maíces transgénicos sobre un insecto predador de éstas (Chrysoperla carnea Stephens), se observó un menor peso y una mortandad mayor. A su vez, larvas de C. carnea (S.) alimentadas con una dieta conteniendo proteína Cry purificada también mostraron efectos negativos sobre el desarrollo y la supervivencia (Hilbeck et al, 1998). A pesar de mostrarse efectos negativos de la proteína Cry sobre este organismo, éstos experimentos fueron realizados en laboratorios, sin tener en cuenta que las dosis utilizadas de proteína eran 30 veces mayores a las alcanzadas en las plantas, que el predador elige libremente las larvas que va a predar y que, debido a que la alimentación de las larvas de O. nubilalis (H.) se da en el interior de las plantas, los individuos intoxicados con proteínas Cry1Ab no estarían disponibles para el consumo por C. carnea (S.) (Dale et al, 2002).
Incorporación y persistencia de las proteínas Bt en el suelo.
La liberación de proteínas a partir de las plantas al suelo puede ocurrir de dos formas. La primera de ellas tiene que ver con la deposición y descomposición (propiciada por una serie de organismos) de material vegetal en el suelo, que llevaría a la liberación gradual de proteínas hacia el mismo (Tapp y Stotzky, 1998; Losey et al, 1999; Zwahlen et al, 2003).
La otra forma de incorporación de proteínas al suelo tiene que ver con el proceso de exudación radicular de una serie de compuestos que le sirve a la planta para muchos procesos (defensa, comunicación con microorganismos, solubilización de metales, entre otros), entre los que se encuentran las proteínas (Walker et al, 2003).
Los residuos de los cultivos (Tapp y Stotzky, 1998; Zwahlen et al, 2003), el polen (Losey et al, 1999) y los exudados de las raíces (Saxena et al, 1999, 2000, 2004; Margarit et al, 2005), son fuentes de incorporación de proteína Cry1Ab en el suelo. Saxena et al (1999) mostraron que plantas transgénicas de maíz expresando el gen Cry1Ab eran capaces de exudar la proteína de Bt hacia la rizosfera en un proceso continuo durante el ciclo de vida de la planta. La cantidad de esta proteína rizosecretada varía con los eventos transgénicos, en función del promotor que integra las construcciones génicas introducidas en los mismos. Así, mientras el evento MON810 exuda alrededor de 300 pg de proteína Bt / planta durante las 5 primeras semanas, el evento E176 no registra valores de exudación Cry en el mismo período (Margarit et al, 2005).
La permanencia de la proteína Bt en el suelo parece depender de una serie de factores entre los que se destacan la composición física del suelo, la actividad microbiológica del mismo y factores abióticos como temperatura y lluvias. Así, se ha observado proteína Cry1Ab en el suelo por un período de 180 días luego de la liberación por exudación (Saxena et al, 2001a), y por un período de 350 días luego de la deposición del material vegetal sobre suelo reconstituido y en condiciones de laboratorio (Saxena et al, 2002). Zwahlen et al (2003) observaron la presencia de proteínas Cry1Ab por al menos 200 días desde la incorporación de material vegetal derivado de plantas de maíz transgénicas en suelos cubiertos de nieve durante el invierno suizo, determinándose que la vida media de las mismas era de 35 a 45 días. Estos valores se diferencian de los observados por Sims y Berberich (1996), quienes estimaron la vida media de las mismas en 1,5 días. Herman et al (2001) y Head et al (2002) informaron también una rápida degradación de la proteína Bt en muestras de suelo obtenidas de campos cultivados con algodón Bt. Margarit et al (2005) detectaron bajos niveles de proteína Bt en muestras de suelo cultivados tanto con maíces transgénicos como no transgénicos, asignando el origen de la misma al Bacillus thuringiensis (B.) habitante común del suelo más que al cultivo transgénico. La prolongada persistencia de la proteína Cry se debería a la capacidad de las mismas de adsorberse sobre partículas con superficies activas como los ácidos húmicos y arcillas (Tapp et al, 1994; Koskella et al, 1997; Saxena et al, 2002), volviéndolas de esta manera estables frente a la acción bacteriana. Koskella y Stotzky (1997) estudiaron la estabilidad de la toxinas (purificadas a partir del producto comercial ® Dipel ) cuando eran sometidas, tanto en solución como unidas a partículas de suelo, a la acción de un cultivo bacteriano mixto conteniendo Proteus vulgaris (Hauser) y Enterobacter aerogenes (Hormaeche and Edwards), observando que en solución las toxinas eran degradadas y utilizadas por los mismos rápidamente como fuente de carbono, en tanto que las toxinas unidas a las partículas de suelo eran capaces de resistir la acción microbiana y de mantener su actividad tóxica en bioensayos con larvas de Manduca sexta (Linnaeus) (Ream et al, 1992). Sin embargo, las condiciones de experimentación con muestras extraídas de lotes de producción parecen indicar que la actividad microbiana es mayor, y como consecuencia la estabilidad de la proteína Bt se reduce sensiblemente (Margarit et al, 2005).
Debido a que la proteína Cry debe ser ingerida por el insecto para ejercer su acción tóxica, sólo aquellos organismos que ingieran tierra conteniéndola estarían expuestos a la misma. Así, Saxena et al (2001b) realizaron estudios de impacto de la proteína liberada desde las raíces (exudación) ó de restos vegetales sobre lombrices de tierra (Lumbricus terrestres Linnaeus). A pesar de observarse la presencia de la proteína Cry en el tracto digestivo y en deyecciones de las mismas, no se observó descenso en el peso ó aumento en las tasas de mortandad de las lombrices. Tampoco se observaron efectos de las proteínas Cry presentes en tejidos incorporados al suelo sobre otros organismos como el insecto descomponedor Porcellio scaber (Latreille) ú otros microorganismos descomponedores (Escher et al, 2000). Saxena et al (2001b) realizaron estudios de impacto sobre nemátodos, protozoos, bacterias y hongos, sin observarse cambios significativos en las poblaciones. Donegan et al (1996) no observaron efectos significativos en las poblaciones microbianas y fúngicas presentes en cultivos de papas que expresaban una proteína Cry derivada de B. thuringiensis ssp. tenebrionis, en tanto que Stotzky (2001) no observó cambios en las poblaciones de bacterias (gram positivas y negativas), hongos (levaduras y hongos filamentosos, incluyendo Zygomycetes, Ascomycetes y Deuteromycetes) y algas (verdes y diatomeas).
| Conclusiones La tecnología Bt incorporada como producto de la ingeniería genética en el control de insectos que atacan cultivos de interés comercial ha sido ampliamente adoptada en el sector agropecuario. La evaluación del impacto ambiental, enfocada desde diversos aspectos entre los que se destacan la potencial aparición de nuevas malezas, la pérdida de biodiversidad, la contaminación de los centros de origen de las especies modificadas genéticamente, el cambio de las frecuencias génicas y la aparición de insectos resistentes generados por una alta presión de selección de los cultivos modificados genéticamente, indica que el uso de OVGMs conteniendo genes de Bacillus thuringiensis (B.) no implica un riesgo en el agroecosistema si se respetan las normas de uso de los materiales autorizados para la comercialización. No obstante las ventajas y bajo riesgo descriptos que ofrecen los eventos Bt presentes en el mercado, la ingeniería genética de plantas permite rediseñar el genoma de las especies, y por lo tanto la misma rigurosidad científica mencionada a lo largo de la presente revisión debe ser aplicada a nuevos eventos transgénicos que se pretendan introducir en los sistemas de producción a los efectos de garantizar la inexistencia de impactos desfavorables para el medio ambiente y la seguridad alimentaria de la sociedad. |
Bibliografía
AGBIOS (Agriculture and Biotechnology Strategies). GMO Database. 2004.
ALSTAD, D.N. y ANDOW, D.A. 1995. Managing the evolution of insect resistance to transgenic plants. Science 268: 1894-1896.
BETZ, F.S.; HAMMOND, B.G. y FUCHS, R.L. 2000. Safety and advantages of Bacillus thuringiensis-protected plants to control insect pests. Regulatory Toxicol. Pharmacol., 32: 156–173.
BRAKE, J. y VLACHOS, D. 1998. Evaluation of transgenic event 176 "Bt" corn in broiler chickens. Poultry Sci., 77: 648-653.
CECCHERINI, M.T.; POTÉ, J.; KAY, E.; VAN TRAN, V.; MARÉCHAL, J.; PIETRAMELLARA, P.; NANNIPIERI, P.; VOGEL, T.M. y SIMONET, P. 2003. Degradation and transformability of DNA from transgenic leaves. Appl. Environ. Microbiol., 69: 673-678.
CLEMENTS, M.J.; CAMPBELL, K.W.; MARAGOS, C.M.; PILCHER, C.; HEADRICK, J.M.; PATAKY, J.K. y WHITE, D.G. 2003. Influence of Cry1Ab protein and hybrid genotype on fumonisin contamination and fusarium ear rot of corn. Crop Sci., 43: 1283-1293.
CRAWLEY, M.J.; BROWN, S.L.; HAILS, R.S.; KOHN, D.D. y REES, M. 2001. Biotechnology: transgenic crops in natural habitats. Nature 409: 682–83.
CRECCHIO, C. y STOTZKY, G. 1998. Binding of DNA on humic acids: effect on transformation of Bacillus subtilis and resistance to DNase. Soil Biol. Biochem., 30: 1060–1067.
DALE, P.A.; CLARKE, B. y FONTES, E.M.G. 2002. Potential for the environmental impact of transgenic crops. Nature Biotechnol., 20: 567-574.
DE MAAGD, R.A.; BOSCH, D. y STIEKEMA, W. 1999. Bacillus thuringiensis toxin-mediated insect resistance in plants. Trends Plant Sci., 4: 9-13.
DE MAAGD, R.A.; BRAVO, A. y CRICKMORE, N. 2001. How Bacillus thuringiensis has evolved specific toxins to colonize the insect world. Trends Genet., 17: 193-199.
DE VRIES, J. y WACKERNAGEL, W. 1998. Detection of nptII (kanamycin resistance) genes in genomes of transgenic plants by marker-rescue transformation. Mol. Gen. Genet., 257: 606-613.
DONEGAN, K.; SCHALLER, D.; STONE, J.; GANIO, L.; REED, G.; HAMM, P.; SEIDLER, R. 1996. Microbial populations, fungal species diversity and plant pathogen levels in field plots of potato plants expressing the Bacillus thuringiensis var. tenebrionis endotoxin. Transgenic Research, 5 (1): 25-35
ESCHER, N.; KÄCH, B.; NENTWIG, W. 2000. Decomposition of transgenic Bacillus thuringiensis maize by microorganisms and woodlice Porcellio scaber (Crustacea: Isopoda). Basic Appl. Ecol., 1:161–69
FOX, J.L. 2003. Resistance to Bt toxin surprisingly absent from pests. Nature Biotechnol., 21: 958-959.
GEBHARD, F. y SMALLA, K. 1998. Transformation of Acinetobacter sp. strain BD413 by transgenic sugar beet DNA. Appl. Environ. Microbiol., 64: 1550-1554.
GEBHARD, F. y SMALLA, K. 1999 Monitoring field releases of genetically modified sugar beets for persistence of transgenic plant DNA and horizontal gene transfer. FEMS Microbiol. Ecol., 28: 261-272.
GRIFFITTS, J.S.; HASLAM, S.M.; YANG, T.; GARCZYNSKI, S.F.; MULLOY, B.; MORRIS, H.; CREMER, P.S.; DELL, A.; ADANG, M.J. y AROIAN, R.V. 2005. Glycolipids as receptors for Bacillus thuringiensis crystal toxin. Science 307: 922-925.
GROOT, A.T. y DICKE, M. 2002. Insect-resistant transgenic plants in a multi-trophic context. Plant J,. 31: 387-406.
HANLEY, A.; HUANG, Z. y PETT, W.L. 2003. Effects of dietary transgenic Bt corn pollen on larvae of Apis mellifera and Galleria mellonella. J. Apicultural Research 42: 77-81.
HEAD, G., SURBER, J.B.; WATSON, J.A.; MARTIN, J.W.; DUAN, J.J. 2002. No Detection of Cry1Ac Protein in Soil After Multiple Years of Transgenic Bt Cotton (Bollgard) Use. Environ. Entomol., 31: 30-36.
HELLMICH, R.L.; SIEGFRIED, B.D.; SEARS, M.K.; STANLEY-HORN, D.E.; DANIELS, M.J.; MATTILA, H.R.; SPENCER, T.; BIDNE, K.G. y LEWIS, L.C. 2001. Monarch larvae sensitivity to Bacillus thuringiensis purified proteins and pollen. Proc. Natl. Acad. Sci. USA, 98: 11925-11930.
HERMAN, R.A.; EVANS, S.L.; SHANAHAN, D.M.; MIHALIAK, C.A.; BORMETT, G.A.; YOUNG, D.L. y BUEHER, J. 2001. Rapid degradation of Cry1F delta-endotoxin in soil. Environ. Entomol., 30: 642-644.
HILBECK, A.; MOAR, W.J.; PUSZTAI-CAREY, M.; FILIPPINI, A.M.; BIGLER, F. 1998. Toxicity of Bacillus thuringiensis Cry1Ab toxin to the predator Chrysoperla carnae. Environ. Entomol., 27:1255–63
HOKANSON, K.; HERON, D.; GUPTA, S.; KOEHLER, S.; ROSELAND, C.; SHANTHARAM, S.; TURNER, J.; WHITE, J.; SCHECHTMAN, M.; MCCAMMON, S. y BECH, R. 1999. The concept of familiarity and pest resistant plants. Workshop on Ecological Effects of Pest Resistance Genes in Managed Ecosystems. Bethesda, MD. U.S.A. (January 31February 3, 1999). www.isb.vt.edu
JAFFE, G. 2004. Regulating transgenic crops: a comparative analysis of different Regulatory processes. Transgenic Research, 13:5-19.
JAMES, C. 2004. Executive summary: Global Status of Commercialized Biotech/GM Crops: 2004. ISAAA Briefs No. 32. ISAAA: Ithaca, NY.
KAPLINSKY, N.; BRAUN, D.; LISCH, D.; HAY, A.; HAKE, S. y FREELING, M. 2002. Maize transgene results in mexico are artefacts. Nature 416: 601.
KAY, E.; VOGEL, T.M.; BERTOLLA, F.; NALIN, R. y SIMONET, P. 2002 In situ transfer of antibiotic resistance genes from transgenic (transplastomic) tobacco plants to bacteria. Appl. Environ. Microbiol., 68: 3345-3351.
KOSKELLA, J. y STOTZKY, G. 1997. Microbial utilization of free and clay-bound insecticidal toxins from Bacillus thuringiensis and their retention of insecticidal activity after incubation with microbes. Appl. Environ. Microbiol., 63: 3561-3568.
LOSEY, J.E.; RAYOR, L.S. y CARTER, M.E. 1999. Transgenic pollen harms monarch larvae. Nature 399: 214.
LUBY J.J. y MCNICHOL R.F. 1995. Gene flow from cultivated to wild raspberries in Scotland: developing a basis for risk assessment for testing and deployment of transgenic cultivars. Theor. Appl. Genet., 90: 1133-1137.
MARGARIT, E.; REGGIARDO, M.I.; VALLEJOS, R.H. y PERMINGEAT, H.R. 2005. Bt protein rhizosecreted from transgenic maize does not accumulate at high levels in the soil. Enviado a publicación.
MASOERO, F.; MOSCHINI, M.; ROSSI, F.; PRANDINI, A. y PIETRI, A. 1999. Nutritive value, mycotoxin contamination and in vitro rumen fermentation of normal and genetically modified corn (Cry1A9b) grown in northern Italy. Maydica 44: 205-209.
METZ, M. y FÜTTERER, J. 2002. Suspect evidence of transgenic contamination. Nature 416: 600-601.
MUNKVOLD, G. P.; HELLMICH, R. L. y SHOWERS, W. B. 1997. Reduced Fusarium ear rot and symptomless infection in kernels of maize genetically engineered for European corn borer resistance. Phytopathology, 87: 1071-1077.
MUNKVOLD, G.P.; HELLMICH, R.L. y RICE, L.G. 1999. Comparison of fumonisin concentrations in kernels of transgenic Bt maize hybrids and non-transgenic hybrids. Plant Disease, 83: 130-138.
NIELSEN, K.M.; VAN ELSAS, J.D. y SMALLA, K. 2000. Transformation of Acinetobacter sp. strain BD413 (pFG4nptII) with transgenic plant DNA in soil microcosms and effects of kanamycin on selection of transformants. Appl. Environ. Microbiol., 66: 1237-1242.
OBERHAUSER, K.S.; PRYSBY, M.D.; MATTILA, H.R.; STANLEY-HORN, D.E.; SEARS, M.K.; DIVELY, G.; OLSON, E.; PLEASANTS, J.M.; LAM, W.-K.F. y HELLMICH, R.L. 2001. Temporal and spatial overlap between monarch larvae and corn pollen. Proc. Natl. Acad. Sci. USA 98: 11913-11918.
ORR, D.B. y LANDIS, D.A. 1997. Oviposition of European corn borer (Lepidoptera: Pyralidae) and impact of natural enemy populations in transgenic versus isogenic corn. J. Econ. Entomol., 90: 905-909.
PEREFOEN, M. 1997. Progress and prospects for field use of Bt genes in crops. Trends Biotechnol., 15: 173-177.
PILCHER, C.D.; OBRYCKI, J.J.; RICE, M.E. y LEWIS, L.C. 1997. Preimaginal development, survival, and field abundance of insect predators on transgenic Bacillus thuringiensis corn. Environ. Entomol., 26: 446-454.
PLEASANTS, J.M.; HELLMICH, R.L.; DIVELY, G.P.; SEARS, M.K.; STANLEY-HORN, D.E.; MATTILA, H.R.; FOSTER, J.E.; CLARK, T.L. y JONES, G.D. 2001. Corn pollen deposition on milkweeds in and near corn fields. Proc. Natl. Acad. Sci. USA 98: 11919-11924.
QUIST, D. y CHAPELA, I.H. 2001 Transgenic DNA introgressed into traditional maize landraces in Oaxaca, Mexico. Nature 414: 541-543.
REAM, J.E.; BERBERICH, S.A.; SIMS, S.R.; ROGAN, G.J. y FUCHS, R.L. 1992. In planta distribution and environmental fate of insect resistant proteins. Plant Physiol. Suppl., 99: 80.
ROUSH, R.T. y SHELTON, A.M. 1997. Assessing the odds: the emergence of resistance to Bt transgenic plants. Nature Biotechnol., 15: 5–6.
SAXENA, D.; FLORES, S. y STOTZKY, G. 1999. Insecticidal toxin in root exudates from Bt corn. Nature 402: 480.
SAXENA, D. y STOTZKY, G. 2000. Insecticidal toxin from Bacillus thuringiensis is released from roots of transgenic Bt corn in vivo and in situ. FEMS Microbial. Ecol., 33: 35-39.
SAXENA, D. y STOTZKY, G. 2001a. Bt toxin uptake from soil by plants. Nature.Biotechnol., 19: 199.
SAXENA, D. y STOTZKY, G. 2001b. Bacillus thuringiensis (Bt) toxin released from root exudates and biomass of Bt corn has no apparent effect on earthworms, nematodes, protozoa, bacteria, and fungi in soil. Soil Biol. Biochem., 33: 1225–1230.
SAXENA, D.; FLORES, S. y STOTZKY, G. 2002. Vertical movement in soil of insecticidal Cry1Ab protein from Bacillus thuringiensis. Soil Biol. Biochem., 34: 111-120.
SAXENA, D.; STEWART, N.C.; ALTOSAAR, I.; SHU, Q. y STOTZKY, G. 2004. Larvicidal Cry proteins from Bacillus thuringiensis are released in root exudates of transgenic B. thuringiensis corn, potato, and rice but not of B. thuringiensis canola, cotton, and tobacco. Plant Physiol. Biochem., 42: 383–387.
SCHNEPF, H.E.; CRICKMORE, N.; VAN RIE, J.; LERECLUS, D.; BAUM, J.; FEITELSON, J.; ZEIGLER, D.R. y DEAN, D.H. 1998. Bacillus thuringiensis and its pesticidal crystal proteins. Microbiol. Mol. Biol. Rev., 62: 775-806.
SHELTON, A.M.; ZHAO, J.Z. y ROUSCH, R.T. 2002. Economic, ecological, food safety, and social consequences of the deployment of Bt transgenic plants. Annu. Rev. Entomol., 47: 845-881.
SIMS, S.R. y BERBERICH, S.A. 1996. Bacillus thuringiensis Cry1A protein levels in raw and processed seed of transgenic cotton: Determination using insect bioassay and ELISA. J. Econ. Entomol., 89: 247-251.
SMALLA, K.; BORIN, S.; HEUER, H.; GEBHARD, F.; VAN ELSAS, J.D. y NIELSEN, K. 2000. Horizontal transfer of antibiotic resistance genes from transgenic plants to bacteria. Are there new data to fuel the debate? Proceedings of the 6th International Symposium on THE BIOSAFETY OF GENETICALLY MODIFIED ORGANISMS. Saskatoon, Canada, Clare Fairbairn, Graham Scoles and Alan McHughen, University Extension Press, Saskatchewan. July 2000, p. 146-154.
STANLEY-HORN, D.E.; DIVELY, G.P.; HELLMICH, R.L.; MATTILA, H.R.; SEARS, M.K.; ROSE, R.; JESSE, L.C.H.; LOSEY, J.E.; OBRYCKI, J.J. y LEWIS, L. 2001. Assessing the impact of Cry1Ab-expressing corn pollen on monarch butterfly larvae in field studies. Proc. Natl. Acad. Sci. USA 98: 11931-11936.
STEWART, C.N.; HALFHILL, M.D. y WARWICK, S.I. 2003. Transgene introgression from genetically modified crops to their wild relatives. Nat. Rev. Genetics 4: 806-817.
STOTZKY, G. 2001. Persistence and biological activity in soil of insecticidal proteins from Bacillus thuringiensis and of bacterial DNA bound on clays and humic acid. Journal of Environmental Quality, 29: 691-705.
TABASHNIK, B.E. 1994. Evolution of resistance to Bacillus thuringiensis. Annual Review of Entomol., 39, 47–79.
TAPP, H.; CALAMAI, L. y STOTZKY, G. 1994. Adsorption and binding of the insecticidal proteins from Bacillus thuringiensis subsp. kurstaki and subsp. tenebrionis on clay minerals. Soil Biol. Biochem., 26: 663–679.
TAPP, H. y STOTZKY, G. 1998. Persistence of the insecticidal toxin from Bacillus thuringiensis ssp. Kurstaki in soil. Soil Biol. Biochem., 30: 471-476.
TEPFER, D.; GARCIA-GONZALES, R.; MANSOURI, H.; SERUGA, M.; MESSAGE, B.; LEACH, F. y CURKOVIC PERICA, M. 2003. Homology-dependent DNA transfer from plants to a soil bacterium under laboratory conditions: implications in evolution and horizontal gene transfer. Transgenic Research 12: 425–437.
WALKER, T.S.; BAIS, H.P.; GROTEWOLD, E. y VIVANCO, J.M. 2003. Root exudation and rhizosphere biology. Plant Physiol., 132: 44-51.
WIDMER, F.; SEIDLER, R.J. y WATRUD L.S. 1996. Sensitive detection of transgenic plant marker gene persistence in soil microcosms. Mol. Ecol., 5: 603–613.
WIDMER, F.; SEIDLER, R.J.; DONEGAN, K.K. y REED, G.L. 1997. Quantification of transgenic plant marker gene persistence in the field. Mol. Ecol., 6: 1–7.
ZANGERL, A.R.; MCKENNA, D.; WRAIGHT, C.L.; CARROLL, M.; FICARELLO, P.; WARNER, R. y BERENBAUM, M.R. 2001. Effects of exposure to event 176 Bacillus thuringiensis corn pollen on monarch and black swallowtail caterpillars under field conditions. Proc. Natl. Acad. Sci. USA 98: 11908-11912.
ZWAHLEN, C.; HILBECK, A.; GUGERLI, P. y NENTWIG, W.2003. Degradation of the Cry1Ab protein withintransgenic Bacillus thuringiensis corn tissue in the field. Mol. Ecol., 12: 765775.
Temas relacionados
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación