Parasitos en ovinos
Clasifcación por el método Famacha y su relación con el valor de hematocrito y recuento de h.p.g. de ovinos criados en condiciones de pastoreo
En una fnca dedicada a la producción de bovinos y ovinos ubicada en el municipio Palmasola, al sudeste del estado Falcón; se realizó el análisis coproparasitológico cuantitativo con la técnica de McMaster con solución salina sobresaturada como liquido de fotación, determinación del valor del hematocrito por el método de microhematocrito por centrifugación y comparación del color de la conjuntiva ocular con la carta Famacha de 164 ovinos: 82 de la raza Bergamasca, 41 West African y 41 mestizos Bergamasca x West African. La integración de la información obtenida, permitió la discriminación de tres categorías de ovinos al interior del rebaño: resistentes, resilientes y sensibles. Esta clasifcación se realizó primero a mano y luego se sometió al método multivariado de análisis discriminante. La fracción de ovinos resistentes resultó dominante al interior del rebaño (82,31%), seguida de los resilientes (12,8%) y por último la correspondiente a los sensibles (4,87%), concentrándose este último grupo en los ovinos de la raza Bergamasca. La coloración de la conjuntiva ocular refejó de manera adecuada el valor del hematocrito, validando positivamente el uso de la carta Famacha como una herramienta útil en el control del parasitismo gastrointestinal en ovinos bajo nuestras condiciones. Los recuentos de h.p.g resultaron similares entre los grupos resilientes y sensibles, pero muy superiores a dichos recuentos en los animales resistentes. La selección de los animales a tratar con antihelmínticos mediante el color de la conjuntiva ocular ocasiona una drástica reducción de la contaminación del pastizal, ya que en los animales cuya conjuntiva ocular es rosada, rosada pálida o blanca se observaron los recuentos de h.p.g mas elevados.
Palabras clave: Haemonchus contortus, Famacha, resistente, resiliente, sensible, conjuntiva ocular, hematocrito, recuento de h.p.g, ovinos, control del parasitismo gastrointestinal.
Classifcation by Famacha method and their relationship among haematocrit value and the e.p.g. counts in sheep reared under grazing conditions
The present work was carried out in a farm where cattle and sheep are reared simultaneously, located in Palmasola municipium, Falcón state. All 164 sheep (82 Bergamasca, 41 West African and 41 cross breed Bergamasca x West African) were submitted to McMaster counting technique with a oversaturated saline solution as fotation liquid.
Determination of the haematocrit values was done by means of the microhematocrit centrifugation method. The color of the ocular mucous membrane of each examined sheep was compared with the color chart called Famacha in order to evaluate the degree of anaemia clinically by classifying the color of the conjunctivae ocular membrane.
The integration of these different criteria were made prior by hand and after by means of multivariate methods (Discriminant Analysis) allowed the classifcation of sheep in three groups: resistants, resilients and sensitives.
The fraction within the fock of resistants sheep was dominant (82,31%), followed by the resilients (12,8%) and for the sensitive ones in the last place (4,87%). The sensitive fraction of sheep was observed in the Bergamasca breed. The coloration of the conjunctive ocular refected in an appropriate way the value of the haematocrit, validating the use of the Famacha chart positively as a useful tool in the control of the gastrointestinal parasitism in sheep reared under our conditions. The e,p,g. counts among the resilients and sensitives groups were similar, but very superior to this one in the resistants animals. The selection of the animals to drench with anthelmintic by means of the color of the conjunctive ocular causes a drastic reduction of the contamination of the pasture, given that the animals whose conjunctive ocular were pink, pink white or white the e.p.g counts were the highest.
Keywords: Haemonchus contortus, Famacha, resistant, Resilient, Sensitive, Conjunctive ocular, haematocrit, e.p.g count, gastrointestinal parasitism control.
Las parasitosis ocasionadas por helmintos de ciclo directo afectan a los rumiantes domésticos en todos los países del mundo (Hansen y Perry, 1994) y se les incrimina como una de las principales causas de pérdidas económicas en las regiones tropicales (FAO, 2003), debido tanto a la reducción en el consumo como en la efciencia de utilización de los alimentos (Preston y Leng, 1989). En el caso particular de los pequeños rumiantes, el parasitismo gastrointestinal se considera como una de las patologías que causa las mayores pérdidas económicas por ocasionar disminución de la fertilidad y muerte en animales jóvenes (Mandonnet, 1995), además de afectar negativamente la tasa de crecimiento, la producción de leche y de lana (Gruner y Cabaret, 1985), lo cual ha contribuido a la frecuente práctica de los tratamientos masivos bajo la falsa premisa que " si un animal esta parasitado, todos lo están", generalmente asociados a dosifcaciones incorrectas e innecesarias en muchos animales (Morales et al., 1998), favoreciendo la aparición de quimioresistencia (Coles y Roush, 1992; Viera y Cavalcante, 1999).
Esta práctica de tratamientos masivos es totalmente injustifcada, ya que los niveles de infestación parasitaria no son similares, ni siquiera al interior de una misma raza y sexo, aunque se trate de animales de semejantes condiciones fsiológicas y edad, puesto que la agregación de los parásitos en el seno de la población hospedadora es algo común que se traduce en que una fracción del rebaño concentra las mayores cargas y el resto esta negativo o con niveles de infestación leves o moderados (Cabaret y Morales, 1983; Barger, 1985; Morales, 1989), fracción esta que es siempre inferior al 20% del total de animales del rebaño (Roberts y Swan, 1982).
Para diversos autores los niveles de infestación parasitaria por estróngilos digestivos hematófagos se correlacionan negativamente con parámetros hematológicos como el valor del hematocrito (Luffau et al., 1981; Mandonnet, 1995; Morales et al., 2002b), por consiguiente, la medida de este parámetro hematológico puede ser empleada como un indicador indirecto de la resistencia a la infestación parasitaria, especialmente en aquellas produccones en las cuales estén presentes especies parásitas hematófagas como el Haemonchus contortus (Morales et al., 2002a;
Morales y Pino, 2009a).
La observación de Malan y Van Wyk (1992), quienes referen la existencia de correlación entre el color de la conjuntiva ocular, valor del hematocrito y nivel de infestación por Haemonchus contortus, así como la asociación del color de la conjuntiva ocular con el valor hematocrito, permite establecer distintos niveles de anemia producida por Haemonchus contortus mediante la observación de dicha mucosa (Van Wyk y Bath, 2002).
Este hallazgo permitió desarrollar el método de control parasitario conocido como Famacha (Bath et al., 2001), en el cual se utiliza la estandarización de los niveles de anemia según los colores de la conjuntiva ocular y cuya fnalidad es la de identifcar clínicamente al interior del rebaño a los animales resistentes, resilientes y sensibles de manera de optimizar los tratamientos selectivos y disminuir el uso del recurso del laboratorio.
Entendiéndose como resistencia, la habilidad del animal para resistir el establecimiento de las larvas infectantes de los esatróngilos digestivos (L3) o sobre el posterior desarrollo de dichas larvas al estado adulto (Mandonnet, 1995; FAO, 2003). Los animales resistentes además de limitar la carga parasitaria, disminuyen el nivel de postura de las hembras (Morales et al., 2006a; 2006b; Morales y Pino, 2009a).
Resiliencia, la habilidad del animal de mantener niveles productivos aceptables aún albergando altas cargas parasitarias.
Clínicamente, el animal se manifesta saludable (FAO, 2003; Morales et al., 2006a; 2006b; Morales y Pino, 2009a) y, Acumuladores de Parásitos o Wormy Animals, la fracción de animales que al interior del rebaño concentra elevadas cargas parasitarias con
manifestación de síntomas clínicos y por ende con deterioro de sus cualidades productivas (Morales et al., 1998; 2006a; 2006b; Morales y Pino, 2009a), a estos animales también se les denomina sensibles se debe destacar que el método Famacha al detectar solo anemia como una manifestación del efecto Haemonchus es más una medida de tolerancia que de resistencia (Bisset, 2000).
El objetivo del presente trabajo es el de validar bajo condiciones de campo y análisis de laboratorio (hematocrito y coproscopía cuantitativa), la utilidad del método Famacha en un rebaño con antecedentes de parasitismo gastrointestinal con presencia de especies hematófagas como Haemonchus contortus y Oesophagostomum columbianum, a fn de identifcar animales resistentes, resilientes y sensibles al interior del mismo.
MATERIALES Y MÉTODOS
Ubicación de la fncaEl muestreo se realizó en una fnca ubicada en el municipio Palmasola al sudeste del estado Falcón, con una superfcie de 50 hectáreas y Brachiaria humidícola como pasto predominante.
Esta explotación ovina ha confrontado serios problemas debidos al parasitismo gastrointestinal según información suministrada por el productor y resultados emitidos por el Laboratorio de Parasitología y Enfermedades Parasitarias, Decanato de Ciencias Veterinarias, Universidad Centroccidental Lisandro Alvarado UCLA, estado Barquisimeto, Venezuela indicaron la presencia del Haemonchus contortus.
Se realizó la evaluación de todo el rebaño, tanto hembras como machos de todas las edades, de las razas Bergamasca, West African y mestizos Bergamasca x West African, representando un total de 164 animales.
Métodos parasitológicos
Las muestras de heces fueron tomadas directamente del recto de los animales y debidamente identifcadas fueron transportadas en refrigeración hasta el Laboratorio de Parasitología de Sanidad Animal, CENIAP-INIA, en el cual se mantuvieron a 4ºC hasta su procesamiento en un lapso de 48 horas. Como técnica coproscópica se utilizó el método cuantitativo de McMaster y como líquido de fotación una solución salina sobresaturada (NaCl).
El recuento de huevos por gramo de heces (h.p.g.), permitió establecer los niveles de infestación por animal examinado (Hansen y Perry, 1994; Morales y Pino, 2009a):
Negativos: 0 h.p.g.
Infestación Leve: 50 a 200 h.p.g.
Infestación Moderada: > 200 a 800 h.p.g.
Infestación Alta: > 800 h.p.g.
Para verifcar la presencia de Haemonchus contortus en la población hospedadora objeto de estudio, se realizó el coprocultivo de un pool de heces de las muestras con los conteos de h.p.g. más elevados, para lo cual las heces fueron mezcladas en partes iguales con vermiculita, humedecidas hasta formar una consistencia pastosa y colocadas en un recipiente plástico en una estufa a 28º C por 10 días.
La recuperación de las larvas se realizó mediante la técnica de Baermann, identifcándose al examen microscópico empleando claves morfológicas y morfométricas (Morales y Pino, 1977; 2009a).
Para la búsqueda de parásitos adultos de Haemonchus contortus se realizó la necropsia a 3 animales cuyas conjuntivas oculares presentaban coloración blanca. El abomaso de cada animal fue separado del resto del tracto gastrointestinal para examinar cuidadosamente su contenido. Para la identifcación de los parásitos se emplearon las claves señaladas por Gibbons (1979); Morales et al., (1992) y Morales y Pino (2009a).
Una muestra de sangre de cada animal fue extraída directamente por punción yugular, empleando tubos vacutainer con anticoagulante EDTA y los valores de hematocrito (%) se determinaron por medio de la técnica de microhematocrito por centrifugación (Hansen y Perry, 1994; Morales y Pino, 2009a).
A las muestras de sangre con valores de hematocrito por debajo de 25% se les realizó descarte de hemoparásitos por métodos parasitológicos directos (Guillén et al., 2001).
Coloración de la conjuntiva ocular
Siguiendo las recomendaciones establecidas por los creadores del método Famacha, se realizó la inspección de la mucosa de la conjuntiva ocular para la observación del color de la misma y compararlo con las coloraciones de la carta guía, la cual presenta una escala de cinco colores que va desde el rojo (1); rojo pálido (2); rosado (3); rosado pálido o blanco rosado (4) y blanco (5) Batch et al., 2001, (Figura), cuya correspondencia con los rangos de valores del hematocrito son conocidos (Van Wyk y Bath, 2002).
Clasifcación inicial de los ovinos
Para la clasifcación inicial de los ovinos como resistentes, resilientes o acumuladores de parásitos se utilizaron los resultados de la coproscopía cuantitativa y el valor hematocrito como variables cuantitativas y el color de la conjuntiva ocular como variable cualitativa, de acuerdo al siguiente esquema:


Figura. Inspección de la mucosa de la conjuntiva ocular y comparación con las coloraciones de la carta Famacha.
En base a las condiciones anteriores se realizó la clasifcación manual de los animales (grupos a priori) en las diferentes categorías. Con esta clasifcación preliminar y por medio de un análisis discriminante se obtuvieron las funciones discriminantes de cada categoría (InfoStat, 2004), las cuales fueron empleados para la ubicación defnitiva de cada animal bajo la condición de resistente, resiliente o sensible.
Con la ubicación defnitiva de cada animal en la categoría correspondiente se realizaron los análisis estadísticos respectivos, se procedió a evaluar el ajuste a una distribución normal de las variables cuantitativas (conteos de h.p.g., valor del hematocrito) mediante la prueba de Kolmogorov Smirnov (Domenech, 1982), resultando no ajustada a la distribución normal en el caso de los hpg y ajustada en el caso del valor hematocrito. Con la fnalidad de validar la utilidad de la carta Famacha en condiciones de campo, se realizó la evaluación del efecto del nivel de infestación parasitaria (0=negativo; 1=leve; 2= moderado; 3=alto), color de la conjuntiva ocular (grados 1 al 5) y condición de resistente, resiliente o acumulador sobre el valor hematocrito mediante un análisis de varianza factorial (Domenech, 1982).
Como prueba de rangos múltiples para la separación de medias a posteriori se recurrió a la prueba de Bonferoni a un nivel α = 0,05 (InfoStat, 2004). Considerando, las recomendaciones de la carta Famacha sobre la selección de los animales a tratar, se utilizó el color de la conjuntiva ocular para realizar la selección de la fracción de animales a tratar y para establecer los valores promedios de los conteos de hpg y del valor hematocrito correspondiente a cada grupo conformado (tratar y no tratar).
La comparación entre los recuentos de huevos de ambos grupos se realizó con la prueba U de Mann y Whitney, mientras que la comparación entre los conteos de huevos por gramo de heces (hpg) entre animales resistentes, resilientes y sensibles o acumuladores como criterio evaluador del efecto contaminante del pastizal por cada categoría de animal, se hizo mediante la prueba no paramétrica de Kruskal - Wallis (Morales y Pino, 1995; 2009b). En todos los análisis estadísticos se empleó el paquete para análisis de datos InfoStat (2004).
RESULTADOS Y DISCUSIÓN
En el coprocultivo se evidenció la presencia de larvas (L3) de Haemonchus y en las tres necropsias parasitológicas se identifcó a la especie Haemonchus contortus. Del total de animales examinados y con identifcación del grupo racial (n= 164), 135 (82,31%) resultaron resistentes, 21 (12,8%) resilientes y 8 (4,87%) sensibles.
La condición de resistente o de resiliente fue observada en todos los grupos raciales, mientras que los sensibles o acumuladores de parásitos se concentraron en la raza Bergamasca (Cuadro 1). El valor del hematocrito resultó similar entre resistentes (X= 30,36 %) y resilientes (X=28,52%), pero muy superior y con diferencias estadísticamente signifcativas con respecto a los animales sensibles (X= 12,75%, Cuadro 2).
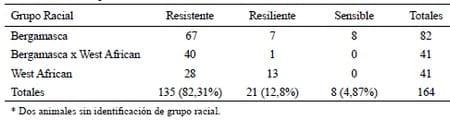

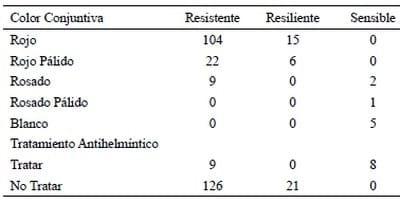
En el Cuadro 4 se observa que en los animales clasifcados como sensibles o acumuladores, el color de la conjuntiva ocular oscilo desde rosado hasta blanco, mientras que en los resistentes va del rojo al rosado y en los resilientes del rojo al rojo pálido.
Al comparar los recuentos de h.p.g., se encontraron valores similares entre resilientes y sensibles pero muy superiores (P<0,05) a los conteos de los animales resistentes (Cuadro 2). La comparación entre los recuentos de h.p.g. de la fracción de ovinos que según la coloración de la conjuntiva ocular requieren tratamiento con respecto a los que no lo requieren resultó con diferencias estadísticamente signifcativas, evidenciándose el impacto de la escogencia de la fracción de animales a tratar sobre la contaminación del pastizal (Cuadro 5).
Los resultados a las técnicas directas no evidenciaron la presencia de hemoparásitos en los animales con valores de hematocrito indicativos de anemia.
El parasitismo gastrointestinal de los ovinos es ocasionado en nuestro país por diferentes especies de nematodos que incluye representantes de al menos tres familias diferentes (Trichostrongylidae, Strongylidae y Ancylostomatidae), de las cuales por su riqueza especifca y frecuencia le corresponde la mayor importancia a los trichostrongilidos (Morales,1989), siendo las infestaciones pluriespecifcas el caso más frecuente en condiciones naturales (Pino et al., 1986; 1998 ; Morales y Pino, 2003). Al interior de las comunidad de parásitos, la especie Haemonchus contortus fgura entre las de mayor importancia numérica y es por tal motivo considerada como una de las especies dominantes en Venezuela (Pino et al.,1986; Morales y Pino, 1987; Morales, 1989), evidenciándose su presencia en la explotación ovina en la cual se desarrolló el presente trabajo, tanto por la identifcación de larvas infectantes (L3), como por la identifcación de especímenes adultos a nivel del abomaso, lo cual era un requisito indispensable para poder utilizar la carta guía de colores de la conjuntiva ocular conocida como Famacha, a fn de evaluar los grados de anemia causados por la presencia de parásitos hematófagos y muy específcamente de la especie H. contortus (Bath et al.,2001).
Otro aspecto de relevante interés lo constituye el hecho de que al interior del rebaño tan solo una pequeña fracción del mismo alberga las mayores cargas, pero unos con manifestaciones clínicas (sensibles o acumuladores de parásitos) y otros, que aun soportando cargas parasitarias altas no
manifestan sintomatología clínica (resilientes), lo cual reviste gran importancia epidemiológica debido a que ambas categorías de animales juegan un papel como contaminadores del pastizal y para la realización de tratamientos selectivos al menos del grupo que expresa sintomatología clínica (Morales et al. ,1998).
Cabe señalar que, el hecho de que en la raza Bergamasca también se observó un grupo de individuos resistentes, confrma que la resistencia a la infestación parasitaria es variable tanto entre razas diferentes como entre individuos de la misma raza (Baker, 1999), lo cual, con el conocimiento de la naturaleza genética y por consiguiente heredable de dicha condición (Stear y Murray, 1994), implica la necesidad de incorporar el criterio de condición de helminto resistentes en los programas de selección de reproductores, además de los requisitos de índole zootécnica (Baker, 1999; Gray, 1997; FAO, 2003;Morales et al., 2005).
Entre ovejas acumuladoras de parásitos y resilientes no se encontraron diferencias signifcativas con respecto a las cargas parasitarias pero si con respecto al valor hematocrito (resilientes>acumuladores). El hecho que el valor hematocrito de los animales incluidos en la categoría de resilientes sea similar al valor de dicho parámetro en los animales considerados resistentes y muy superior con respecto al de los acumuladores, refeja la buena adaptabilidad al medio de la categoría de los resilientes, razón por la cual se les considera tolerantes (FAO, 2003), pero esa tolerancia es también una limitante para el control efcaz del parasitismo, ya que los resilientes tienen un alto poder contaminador del pastizal, pero al no manifestar sintomatología clínica no pueden ser incluidos dentro de los tratamientos selectivos (FAO, 2003).
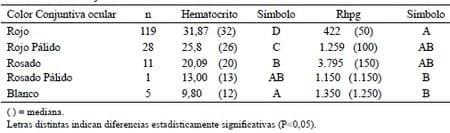
Al comparar el valor hematocrito utilizando el color de la conjuntiva ocular como variable de clasifcación (carta Famacha), observamos una excelente relación entre el color de la conjuntiva y el valor hematocrito, tal como fue reportado por Van Wyk y Bath (2002), destacando el hecho de que los animales con la conjuntiva color rojo pálido y rosado, aunque presentaron similares cargas parasitarias, su valor hematocrito resultó diferente (rojo pálido>rosada), lo que nos permite suponer que en el caso de la conjuntiva rojo pálida estamos frente a animales resilientes y en los de color rosado se trata de animales sensibles o acumuladores.
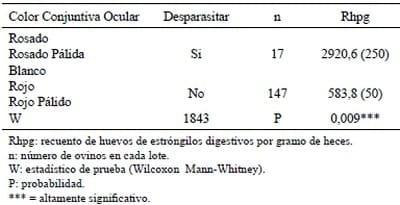
La efcacia del uso de la carta Famacha en el control parasitario mediante el tratamiento selectivo de la fracción del rebaño con conjuntivas que van del color rosado al blanco, nos indica que al interior del rebaño tan solo 17 animales requerían tratamiento antihelmíntico, todos con un valor de hematocrito bajo y cargas parasitarias altas, sin embargo, quedarían sin tratar aquellos animales tolerantes a la infestación parasitaria, es decir que aun soportando altas cargas parasitarias su valor de hematocrito y su refejo a través del color de la conjuntiva ocular indicaban que no ameritaban ser tratados.
El tratamiento de la fracción seleccionada por el color de la conjuntiva ocular, que representó tan solo 10,4 % (17/162) del rebaño, garantiza una reducción de la contaminación del pastizal del 80%. Ahora bien, el hecho de que 9 animales considerados resistentes por no albergar cargas parasitarias elevadas presentaron conjuntiva ocular de color rosado y por consiguiente ubicados dentro de la fracción que requiere tratamiento, nos indica que la anemia no es de origen parasitario y por ende se recomienda que frente a este tipo de situaciones se realicen ensayos más profundos para determinar el origen de la anemia.
El no aplicar antihelmínticos al 89,6 % del rebaño, además de la reducción en los costos de producción garantiza la presencia de poblaciones parasitarias en refugio a nivel del pastizal, es decir, que no han estado en contacto con el antiparasitario y por consiguiente no sometidas a la presión de selección que conlleva a la aparición de cepas de parásitos quimioresistentes, disminuyendo el respectivo riesgo (FAO, 2003).
En conclusión el uso de la carta Famacha en explotaciones en las cuales este presente el Haemonchus contortus es una buena medida de la resiliencia y de la resistencia, derivado de la fuerte correlación entre la coloración de la conjuntiva ocular y el valor hematocrito (Malan et al., 2000).
El uso del método Famacha constituye una herramienta de gran utilidad dentro de una estrategia a largo plazo tendiente al control sustentable de la estrongilosis (Morales y Pino, 2009), eliminando del rebaño a aquellos reproductores que mediante su evaluación periódica y de su descendencia se manifesten como sensibles (Morales et al.,2002a; 2002b).
En el caso de los animales resilientes, por su tolerancia a niveles de infestación elevada, la utilización de la carta Famacha también permite su selección, los cuales en condiciones tropicales y húmedas requieren menor número de tratamientos antihelmínticos en periodos de tiempo y desafó parasitario, que la categoría de los sensibles (Bisset y Morris, 1996), representando una interesante alternativa para la producción ovina bajo nuestras condiciones ambientales.
RECOMENDACIONES
La utilización de la carta FAMACHA requiere del conocimiento previo de la presencia de parásitos hematófagos en la explotación, mereciendo especial énfasis el género Haemonchus, es por ello, que la realización de necropsias y /o cultivo de larvas sean de interés.
Conociendo que la distribución de los parásitos en el seno de la población de hospedadores es en agregados, la escogencia de un animal con sintomatología clínica evidente y su sacrifcio para la realización de una necropsia parasitaria es una vía adecuada para conocer la fauna parasitaria presente en la explotación.
La carta FAMACHA no permite discernir entre resilientes y resistentes, ya que para ubicar las categorías al interior del rebaño se requiere realizar tanto la coproscopía cuantitativa como la determinación del valor del hematocrito.
Aquellos animales que resulten sensibles deben ser descartados como reproductores debido al carácter heredable de esta condición y eliminados del rebaño ya que, además de requerir tratamientos antihelmínticos
con mayor frecuencia, al concentrar altas cargas parasitarias incrementan la contaminación de los pastizales.
Los animales resilientes merecen una cuidadosa atención y riguroso manejo debido a que también concentran altas cargas parasitarias, teniendo un poder contaminante del pastizal similar al de los sensibles y por consiguiente después de ser identifcados solo deberían tener acceso a potreros con animales adultos cuya condición sea la de resistente.
Queremos dar nuestro agradecimiento a la Srta. Amanda Álvarez, por su colaboración en el procesamiento de las muestras y al Sr. Raúl Vásquez por su colaboración en los traslados y toma de muestras durante el desarrollo de este trabajo.
LITERATURA CITADA
Baker, R. 1999. Genetic resistance to endoparasites in sheep and goats in the tropic and evidence for resistance in some sheep and goats breeds in sub-humid coastal Kenya. Animal Genetic Resources Information; 24: 13-30.
Barger, J. 1985. The statistical distribution of trichostrongylid nematodes in grazing lambs. International Journal for Parásitology; 15: 645-649.
Batch,G., J. Hansen, R. Krecek, J. Vanwyk and A. Vatta. 2001. Sustainable approaches for managing haemonchosis in sheep and goats . Final report of F.A.O Technical Cooperation in Africa.Project No. TCP/ SAF/8821 (a), F.A.O; Roma; p 90.
Bisset, S. and C. Morris. 1996. Feasibility and implications of breeding sheep for resilience to nematode challenge.International Journal for Parasitology; 26: 857-868.
Bisset, S. 2000. Practical ways of implementing identifcation of host resistance in sheep and its use in breeding programmes. in: " F.A.O TCP Workshop Sustainable Worm Control Programmes for Sheep and Goats" South Africa; pp 16-21.
Cabaret, J. and G. Morales. 1983. Stratégie comparée des infestations naturelles par Teladorsagia circumcincta et T. trifurcata chez les ovins. Parásitologia; 25: 171-177.
Coles, G. and R. Roush. 1992. Slowing the spreed of antihelmintic resistant nematodes of sheep and goats in the United Kingdom. The Veterinary Record; 130: 505-510.
Doménech, J. 1982. Bioestadística. Métodos estadísticos para investigadores. Editorial Herder, Barcelona, España; p 648.
FAO. 2003. Resistencia a los antiparasitarios: Estado actual con énfasis en América Latina. Dirección de Producción y Sanidad Animal; No. 157, Roma; p 52.
Gibbons, L. 1979. Revision of the genus Haemonchus, Cobb, 1898 (Nematoda: Trichostrongylidae). Systematic Parásitology; 2: 219-252.
Gray, G. 1997. Genetic resistance to haemonchosis in sheep. Parásitology Today; 8: 253-255.
Gruner, L. and J. Cabaret. 1985. Current methods for estimating parasite populations: potential and limits to control gastrointestinal and pulmonary strongyles of sheep on pasture. Livestock Production Science; 13: 53-70.
Guillén, A. T., E. León, W. Aragort y M. Silva. 2001. Diagnóstico de hemoparásitos en el Instituto de Investigaciones Veterinarias. Período 1986-2000. Veterinaria Tropical; 26(1): 47-72
Hansen, J. and B. Perry. 1994. The epidemiology, diagnosis and control of helminth parasites of ruminants .International Laboratory for Research on Animal Diseases, Nairobi, Kenya; p 171.
InfoStat. 2004. InfoStat versión 2004. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina.
Luffau, G., P. Perry and A. Petit. 1981. Self-cure and immunity following infection and re-infection with ovine haemonchosis. Veterinary Parásitology; 9: 57-67
Malan, F. and J. Van Wyk. 1992. The packed cell volume and colour of the conjuntivae as aids for monitoring Haemonchus contortus infestations in sheep. Proceedings of the South Africa Veterinary Association. Biennial National Veterinary Congress, Grahamstown; 139 pp.
Malan, F. S., J. A. Van Wyk and C. D. Wessel. 2000. Clinical evaluation of anaemia in sheep: early trials in: " F.A.O TCP Workshop Sustainable Worm Control Programmes for Sheep and Goats" South Africa; pp 34-39.
Mandonnet, N. 1995. Analyse de la variabilité génétique de la résistance aux strongles gastro-intestinaux chez les petits ruminants. Eléments pour la défnition d´objectifs et de critères de sélection en milieu tempéré ou tropical. Thèse Docteur en Sciences. Université de Paris XI, Orsay (France) ; p 115.
Morales. G. y L. A. Pino. 1977. Manual de diagnostico helmintológico en rumiantes. Edit. Colegio de Médicos Veterinarios del Estado Aragua, Venezuela; p 101.
Morales, G. y L. Pino. 1987. Eco-epidemiologia de Haemonchus contortus bahiensis, ecotipo presente en ovinos de zonas áridas de Venezuela. Memorias Instituto Oswaldo Cruz, Rio de Janeiro; 82 (3): 359-369.
Morales, G. 1989. Epidemiología y sinecología de los helmintos parásitos de ovinos y caprinos de zonas áridas del estado Lara (Venezuela). Revista de la Facultad de Ciencias Veterinarias. Universidad Central de Venezuela; 36: 10-52.
Morales, G., L. A. Pino y A. Bravo. 1992. Diferenciación de especies congenéricas de Haemonchus mediante funciones discriminantes. Revista Científca, Facultad de Ciencias Veterinarias de la Universidad del Zulia (FCV-LUZ); 2 (1):53- 58
Morales, G. y L. Pino. 1995. Parasitometría. Editorial de la Universidad de Carabobo, Valencia, Venezuela; p 224.
Morales, G., L. A. Pino, E. Sandoval y L. Moreno. 1998. Importancia de los animales acumuladores de parásitos (wormy animals) en rebaños de ovinos y caprinos naturalmente infectados. Analecta Veterinaria; 18:1-6.
Morales, G., L. Pino, E. León, Z. Rondón, A. Guillén, C. Balestrini y M. Silva. 2002a. Relación entre los parámetros hematológicos y el nivel de infestación parasitaria en ovinos de reemplazo.Veterinaria Tropical; 27 (2), 87-98.
Morales, G., L. Pino, E. León, Z. Rondón, A. Guillén, C. Balestrini y M. Silva. 2002b. Niveles de infección parasitaria en ovinos de reemplazo naturalmente infectados. Veterinaria Tropical; 27 (2): 123-135.
Morales, G. y L. Pino. 2003. Carga parasitaria de nematodos gastrointestinales y la riqueza específca en ovinos naturalmente infectados. Veterinaria Argentina; 20: 100-108.
Morales, G., E. Sandoval, L. A. Pino y D. Jimenez. 2005. Utilización de rumiantes domésticos genéticamente resistentes a la infección por estróngilos digestivos en estrategias de control. CENIAP HOY, Número 8. urt:http://www.ceniap.gov.ve/ceniaphoy/index.html.
Morales, G., L.A., Pino, E. Sandoval, J. Florio y D. Jiménez. 2006a. Niveles de infestación parasitaria, condición corporal y valores de hematocrito en bovinos resistentes, resilientes y acumuladores de parásitos en un rebaño Criollo Río Limón. Zootecnia Tropical; 24 (3): 333-346.
Morales, G., L. A. Pino, E. Sandoval, J. Florio y D. Jiménez. 2006b. Niveles de infestación parasitaria y condición corporal en bovinos doble propósito infestados en condiciones naturales. Revista Electrónica de Veterinaria REDVET, ISSN 1695-7504, Vol. VII, N° 04, Abril/2006. http://veterinaria.org/revistas/redvet/n040406.html.
Morales, G. y L. A. Pino. 2009a. Nematodes parásitos de los rumiantes domésticos en Venezuela: diagnóstico y control. Editado por Laboratorio de Diagnóstico Veterinario "Aliani". Impreso en Talleres Gráfcos Dot Print C.A , Caracas; 143 pp.
Morales, G. y L. A.Pino. 2009b. Estadística no Paramétrica aplicada a las ciencias de la salud. Universidad Católica Andrés Bello, Caracas; p102.
Pino, L., G. Morales, E. Aldana, L. Perdomo y E. Molina,. 1986. Caracterización micro ecológica de los nematodos parásitos de ovinos de zonas áridas de Venezuela. (Un nuevo criterio para el control). Revista Ibérica de Parasitología; 46: 395-401.
Pino, L., G. Morales, E. Sandoval y L. Moreno. 1998. Biodiversidad y similaridad en la comunidad de parásitos de ovinos y caprinos naturalmente infectados en zonas áridas de Venezuela. Veterinaria Tropical; 23: 109-115.
Preston, T. y R. Leng. 1989. Ajustando los sistemas de producción pecuaria a los recursos disponibles: Aspectos básicos y aplicados del nuevo enfoque sobre la nutrición de rumiantes en el trópico. Consultorías para el Desarrollo Rural Integrado en el Trópico (CONDRIT) Ltda, Cali , Colombia; p 311
Roberts, J. and R. Swan. 1982. Quantitative studies of ovine haemonchosis. The interpretation and diagnostic signifcance of the changes in serial egg counts of Haemonchus contortus in a sheep fock. Veterinary Parásitology; 9: 211-216.
Stear, M. J. and M. Murray. 1994. Genetic resistance to parasitic disease: particularly of resistance in ruminants to gastrointestinal nematodes. Veterinary Parasitology; 54: 161-176
Van Wyk, J. and G. Bath. 2002. The Famacha system for managing haemonchosis in sheep and goats by clinically identifying individual animals for treatment. Veterinary Research; 33: 509-529
Viera, L. and A. Calvacante. 1999. Anthelmintic resistance in goat herds in the state of Ceará. Pesquisa Veterinária Brasileira; 19: 99-103.
Tomado de : Morales,G ; Pino,L.A (2009).Nematodes Parásitos de los Rumiantes Domésticos en Venezuela : Diagnóstico y Control.Laboratorio Diagnóstico " Alianis"(Editores). Talleres Graficos Dot Print, Caracas, Venezuela ;143 pp.
Método FAMACHA en el control parasitario en pequeños rumiantes
Los niveles de infección parasitaria por estròngílos digestivos hematófagos se correlacionan negativamente con el hematocrito, por consiguiente la medida de este parámetro hematológico puede ser empleada como un indicador indirecto de la resistencia a la infección parasitaria, especialmente en aquellas explotaciones en las cuales estén presentes especies parasitas hematófagas como el Haemonchus contortus.
La patogénesis de la haemoncosis esta vinculada a una anemia hemorrágica debida a los hábitos hematófagos del parásito, cuando la infección es aguda su característica principal es una progresiva y dramática caída del valor Hematocrito, asociada a una continua perdida de hierro y proteínas a nivel del tracto intestinal con incremento de la inapetencia, lo cual afecta la función eritropoyetica de la medula y el hematocrito baja aún mas poco antes de que la muerte ocurra. Malan y Van Wyk (1992), evidenciaron la existencia de correlación entre el color de la conjuntiva ocular, el valor hematocrito y el nivel o grado de infección por Haemonchus contortus mediante la observación de la coloración de dicha mucosa. Estas coloraciones fueron pre establecidas con ayuda de computación grafica y se representaron cinco grados del valor hematocrito, incluyendo los limites para cada grado y comprobaron que la correlación entre los grados de anemia y la infección por Haemonchus contortus a un nivel de probabilidad de a= 0,5 era de 0,80.
Este hallazgo permitió desarrollar el método de control parasitario conocido como FAMACHA, cuya finalidad es la de identificar al interior de un rebaño, a la fracción de animales que requiere tratamiento y de esta manera optimizar los tratamientos selectivos al disminuir el lapso que media entre el disponer de los resultados de laboratorio y la aplicación del tratamiento, recurso este cuya frecuencia de uso, con la aplicación de este método puede reducirse. Este sistema utiliza una carta de ilustraciones a color de los cinco grados de anemia con las respectivas indicaciones en torno al requerimiento de tratamiento antihelmíntico (Fig.83) La aplicación del sistema FAMACHA conlleva a variados beneficios al productor, entre los cuales destacan la reducción de la frecuencia de los tratamientos, distinción de los animales considerando su capacidad de defensa frente a la infección por Haemonchus contortus, lo cual permite realizar una selección genética e incorporar un valor agregado, como lo es el de la resistencia a la infección parasitaria a los animales que serán destinados a la actividad reproductiva, además de disminuir la presión de selección sobre H. contortus por la resistencia a los antihelmínticos. Sin embargo y a pesar de sus bondades y practicidad, debemos resaltar la posibilidad de diagnósticos erróneos, principalmente en zonas en donde Fasciola hepatica y Trichostrongylus colubriformis constituyen un problema (FAO, 2003), lo cual nos permite recordar la importancia del recurso del laboratorio en helmintología y no pensar que estas nuevas metodologías surgieron para reemplazar en vez de complementar a la coproscopia cuantitativa y a la necropsia helmintológica.
DETERMINACION DEL VALOR HEMATOCRITO
Toma de una muestra de sangre total En la actualidad para la toma de una muestra de sangre se usan corrientemente los tubos al vacío, conocidos como Vacutainer, los cuales además de permitir un trabajo limpio y rápido, disminuyen los riesgos de hemólisis. En el caso de pequeños rumiantes, es recomendable el uso de agujas calibre 21 ó 18 en bovinos y búfalos (Sandoval et al, 2008) Anticoagulantes El EDTA (etilendiamina tetra acetato di sódico) es el anticoagulante mas indicado para hematología, aunque la heparina también puede ser usada, esta tiene la desventaja de que su efecto anticoagulante es transitorio y a lo máximo con una duración de tres días. La muestra de sangre debe ser refrigerada (4 – 8ºC) inmediatamente después de tomada.
Proteger los tubos para que no les entre agua, en caso de usar hielo como refrigerante. Su envió al laboratorio para estudio hematológico no debe ser mayor de 24 horas y en el caso de determinación de hemoparásitos, el lapso no debe pasar de 48 horas. Determinación del valor hematocrito Tome una muestra de sangre venosa (yugular o caudal) en un tubo Vacutainer (tapa morada) con anticoagulante, preferiblemente EDTA y de una capacidad de 5 mm (aproximadamente). Mezcle bien, pero suavemente durante 2 minutos, la muestra tomada Con la sangre bien mezclada, llene un tubo capilar (75 x 1,5mm) hasta las ¾ partes de su longitud. Selle uno de sus extremos a la ayuda de un mechero o con plastilina. Coloque el tubo capilar en la centrifuga para micro hematocrito, asegurándose que el extremo sellado quede hacia la parte externa en contacto con la banda de caucho adherida a la periferia del plato en el cual se colocan dichos tubos.
Cierre la tapa de la centrífuga Centrifugue los tubos capilares a 12.000 rpm durante 4 minutos Coloque los tubos sobre el lector y anote la lectura Exprese la lectura como un porcentaje de células rojas en el volumen total de sangre entera, ya que el Hematocrito es la relación expresada en porcentaje, del volumen de glóbulos rojos con respecto al volumen total de sangre
La resistencia a la infestación parasitaria es heredable y por consiguiente de indole genética, esto nos explica porque la variabilidad dentro de una raza muchas veces sea superior a dicha variabilidad entre razas,sin embargo esto no descarta el hecho de que existan unas razas mas resistentes que otras como la WEST AFRICAN y la BARBADOS BARRIGA NEGRA frente a razas muy susceptibles como la ROMANOF. Considero muy acertado el comentario sobre la selección natural el cual se explica por si solo. Frente a la inquietud del Ing.Ramos, el Hematocrito y los recuentos de h.pg, así como el cultivo de larvas o la necropsia parasitaria , los cuales requieren del apoyo de un laboratorio especializado , son de indudable necesidad al comienzo para saber que especies o al menos generos parasitarios son responsables de la problematica, siendo de indudable importancia corroborar la presencia del genero Haemonchus.
Deseo destacar que la carta FAMACHA no diferencia entre Resistentes(buen valor hematocrito y baja carga parasitaria o negativos) y Resilientes (buen valor hematocrito y altos recuento de h.p.g,)garantizando estos ultimos la contaminación del pastizal, ya que la carta FAMACHA los ubicaria dentro del grupo de los que no requieren tratamiento y son de utilidad para evitar o retardar la aparición de la quimioresistencia de los parásitos frente a los productos comerciales,con las debidas precauciones incluidas en el articulo.
En el caso de los sensibles y los anemicos por otras causas , podemos bien sea someterlos a un diagnostico diferencial para establecer quienes requieren de tratamiento antiparasitario y quienes no .Como este grupo en general representa una fracción pequeña al interior del rebaño(no mas del 25%),su destino final para definir si se descarta de una vez como reproductor o para engorde vendrá definido por los posteriores resultados ,ya que si continua infectandose con altas cargas se debe eliminar de dicho rebaño , sobre todo si consideramos la presencia de los resilientes con su poder contaminador del pastizal.La decisión final se puede basar en el hecho de que si la carta FAMACHA lo continua identificando como problema frente a otros que bajo las mismas condiciones no presentan la conjuntiva ocular palida , nos estaria indicando una mayor susceptibilidad y una menor adaptabilidad a las condiciones ambientales y representaria por consiguiente una mayor erogación por tratamientos , lo cual determina su salida rapida del rebaño.
Gracias por los comentarios ,todos muy valiosos e interesantes. Invitamos a releer el resumen y las conclusiones para aclarar que si lo consideramos de utilidad en el control parasitario y en programas de selección considerando la resistencia-resiliencia a la infestación por nematodes hematofagos. Atentamente, Gustavo Morales






