Alternativas Naturales para el control de parásitos gastrointestinales de ovinos y caprinos
Publicado: 9 de noviembre de 2011
Por: Leyla Rios De Alvarez, Instituto de Producción Animal. Facultad de Agronomía-Universidad Central de Venezuela; Frank Jackson y John Huntley, División de Parasitología, Moredun Research Institute, Edimburgo, Escocia-RU; Andy Greer, Lincoln University, Nueva Zelanda.
RESUMEN
El control de parásitos gastrointestinales (PGI) de los rumiantes se ha realizado con éxito por más de 40 años, a través del uso de productos químicos comerciales. Sin embargo, en los últimos años se han incrementado los problemas de resistencia en la población de parásitos a nivel mundial; además, han surgido problemas y preocupación por la posible contaminación que surge debido al uso de estos fármacos en la producción animal (residuos en alimentos y el ambiente). Es por esto que muchos investigadores se han centrado en el estudio de alternativas naturales para el control de los PGI, entre las cuales se incluye el uso de plantas con propiedades antihelmínticas o forrajes bioactivos, productos de plantas y metabolitos secundarios de plantas (MSP). Estos estudios se han centrado principalmente en aquellas plantas con elevados niveles de taninos y sus productos, sin embargo, en los últimos años también se han estudiado otros MSP como las lectinas. Estudios recientes con lectinas han demostrado que no solo se logra un efecto directo sobre los PGI, sino también un efecto indirecto de mejora en la inmunidad del hospedero, lo cual resulta en un doble beneficio. Los mecanismos involucrados en el uso de bioactivos y MSP aun deben ser precisados.
El control de parásitos gastrointestinales (PGI) de los rumiantes se ha realizado con éxito por más de 40 años, a través del uso de productos químicos comerciales. Sin embargo, en los últimos años se han incrementado los problemas de resistencia en la población de parásitos a nivel mundial; además, han surgido problemas y preocupación por la posible contaminación que surge debido al uso de estos fármacos en la producción animal (residuos en alimentos y el ambiente). Es por esto que muchos investigadores se han centrado en el estudio de alternativas naturales para el control de los PGI, entre las cuales se incluye el uso de plantas con propiedades antihelmínticas o forrajes bioactivos, productos de plantas y metabolitos secundarios de plantas (MSP). Estos estudios se han centrado principalmente en aquellas plantas con elevados niveles de taninos y sus productos, sin embargo, en los últimos años también se han estudiado otros MSP como las lectinas. Estudios recientes con lectinas han demostrado que no solo se logra un efecto directo sobre los PGI, sino también un efecto indirecto de mejora en la inmunidad del hospedero, lo cual resulta en un doble beneficio. Los mecanismos involucrados en el uso de bioactivos y MSP aun deben ser precisados.
PALABRAS CLAVE: control parasitario, forrajes bioactivos, metabolitos secundarios de plantas, lectinas.
ABSTRACT
Gastrointestinal parasites (GIP) control in ruminants has been successfully achieved for more than 40 years through the use of commercial drugs. However, in the last years problems of resistance in the parasite population have increased and also the concern of chemical residues in food and the environment are problems leading to studies related with controlling parasites through natural ways, such as plants, plant extracts, bioactive forages and plant secondary metabolites (PSM). Most of these studies have focused on tannins and tannin rich plants. However, more recently a new PSM, lectins, is also included in these studies; with findings related
with a double mechanism of act
Gastrointestinal parasites (GIP) control in ruminants has been successfully achieved for more than 40 years through the use of commercial drugs. However, in the last years problems of resistance in the parasite population have increased and also the concern of chemical residues in food and the environment are problems leading to studies related with controlling parasites through natural ways, such as plants, plant extracts, bioactive forages and plant secondary metabolites (PSM). Most of these studies have focused on tannins and tannin rich plants. However, more recently a new PSM, lectins, is also included in these studies; with findings related
with a double mechanism of act
KEY WORDS: parasite control, bioactive forrages, plant secondary metabolites, lectins.
INTRODUCCIÓN
Los parásitos gastrointestinales (PGI) son un problema universal para productores y una causa frecuente de la pobre eficiencia de las ganaderías a nivel mundial. El control de PGI en los años recientes se ha logrado con éxito a través del uso profiláctico y terapéutico de compuestos antihelmínticos comerciales (Coop y Sykes, 2002). Sin embargo, el uso continuo de estos productos ha resultado en la aparición a nivel mundial de resistencia de los nematodos (Waller, 1997). Por esta razón, y con la finalidad de evitar la fuente de contaminación que estos compuestos químicos pudiesen generar a nivel del ambiente y de alimentos, se han desarrollado líneas de investigación relacionadas con vías alternativas o naturales para el control de PGI en rumiantes. Algunos de estos métodos alternativos propuestos son de largo plazo, como la mejora genética para la obtención de animales resistentes a PGI (Morris et al., 2000) y el desarrollo de vacunas (Knox et al., 2003; Smith y Zarlenga, 2006). Sin embargo, el consumo de forrajes bioactivos o forrajes ricos en metabolitos secundarios de plantas (MSP), control biológico de parásitos a través del uso de hongos, la suplementación nutricional al hospedador, también han sido consideradas como potenciales soluciones a corto plazo (Krecek y Waller, 2006). La presente revisión se enfocará en las propiedades antihelmínticas de los MSP y su importancia como alternativa natural para controlar los PGI. Aspectos innovadores como el estudio del uso de lectinas de plantas para el control parasitario, nos enfoca en un nuevo grupo de compuestos, extraídos de cultivos y semillas, tanto de plantas tropicales como de clima templado, que pudiesen generar en el futuro, una nueva forma de control a nivel de rebaños comerciales. El mecanismo
a través del cual los MSP reducen las cargas parasitarias y/o los contajes de huevos también será revisado.
PARÁSITOS GASTROINTESTINALES COMUNES DE LOS PEQUEÑOS RUMIANTES
Parásitos del tracto digestivo
Parásitos del tracto digestivo
Los parásitos más comunes de los ovinos y caprinos también son clasificados como: nematodos o gusanos redondos, céstodos o tenias y tremátodos o fasciola del hígado. Los nematodos son encontrados en diferentes lugares del tracto del hospedador, tales como el abomaso, intestino delgado, intestino grueso y pulmones. La presente revisión se enfocará en las especies de nematodos H. contortus y T. colubriformis, la primeras encontrada en el abomaso mientras que la última se localiza en el intestino delgado; ambas son llamadas trichostrongyloidea. Entender los ciclos de vida de estos nematodos es importante a fin de poder implementar programas de control efectivos. Todos los PGI de importancia económica se caracterizan por tener una parasites adultos dentro del tracto digestivo del hospedador y por excretar huevos en sus heces. Las fases no parasíticas del ciclo ocurren en los pastizales, donde los huevos se desarrollan hasta larvas de primer estadio (L1), segundo (L2) y tercer estadio (L3), la cual es la larva infectiva.
Este ciclo de vida se muestra en la Figura 1. El periodo de tiempo requerido para la eclosión de los huevos y el desarrollo de las larvas, puede variar desde 5 días hasta varios meses dependiendo de las condiciones ambientales (Whittier et al., 2003).
Para H. contortus and T. colubriformis el ciclo de vida es comúnmente llamada trichostrongyloidea.
Luego de la eclosión de los huevos hasta L1 y su desarrollo hasta L3, estas larvas son ingeridas y ocurre la muda en el rumen y en el abomaso, respectivamente. La larva muda dos veces. En H. contortus la larva desarrolla una estructura en forma de lanza con la cual es capaz de perforar la capa mucosa en búsqueda de sangre. El periodo prepatente es de 2 a 3 semanas, el cual es el tiempo de desarrollo desde el momento de la infección hasta que es adulto y capaz de producir huevos (Taylor et al., 2007).
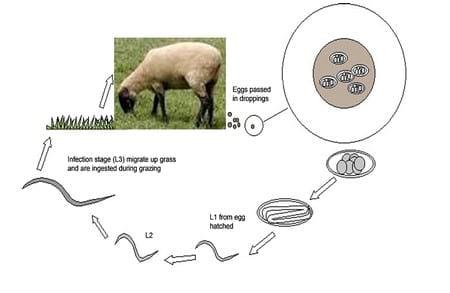
Figura 1. Ciclo de vida de parásitos gastrointestinales. El ciclo de vida incluye dos fases,una dentro de la oveja u hospedador (fase endógena), con duración de 21 días y unasegunda fase en las pasturas (fase exógena), con duración de entre 10 y 21 días.
Para T. colubriformis el tiempo de desarrollo de los huevos puede ser entre 7 a 10 días. Después de la ingestión y la muda en el abomaso, la larva penetra la mucosa del intestino delgado y luego de dos mudas adicionales, las larvas L5 son encontradas debajo del epitelio, cerca de la segunda semana después de la infección (periodo prepatente 2-3 semanas) (Taylor et al., 2007).
La epidemiología o factores que afectan las infecciones por nematodos parasíticos, incluyen temperatura y humedad, las cuales son variables criticas que afectan la supervivencia de huevos y larvas (Sargison, 2008). Los gusanos redondos requieren de una temperatura promedio diaria de 10°C y 50% de humedad a fin de poder eclosionar. A excepción de H. contortus que requiere de más de 15°C. Una vez que los huevos son excretados por los animales en sus heces, estos eclosionan como larvas y luego, otros factores, tales como la lluvia, juegan un importante rol en humedecer las heces, lo cual es necesario para la eclosión de los huevos y el desarrollo de las larvas. Este proceso involucra la migración de las larvas fuera de las heces, para lo cual la lluvia es imprescindible, ya que contribuye a la exposición de las mismas, haciendo posible que migren hasta los pastizales para la continuidad del ciclo. En las zonas tropicales las temperaturas no son muy variables a lo largo del año, por lo que las lluvias pueden ser el factor que más influencia elciclo de vida de los parásitos. Algunos estudios han demostrado la cercana relación que existe entre la lluvia y la recuperación de larvas inefectivas del pasto (Soulsby, 1982; Agyei, 1997).
H. contortus puede tener un efecto detrimental en ovinos y es el parásito que más afecta el ganado en zonas tropicales y subtropicales. Sin embargo, se ha hecho más frecuente en países europeos tales como Francia, Dinamarca, Suecia y los Países Bajos, tal vez por su habilidad arrestar su desarrollo en el estadio L4, teniendo un periodo más largo como L4 y más corto como larva de vida libre (O´Connor et al., 2006). Adultos Haemonchus se alimentan de sangre de manera obligada, teniendo la habilidad de penetrar la mucosa para tener acceso a la fuente de sangre del hospedador. Este comportamiento causa pérdidas de sangre, proteínas y anemia en los ovinos y caprinos, mostrando las características mucosas pálidas, especialmente la mucosa ocular inferior, así como la hinchazón y acumulación de liquido debajo de la mandíbula, llamado cuello de botella (Schoenian, 2006).
La epidemiología o factores que afectan las infecciones por nematodos parasíticos, incluyen temperatura y humedad, las cuales son variables criticas que afectan la supervivencia de huevos y larvas (Sargison, 2008). Los gusanos redondos requieren de una temperatura promedio diaria de 10°C y 50% de humedad a fin de poder eclosionar. A excepción de H. contortus que requiere de más de 15°C. Una vez que los huevos son excretados por los animales en sus heces, estos eclosionan como larvas y luego, otros factores, tales como la lluvia, juegan un importante rol en humedecer las heces, lo cual es necesario para la eclosión de los huevos y el desarrollo de las larvas. Este proceso involucra la migración de las larvas fuera de las heces, para lo cual la lluvia es imprescindible, ya que contribuye a la exposición de las mismas, haciendo posible que migren hasta los pastizales para la continuidad del ciclo. En las zonas tropicales las temperaturas no son muy variables a lo largo del año, por lo que las lluvias pueden ser el factor que más influencia elciclo de vida de los parásitos. Algunos estudios han demostrado la cercana relación que existe entre la lluvia y la recuperación de larvas inefectivas del pasto (Soulsby, 1982; Agyei, 1997).
H. contortus puede tener un efecto detrimental en ovinos y es el parásito que más afecta el ganado en zonas tropicales y subtropicales. Sin embargo, se ha hecho más frecuente en países europeos tales como Francia, Dinamarca, Suecia y los Países Bajos, tal vez por su habilidad arrestar su desarrollo en el estadio L4, teniendo un periodo más largo como L4 y más corto como larva de vida libre (O´Connor et al., 2006). Adultos Haemonchus se alimentan de sangre de manera obligada, teniendo la habilidad de penetrar la mucosa para tener acceso a la fuente de sangre del hospedador. Este comportamiento causa pérdidas de sangre, proteínas y anemia en los ovinos y caprinos, mostrando las características mucosas pálidas, especialmente la mucosa ocular inferior, así como la hinchazón y acumulación de liquido debajo de la mandíbula, llamado cuello de botella (Schoenian, 2006).
CONTROL QUÍMICO
Tradicionalmente los PGI han sido controlados efectivamente a través del uso de fármacos comerciales, clasificados en las siguientes tres familias: los benzimidazoles, imidazotiazoles / tetrahiirimidinas y la familia de las lactonas macrocíclicas. Todas estas drogas se desarrollaron a mediados del siglo 20, requiriendo cada vez dosis más pequeñas con cada producto nuevo que se desarrollaba. A pesar de la producción de nuevos principios químicos, la resistencia parasitaria se ha desarrollado rápidamente, aproximadamente 10 años después de la entrada de cada nuevo producto al mercado (Waller, 1994; McKellar y Jackson, 2004; Waller, 1997, 2006).
Sin embargo, es importante destacar que muchos casos de tratamientos no efectivos con estos fármacos, se debían principalmente a factores como, uso incorrecto de los productos comerciales, fecha de expiración, dosis no ajustada al peso del animal, uso incorrecto del aparato dosificador.
Ocasionando un pobre resultado del producto antihelmíntico y el desarrollo de la resistencia (Torres-Acosta y Hoste, 2008). Actualmente no existe ningún país ganadero del mundo que no presente casos de resistencia a los antihelmínticos (Kaplan, 2004), lo cual ha incrementado la necesidad de investigar en alternativas de control parasitario.
CONTROL ALTERNATIVO
La investigación en alternativas naturales para el control de PGI de rumiantes ha cobrado relevancia y existe la urgencia de encontrar compuestos nuevos, más seguros y efectivos que no generen resistencia de parte de las poblaciones de parásitos y además que no produzcan preocupación por la presencia de residuos contaminantes en los alimentos para los humanos y el ambiente (Hoste et al., 2008b). Una de estas alternativas el uso de plantas y productos de plantas con propiedades antihelmínticas. Sin embargo, uno de los problemas de estos métodos alternativos de control es su eficacia parcial o variabilidad de los resultados, dependiendo de la especie de parásitos, y diferencias en las concentraciones de los principios activos responsables por el efecto antihelmíntico (Jackson y Miller, 2006). Por ejemplo, la concentración del compuesto activo puede variar con la época del año, estado de desarrollo de la planta cuando se cosecha y el tratamiento post-cosecha que se le dé a la planta. La mayoría de estos compuestos activos se encuentran agrupados en los llamados metabolitos secundarios de plantas (MSP), los cuales han sido estudiados en profundidad en los últimos años, tanto in vivo como in vitro. Sin embargo, aun existen preguntas con respecto a los MSP, que no han sido respondidas, tales como: modo de acción sobre los parásitos, causas de variabilidad en la eficacia, caracterización bioquímica exacta de los compuestos y condiciones óptimas para su uso o aplicación (Torres-Acosta y Hoste, 2008).
Adicionalmente, es de aceptación generalizada que los MSP estudiados hasta ahora son de menor efectividad que los fármacos antihelmínticos de uso tradicional hasta la fecha.
METABOLITOS SECUNDARIOS DE PLANTAS:
Los MSP carecen o tienen muy poco valor nutricional y además no tienen función en el metabolismo primario de las plantas (Greathead, 2003; Iason, 2005). Sin embargo, pueden tener otras funciones relacionadas con la planta, tales como protección a la planta de patógenos y herbívoros, un rol en la competencia entre plantas, atrayentes de organismos benéficos (polinizadores) y también pueden estar involucrados en mecanismos de defensa y respuesta a factores de estrés, tales como la poda continua (Greathead, 2003). Pueden ser encontrados en el follaje, semillas y en la planta entera, usada en la alimentación de los animales. Los MSP incluyen una larga y diversa lista de compuestos tales como los taninos, lectinas, saponinas y alcaloides. En la próxima sección, los dos MSP de mayor interés para esta revisión serán analizados, estos son taninos y lectinas, serán caracterizados incluyendo sus propiedades y su uso para el control de parásitos en rumiantes.
TANINOS
Los MSP más estudiados son los taninos, debido a su amplia distribución en plantas y semillas y también por su elevada actividad biológica. Estos compuestos se dividen en dos grupos: taninos hidrolizados y proantocianidinas (o taninos condensados -TC) (D´Mello, 2000; Waghorn y McNabb, 2003). Los taninos hidrolizados son poliésteres de ácido gálico y azúcares simples, mientras que los TC son polímeros de flavonoides (Khanbabaee y van Ree, 2001).
Los taninos son bien conocidos por sus propiedades médicas, incluyendo las anticancerígenas (Yi et al., 2006), actividad antimicótica (Ngono Ngane et al., 2006) y de mayor importancia en esta revisión, efecto antihelmíntico. Algunas investigaciones importantes, usando taninos y plantas ricas en taninos (o taníferas) serán descritas en la presente revisión.
Los MSP más estudiados son los taninos, debido a su amplia distribución en plantas y semillas y también por su elevada actividad biológica. Estos compuestos se dividen en dos grupos: taninos hidrolizados y proantocianidinas (o taninos condensados -TC) (D´Mello, 2000; Waghorn y McNabb, 2003). Los taninos hidrolizados son poliésteres de ácido gálico y azúcares simples, mientras que los TC son polímeros de flavonoides (Khanbabaee y van Ree, 2001).
Los taninos son bien conocidos por sus propiedades médicas, incluyendo las anticancerígenas (Yi et al., 2006), actividad antimicótica (Ngono Ngane et al., 2006) y de mayor importancia en esta revisión, efecto antihelmíntico. Algunas investigaciones importantes, usando taninos y plantas ricas en taninos (o taníferas) serán descritas en la presente revisión.
LECTINAS
Originalmente el término lectina estaba restringido a proteínas solubles, multivalentes con propiedades aglutinantes, limitadas a proteínas de origen vegetal. Sin embargo, hoy en día es usado para todo tipo de proteínas que se enlazan a carbohidratos y que no los alteran enzimáticamente (Goldstein et al., 1980; Varki et al., 1999). Las lectinas se han encontrado en plantas, bacterias, esponjas y otros invertebrados y vertebrados. Su propiedad más resaltante es la habilidad de estimular la proliferación de linfocitos, en particular células T, lo cual puede resultar en una respuesta inmune mejorada (Rüdiger, 1984).
Las lectinas fueron descubiertas por Peter Stillmark a finales de los años 1800´s en una Universidad de Estonia. Este investigador encontró que algunas proteínas extraídas de las semillas de ricino (Ricinus comunis) eran capaces de aglutinar eritrocitos. Años más tarde en 1960, Peter Nowell mostró que algunas lectinas, como la del frijol (Phaseolus vulgaris), llamada aglutinina o fitohemaglutinina (PHA) es capaz de inducir actividad mitótica en los linfocitos (Kilpatrick, 1999).
Las lectinas tienen potentes propiedades inmunoestimulatorias y han sido ampliamente usadas en sistemas artificiales para la activación de células T. PHA y Con A se enlazan fuertemente a glicoproteínas de la membrana, incluyendo los complejos de receptores de células T CD3 (TCR- CD3), induciendo la activación y proliferación de la mayoría de las células T (Kay, 1991). Las lectinas de plantas también han sido descritas como capaces de inducir acciones proinflamatorias, activando o inhibiendo la migración de neutrófilos (Alencar et al., 2003, 2005). Algunas lectinas han sido usadas recientemente para el estudio del rol de los carbohidratos estructurales en la interacción hospedero-parásito. Ohashi et al. (2007) estudió la especificidad del hospedero de Neobenedenia girellae, el cual es un parásito de la piel de un pez marino, que causa elevadas pérdidas económicas. Identificaron la glicoproteina Wap 65-2 que era capaz de unirse a la oncomiracidia de este parásito. Por otra parte, un grupo de lectinas han sido usadas para estudiar las relaciones hospedero-Schistosoma bovis e identificar posibles glicanos y glicoproteínas involucradas en estas interacciones (Ramajo-Hernández et al., 2007).
En resumen, estos últimos resultados descritos sugieren que los efectos de las lectinas abarcan un amplio rango, actuando directa e indirectamente sobre numerosos objetivos e influenciando las respuestas tanto la inmunidad adquirida como la innata. Además, los complejos que se forman con las lectinas pueden ser usados para identificar factores importantes de las interacciones hospedero-parásito.
EFECTO ANTIHELMÍNTICO DE LOS TANINOS Y PLANTAS RICAS EN TANINOS. RESULTADOS IN VITRO E IN VIVO
Resultados in vitro
El efecto antiparasitario de los MSP y de los TC en particular, ha sido demostrado in vitro usando diversos extractos de plantas. Uno de los extractos de plantas más ampliamente usados para estos experimentos es el Quebracho (Q), el cual contiene alrededor de 70-76% TC. Este extracto es producido a partir de un árbol subtropical llamado Schinopsis lorentzii, de la familia Anacardiaceae. La incubación de larvas de T. circumcincta, Trichostrongylus vitrinus y H. contortus, en diferentes concentraciones de extracto de Q, se encontró que no tuvo efecto sobre el desarrollo de las larvas infectivas L3. Sin embargo, se encontró que a mayores concentraciones, el efecto sobre la viabilidad de las larvas era mayor, mostrando una relación lineal entre la viabilidad de las larvas y la concentración de Q (Athanasiadou et al., 2001) (Tabla 1).
Otros extractos de plantas (mezclas de MSP) han sido estudiados por sus propiedades antihelmínticas in vitro. Molan et al. (2002) y Niezen et al. (2002) probaron los efectos de TC, extraídos a partir de diferentes forrajes de clima templado sobre la viabilidad de huevos y larvas L1 del nematodo de ovinos T. colubriformis. En el primer estudio, Molan et al. (2002) encontraron que los extractos eran significativamente más efectivos inhibiendo el desarrollo larvario cuando eran añadidos antes de la eclosión de los huevos que cuando se añadían después.
Adicionalmente, Niezen et al. (2002) evaluaron el efecto de estos extractos de TC sobre el desarrollo larvario in vitro y en las pasturas. Ellos encontraron que los efectos in vitro no estimaban de manera precisa lo que ocurría a nivel de campo. Los ensayos en laboratorio se hacían usando huevos extraídos de las heces y de manera contraria, en condiciones de campo los huevos permanecían en las heces bajo el efecto de los TC por muchos días, teniendo esto un importante efecto sobre el posterior desarrollo de las larvas de T. colubriformis. Ellos concluyeron que si los TC eran capaces de afectar el ciclo de vida de los nematodos y de este modo, reducir la contaminación de las pasturas con huevos viables, esta pudiera ser una forma útil de control alternativo de parásitos en condiciones de sistemas a pastoreo.
Cuando probaron TC de extractos de forrajes, Molan et al. (2003) aislaron extracto crudo de lactonas sesquiterpénicas (LSC) a partir de la planta achicoria (Chicorium intybus) y esta fue probada sobre la motilidad de larvas L1 y L3 del parásito pulmonar del ciervo (Dictyocaulus viviparus) y PGI in vitro. En este estudio los autores encontraron que los TC eran más efectivos que las LSC, inactivando L1 y L3 del parásito pulmonar y L3 de PGI, usando como medio fluido ruminal, pero LSC resultó más efectivo en contra de las L3 del parásito pulmonar usando fluido abomasal.
Aun cuando todos estos resultados in vitro son interesantes, es difícil compararlos o aplicarlos a las condiciones reales del campo in vivo. Adicionalmente, existen diferencias de pH y físico- químicas en los experimentos in vivo que no pueden ser replicados en condiciones de laboratorio y pueden afectar los resultados alcanzados.
Tabla 1. Algunos estudios in vitro desarrollados usando Quebracho-Q y extractos deplantas (mezclas de metabolitos secundarios de plantas -MSP) para el control de parásitosgastrointestinales.
Resultados in vivo
Resultados usando diferentes forrajes ricos en MSP para controlar PGI en pequeños rumiantes son contradictorios, debido a las diferentes especies de parásitos, sus habitats (abomaso vs. intestino) (Athanasiadou et al., 2001; Athanasiadou y Kyriazakis, 2004) y las especies de hospederos (ovinos vs. cabras) (Hoste et al., 2008a). Adicionalmente, diferencias de edad de los animales infectados (adultos vs. animales jóvenes) (Waghorn, 2008), la experiencia previa con parásitos (adultos con experiencia previa vs. animales jóvenes sin experiencia previa con parásitos) (Hoste et al., 2008a) y diferencias en tiempo consumiendo forrajes con MSP (estudios de corta duración vs. estudios de larga duración) (Athanasiadou y Kyriazakis, 2004), pueden hacer los resultados difíciles de interpretar. Además, la mayoría de los forrajes ricos en MSP que son usados en estos estudios, son seleccionados por su alto contenido de taninos, no tomando en cuenta que estas plantas también pueden contener otros MSP tales como lectinas, saponinas, etc. Todos estos factores hacen difícil confirmar que exista una clara evidencia del efecto antihelmíntico de los MSP.
Estudios relevantes in vivo son resumidos en una revisión reciente (Hoste et al., 2006), alimentando ovinos, cabras y ciervos con diferentes forrajes ricos en taninos. Se muestran detalles importantes, tales como nivel de TC en los forrajes, efectos sobre el comportamiento y la resiliencia de los animales y los efectos principales sobre la población de parásitos. En la mayoría de los estudios descritos, el comportamiento de los animales es mejorado a través del consumo de estos forrajes bioactivos e incluso se ha asociado con efectos antiparasitarios, generalmente expresados como reducciones de cargas parasitarias (hpg) y efecto sobre la fecundidad de los nematodos hembra. Ésta revisión refuerza la idea de que resultados encontrados con plantas taníferas pueden variar de acuerdo a la especie y edad de la planta, el ambiente en el cual se desarrolla la planta, el estado y composición de la población nematoda y posiblemente las especies de parásitos. Algunos de estos estudios in vivo son descritos en detalle a continuación.
Niezen et al. (1998) estudiaron el efecto del pastoreo de diferentes forrajes con taninos sobre los contajes parasitarios y comportamiento productivo de ovejas primerizas naturalmente infectadas. Ellos encontraron que los animales que pastoreaban Hedysarium coronarium tuvieron una reducción en el número de parásitos intestinales Trichostrongylus y también reducción de la densidad de parásitos en abomaso e intestino (nematodos/g de órgano); asimismo, los animales pastoreando L. pedunculatus mantuvieron un mejor comportamiento productivo a pesar de los altos contajes parasitarios y poblaciones parasitarias mayores.
Paolini et al. (2003, 2004), Athanasiadou et al. (2005a, 2005b) y Tzamaloukas et al. (2005) desarrollaron experimentos in vivo usando animales artificialmente infectados. En el primer experimento, Paolini et al. (2003) encontraron un efecto diferente de Q sobre las poblaciones de nematodos adultos vs. larvas más jóvenes. En el segundo estudio, Paolini et al. (2004) no encontraron efecto del extracto de Q o del heno de esparceta (Onobrychis viciifolia) sobre la especie abomasal H. contortus en cabras jóvenes. Athanasiadou et al. (2005a, 2005b) infectaron ovinos artificialmente con la especie intestinal T. colubriformis usando tanto animales confinados como a pastoreo; encontrando que la esparceta tuvo efecto sobre la expulsión total de huevos de los animales confinados. En contraste, en el segundo experimento (Athanasiadou et al., 2005b) los forrajes ricos en MSP evaluados, incluyendo la esparceta no mostraron efecto antihelmíntico. Por otra parte, Tzamaloukas et al. (2005) estudiaron el efecto a corto plazo del pastoreo de diferentes forrajes ricos en MSP sobre la viabilidad y fecundidad de una población adulta de nematodos y sobre el establecimiento y desarrollo de una población entrante de larvas de T. circumcincta, usando animales infectados, pero sin experiencia previa con éste parásito. Sus resultados sugieren que el mejor efecto fue logrado con achicoria, con reducción del establecimiento de la población adulta; el efecto alcanzado con otros forrajes fue muy pequeño.
Todos estos son claros ejemplos de la gran variabilidad entre estudios y resultados obtenidos usando condiciones in vivo. En resumen, los forrajes ricos en MSP han tenido efectos sobre parásitos intestinales de ovinos y caprinos, pero no sobre los abomasales, aun cuando su acción no fue consistente a través de las estaciones de pastoreo. Tanto en confinamiento, como en pastoreo, la calidad del alimento (contenido proteico, contenido de MSP) puede cambiar de un experimento a otro e incluso influenciar los resultados alcanzados. Las inconsistencias observadas entre especies de parásitos, hábitats (abomasal o intestinal), puede deberse a la formación de complejos entre los taninos y las proteínas. Es aceptado que las interacciones entre proteínas y TC son dependientes del pH, los TC se enlazan a las proteínas en pH cercano a la neutralidad (pH 3.5-7.5), como suele ocurrir en el rumen, formando complejos TC-proteínas (Jones and Mangan, 1977). La formación de estos complejos puede resultar en la inhibición de los taninos de ejercer un efecto sobre los parásitos abomasales, pero una vez estos complejos llegan al intestino, el cambio de pH y la presencia de surfactantes pudieran causar la disociación de estos complejos, haciendo posible que los taninos libres afecten negativamente los parásitos (Martin et al., 1985).
Los próximos MSP a describir son las lectinas, que han sido estudiadas menos que los taninos, por sus propiedades antihelmínticas, pero constituyen metabolitos interesantes de ser estudiados en el campo del control natural de parásitos.
Estudios relevantes in vivo son resumidos en una revisión reciente (Hoste et al., 2006), alimentando ovinos, cabras y ciervos con diferentes forrajes ricos en taninos. Se muestran detalles importantes, tales como nivel de TC en los forrajes, efectos sobre el comportamiento y la resiliencia de los animales y los efectos principales sobre la población de parásitos. En la mayoría de los estudios descritos, el comportamiento de los animales es mejorado a través del consumo de estos forrajes bioactivos e incluso se ha asociado con efectos antiparasitarios, generalmente expresados como reducciones de cargas parasitarias (hpg) y efecto sobre la fecundidad de los nematodos hembra. Ésta revisión refuerza la idea de que resultados encontrados con plantas taníferas pueden variar de acuerdo a la especie y edad de la planta, el ambiente en el cual se desarrolla la planta, el estado y composición de la población nematoda y posiblemente las especies de parásitos. Algunos de estos estudios in vivo son descritos en detalle a continuación.
Niezen et al. (1998) estudiaron el efecto del pastoreo de diferentes forrajes con taninos sobre los contajes parasitarios y comportamiento productivo de ovejas primerizas naturalmente infectadas. Ellos encontraron que los animales que pastoreaban Hedysarium coronarium tuvieron una reducción en el número de parásitos intestinales Trichostrongylus y también reducción de la densidad de parásitos en abomaso e intestino (nematodos/g de órgano); asimismo, los animales pastoreando L. pedunculatus mantuvieron un mejor comportamiento productivo a pesar de los altos contajes parasitarios y poblaciones parasitarias mayores.
Paolini et al. (2003, 2004), Athanasiadou et al. (2005a, 2005b) y Tzamaloukas et al. (2005) desarrollaron experimentos in vivo usando animales artificialmente infectados. En el primer experimento, Paolini et al. (2003) encontraron un efecto diferente de Q sobre las poblaciones de nematodos adultos vs. larvas más jóvenes. En el segundo estudio, Paolini et al. (2004) no encontraron efecto del extracto de Q o del heno de esparceta (Onobrychis viciifolia) sobre la especie abomasal H. contortus en cabras jóvenes. Athanasiadou et al. (2005a, 2005b) infectaron ovinos artificialmente con la especie intestinal T. colubriformis usando tanto animales confinados como a pastoreo; encontrando que la esparceta tuvo efecto sobre la expulsión total de huevos de los animales confinados. En contraste, en el segundo experimento (Athanasiadou et al., 2005b) los forrajes ricos en MSP evaluados, incluyendo la esparceta no mostraron efecto antihelmíntico. Por otra parte, Tzamaloukas et al. (2005) estudiaron el efecto a corto plazo del pastoreo de diferentes forrajes ricos en MSP sobre la viabilidad y fecundidad de una población adulta de nematodos y sobre el establecimiento y desarrollo de una población entrante de larvas de T. circumcincta, usando animales infectados, pero sin experiencia previa con éste parásito. Sus resultados sugieren que el mejor efecto fue logrado con achicoria, con reducción del establecimiento de la población adulta; el efecto alcanzado con otros forrajes fue muy pequeño.
Todos estos son claros ejemplos de la gran variabilidad entre estudios y resultados obtenidos usando condiciones in vivo. En resumen, los forrajes ricos en MSP han tenido efectos sobre parásitos intestinales de ovinos y caprinos, pero no sobre los abomasales, aun cuando su acción no fue consistente a través de las estaciones de pastoreo. Tanto en confinamiento, como en pastoreo, la calidad del alimento (contenido proteico, contenido de MSP) puede cambiar de un experimento a otro e incluso influenciar los resultados alcanzados. Las inconsistencias observadas entre especies de parásitos, hábitats (abomasal o intestinal), puede deberse a la formación de complejos entre los taninos y las proteínas. Es aceptado que las interacciones entre proteínas y TC son dependientes del pH, los TC se enlazan a las proteínas en pH cercano a la neutralidad (pH 3.5-7.5), como suele ocurrir en el rumen, formando complejos TC-proteínas (Jones and Mangan, 1977). La formación de estos complejos puede resultar en la inhibición de los taninos de ejercer un efecto sobre los parásitos abomasales, pero una vez estos complejos llegan al intestino, el cambio de pH y la presencia de surfactantes pudieran causar la disociación de estos complejos, haciendo posible que los taninos libres afecten negativamente los parásitos (Martin et al., 1985).
Los próximos MSP a describir son las lectinas, que han sido estudiadas menos que los taninos, por sus propiedades antihelmínticas, pero constituyen metabolitos interesantes de ser estudiados en el campo del control natural de parásitos.
LECTINAS E INFECCIONES PARASITARIAS
El efecto directo e indirecto de las lectinas de plantas, presentes en semillas y forrajes, sobre las poblaciones de PGI de rumiantes no ha sido estudiado con anterioridad. Sin embargo, algunos hallazgos interesantes, relacionados con la mejora de la proliferación celular de la mucosa intestinal, luego del la dosificación de ratas con lectina de frijol (Grant, 1999) y mejor respuesta del tracto digestivo luego del trauma (Grant et al., 2008), sugiere que las lectinas pudiesen ser capaces de afectar la interacción hospedero-parásito. Pudiera ser posible mejorar los mecanismos de resistencia de inmunidad natural o innata a través del consumo de lectinas, y así asistir en el control de infecciones de PGI. Sin embargo, es conocido que algunas lectinas, tales como el ricino son altamente tóxicas. Vasconcelos y Oliveira (2004) en una revisión reciente señalan que elevados consumos de algunas lectinas de plantas pueden causar efecto adverso en el metabolismo del tracto digestivo, conduciendo a daños de las membranas luminales, pérdidas de células del epitelio del tracto, disrupción de la relación criptas/vellosidad e interferencia de la digestión y absorción de nutrientes. Como resultado, el crecimiento y salud de de los animales puede verse desmejorado (Grant, 1999). De este modo, si se toma en cuenta lo anterior, consideraciones de cuidado, deben tomarse en cuenta para establecer la dosis correcta de lectinas, conociendo su toxicidad. En humanos, se ha sugerido que las lectinas pudieran estar involucradas en la incidencia de enfermedades autoinmunes, tales como artritis reumatoide (Cordain et al., 2000). Esta es una enfermedad compleja caracterizada por una inflamación sinovial persistente, destrucción local de hueso y cartílago y variadas manifestaciones que generan minusvalía en las personas afectadas. Las enfermedades autoinmunes ocurren cuando el cuerpo no es capaz de distinguir los antígenos propios de los que no lo son, resultando en la generación de anticuerpos que reaccionan con los antígenos propios. El consumo de cereales y lectinas de leguminosas, puede causar una condición crónica, a través de la repetida estimulación antigénica y ha sido sugerida como una de las posibles causas de estos mecanismos. Sin embargo, esto solo se ha demostrado in vivo, cuando las lectinas se inyectaban directamente en las articulaciones (Cordain et al., 2000).
La PHA es una poderosa lectina mitogénica y hemaglutinante que comprende cinco diferentes formas de isolectinas (subunidades E, de eritroaglutinación y L, con propiedades leucoaglutinantes): E4, E3L, E2L2, EL3 y L4 (Leavitt et al., 1977). Estas tienen una resistencia particularmente alta a la degradación proteolítica in vivo (Herzig et al., 1997). Pueden sobrevivir intactas y funcionales, al pasar por el lumen intestinal, interactuar con las células epiteliales del tracto y modificar su metabolismo, pero pueden ejercer efecto adverso si son consumidas en cantidades elevadas (Grant, 1999). Sin embargo, consumos bajos a moderados modifican el metabolismo intestinal de ratas, sin causar efectos adversos (Grant, 1999; Grant et al., 2008). De este modo, el suministro de lectinas en las dietas de ovinos, posiblemente pudiese producir un efecto antihelmíntico sin causar efectos nocivos al animal.
Estudios relacionados con el enlace y degradación de las lectinas por componentes del licor ruminal y la pérdida de lectinas en el tracto gastrointestinal de ovinos muestran que muchas lectinas se enlazan a los componentes del alimento y a las células bacterianas, y son capacesde resistir a ser degradadas en el rumen (Baintner et al., 1993a, 1993b). Una importante característica de algunas lectinas de plantas es su alta resistencia a la proteólisis y estabilidad a un amplio rango de pH, algunos estudios han demostrado que PHA, Con A, lectina de la campanilla de invierno (Galanthus nivalis-GNA) y lectina de la semilla de trigo (WGA), son capaces de atravesar el intestino delgado de ratas y humanos sin que ocurra una degradación significante (Vasconcelos y Oliveira, 2004). La fortaleza de este hecho, es que al menos algunas lectinas tienen el potencial de ser empleadas para el control de nematodos parásitos en el abomaso e intestino delgado, debido a su estabilidad y que son capaces conservar su actividad biológica a través de su paso por el tracto gastrointestinal.
Las lectinas también pueden afectar el metabolismo de PGI. Tobata-Kudo et al. (2005) mostraron que algunas lectinas suprimieron la migración in vivo de L3 de Strongyloides ratti. Los autores sugirieron que las funciones quimo sensoriales del parásito eran interrumpidas, usando Con A, WGA y aglutinina de la soya (SBA) a una concentración de 0.5 mg/ml. El lugar de enlace de la lectina con el parásito también fue estudiado usando Con A conjugada con fluoresceina isotiocianato (FITC), mostrando que la lectina se enlazaba fuertemente al área de la cabeza, cavidad bucal y con menor intensidad a la cutícula.
Estudios de diferenciación de parásitos de filaria, específicamente Wuchereria bancrofti y Brugia patei usando lectinas de plantas (Rao et al., 1987, 1989), los autores encontraron diferencias entre los mismos de acuerdo a los lugares de unión de las lectinas. Otro estudio mostró que las lectinas de plantas pueden jugar un rol importante en la interacción parásito-hospedero en plantas. Esto se refiere a nematodo quístico Heterodera avenae que invade las raíces de la planta de cereal, incrementando los niveles de la lectina de la cebada y la WGA en las raíces. No es conocido si este incremento se debe a una reacción específica de la planta al nematodo o es debido al estrés causado por la invasión del nematodo (Oka et al., 1997).
Finalmente, las lectinas de plantas también han sido estudiadas, como una vía de controlar nematodos de plantas. En el caso del nematodo del pino (Gaofu et al., 2008), estos autores purificaron dos lectinas a partir de los frutos de Pinellia ternata y Lycoris radiata (aglutinina P. ternata-PTA y aglutinina L. radiata-LRA) y evaluaron su efecto sobre el nematodo del pino, demostrando que estas lectinas tenían un fuerte efecto antihelmíntico en condiciones in vitro.
Recientemente, se ha investigado sobre fuentes de MSP de origen tropical, Ríos-de Álvarez etal. (2011) probaron la semilla molida de Canavalia ensiformis, conocida leguminosa tropical y fuente de la lectina Con A y otros MSP; incorporada en el suplemento de corderos en crecimiento a pastoreo con infecciones naturales. Estos autores encontraron que el uso de esta semilla en la dieta (incluida en el suplemento en una proporción de 2 g/kg PV) incrementó las ganancias de peso de -10 ± 9.2 g por día para el grupo no suplementado (C-) a +21 ± 8.2 g por día para el grupo suplementado con canavalia (C+) (P=0.02), resultando en una ventaja de 2.2 kg en peso vivo para los animales que recibían la canavalia en el suplemento. La suplementación con canavalia produjo una reducción general de los contajes parasitarios expresados como huevos por gramo de heces (hpg) con medias de 2020 y 1370 hpg (P=0.002) para los grupos C- y C+, respectivamente. En conclusión dosificar con semilla de canavalia produjo una mejora significativa del comportamiento productivo de los ovinos a la vez que redujo las cargas parasitarias, sin producir efectos adversos en los animales.
Son muchas las fuentes de lectinas tropicales que podrían ser evaluadas, con el fin de controlar de forma natural los PGI. Asimismo, los estudios deben continuarse para dilucidar los mecanismos de control y su efecto sobre la inmunidad del hospedero.
Las lectinas también pueden afectar el metabolismo de PGI. Tobata-Kudo et al. (2005) mostraron que algunas lectinas suprimieron la migración in vivo de L3 de Strongyloides ratti. Los autores sugirieron que las funciones quimo sensoriales del parásito eran interrumpidas, usando Con A, WGA y aglutinina de la soya (SBA) a una concentración de 0.5 mg/ml. El lugar de enlace de la lectina con el parásito también fue estudiado usando Con A conjugada con fluoresceina isotiocianato (FITC), mostrando que la lectina se enlazaba fuertemente al área de la cabeza, cavidad bucal y con menor intensidad a la cutícula.
Estudios de diferenciación de parásitos de filaria, específicamente Wuchereria bancrofti y Brugia patei usando lectinas de plantas (Rao et al., 1987, 1989), los autores encontraron diferencias entre los mismos de acuerdo a los lugares de unión de las lectinas. Otro estudio mostró que las lectinas de plantas pueden jugar un rol importante en la interacción parásito-hospedero en plantas. Esto se refiere a nematodo quístico Heterodera avenae que invade las raíces de la planta de cereal, incrementando los niveles de la lectina de la cebada y la WGA en las raíces. No es conocido si este incremento se debe a una reacción específica de la planta al nematodo o es debido al estrés causado por la invasión del nematodo (Oka et al., 1997).
Finalmente, las lectinas de plantas también han sido estudiadas, como una vía de controlar nematodos de plantas. En el caso del nematodo del pino (Gaofu et al., 2008), estos autores purificaron dos lectinas a partir de los frutos de Pinellia ternata y Lycoris radiata (aglutinina P. ternata-PTA y aglutinina L. radiata-LRA) y evaluaron su efecto sobre el nematodo del pino, demostrando que estas lectinas tenían un fuerte efecto antihelmíntico en condiciones in vitro.
Recientemente, se ha investigado sobre fuentes de MSP de origen tropical, Ríos-de Álvarez etal. (2011) probaron la semilla molida de Canavalia ensiformis, conocida leguminosa tropical y fuente de la lectina Con A y otros MSP; incorporada en el suplemento de corderos en crecimiento a pastoreo con infecciones naturales. Estos autores encontraron que el uso de esta semilla en la dieta (incluida en el suplemento en una proporción de 2 g/kg PV) incrementó las ganancias de peso de -10 ± 9.2 g por día para el grupo no suplementado (C-) a +21 ± 8.2 g por día para el grupo suplementado con canavalia (C+) (P=0.02), resultando en una ventaja de 2.2 kg en peso vivo para los animales que recibían la canavalia en el suplemento. La suplementación con canavalia produjo una reducción general de los contajes parasitarios expresados como huevos por gramo de heces (hpg) con medias de 2020 y 1370 hpg (P=0.002) para los grupos C- y C+, respectivamente. En conclusión dosificar con semilla de canavalia produjo una mejora significativa del comportamiento productivo de los ovinos a la vez que redujo las cargas parasitarias, sin producir efectos adversos en los animales.
Son muchas las fuentes de lectinas tropicales que podrían ser evaluadas, con el fin de controlar de forma natural los PGI. Asimismo, los estudios deben continuarse para dilucidar los mecanismos de control y su efecto sobre la inmunidad del hospedero.
REFERENCIAS
Agyei, A.D. 1997. Seasonal changes in the level of infective strongylate nematode larvae onpasture in the coastal savanna regions of Ghana. Veterinary Parasitology 70:175-182.
Alencar, N.M.N., Assreuy, A.M.S., Alencar, V.B.M., Melo, S.C., Ramos, M.V., Cavada, B.S.,Cunhad, F.Q. and Ribeiro, R.A. 2003. The galactose-binding lectin from Vatairea macrocarpaseeds induces in vivo neutrophil migration by indirect mechanism. The International Journal ofBiochemistry & Cell Biology 35:1674-1681.
Alencar, V.B.M., Alencar, N.M.N., Assreuy, A.M.S., Mota, M.L., Brito, G.A.C., Aragão, K.S.,Bittencourt, F.S., Pinto, V.P.T., Debray, H., Ribeiro, R.A. and Cavada, B.S. 2005. Pro-inflammatoryeffect of Arum maculatum lectin and role of resident cells. The International Journal ofBiochemistry & Cell Biology 37:1805-1814.
Athanasiadou, S., Kyriazakis, I., Jackson, F. and Coop, R.L. 2001. Direct anthelmintic effects ofcondensed tannins towards different gastrointestinal nematodes of sheep: in vitro and in vivostudies. Vet. Parasitol. 99:205-219.
Athanasiadou, S. and Kyriazakis, I. 2004. Plant secondary metabolites: antiparasitic effects andtheir role in ruminant production systems. Proceedings of the Nutrition Society 63:631-639.
Athanasiadou, S., Kyriazakis, I. and Jackson, F. 2005a. The effects of feeding sainfoin hay in sheepparasitised with Trichostrongylus colubriformis. Annual Conference BSAS, 4-6 April 2005, YorkUniversity, UK. [On-line]: http://www.bsas.org.uk/downloads/annlproc/Pdf2005/090.pdf
Athanasiadou, S., Tzamaloukas, O., Kyriazakis, I., Jackson, F. and Coop, R.L. 2005b. Testing fordirect anthelmintic effects of bioactive forages against Trichostrongylus colubriformis in grazingseason. Veterinary Parasitology 127:233:243.
Baintner, K., Duncan, S. Stewart, C. and Pusztai, A. 1993a. Binding and degradation of lectins bycomponents of rumen liquor. Journal of Applied Bacteriology 74:29-35.
Baintner, K., Farningham, D.A.H., Bruce, L.A., MacRae, J.C. and Pusztai, A. 1993b. Fate of theantinutritive proteins of soyabean in the ovine gut. Journal of Veterinary Medicine 40:427-431.
Coop, R.L. and Sykes, A.R. 2002. Interactions between gastrointestinal parasites and nutrients. In:Freer, M. and Dove, H. (eds) Sheep Nutrition. CAB International. pp. 313-331.
Cordain, L., Toohey, L., Smith, M.J. and Hickey, M.S. 2000 Modulation of immune function bydietary lectins in rheumatoid arthritis. British Journal of Nutrition 83:207-217.
D´Mello, J.P.F. 2000. Antinutritional factors and mycotoxins. In J.P.F. D´Mello, ed. Farm animalmetabolism and nutrition. Wallingford, UK, CAB International. p. 383-403.
Gaofu, Q., Shiqing, M., Fayin, Z., Zhiniu, Y. and Xiuyun, Z. 2008. In vitro assessment of plantlectins with anti-pinwood nematode activity. Journal of Invertebrate Pathology 98:40-45.
Goldstein, I.J., Hughes, R.C., Monsigny, M., Osawa, T. and Sharon, N. 1980. What should be calleda lectin? Nature 285:66.
Grant, G. 1999. Plant lectins, in Caygill, J. C., Mueller-Harvey, I. (eds): Secondary Plant Products.Antinutritional and beneficial actions in animal feeding. Nottingham, Notingham University Press,pp 87-110.
Grant, G., Duncan, M. and Fish, N. 2008. Lectin ATL-104 in amelioration of intestinal damagecaused by 5-fluorouraxil in rats. Journal of Clinical Oncology 26:15S.
Greathead, H. 2003. Plants and plants extracts for improving animal productivity. Proceedings ofthe Nutrition Society 62:279-290.
Herzig, K.H., Bardocz, S., Grant, G., Nustede, R., Fölsch, U.R. and Pusztai, A. 1997. Red kidneybean lectin is a potent cholecystokinin releasing stimulus in the rat inducing pancreatic growth.Gut 41:333-338.
Hoste, H., Jackson, F., Athanasiadou, S., Thamsborg, S.M. and Hoskin, S. O. 2006. The effects oftannin-rich plants on parasitic nematodes in ruminants. Trends in Parasitology 22:253-261. doi:10.1016/j.pt.2006.04.004
Hoste, H., Torres-Acosta, J.F.J., Aguilar-Caballero, A.J. 2008a. Nutrition-parasite interactionsingoats: in immunoregulation involved in the control of gastrointestinal nematodes? ParasiteImmunology 30:79-88. doi: 10.1111/j.1365-3024.2007.00987.x
Hoste, H., Torres-Acosta, J.F.J., Alonso-Díaz, M.A., Brunet, S., Sandoval-Castro, C. andHouzangbe-Adote, S. 2008b. Identification and validation of bioactive plants for the control ofgastrointestinal nematodes in small ruminants. In: Proceedings of 5th International Workshop:Novel Approaches to the control of Helminth Parasites of Livestock 2008. Tropical Biomedicine.http://www.msptm.org/procceding_journal.html
Iason, G. 2005. The role of plant secondary metabolites in mammalian herbivory: ecologicalperspectives. Proceedings of the Nutrition Society 64:123-131.
Jackson, F. and Miller, J. 2006. Alternative approaches to control-Quo vadit? VeterinaryParasitology 139:371-384.
Jones, W.T. and Mangan, J.L. 1977. Complexes of the condensed tannin of sainfoin (Onobrychisviciifolia Scop.) with fraction 1 leaf protein and with submaxilary mucoprotein, and their reversalby polyethylene glycol and pH. Journal of the Science of Food and Agriculture 28:126-136.
Kaplan, R.M. 2004. Drug resistance in nematodes of veterinary importance: a status report. TrendsParasitology 20:477-481.
Kay, J.E. 1991. Mechanisms of T lymphocyte activation. Immunology Letters 29:51-54.doi:10.1016/0165-2478(91)90198-J
Khanbabaee, K. y van Ree, T. 2001. Tannins: classification and definition. Natural Product Reports18:641-649.
Kilpatrick, D.C. 1999. Mechanisms and assessment of lectin-mediated mitogenesis. MolecularBiotechnology 11:55-65.
Knox, D.P., Redmond, D.L., Newlands, G.F., Skuce, P.J., Pettit, D. and Smith, W.D. 2003. Thenature and prospects for gut membrane proteins as vaccine candidates for Haemonchus contortusand other ruminant trichostrongyloids. International Journal for Parasitology 33:1129-1137.
Krecek, P. and Waller, J. 2006. Towards the implementation of the "basket of options" approachto helminth parasite control of livestock: Emphasis on the tropics/subtropics. VeterinaryParasitology 139:270-282.
Leavitt, R.D., Felsted, R.L. and Bachur, N.R. 1977. Biological and biochemical properties ofPhaseolus vulgaris isolectins. Journal of Biological Chemistry 252: 2967-71.
Martin, M.M., Rockholm, D.C. and Martin, J.S. 1985. Effects of surfactants, pH and certain cationson precipitation of proteins by tannins. Journal of Chemical Ecology 11:485-494.
McKellar, Q.A. and Jackson, F. 2004. Veterinary anthelmintics: old and new. Trends Parasitology20:456-461.
Molan, A.L., Waghorn, G.C. and McNabb, W.C. 2002. Effect of condensed tannins on egg hatchingand larvae development of Trichostrongylus colubriformis in vitro. Veterinary Record 150:65-69.
Molan, A.L., Duncan, A.J., Barry, T.N. and McNabb, W.C. 2003. Effects of condensed tannins andcrude sesquiterpene lactones extracted from chicory on the motility of larvae of deer lungwormand gastrointestinal nematodes. Parasitology International 52:209-218.
Morris, C.A., Vlassoff, A., Bisset, S.A., Baker, R.L., Watson, T.G., West, C.J. and Wheeler, M.2000. Continued selection of Romney sheep for resistance or susceptibility to nematode infection:estimates of direct and correlated responses. Animal Science 70:17-27.
Ngono Ngane, A., Ebelle Etame, R., Ndifor, F., Biyiti, L., Amvam Zollo, P. H. and Bouchet, P.2006. Antifungal Activity of Chromolaena odorata (L.) King & Robinson (Asteraceae) of Cameroon.Chemotherapy 52:103-106.
Nieuwhof, G.H. and Bishop, S.C. 2005. Costs of the major endemic diseases of sheep in GreatBritain and the potential benefits of reduction in disease impact. Animal Science 81:23-29.
Niezen, J.H., Robertson, H.A., Waghorn, G.C. and Charleston, W.A.G. 1998. Production, faecalegg counts and worm burdens of ewe lambs which grazed six contrasted forages. VeterinaryParasitology 80:15-27.
Niezen, J.H., Waghorn, G.C., Graham, T., Carter, J.L. and Leathwick, D.M. 2002. The effect of dietfed to lambs on subsequent development of Trichostrongylus colubriformis larvae in vitro and onpasture. Veterinary Parasitology 105:269-283.
O´Connor, L.J., Walkden-Brown, S.W. and Kahn, L.P. 2006. Ecology of the free-living stages ofmajor trichostrongylid parasites of sheep. Veterinary Parasitology 142:1-15.
Ohashi, H., Umeda, N., Hirazawa, N., Ozaki, Y., Miura, C. and Miura, T. 2007. Purification andidentification of a glycoprotein that induces the attachment of oncomiracidia of Neobenedeniagirellae (Monogenea, Capsalidae). International Journal for Parasitology 37:1483-1490.
Oka, Y., Chet, I. and Spiegel, Y. 1997. Accumulation of lectins in cereal roots invaded by the cerealcyst nematode Heterodera avenae. Physiological and Molecular Plant Pathology 51:333-345.
Paolini, V., Frayssines, A., De La Farge, F., Dorchies, P. and Hoste, H. 2003. Effects of condensedtannins on established populations and on incoming larvae of Trichostrongylus colubriformis andTeladorsagia circumcincta in goats. Veterinary Research 34:331-339.
Paolini, V., Prevot, F., Dorchies, Ph. and Hoste, H. 2004. Lack of effect of quebracho and sainfoinhay on incoming third-stage larvae of Haemonchus contortus in goats. Veterinary Journal 170:260-263.
Ramajo-Hernández, A, Oleaga, A., Ramajo-Martín, V. and Pérez-Sánchez, R. 2007. Carbohydrateprofiling and protein identification of tegumental and excreted/secreted glycoproteins of adultSchistosoma bovis worms. Veterinary Parasitology 144: 45-60
Rao, U.R., Chandrashekar, R., Rajasekariah, G. R. and Subrahrnanyarn, D. 1987. Wheat germagglutinin specifically binds to the surface of infective larvae of Wuchereria bancrofti. The Journalof Parasitology 6: 1256-1257.
Rao, U.R., Kwa, B.H., Nayar, J.K. and Vickery, A.C. 1989. Lectin binding to larval stages of Brugiapatei. International Journal for Parasitology 19:689-690.
Ríos-de Álvarez, L., Huntley, J.F., Jackson, F., Cortez, F., Grant, G. y Greer, A. 2011. Effect ofthe intake of jackbean (Canavalia ensiformis) on the control of gastrointestinal parasites andthe growth of tropical lambs. 23rd Conference of the World Association for the Advancement ofVeterinary Parasitology. Buenos Aires-Argentina, from 21-25 August, 2011.
Rüdiger, H. 1984. On the physiological role of plant lectins. BioScience 34:95-99.
Sargison, N. 2008. Sheep Flock Health: A Planned Approach. University of Edinburgh, Royal (Dick)School of Veterinary Studies, Large Animal Practice. Blackwell Publishing. Oxford, UK. 465 p.
Schoenian, S. 2006. Internal parasite control. Western Maryland Research & Education Center.Maryland Cooperative Extension. http://www.sheep101.info/201/parasite.html
Smith, W.D. and Zarlenga, D.S. 2006. Developments and hurdles in generating vaccines forcontrolling helminth parasites of grazing ruminants. Veterinary Parasitology 139:347-359.
Soulsby, E.J.L. 1982. Helminths, Arthropods and Protozoa of Domesticated Animals. BaillièreTindall, London.
Taylor, M.A., Coop, R.L. and Wall, R.L. 2007. Veterinary Parasitology. Third Edition. BlackwellPublishing. Oxford, UK. 874 p.
Tobata-Kudo, H., Kudo, H. and Tada, I. 2005. Strongyloides ratti: Chemokinesis of glycolyticenzyme- and lectin treated third stage infective larvae in vitro. Parasitology International 54:147-152.
Tzamaloukas, O., Athanasiadou, S., Kyriazakis, I., Jackson, F. and Coop, R. L. 2005. Theconsequences of short-term grazing of bioactive forages on established adult and incoming larvaepopulations of Teladorsagia circumcincta in lambs. International Journal of Parasitology 35:329-335.
Vasconcelos, I.M. and Oliveira, J.T.A. 2004. Antinutritional properties of plant lectins. Toxicon44:385-403.
Varki, A., Cummings, R., Esko J., Freeze H., Hart G., and Marth J. 1999. Essentials of Glycobiology.
Cold Spring Harbor Laboratory Press, La Jolla, California, USA. 653 p.
Waghorn, G.C. and McNabb, W.C. 2003. Consequences of plant phenolic compounds forproductivity and health of ruminants. Proceedings of the Nutrition Society 62: 383-392.
Waller, P.J. 1994. The development of anthelmintic resistance in ruminant livestock. Acta Tropica56:233-243.
Waller, P.J. 1997. Anthelmintic resistance. Veterinary Parasitology. 72:391-412.
Waller, P.J. 2006. From discovery to development: Current industry perspectives for thedevelopment of novel methods of helminth control in livestock. Veterinary Parasitology 139:1-14.
Whittier, W.D., Zajac, A. and Umberger, S.H. 2003. Control of Internal Parasites in Sheep. VirginiaCooperative Extension. Virginia Tech. Publication Number 410-027. http://www.ext.vt.edu/pubs/sheep/410-027/410-027.html
Yi, W., Akoh, C., Fischer, J. and Krewer, G. 2006. Effects of phenolic compounds in blueberries andmuscadine grapes on HepG2 cell viability and apostosis. Food Research International 39:628-638.
Athanasiadou, S., Kyriazakis, I., Jackson, F. and Coop, R.L. 2001. Direct anthelmintic effects ofcondensed tannins towards different gastrointestinal nematodes of sheep: in vitro and in vivostudies. Vet. Parasitol. 99:205-219.
Athanasiadou, S. and Kyriazakis, I. 2004. Plant secondary metabolites: antiparasitic effects andtheir role in ruminant production systems. Proceedings of the Nutrition Society 63:631-639.
Athanasiadou, S., Kyriazakis, I. and Jackson, F. 2005a. The effects of feeding sainfoin hay in sheepparasitised with Trichostrongylus colubriformis. Annual Conference BSAS, 4-6 April 2005, YorkUniversity, UK. [On-line]: http://www.bsas.org.uk/downloads/annlproc/Pdf2005/090.pdf
Athanasiadou, S., Tzamaloukas, O., Kyriazakis, I., Jackson, F. and Coop, R.L. 2005b. Testing fordirect anthelmintic effects of bioactive forages against Trichostrongylus colubriformis in grazingseason. Veterinary Parasitology 127:233:243.
Baintner, K., Duncan, S. Stewart, C. and Pusztai, A. 1993a. Binding and degradation of lectins bycomponents of rumen liquor. Journal of Applied Bacteriology 74:29-35.
Baintner, K., Farningham, D.A.H., Bruce, L.A., MacRae, J.C. and Pusztai, A. 1993b. Fate of theantinutritive proteins of soyabean in the ovine gut. Journal of Veterinary Medicine 40:427-431.
Coop, R.L. and Sykes, A.R. 2002. Interactions between gastrointestinal parasites and nutrients. In:Freer, M. and Dove, H. (eds) Sheep Nutrition. CAB International. pp. 313-331.
Cordain, L., Toohey, L., Smith, M.J. and Hickey, M.S. 2000 Modulation of immune function bydietary lectins in rheumatoid arthritis. British Journal of Nutrition 83:207-217.
D´Mello, J.P.F. 2000. Antinutritional factors and mycotoxins. In J.P.F. D´Mello, ed. Farm animalmetabolism and nutrition. Wallingford, UK, CAB International. p. 383-403.
Gaofu, Q., Shiqing, M., Fayin, Z., Zhiniu, Y. and Xiuyun, Z. 2008. In vitro assessment of plantlectins with anti-pinwood nematode activity. Journal of Invertebrate Pathology 98:40-45.
Goldstein, I.J., Hughes, R.C., Monsigny, M., Osawa, T. and Sharon, N. 1980. What should be calleda lectin? Nature 285:66.
Grant, G. 1999. Plant lectins, in Caygill, J. C., Mueller-Harvey, I. (eds): Secondary Plant Products.Antinutritional and beneficial actions in animal feeding. Nottingham, Notingham University Press,pp 87-110.
Grant, G., Duncan, M. and Fish, N. 2008. Lectin ATL-104 in amelioration of intestinal damagecaused by 5-fluorouraxil in rats. Journal of Clinical Oncology 26:15S.
Greathead, H. 2003. Plants and plants extracts for improving animal productivity. Proceedings ofthe Nutrition Society 62:279-290.
Herzig, K.H., Bardocz, S., Grant, G., Nustede, R., Fölsch, U.R. and Pusztai, A. 1997. Red kidneybean lectin is a potent cholecystokinin releasing stimulus in the rat inducing pancreatic growth.Gut 41:333-338.
Hoste, H., Jackson, F., Athanasiadou, S., Thamsborg, S.M. and Hoskin, S. O. 2006. The effects oftannin-rich plants on parasitic nematodes in ruminants. Trends in Parasitology 22:253-261. doi:10.1016/j.pt.2006.04.004
Hoste, H., Torres-Acosta, J.F.J., Aguilar-Caballero, A.J. 2008a. Nutrition-parasite interactionsingoats: in immunoregulation involved in the control of gastrointestinal nematodes? ParasiteImmunology 30:79-88. doi: 10.1111/j.1365-3024.2007.00987.x
Hoste, H., Torres-Acosta, J.F.J., Alonso-Díaz, M.A., Brunet, S., Sandoval-Castro, C. andHouzangbe-Adote, S. 2008b. Identification and validation of bioactive plants for the control ofgastrointestinal nematodes in small ruminants. In: Proceedings of 5th International Workshop:Novel Approaches to the control of Helminth Parasites of Livestock 2008. Tropical Biomedicine.http://www.msptm.org/procceding_journal.html
Iason, G. 2005. The role of plant secondary metabolites in mammalian herbivory: ecologicalperspectives. Proceedings of the Nutrition Society 64:123-131.
Jackson, F. and Miller, J. 2006. Alternative approaches to control-Quo vadit? VeterinaryParasitology 139:371-384.
Jones, W.T. and Mangan, J.L. 1977. Complexes of the condensed tannin of sainfoin (Onobrychisviciifolia Scop.) with fraction 1 leaf protein and with submaxilary mucoprotein, and their reversalby polyethylene glycol and pH. Journal of the Science of Food and Agriculture 28:126-136.
Kaplan, R.M. 2004. Drug resistance in nematodes of veterinary importance: a status report. TrendsParasitology 20:477-481.
Kay, J.E. 1991. Mechanisms of T lymphocyte activation. Immunology Letters 29:51-54.doi:10.1016/0165-2478(91)90198-J
Khanbabaee, K. y van Ree, T. 2001. Tannins: classification and definition. Natural Product Reports18:641-649.
Kilpatrick, D.C. 1999. Mechanisms and assessment of lectin-mediated mitogenesis. MolecularBiotechnology 11:55-65.
Knox, D.P., Redmond, D.L., Newlands, G.F., Skuce, P.J., Pettit, D. and Smith, W.D. 2003. Thenature and prospects for gut membrane proteins as vaccine candidates for Haemonchus contortusand other ruminant trichostrongyloids. International Journal for Parasitology 33:1129-1137.
Krecek, P. and Waller, J. 2006. Towards the implementation of the "basket of options" approachto helminth parasite control of livestock: Emphasis on the tropics/subtropics. VeterinaryParasitology 139:270-282.
Leavitt, R.D., Felsted, R.L. and Bachur, N.R. 1977. Biological and biochemical properties ofPhaseolus vulgaris isolectins. Journal of Biological Chemistry 252: 2967-71.
Martin, M.M., Rockholm, D.C. and Martin, J.S. 1985. Effects of surfactants, pH and certain cationson precipitation of proteins by tannins. Journal of Chemical Ecology 11:485-494.
McKellar, Q.A. and Jackson, F. 2004. Veterinary anthelmintics: old and new. Trends Parasitology20:456-461.
Molan, A.L., Waghorn, G.C. and McNabb, W.C. 2002. Effect of condensed tannins on egg hatchingand larvae development of Trichostrongylus colubriformis in vitro. Veterinary Record 150:65-69.
Molan, A.L., Duncan, A.J., Barry, T.N. and McNabb, W.C. 2003. Effects of condensed tannins andcrude sesquiterpene lactones extracted from chicory on the motility of larvae of deer lungwormand gastrointestinal nematodes. Parasitology International 52:209-218.
Morris, C.A., Vlassoff, A., Bisset, S.A., Baker, R.L., Watson, T.G., West, C.J. and Wheeler, M.2000. Continued selection of Romney sheep for resistance or susceptibility to nematode infection:estimates of direct and correlated responses. Animal Science 70:17-27.
Ngono Ngane, A., Ebelle Etame, R., Ndifor, F., Biyiti, L., Amvam Zollo, P. H. and Bouchet, P.2006. Antifungal Activity of Chromolaena odorata (L.) King & Robinson (Asteraceae) of Cameroon.Chemotherapy 52:103-106.
Nieuwhof, G.H. and Bishop, S.C. 2005. Costs of the major endemic diseases of sheep in GreatBritain and the potential benefits of reduction in disease impact. Animal Science 81:23-29.
Niezen, J.H., Robertson, H.A., Waghorn, G.C. and Charleston, W.A.G. 1998. Production, faecalegg counts and worm burdens of ewe lambs which grazed six contrasted forages. VeterinaryParasitology 80:15-27.
Niezen, J.H., Waghorn, G.C., Graham, T., Carter, J.L. and Leathwick, D.M. 2002. The effect of dietfed to lambs on subsequent development of Trichostrongylus colubriformis larvae in vitro and onpasture. Veterinary Parasitology 105:269-283.
O´Connor, L.J., Walkden-Brown, S.W. and Kahn, L.P. 2006. Ecology of the free-living stages ofmajor trichostrongylid parasites of sheep. Veterinary Parasitology 142:1-15.
Ohashi, H., Umeda, N., Hirazawa, N., Ozaki, Y., Miura, C. and Miura, T. 2007. Purification andidentification of a glycoprotein that induces the attachment of oncomiracidia of Neobenedeniagirellae (Monogenea, Capsalidae). International Journal for Parasitology 37:1483-1490.
Oka, Y., Chet, I. and Spiegel, Y. 1997. Accumulation of lectins in cereal roots invaded by the cerealcyst nematode Heterodera avenae. Physiological and Molecular Plant Pathology 51:333-345.
Paolini, V., Frayssines, A., De La Farge, F., Dorchies, P. and Hoste, H. 2003. Effects of condensedtannins on established populations and on incoming larvae of Trichostrongylus colubriformis andTeladorsagia circumcincta in goats. Veterinary Research 34:331-339.
Paolini, V., Prevot, F., Dorchies, Ph. and Hoste, H. 2004. Lack of effect of quebracho and sainfoinhay on incoming third-stage larvae of Haemonchus contortus in goats. Veterinary Journal 170:260-263.
Ramajo-Hernández, A, Oleaga, A., Ramajo-Martín, V. and Pérez-Sánchez, R. 2007. Carbohydrateprofiling and protein identification of tegumental and excreted/secreted glycoproteins of adultSchistosoma bovis worms. Veterinary Parasitology 144: 45-60
Rao, U.R., Chandrashekar, R., Rajasekariah, G. R. and Subrahrnanyarn, D. 1987. Wheat germagglutinin specifically binds to the surface of infective larvae of Wuchereria bancrofti. The Journalof Parasitology 6: 1256-1257.
Rao, U.R., Kwa, B.H., Nayar, J.K. and Vickery, A.C. 1989. Lectin binding to larval stages of Brugiapatei. International Journal for Parasitology 19:689-690.
Ríos-de Álvarez, L., Huntley, J.F., Jackson, F., Cortez, F., Grant, G. y Greer, A. 2011. Effect ofthe intake of jackbean (Canavalia ensiformis) on the control of gastrointestinal parasites andthe growth of tropical lambs. 23rd Conference of the World Association for the Advancement ofVeterinary Parasitology. Buenos Aires-Argentina, from 21-25 August, 2011.
Rüdiger, H. 1984. On the physiological role of plant lectins. BioScience 34:95-99.
Sargison, N. 2008. Sheep Flock Health: A Planned Approach. University of Edinburgh, Royal (Dick)School of Veterinary Studies, Large Animal Practice. Blackwell Publishing. Oxford, UK. 465 p.
Schoenian, S. 2006. Internal parasite control. Western Maryland Research & Education Center.Maryland Cooperative Extension. http://www.sheep101.info/201/parasite.html
Smith, W.D. and Zarlenga, D.S. 2006. Developments and hurdles in generating vaccines forcontrolling helminth parasites of grazing ruminants. Veterinary Parasitology 139:347-359.
Soulsby, E.J.L. 1982. Helminths, Arthropods and Protozoa of Domesticated Animals. BaillièreTindall, London.
Taylor, M.A., Coop, R.L. and Wall, R.L. 2007. Veterinary Parasitology. Third Edition. BlackwellPublishing. Oxford, UK. 874 p.
Tobata-Kudo, H., Kudo, H. and Tada, I. 2005. Strongyloides ratti: Chemokinesis of glycolyticenzyme- and lectin treated third stage infective larvae in vitro. Parasitology International 54:147-152.
Tzamaloukas, O., Athanasiadou, S., Kyriazakis, I., Jackson, F. and Coop, R. L. 2005. Theconsequences of short-term grazing of bioactive forages on established adult and incoming larvaepopulations of Teladorsagia circumcincta in lambs. International Journal of Parasitology 35:329-335.
Vasconcelos, I.M. and Oliveira, J.T.A. 2004. Antinutritional properties of plant lectins. Toxicon44:385-403.
Varki, A., Cummings, R., Esko J., Freeze H., Hart G., and Marth J. 1999. Essentials of Glycobiology.
Cold Spring Harbor Laboratory Press, La Jolla, California, USA. 653 p.
Waghorn, G.C. and McNabb, W.C. 2003. Consequences of plant phenolic compounds forproductivity and health of ruminants. Proceedings of the Nutrition Society 62: 383-392.
Waller, P.J. 1994. The development of anthelmintic resistance in ruminant livestock. Acta Tropica56:233-243.
Waller, P.J. 1997. Anthelmintic resistance. Veterinary Parasitology. 72:391-412.
Waller, P.J. 2006. From discovery to development: Current industry perspectives for thedevelopment of novel methods of helminth control in livestock. Veterinary Parasitology 139:1-14.
Whittier, W.D., Zajac, A. and Umberger, S.H. 2003. Control of Internal Parasites in Sheep. VirginiaCooperative Extension. Virginia Tech. Publication Number 410-027. http://www.ext.vt.edu/pubs/sheep/410-027/410-027.html
Yi, W., Akoh, C., Fischer, J. and Krewer, G. 2006. Effects of phenolic compounds in blueberries andmuscadine grapes on HepG2 cell viability and apostosis. Food Research International 39:628-638.
Temas relacionados:
Autores:
Universidad Central de Venezuela - UCV
Recomendar
Comentar
Compartir
22 de marzo de 2016
Buenas noches Dra.
Tengo una duda como puedo calcular la dosis para un animal de 25 kg, vamos a ofrecer el extracto de una planta en vehículo acuoso y cuantas tomas me aconseja dar.
Gracias.
Recomendar
Responder
15 de noviembre de 2020
Buen dia
quisiera mas orientacion de este tratamiento si alguien puede ayudarme ????
Recomendar
Responder
16 de septiembre de 2019
El control de parásitos en ovinos esta muy de la mano con el manejo que se este brindando a los animales en cada una de las fases que se operan en la explotación, acordes a los planes que se implementan, los sistemas de alimentación, la calidad de la dieta que se le brinda, la rotación de los medicamentos que se usan, además es importante el conocimiento que se tenga de algunas plantas que se utilizan para el manejo de algunos parásitos en cada zona. De igual forma es tener en cuenta los costos en que se incurren para el control de parásitos en una explotación ovina, donde se debe hacer mucho en énfasis en las edades tempranas las cuales son muy criticas, teniendo en cuenta la zona de ubicación de la explotación.
Recomendar
Responder
Universidad Central de Venezuela - UCV
15 de septiembre de 2019
Hola Walter por escribir y disculpen mi larga ausencia.
Preguntas y RESPUESTAS:
1) la duda que tengo es porque solo le salen a los destetados y a los grandes no: POR QUE DE MANERA GENERAL LOS ANIMALES JÓVENES AUN NO TIENEN DESARROLLADA COMPLETAMENTE SU INMUNIDAD Y POR ESO SE VEN MAS AFECTADOS POR PARASITISMO. NO QUERIENDO DECIR ESTO QUE LOS ADULTOS ESTÉN "100% LIMPIOS", NO SEGURAMENTE TIENEN CARGAS PERO NO LES AFECTAN POR QUE SU INMUNIDAD ES MAS ROBUSTA.
2) es un test que me compre en españa que trajo una tablita de colores: EXCELENTE, ESTAS USANDO EL MÉTODO FAMACHA, QUE ES MUY ÚTIL CUANDO EL PARÁSITO PROTAGONISTA ES HAEMONCHUS CONTORTUS, COMO SE ALIMENTA DE SANGRE CAUSA ANEMIA Y POR ESO VES LA MUCOSA OCULAR CON ESA COLORACIÓN MAS CLARA. PUES HACES LO CORRECTO, USAS CARTILLA FAMACHA Y ASI SOLO DESPARASITAS AQUELLOS ANIMALES QUE LO REQUIEREN
3) he fumigado los pastos con un biologico que compre por una web mercadolibre ahora no tengo tanto parasito: INTERESANTE PRÁCTICA, SERIA BUENO QUE COLOQUES EL NOMBRE Y PRINCIPIO ACTIVO DEL PRODUCTO PARA SABER QUE ESTAS APLICANDO Y ASI SE BENEFICIEN TUS COLEGAS OVINOCULTORES.
4) he notado en varios años que usar los pastos que brotan en corrales naturales me reduce los parasitos en los animales, y cuando uso pastos sembrados y tecnificados aumenta el parasito y el gasto: ESTO ES UNA EXPERIENCIA MUY PERO MUY INTERESANTE, QUE SOLO LO DA EL TIEMPO EN EL NEGOCIO. CUANDO HABLAS DE CORRALES O POTREROS NATURALES, ALLÍ CRECEN CUALQUIER PLANTA ADEMAS DE LAS GRAMÍNEAS, ASI QUE ES COMO OFRECERLE A LOS ANIMALES UNA "ENSALADA DE PLANTAS" PARA QUE ELLOS DESDE SU INSTINTO ESCOJAN AQUELLAS QUE LE SEAN DE MAYOR PROVECHO, HAY INVESTIGACIONES QUE DEMUESTRAN ESTO QUE TU NOS INDICAS, ES UNA VENTAJA PARA LOS ANIMALES PODER SELECCIONAR SU DIETA DE UN POTRERO VARIADO Y DONDE CRECEN PLANTAS (A VECES LES DECIMOS MALEZAS, PERO SON TAL VEZ BUENEZAS), QUE LE PERMITEN AL ANIMAL AUTOMEDICARSE, YA QUE MUCHAS DE ESTAS PUEDEN TENER METABOLITOS SECUNDARIOS QUE EJERCEN EN LOS ANIMALES UN EFECTO DESPARASITANTE. EL CASO CONTRARIO ES EL QUE ENCUENTRAS EN LOS POTREROS QUE SOLO TIENEN GRAMINEAS, ESTAMOS ACOSTUMBRADOS A PENSAR QUE ESTOS SON LOS MEJORES POTREROS, PERO NO NECESARIAMENTE ES ASI Y TUS ANIMALES LO HAN DEMOSTRADO. TAL VEZ LO MEJOR ES QUE HAGAS MENOS ROTACIONES EN LOS CUADROS DONDE SOLO TIENES UN TIPO DE PASTO Y SAQUES CON MAYOR FRECUENCIA A LOS ANIMALES A LOS POTREROS NATURALES (CUIDANDO SIEMPRE DE NO ACABAR CON LA VARIEDAD DE ESPECIES QUE TIENES ALLI POR SOBREPASTOREO).
Que sigas cosechando éxitos Walter y todos los productores y profesionales que han escrito en esta columna
Recomendar
Responder
15 de septiembre de 2019
Soy criador pequeño de persa cabeza negra en el estado miranda, Use un desparasitante llamado ivermectina al 1% en las ovejas destetadas de 3 meses y algunas expulsan unos parasitos blancos redondos aplanados, la duda que tengo es porque solo le salen a los destetados y a los grandes no, la primera vez le aplico ivermectina al 1% y luego uso albeldasol cuando detras de los parpados les veo un rosado siendo a blanco, es un test que me compre en españa que trajo una tablita de colores se me agoto el liquido ahora solo uso la tablita me ha sido de mucha rentabilidad ya que no desperdicio el desparasitante, aplico al destete sabiendo que aca hay dos destetes por año, y a los grandes los desparasito unicamente saliendo el verano y luego les reviso detras de parpados y desparasito los que requieran, he fumigado los pastos con un biologico que compre por una web mercadolibre ahora no tengo tanto parasito. Otro punto he notado en varios años que usar los pastos que brotan en corrales naturales me reduce los parasitos en los animales, y cuando uso pastos sembrados y tecnificados aumenta el parasito y el gasto. Quiero si alguno me explica porque en los corrales naturales disminuye el parasito y aumenta en los corrales de pasto sembrado. No se si me entiendan un corral natural es lo que nace solo puede tener una variedad de 50 o mas especies de pastos rastrojos arboles, lo unico que lo cerco y uso 1 cuadro 1 vez al mes 12 veces al año, tengo 30 cuadros, solo comen desde las 3pm hasta las 7pm, cambio el agua en las mañanas, y en las tardes, en verano dejo los corrales rotando 35 dias y para eso dejo 5 corrales apartes de verano ya luego saliendo el verano esos corrales son para sembrar maiz, inclusive he notado que en invierno puedo usar 25 corrales en vez de 30, al dia siguiente de comer el cuadro anterior ese cuadro se poda temprano no dejo la basura de la poda eso va al descarte y en la tarde se abona el corral con humus liquido que me ha funcionado muy bien el pasto sale mas nutrido y sale el pasto parejo sea corral natural o sembrado, estoy metiendo en los corrales sembrados otro tipo de pastos que me ha resultado mejor.
Recomendar
Responder
Recomendar
Responder
8 de diciembre de 2018
Estimados
Con respecto a fasciola, este parásito es muy grave en crianzas de ovinos y por ello es que los ovinos se crían preferentemente en zonas áridas.
Cuando se tiene el problema se debe actuar considerando la ecología del parásito. Este requiere NECESARIAMENTE de un huésped intermediario, un pequeño caracol acuático o de zonas húmedas.
Su ciclo se inicia por la descarga junto a los excrementos de huevos de fasciola que llegan al agua en donde se liberan las fases larvarias primarias del parásito y llegan al caracol dentro del cual se multiplican, luego se liberar y por el agua llegan al forraje flotante o de las orillas de la zona húmeda en donde se enquistan y esperan a un nuevo huésped que puede ser un vacuno; una oveja, un cerdo, un caballo (ya muy común en nuestro país) e incluso el hombre si se le antoja consumir hierbas acuáticas como los berros u otros.
Para su control se debe considerar justamente la ecología del parásito y de su huésped intermediario, el caracol, el cual no se le encuentra en el ambiente en periodos de frío (invierno) y por tanto, el momento de mayor impacto en el control de este parásito será cuando en su zona este escondido el caracol en el suelo por efecto de la temperatura ambiente. Si eliminamos "todos" los parásitos adultos y formas larvarias presentes en el animal, teóricamente no habrán larvas para iniciar nueva infestación en la primavera siguiente.
Efectivamente se reduce la población de larvas infestantes pero quedan larvas anteriores en el forraje que pueden ser causa de nuevos casos clínicos de fasciolasis. Si repetimos esta forma de control podemos llegar a tener praderas libres de este parásito.
Los controles antiparasitarios contra fasciola debe ser en base a productos a usar según condición ambiental de los parásitos. Así la dosificación de otoño y de invierno debe usarse un producto efectivo contra fasciola adultas y fases larvarias y en primavera principalmente contra fases larvarias que son las que realmente causan los síntomas de la enfermedad.
Privilegiar productos inyectables a los productos orales en los cuales corrientemente se sub dosifican a los animales. Se debe tener claro si el producto utilizado tiene efecto sobre las larvas del parásito o solo contra fasciola adultas.
No olvidar la intima relación entre los problemas de fasciola con enfermedades graves de Clostridium.
Con respecto al uso de sulfato de cobre como forma de control de caracoles, aunque se le ha definido como efectivo, la extrema toxicidad del cobre para las ovejas no aconseja su utilización.
Los caracoles se exterminan reduciendo la humedad de la pradera con adecuados medios de drenaje superficial o subterráneos. Otra condición es que el pastoreo de las zonas más húmedas sea destinada al pastoreo de vacunos que son más resistentes a este parásito.
Resumiendo, en el control de parásitos, ya sea fasciola como gastrointestinales, el uso estratégico de productos farmacológicos funciona muy bien si se les relaciona su momento de uso con la ecología de los parásitos a combatir y esta condición varia de zona en zona.
Recomendar
Responder
8 de diciembre de 2018
Muchas gracias y con se podrian exterminar del todo los caracoles de las praderas? gracias.
Recomendar
Responder
7 de diciembre de 2018
Hola yo tengo un rebaño de unas 26 cabezas y e tenido problemas con la fasciola hepatica desparasito con albendazoles y con closantel pero animales infectados es muy dificil curarlos. Alguien sabria como mejorar en esto o como tratar a animales infectados con la fasciola.? Muchas gracias.
Recomendar
Responder
6 de diciembre de 2018
Seria bueno que se mencionara con los nombres científico y comunes además de la forma de preparación teniendo en cuenta que se pueda prepara de forma casera como se realizan algunas infusiones, colirios, suministros de harinas en los alimentos
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.









