La nutrición de cebada cervecera en Argentina: Mejores prácticas de manejo de la fertilización
Publicado: 4 de septiembre de 2014
Por: Laureano Boga. Ingeniero Agronomo; Especialista en Produccion de Cultivos en Mosaic Argentina, Buenos Aires, Argentina.
Introducción
La superficie de cebada cervecera (Hordeum distichum L.) aumentó considerablemente en los últimos años en la Argentina debido a las ventajas de comercialización y agronómicas respecto al trigo. Sin embargo, este crecimiento puede no estar acompañado de adecuadas prácticas de manejo nutricional necesarias para alcanzar los objetivos de producción y porcentaje de proteína (PP) requeridos por las malterías. El estudio del manejo nutricional de los cultivos puede ser abordado en base a las mejores prácticas de manejo de nutrientes y fertilizantes (MPM), definidas como la dosis y la fuente de nutrientes aplicados en la forma y momento correctos (Bruulsema et al., 2008). El objetivo de esta revisión fue discutir las MPM de la fertilización en el cultivo de cebada. Para ello, se describió la dinámica de acumulación de los principales nutrientes a lo largo del ciclo del cultivo, se determinaron qué factores afectan dicha dinámica y se evaluaron los métodos de diagnóstico empleados en la actualidad, marcando diferencias y similitudes con trigo.
Nitrógeno
Dinámica de acumulación y eficiencia de utilización
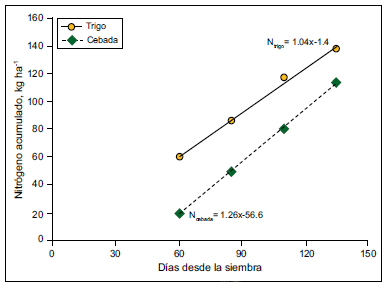
En general, se supone que la dinámica de acumulación de N en cebada sería similar al trigo por ser ambos cultivos invernales. Para el sudeste bonaerense, se muestra que un cultivo de trigo acumula más N total que cebada pero a una tasa menor (Figura 1).
Figura 1. Acumulación de nitrógeno para trigo y cebada fertilizados en el sudeste bonaerense. Adaptado de Echeverría y García (2005).
Diferentes estudios evidencian que la absorción preantesis sería de mayor importancia para el cultivo de cebada respecto a trigo. Vera Núñez et al. (2002) determinó que la cantidad total de N acumulado en cebada bajo riego hasta floración fue 80% del N total a madurez fisiológica. Para trigo, Golik et al. (2002) determinaron que el N total acumulado en antesis relativo al total a madurez fue del 64 y 72% para aplicaciones de 0 y 160 kg de N, respectivamente.
Respecto de la partición del N, la mayor parte del N en grano de cebada proviene de la removilización del N absorbido en pre-antesis (Dordas, 2011). A diferencia de trigo, el autor no observó incrementos en el nivel de N en grano en cebada por efecto de las aplicaciones de N en postfloración. Por otra parte, para asimilados, Evans y Wardlaw (1980) determinaron un 5-10% y 30% de removilización en trigo y cebada, respectivamente. En síntesis, para el cultivo de cebada la absorción preantesis de N y su posterior removilización jugarían un rol fundamental al momento de definir el contenido de N en grano.
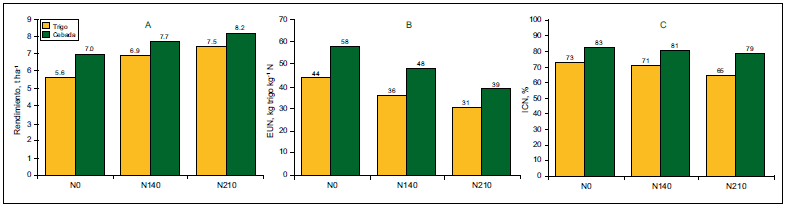
La eficiencia de utilización de N (EUN, kg de grano por kg de N aplicado) es definida como el producto entre la eficiencia de absorción de N (EAN, kg N absorbido por kg de N aplicado) y la eficiencia fisiológica (EFN, kg de grano por kg de N absorbido). Delogu et al. (1997), comparando cebada de seis hileras con trigos de invierno, determinó mayor rendimiento, EUN e índice de cosecha de N (ICN) de cebada respecto a trigo para una misma dosis de N (Figura 2). La mayor EUN en cebada fue explicada por una mayor EFN (32 y 8% para 0 y 140N, respectivamente).
Bingham (2011) determinó diferencias en el patrón de acumulación de N entre genotipos de cebada, asociado posiblemente a la variación en el IC. Similares resultados han sido reportados por Berthodlsson y Brantestam (2008) para variedades de cebada originarias de Suecia y Dinamarca en donde el IC varió entre 42 y 55% desde 1900 a 2005. Esto permitiría hipotetizar que los cultivares más modernos tendrían mayor IC y fijarían mayor cantidad de destinos (número de granos), induciendo una mayor absorción de N postfloración y alterando la relación entre removilización y absorción (Abeledo et al., 2007).
En síntesis, la diferente dinámica de acumulación de N en cebada respecto a trigo debería ser considerada al momento de definir los métodos de diagnóstico o de monitoreo de dicho nutriente para el cultivo. Los mismos debieran poder relacionar la disponibilidad de N en biomasa en prefloración con el rendimiento y/o contenido de proteína en grano.
Métodos de diagnóstico y respuesta
En la actualidad, los métodos más difundidos en Argentina para la recomendación de N en cebada se basan en la determinación del contenido de N-nitratos (0- 60 cm) en suelo a la siembra del cultivo. Se han propuesto distintos niveles (umbrales) de disponibilidad de N a la siembra (suelo+fertilizante), con los cuales se alcanza el rendimiento máximo según las zonas. Para el sudeste de Buenos Aires, González Montaner (2009) determinó umbrales desde 150 hasta 175 kg N ha-1, mientras que para el sudoeste y centro de la provincia se determinaron niveles críticos de 100 y 130 kg N ha-1, respectivamente (Prystupa, 2005). Sin embargo, la capacidad predictiva de dicha metodología con fines de recomendación ha sido cuestionada (Prystupa et al., 2006).
Figura 2. Rendimiento (A), EUN (B) e índice de cosecha de nitrógeno (C) para trigo y cebada en función de la disponibilidad de N. Adaptado de: Delogu et al. (1997).
Figura 3. Rendimiento de cebada en función del contenido de N inicial en suelo (0-60 cm) + N del fertilizante (Prystupa y Ferraris, 2011).
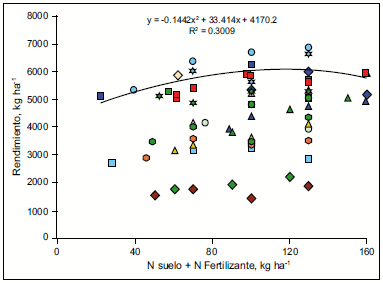
Los mismos autores en una red de ensayos realizados con la variedad Scarlett, determinaron respuestas significativas desde 24 hasta 45% en rendimiento a N, no obstante, la disponibilidad de N en suelo explicó solo el 30% de la variabilidad (Figura 3). Similares asociaciones fueron observadas por Lazzari (2005) para el sudoeste y centro de provincia de Buenos Aires con la variedad Quilmes Palomar. Una hipótesis es que esta metodología no considera en forma directa los aportes de N por mineralización y estos podrían ser muy distintos en función del cultivo antecesor, el nivel de materia orgánica (MO) y el sistema de labranza (Studdert y Echeverría, 2000). Para el cultivo de trigo en el sudeste bonaerense, Reussi Calvo et al. (2013) reportaron que la asociación entre la disponibilidad N a la siembra (suelo+fertilizante) y el rendimiento del trigo aumentó del 24 al 66% cuando se incorporó el N incubado en anaerobiosis durante 7 días a 40 oC (Nan) como estimador del aporte de N por mineralización. Similares resultados han sido reportados por Mengel (2005), quien obtuvo mejoras en el diagnóstico de N cuando incorporó una fracción de N orgánico asociada con el aporte de N por mineralización.
Para las condiciones del sudeste de Buenos Aires, Ross (2012) determinó interacción significativa entre el año, la localidad y la dosis de N sobre el rendimiento y PP. Similares resultados fueron reportados por Prystupa y Ferraris (2011) quien mediante el empleo de modelos de regresión múltiple que integran la disponibilidad de N, las lluvias de octubre y el contenido de MO explicaron más del 40% (p<0.01) de la variación en rendimiento y PP. Estos trabajos evidencian que existen otros factores que condicionan la respuesta en rendimiento y en PP además de la disponibilidad inicial de N (suelo+fertilizante) medida a la siembra del cultivo.
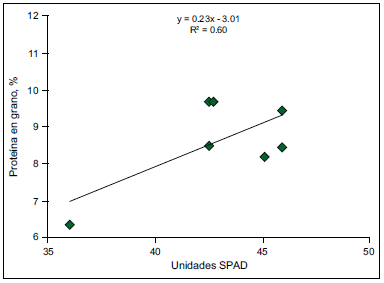
Considerando las limitaciones de utilizar solamente la determinación del N a la siembra del cultivo como único método de diagnóstico, se han explorado otras metodologías para tal fin como el medidor de clorofila SPAD, la curva de dilución de N y los modelos de simulación. El medidor de Clorofila SPAD podría ser considerado una alternativa para el diagnóstico de N en cebada. González Montaner (2009) en cebada, reportó que la determinación de SPAD en hoja bandera explicó el 60% de la variación en el contenido de proteína en grano (Figura 4). En situaciones contrastantes de suministro de N (0, 100 y 300 kg N ha-1), se observó que la lectura de SPAD (cerca de floración) explicó el 64.7% de las variaciones en rendimiento (Pagola, 2008). Por lo tanto, el medidor de clorofila SPAD sería una herramienta válida para predecir rendimiento y PP en cebada. No obstante, surge la necesidad de generar calibraciones locales para determinar el momento de lectura y desarrollar los modelos que permitan predecir el rendimiento, la respuesta a N y, por ende, la dosis de N a aplicar.
Otra alternativa para el diagnóstico de N en cebada es el empleo de la curva de dilución crítica de N. Esta permite calcular el índice de nutrición nitrogenada (INN) definido como la relación entre la concentración de N actual para una determinada fase fenológica del cultivo y la crítica que no limita la producción de biomasa para el mismo periodo (Lemaire, 2008). Esta metodología presenta como desventaja el tiempo que insume, por lo que su empleo como método de rutina es limitado. En la actualidad, existen métodos indirectos que reflejan satisfactoriamente el INN. Los sensores remotos que integran mediciones de N con índice de área foliar (IAF) son los que mejor reflejan el INN, y representan una herramienta promisoria de monitoreo y corrección de N en etapas tempranas del ciclo de cultivo (Lemaire, 2008). En cebada, para el estadio de 3 nudos, se determinó que la integración de las lecturas de índice de verdor (IV) con los días de atraso de la fecha de siembra respecto a la óptima, explicaron el 73% de la variación en PP independientemente del nivel de N aplicado (Petterson, 2007). En base a estos resultados, los sensores remotos reflejarían adecuadamente el INN aunque dichas determinaciones debieran ser usadas integrándolas con otros indicadores como fue propuesto por Petterson (2007).
Figura 4. Porcentaje de proteína en función del valor de SPAD en hoja bandera de cebada. Adaptado de González Montaner (2009).
Otra herramienta a tener en cuenta dentro de los métodos de diagnostico de N es el uso de modelos de simulación. Travasso y Magrin (1998) mencionan que el modelo CERES (de la familia DSSAT) simula en forma adecuada el crecimiento del cultivo de cebada para un amplio rango de ambientes de modo que podría ser empleado en dicho cultivo con fines de diagnóstico de N.
Momento de aplicación
Uno de los aspectos a considerar para definir las estrategias de fertilización nitrogenada en cebada, es determinar el momento correcto de aplicación de N con el objetivo de maximizar la EUN. Para esto es necesario sincronizar la disponibilidad de N con la demanda del cultivo, para lograr buenas coberturas foliares al comienzo del periodo crítico de definición de rendimiento. En trigo, dicho período comprende desde 20-30 días preantesis y 10 días post-antesis (García y Berardo, 2005), sin embargo, para cebada dicho periodo se situaría 10 días antes respecto a trigo (Arisnabarreta y Miralles, 2000). Por otro lado, las estrategias de fertilización deberían considerar el requisito de mantener un determinado nivel de N en grano acorde a los estándares industriales. En cebada, el rendimiento se construye a partir de relaciones entre el número de macollos logrados hasta Zadocks-30 que originarán un determinado número de espigas, con un determinado número de granos por espiga. Estos parámetros combinados dan como resultado el número de granos por metro cuadrado, fuertemente asociado con el rendimiento del cultivo (Baethgen et al., 1995). En general, las aplicaciones tempranas (siembra o Zadocks-22) tienen alto efecto sobre el número de macollos, mientras que en Zadocks-30 afectan el número de granos por espiga (Baethgen et al., 1995). Además, Prystupa y Ferraris (2011) determinaron que las aplicaciones foliares de N durante espigazón fueron 25% más efectivas que las aplicaciones durante macollaje para aumentar el PP. Esto sugiere la posibilidad de combinar en los programas de fertilización de cebada, las aplicaciones tempranas de N (emergencia–Zadocks-30) con las foliares durante espigazón, con el objetivo de lograr altos rendimientos con adecuados PP acorde a los requerimientos de la industria.
Fuente y forma de aplicación
A nivel país, el 80% de la producción de cebada proviene de la región centro sur de la provincia de Buenos Aires (Tomasso, 2003), geográficamente y temporalmente coincidente con la zona triguera. Por lo tanto, es esperable que las condiciones que pudieran generar pérdidas de N afectando la EUN y la eficiencia de las distintas fuentes de N en cebada fueran similares a las determinadas para trigo.
Para las condiciones del sur de Santa Fe, Fontanetto et al. (2011) determinaron diferencias significativas en EUN en cebada por efecto de las fuentes de N. La EUN fue de 21.9, 18.3 y 12.7, para urea tratada con inhibidor de la ureasa, UAN y Urea, respectivamente. Similares resultados fueron reportados para trigo en dicha región (Fontanetto et al., 2007).
En síntesis, estos trabajos sugieren que los mismos factores que condicionan la EUN en trigo estarían actuando para el cultivo de cebada.
Fósforo
Dinámica de acumulación
A pesar de la distinta fecha de floración, tanto en trigo como en cebada, las deficiencias de P reducen el número de granos y biomasa en espiga durante el periodo crítico del cultivo (Prystupa, 2005). La dinámica comparada de absorción de P en trigo y cebada sugiere patrones de acumulación diferentes para una misma disponibilidad de P. Ambas especies llegan a antesis con similares cantidades de P, no obstante, presentan diferentes tasas de acumulación antes de dicho periodo. La cebada muestra una mayor tasa acumulación hasta los 60 días desde la siembra respecto a trigo. Estas diferencias podrían deberse a la habilidad que tienen algunos genotipos de cebada para producir ácidos orgánicos en sus raíces que aumentan la disponibilidad inicial de P proveniente de fracciones menos lábiles, las cuales se vuelven disponibles para el cultivo (Tara, 2000).
La acumulación de P afecta la cantidad de macollos formados y, posteriormente, el número de espigas, factores estrechamente asociados al número de granos y el rendimiento (Prystupa y Ferraris, 2011). Para más de 15 variedades de cebada creciendo bajo condiciones experimentales y disponibilidades contrastantes de P, Römer (1998) determinó que la absorción de P hasta la mitad de macollaje (Zadocks-25) explicó el 71% de la variación del rendimiento. Estos resultados sugirieren que la absorción temprana es un factor relevante para el desarrollo de macollos y espigas. Por lo tanto, la cebada sería más sensible a deficiencias de P en etapas tempranas respecto a trigo, razón por la cual la especie ha desarrollado mecanismos para asegurarse el abastecimiento de dicho nutriente antes de llegar al estadio de Zadocks-25. Ferraris et al. (2012) determinaron, para 12 sitios con variada disponibilidad de P de la región pampeana centro-norte, que la respuesta en rendimiento de cebada fue 30% mayor respecto a trigo, con niveles de eficiencia de uso de P (EUP) promedio de 40.3 y 33.0 kg grano kg-1 de P, respectivamente. Similares resultados fueron observados por Valkama (2009). No obstante, es necesario considerar el efecto de la variedad de cebada sobre la EUP (Tara, 2000). La mayor susceptibilidad de la cebada a la deficiencia de P respecto al trigo, se explicaría por la mayor limitación del cultivo de cebada para alcanzar y mantener el IAF crítico durante el periodo de definición de rendimiento (Ferraris et al., 2012).
Métodos de diagnóstico
Al igual que en trigo, el manejo de la fertilización fosforada en cebada podría realizarse siguiendo el criterio de suficiencia, en donde la dosis de P máxima es aquella que genera el máximo rendimiento económico, o a través del criterio de reposición en donde la fertilización tiene como objetivo llegar y mantener un determinado nivel de P en el suelo donde se logra el rendimiento máximo del cultivo. Sin embargo, para cebada aún no se han realizado calibraciones para el criterio de suficiencia ni tampoco se determinó el umbral para el criterio de reposición (Prystupa y Ferraris, 2011).
Momento de aplicación
Considerando el patrón de acumulación de P en cebada, el momento óptimo debería ser aquel que asegure un nivel de P extractable en el suelo no limitante antes de Zadocks-25, momento en el cual este nutriente tiene alto impacto en la supervivencia del número de macollos (Prystupa y Ferraris, 2011).
Para las condiciones de la región pampeana, García et al. (2005) determinaron que la aplicación de P vía fertilizantes fosfatados resulta en un incremento de los niveles de P extractable del suelo en función de la dosis aplicada y que la variación del contenido de P en el suelo fue explicada principalmente por el nivel de extracción de los cultivos, validando el concepto de residualidad de este nutriente. Por lo tanto, el momento de aplicación de P podría situarse desde la cosecha del cultivo antecesor hasta el momento de la siembra. La escasa movilidad del P en el suelo es otro factor a tener en cuenta para definir si la aplicación de P puede ser realizada en bandas al momento de la siembra (BS) o al voleo en forma anticipada (VA). La aplicación BS tiende a presentar mayor EUP en suelos con alta capacidad de fijación, bajo contenido de P y para dosis bajas, mientras que las aplicaciones VA muestran EUP iguales a BS en suelos no fijadores, con niveles de P Bray-1 mayores a 8-10 mg kg-1, dosis de P mayores a 20 kg ha-1, sistemas de siembra directa sin cobertura excesiva y lluvias post aplicación superiores a 50 milímetros (Ciampitti et al., 2009). Otro aspecto a considerar para las aplicaciones BS es la fitotoxicidad de los fertilizantes, la cual es ocasionada por el efecto salino y/o la emisión de amoniaco. Para trigo y cebada, aplicaciones junto con la semilla de dosis de fosfato diamónico (FDA) superiores a 55 kg ha-1 podrían causar disminuciones del 20% en la población de plantas (Ciampitti et al., 2006).
En síntesis, el momento de aplicación de P en cebada podría ser diferente respecto a trigo por las siguientes cuestiones: i) La mayor demanda de P en los primeros estadios de desarrollo de la cebada (Figura 5), ii) La cebada generalmente va seguida de un cultivo de soja de segunda el cual presenta mayores expectativas de rendimiento que sobre trigo debido al adelanto en la fecha de siembra (Calviño et al., 2003). Por lo tanto, a rendimientos equivalentes de cebada y trigo, el mayor rendimiento de soja de segunda sobre cebada produciría una mayor demanda de P que debiera ser compensada con una mayor dosis de fertilizante. En dicha situación, las aplicaciones VA o combinadas con BS podrían ser más efectivas.
Fuente y forma de aplicación
A diferencia de lo descripto para N, en donde el tipo de fuente puede tener influencia en la EUN, para el caso de P las reacciones en el suelo tienen mayor importancia que la fuente utilizada (García et al., 2005). Por lo tanto, el criterio de selección de fuentes fosforadas para cebada no debiera ser distinto a trigo.
Azufre
Dinámica de acumulación
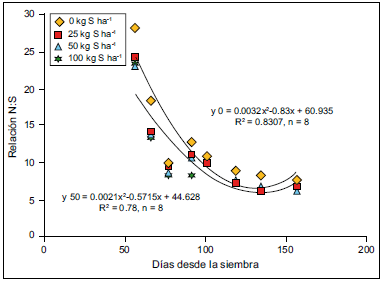
La dinámica de la acumulación de S en cebada se analizará en relación a N, debido a la estrecha asociación entre las vías de absorción y acumulación de ambos nutrientes (Echeverría, 2005; Reussi Calvo y Echeverría, 2009). En la Figura 6 se presenta el porcentaje de acumulación de N y S del fertilizante hasta los 60 días desde la siembra para el cultivo de cebada (Vera Nuñez et al. 2002; Vong, 2007). En la misma se observa que la acumulación de S seria demorada respecto a N, resultados que coinciden con los determinados en trigo por Reussi Calvo y Echeverría (2009) y en maíz por Pagani et al. (2009). Para cebada, Grzebisz (2007) obtuvo disminuciones en la relación N:S en hoja a lo largo del ciclo del cultivo en situaciones de alta como de baja disponibilidad de S (Figura 7), lo que sugiere una acumulación más tardía de S respecto a N.
Figura 5. Acumulación de P para trigo y cebada en función de los días desde la siembra para un suelo con 15 mg P kg-1. Adaptado de Echeverría y García (2005) y Tara (2000).
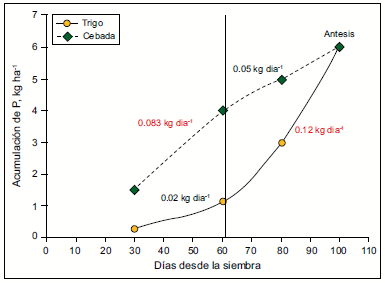
Figura 6. Acumulación de nitrógeno (N) y azufre (S) del fertilizante en cebada. Adaptado de Vera Nuñez et al. (2002) y Vong (2007).
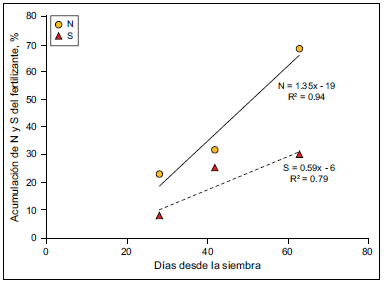
Figura 7. Evolución de la relación N:S en hoja de cebada (Grzebisz, 2007).
Esta acumulación más tardía de S relativa a N podría estar relacionada a que el S es un nutriente poco móvil en la planta (Echeverría, 2005). Sin embargo, cuando solo se considera el N y S proveniente del fertilizante, una condición de stress hídrico podría demorar la acumulación de N alterando las diferencias entre los momentos de acumulación de estos nutrientes (Echeverría, 2013, com. personal). En base a esto la absorción de S desde el suelo durante el ciclo del cultivo sería más importante que la removilización.
Métodos de diagnóstico
Un aspecto a definir para el diagnóstico de S en cebada es conocer la magnitud de la respuesta esperada en rendimiento a la aplicación de dicho nutriente. Para las condiciones de Inglaterra se reportaron respuestas en rendimiento a S entre 5 y 30%, tanto en trigo como en cebada para aplicaciones de 20 kg S ha-1 (Zhao, 2002). En general, las respuestas para el cultivo de cebada fueron de mayor magnitud y frecuencia respecto a trigo debido a que dicho cultivo se siembra en ambientes de menor fertilidad. Otro aspecto relacionado a la respuesta a S en cereales es el nivel de rendimiento del cultivo. En Argentina, para una red de ensayos de cebada realizada en la región pampeana, se observaron respuestas significativas a S en el 20% de los casos, particularmente en ambientes de mayor potencial de rendimiento, siendo la magnitud de la misma de 593 kg ha-1 (Prystupa y Ferraris, 2011). Otro factor a considerar para evaluar la respuesta a S es la interacción con N. Para trigo, Salvagiotti et al. (2009) determinaron que la aplicación de S produjo incrementos en la biomasa y el rendimiento per se y que, además, evidenció interacción positiva con el N. Similares resultados fueron determinados en cebada por Veliz (2010), respecto a la concentración de proteína en grano.
En la actualidad, no se ha logrado desarrollar un método de diagnóstico de deficiencias de S basado en el análisis de suelo lo suficientemente robusto, económico y rápido que permita caracterizar la disponibilidad de S para los cultivos. Esto se explicaría en parte por la poca precisión de los métodos, que además requieren equipamiento de elevado costo (inducción de plasma ICP, o cromatografía iónica) o requieren reactivos de elevado costo y son poco prácticos (colorimetría de azul de metileno). Por lo tanto, la aplicación de dicho nutriente se realiza rutinariamente con dosis de 10-15 kg S ha-1 en áreas donde se han observado respuestas en los cultivos previos (Rasmussen y Kresge, 1986).
Para las condiciones de la región pampeana argentina, Prystupa et al. (2006) determinaron una respuesta promedio al agregado de S de 112 kg ha-1, siendo baja la asociación entre el nivel de S-sulfato en suelo a la siembra y la respuesta a S (Figura 8). Estos resultados sugieren que el método de análisis de suelo no representa una alternativa precisa para el diagnóstico de los requerimientos de S para los cultivos de invierno incluyendo cebada.
Figura 8. Relación entre la respuesta a S en cebada y la concentración de S-SO4 = en suelo en los primeros 20 cm de profundidad (Prystupa et al., 2006).
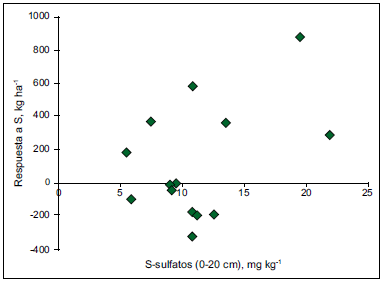
Figura 9. Rendimiento relativo en cebada en función de la relación N:S a fin de macollaje (Grzebisz, 2007).
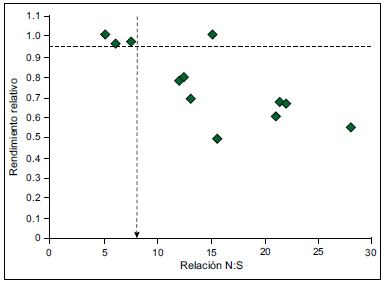
Los métodos basados en análisis de material vegetal podrían ser una alternativa para el diagnóstico de S, ya que determinan la cantidad de nutriente disponible para el cultivo en el momento de muestreo. Para trigo, la determinación de la relación N:S en biomasa aérea desde Z20 hasta Z39 mostró resultados alentadores para el diagnóstico de deficiencias de S en el SE Bonaerense (Reussi Calvo y Echeverría, 2009). Para cebada, Grzebisz (2007) determinó una relación N:S crítica de 8:1 en biomasa aérea a fin de macollaje (Figura 9), lo cual sugiere que esta metodología podría implementarse para el diagnóstico de S en dicho cultivo.
Fuente, forma y momento de aplicación
Al igual que para N y P, la selección de la fuente, forma y el momento adecuados para la aplicación de S debe estar orientada a lograr la mayor eficiencia de uso de este nutriente (EUS).
Al integrar las características de las fuentes con el tipo de suelo, suelos con pH mayor a 6, textura franco arenosas, altas precipitaciones post aplicación y utilización de fuentes como sulfato de amonio son las condiciones predisponentes para tener pérdidas de S por lavado de sulfatos, y como consecuencia, reducidas eficiencias del S aplicado (Reussi Calvo y Echeverría, 2009). Por el contrario, suelos molisoles con pH ligeramente ácido y alta saturación de bases intercambiables como Ca, minimizarían dichas pérdidas.
Si consideramos la acumulación demorada de S respecto de N, se tendría una mayor ventana de aplicación de S para el cultivo de trigo. Sin embargo, para cebada, el comienzo del período crítico de definición del número de granos, ocurre antes que en trigo, razón por la cual el intervalo entre aplicaciones debiera ser menor. La forma de aplicación guarda relación directa con la fuente y momento. En la medida que la aplicación se realice durante el período de macollaje, se recomienda aplicaciones al voleo empleando sulfato de calcio como fuente de S. Si se realizara en la línea de siembra, se recomienda aplicar el S en forma conjunta con P o mediante mezclas físicas o químicas.
Micronutrientes
Al evaluar la respuesta de los cultivos a los micronutrientes, el efecto del genotipo es un factor importante a ser considerado. A modo de ejemplo para boro (B) en cereales, Benjavan et al. (2003) determinó que la mayoría de los genotipos de trigo y cebada presentan respuesta a dicho nutriente en ambientes caracterizados como deficientes. Asimismo, Narwal (2012) determinó deficiencias moderadas de zinc (Zn), hierro (Fe) y manganeso (Mn) en trigo, de magnitud dependiente del genotipo. Esto sugiere la necesidad de considerar el genotipo en la aplicación de las MPM para micronutrientes, con posibles diferencias en el comportamiento de cebada respecto a trigo.
Se han documentado diferencias entre especies respecto a la sensibilidad a Zn, según el siguiente orden de mayor a menor sensibilidad: trigo candeal>avena>trigo pan> cebada >triticale>rye grass (Cakmak et al., 1999). La menor sensibilidad de cebada a Zn estaría relacionada a la capacidad de producir fitosideróforos a nivel de la rizósfera, sustancias relacionadas a la solubilización y movilidad de Zn (Fageria et al., 2001). Por otra parte, el Mn y el cobre (Cu) son micronutrientes que también limitan la producción de cebada (Mc Kemzie et al., 2004, Obrador et al., 2007). En Argentina, se reportaron incrementos en los contenidos de proteína en grano por efecto de la fertilización con Cu, aunque fueron variables según el sitio experimental (Prystupa et al., 2010). Para Mn, Pedas et al. (2008) reportaron diferente tolerancia de genotipos de cebada para crecer en ambientes deficientes en este micronutriente. Por otra parte, si consideramos un relevamiento reciente de suelos de la Región Pampeana Argentina (Sainz Rozas et al., 2013), el 50% de los mismos presentan valores inferiores a 0.9 mg kg-1 de Zn, valor considerado como umbral para extracciones con DTPA por Sims y Johnson (1991).
En referencia a los métodos de diagnóstico, Prochnow et al. (2009) cita como válidos los análisis foliares o de suelo, siendo los últimos menos robustos debido a la falta de calibración entre disponibilidad en el suelo y la respuesta de los cultivos. Para el diagnóstico foliar existe suficiente información sobre los niveles críticos de deficiencia pero no sobre los niveles críticos de toxicidad (Fageria et al., 2001).
Por otra parte, la menor dosis relativa de los micronutrientes respecto a los macronutrientes limita las posibilidades de aplicarlos solos, de modo tal que frecuentemente se emplean en forma conjunta con los macronutrientes o combinados con pesticidas, razón por la cual se necesita más información sobre las posibles interacciones (Fageria et al., 2001). A modo de ejemplo, la efectividad de un micronutriente como el Zn varía significativamente en función de la fuente utilizada (oxido o sulfato) y del macronutriente con el cual pueda estar combinada la aplicación (P o K) (Mc Laughlin et al., 2010).
Conclusiones
Las MPM de los nutrientes contemplan la aplicación de los conceptos de 4Rs (los 4 Requisitos), siendo indispensable para poder aplicar estos principios en el cultivo de cebada contar con información sobre: 1) requerimientos de nutrientes, 2) dinámica de acumulación, 3) métodos de diagnóstico precisos y 4) curvas de respuesta que permitan definir la dosis óptima económica. Esta revisión permitió identificar posibles líneas de investigación es pos de poder desarrollar y aplicar las MPM:
Para N: Calibrar una metodología de diagnóstico que además de considerar el N mineral inicial en suelo al momento de la siembra incluya estimadores de la mineralización. Además, evaluar el empleo de determinaciones indirectas de N en biomasa (SPAD o sensores) alrededor de macollaje para ajustar la dosis de N orientada a rendimiento y calidad.
Para P: Determinar los umbrales críticos de P en suelo para las principales zonas de producción del cultivo. Evaluar el efecto de los nuevos genotipos sobre la EUP.
Para S: Al igual que para N, es necesario desarrollar métodos de diagnóstico basado en el análisis de muestras de suelo y planta que permitan definir los requerimientos de S para el cultivo. Además, no hay registro de curvas de acumulación y dilución de este nutriente en el cultivo.
Para micronutrientes: Comenzar con ensayos exploratorios de respuesta a aquellos micronutrientes que presentan valores de disponibilidad por debajo del umbral citado en la bibliografía internacional (Ejemplo, Zn).
Bibliografía
- Abeledo, G.L., D.F. Calderini, y G.A. Slafer. 2007.Nitrogen Economy in old an modern malting barley. Field Crop Res.106:171-178.
- Arisnabarreta,S., y D. Miralles.2000. Período crítico en la generación del rendimiento en líneas isogénicas de cebada. Proc. IV Congreso Nacional de Cultivos de Siembra Otoño Invernal 2004 Bahia Blanca, pp. 333-335.
- Baethgen, E., B. Christianson, y A. García Lamothe. 1995. Nitrogen fertilizer effects on growth, grain yield, and yield components of malting barley. Field Crops Res. 43: 87-99.
- Benjavan, R., N. Sunis, y J. Sansanee. 2003. Increasing boron efficiency in international bread wheat, triticale and barley germplasm will boost on soils low in boron. Field Crops Res. 86:175-184.
- Bertholdsson, N.O., y A. Kolodinska Brantestam. 2008. A century of Nordic Barley breeding-Effects on early vigor root and shoot growth, straw length, harvest index ang grain weight. Eur. J. Agron. 30:266-274.
- Bingham, I.J. 2011.Analysis of improvements in nitrogen efficiency associated with 75 years of spring barley breeding. Eur .J .Agron. 42:49-48.
- Bruulsema, T.W., C. Witt, F.O. García, S. Li., T.N. Rao, F. Chen, y S. Ivanova. 2008. A Global Framework for Fertilizer BMPs. Better Crops 92(2):13-15. IPNI. Norcross, EE.UU.
- Calviño, P.A., V.O. Sadras, y F. Andrade. 2003. Development, growth and yield of late sown soybean in the southern Pampas. Eur. J. Agron. 19:265-275.
- Cakmak, I., M. Kalayci, H. Ekiz, H.J. Braun, H.J., I. Kilinc, y A. Yilmaz. 1999. Zinc deficiency as a practical problem in plant and human nutrition in Turkey. A NATO–Science for stability project. Field Crop Res. 60:175-188.
- Ciampitti, I.A., G. Rubio, L.I. Picone, y F.O. García. 2009. El fósforo en la agricultura: Mejores prácticas de manejo (MPM). Simposio Fertilidad 2009. IPNI Cono Sur y Fertilizar A.C., Rosario: 35-51.
- Ciampitti, I.A., F.G. Micucci, H. Fontanetto, y F.O. García. 2006. Manejo y ubicación del fertilizante junto a la semilla: Efectos fitotóxicos. Archivo Agronómico No. 10:1-8.
- Delogu, G., L. Cattivelli, N. Pechioni, D. de Falcis, T. Maggiore, y A.M. Stanca. 1997.Uptake and agronomic efficiency of nitrogen in winter barley and winter wheat. Eur. J. Agron. 9:11-20.
- Dordas, C. 2011. Variation in dry matter and nitrogen accumulation and remobilization in barley as affected by fertilization, cultivar, and source-sink relations. Eur. J. Agron. 37:31-42.
- Echeverría, H.E. 2005. Azufre. En: Echeverría, H.E., y García, F.O. (eds.) Fertilidad de suelos y Fertilización de Cultivos .Ediciones INTA .Buenos Aires, Argentina pp. 139-160.
- Echeverría, H.E., y F.O. García. 2005. Fertilidad de suelos y Fertilización de Cultivos. Ediciones INTA. Buenos Aires, Argentina. 525 p.
- Evans, L.T., e I.F. Wardlaw. 1980. Aspects of the comparative physiology of grain yields in cereals. CSIRO, Division of plant industry, Australia, 58 p.
- Fageria, N.K., B.C. Baligar, y R.B. Ang Clark. 2001. Micronutrients in Crop Production. Adv. Agron. 7:185-267.
- Ferraris, G.N., F. Mousegne, M. Barraco, L. Couretot, J. Cavo, R. Falconi, O. Ferraris, E. Lemos, M. Lopez De Sabando, G. Magnone, A. Maertin, P. Melilli, A. Paganini, G. Perez, R. Pontoni, J. Zanettini, C. Scianca, R. Sola, M.G. Telleria, y L. Ventimiglia. 2012. Rendimiento y eficiencia comparativa de uso de fósforo, nitrógeno y agua en trigo y cebada cervecera en la región centro y noroeste de Buenos Aires. Área de Desarrollo Rural. INTA Proyecto Regional Agrícola, CRBAN. 12 p.
- Fontanetto, H., O. Keller, O. Quaino, L. Bellotti, C. Negro, y D. Giailevra. 2007. Trigo en siembra directa: formas de aplicación, dosis y fuentes nitrogenadas. INTA , Estación Experimental Agropecuaria Rafaela. Publicación Miscelánea (107):17-20.
- Fontanetto, H., S. Gambaudo, O. Keller, E. Weder, M. Sillón, G. Gianetto, G. Meroi, G. Berrone, M. Meyer, C. Canepa, y P. Ruffino. 2011. Formas de aplicación, dosis y fuentes nitrogenadas en cebada. Publicación Miscelánea INTA Rafaela 119: 93-99.
- García, F.O., y A. Berardo. 2005. Trigo. En: Echeverría, H.E., y García, F.O. (eds) Fertilidad de suelos y Fertilización de Cultivos. Ediciones INTA. Buenos Aires, Argentina pp. 233-253.
- García, F.O., L.I. Picone y A. Berardo. 2005. Fósforo. En: Echeverría, H.E., y García, F.O. (eds.) Fertilidad de suelos y fertilización de Cultivos .Ediciones INTA. Buenos Aires, Argentina pp. 99-121.
- Golik, S.I., H.O. Chidichimo, y M.R. Simom. 2002. Tasa de absorción específica de nitrógeno en Triticum sativum. Proc 6° Congreso Nacional de Trigo y 4° Simposio Nacional de Cultivos de siembra Invernal, Bahia Blanca, Argentina pp. 61-66.
- González Montaner, J.H. 2009. Decisiones empresariales para un año sin red. Proc Jornada de Actualización Técnica Trigo, Cebada y Colza 2009., Azul Buenos Aires, Argentina: 19-20.
- Grzebisz, K. 2007. Spring malt barley response to elemental sulphur-the prognostic value of N and S concentrations in malt barley leaves. Plant Soil Environt. 53(9):388-394
- . Lazzari, M.A. 2005. Patrones de absorción de nitrógeno nativo y del fertilizante en cebada cervecera con fertilizaciones cercanas a la siembra. Ciencia del Suelo 23:69-77.
- Lemaire, G. 2008. Diagnosis tool for plant and crop N status in vegetative stage. Theory and practices for crop N management. Eur. J. Agron. 28:614-624.
- Mc Kemzie, R.H., A.B. Middleton, L. Hall, J. Demuldelder, E. Bremer. 2004. Fertilizer Response of Barley Grain in Southern and Central Alberta. Can. J. Soil Sci. 84:513-523.
- Mc Laughlin, M.J., A. Peacock, y S.P. Stacey. 2010. Fertilizer Composition Containing Micronutrients and Methods of Making Same. United States Patent and Trademark Office Application 61:309-894.
- Mengel, K. 2005. Nitrogen fertilizer application rates on cereal crops according to available mineral and organic soil nitrogen. Eur. J. Agron. 24:343-348.
- Narwal, R.P. 2012. Influence of genetic variability on zinc iron and manganese responses in wheat .J Geochem Explor. 121:45-48.
- Obrador, A., L.M. Valdivia, D. González, J. Novillo, M.I. Rico. 2007. Relationships of soil properties with Mn and Zn distribution in acid soils and their uptake by a barley crop. Geoderma. 137:432-443.
- Pagani, A., H.E. Echeverría, y H. Sainz Rozas. 2009. Respuesta a nitrógeno y azufre en cultivo de maíz en diferentes ambientes de la provincia de Buenos Aires. Ciencia deI Suelo. 27(1):21-29.
- Pagola, M. 2008. New method to assess barley nitrogen nutrition status based on image colour analysis. Comparison with SPAD- 502. Computers and electronics in agriculture 65(2009):213-218.
- Pedas, P., C.K. Yitting, A.T. Fuglsang, T.P. Jahn, J.K. Schjoerring, y S. Husted. 2008. Manganese efficiency in Barley: Identification and Characterization of the metal ion transporter HvIRT1 1[0A]. Plant physiology. 148:455-466.
- Pettersson, C.G. 2007. Prediction of grain protein in spring malting barley grown in northern of Europe. Eur. J. Agron. 27:205-214.
- Prystupa, P. 2005. Cebada y Avena. En: Echeverría, H.E., y García, F.O. (eds.). Fertilidad de suelos y Fertilización de Cultivos. Ediciones INTA. Buenos Aires, Argentina pp. 317-334.
- Prystupa, P., y G. Ferraris. 2011. Nutrición mineral y fertilización en cebada cervecera. En: Miralles, D.J., Benech, A., Abeledo, L.G (eds.) Cebada Cervecera. Editorial Facultad de Agronomía Buenos Aires pp. 35-62.
- Prystupa, P., E.A. Lemos, M.G. Telleria, y M.A. Bergara. 2010. Fertilización foliar con cobre: ¿Aumenta el contenido proteico de los granos de cebada cervecera?. Ciencia del Suelo. 31(1):119-124.
- Prystupa, P., R. Bergh, G. Ferraris, T. Loewy, L. Ventimiglia, F. Gutierrez Boem, y L. Couretot. 2006. Fertilización nitrogenada y azufrada en cebada cervecera cv Scarlett. Informaciones Agronómicas del Cono Sur. IPNI Cono Sur. Buenos Aires. 38:5-8.
- Prochnow, L. I., M.F. De Moraes, y S.R. Stripp. 2009 Micronutrientes Proc. Simposio Fertilidad 2009. IPNI Cono Sur y Fertilizar A.C. Rosario: 60-77.
- Rasmussen, P., y P. Kresge. 1986. Plant response to sulfur in the Western United States. In: Tabatabai, M. (ed). Sulfur in agriculture. ASA-CSSA-SSSA. Madison, Wisconsin, EE.UU. pp. 357-374.
- Reussi Calvo, N.I., y H.E. Echeverría. 2009. Azufre: Marco conceptual para definir las mejores prácticas de manejo en los cultivos. Simposio Fertilidad 2009. IPNI Cono Sur y Fertilizar A.C. Rosario: 52-59.
- Reussi Calvo, N.I., y H.E. Echeverría. 2006. Estrategias de fertilización nitrogenada en trigo: balance hídrico para el sur bonaerense. Ciencia del Suelo 24(2):115-122.
- Reussi Calvo, N.I., H. Sainz Rozas, H.E. Echeverría, y A. Berardo. 2013. Contribution of anaerobiosis incubated nitrogen to the diagnosis of nitrogen status in spring wheat. Agronomy Journal 105:321- 328.
- Römer, W. 1998. Influence of genotype on phosphate uptake and utilization efficiencies in spring barley. Eur. J. Agron. 8:215-224.
- Ross, F. 2012. Interacción fertilización nitrogenada y ambiente en cebada cervecera Scarlett. Proc. XIX Congreso Latinoamericano de la Ciencia del Suelo. XXIII Congreso Argentino de la Ciencia del Suelo. 16-20 de Abril de 2012. Mar del Plata. pp. A1-A6.
- Sainz Rozas, H. 2013. ¿Cuál es el estado de fertilidad de los suelos argentinos ? En: García, F.O. y Correndo A.A. (Eds.). Nutrición de Cultivos para la Intensificación Productiva Sustentable. Simposio Fertilidad 2013. IPNI Cono Sur y Fertilizar A.C. Rosario. pp. 62-72.
- Salvagiotti, F., J. Castellarin, D.L. Miralles, y H. Pedrol. 2009. Sulfur fertilization improves nitrogen use efficiency in wheat by increasing nitrogen uptake Field Crops Res. 113:170-177.
- Sims, J.T., y G.V. Johnson. 1991. Micronutrient soil tests. In micronutrients in agriculture (Book series 4): 427-476. Mortvedt, J , Cox F.R., Shuman L.M. y M.R.Welch (Eds.) Ed. SSSA Madison, Wisconsin, USA.
- Studdert, G.A., y H.E. Echeverría. 2000. Crop rotations and nitrogen fertilization to manage soil organic carbon dynamics. Soil Sci. Soc. Am. J. 64:1496-1503.
- Tara, S. 2000. Root released organic acids and phosphorus uptake of two barley cultivars in laboratory and field experiments. Eur. J. Agron. 12:81-289.
- Tomaso, J.C. 2003. Cebada Cervecera en la Argentina idia XX1. pp. 210-216.
- Travasso, M., y G.O. Magrin. 1998. Utility of CERES-Barley under Argentine conditions. Field Crop Res. 57(3):329-333.
- Valkama, E. 2009. Phosphorus fertilization: A meta-analysis of 80 years of research in Finland. Agri, Ecosyst Enviro. 130:75-85.
- Veliz, G. 2010. Impacto de la deficiencia combinada de nitrógeno y azufre sobre la removilización de aminoácidos y azúcares en plantas de cebada. Tesina N° 477. Facultad de ciencias exactas y naturales, Universidad de Belgrano. Buenos Aires, Argentina. 35.
- Vera Nuñez, J.A., O.A. Grageda Cabrera, M.A. Vuelvas Cisneros, y J.J. Peña Cabriales. 2002. Absorción de nitrógeno (15N) por el cultivo de cebada en relación con la disponibilidad de agua en “El Bajío” Guanajuato México. Terra Latin-American 20:57-64.
- Vong, P.C. 2007. Fertilizer sulphur uptake and transformations in soil as affected by plant species and soil type. Eur. J. Agron. 27:5-43.
- Zhao, F.J. 2002. Crop responses to sulphur fertilization in Europe. International Fertilizer Society, York, UK. 504:2-25.
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación