Leptospirosis: Caso clínico y revisión bibliográfica
Publicado: 14 de septiembre de 2006
Por: Alberto Morillo Alujas, Jaime Almajano Hernández, José Antonio Oliveros Use. Tests and Trials S.L.
Así mismo se hace una revisión bibliográfica de la enfermedad, principalmente de autores ingleses y australianos.
La leptospirosis es una enfermedad infecciosa que afecta a todas las especies animales, entre ellas al cerdo, ocasionando graves pérdidas económicas por su incidencia en el área reproductiva causando abortos, lechones nacidos muertos, lechones nacidos débiles y fallos reproductivos, siendo difícil su diagnóstico, dadas las especiales características de este género y la dificultad que entraña su cultivo.
Etiología
Las leptospiras son finas espiroquetas de 10 µ de largo y 0.2 µ de diámetro, con los extremos en forma de gancho y con movimientos ondulares y de rotación (5). Crecen en medios complejos como el EMJH (Ellinghausen-McCullough-Johnson-Harris) (10) y el Tween 80/40/ con lactoalbúmina hidrolizada (10,11). Debe incluirse inhibidores como el 5-fluorouracil y cicloserina(5).
Son sensibles a jabones, detergentes y desinfectantes y se destruyen rápidamente en medios secos (5).
Todas las especies son morfológicamente similares pero diferentes en el aspecto antigénico. Hay dos especies principales:
* L. interrogans que agrupa a todos los serovares conocidos, alrededor de 212 subdivididos en 23 serogrupos (8).
* L. biflexa que agrupa a los serovares saprofíticos.
La identificación del serovar requiere el aislamiento de la leptospira y su subsiguiente clasificación. Por ejemplo el serogrupo Australis tiene 12 serovares, siendo los más importantes bratislava, jalma, lora y muenchen (7).
Cuando un serovar infecta a una especie animal sin producir síntomas agudos, pero produciendo una infección renal crónica, se considera a dicho animal como hospedador reservorio para dicho serovar especifico. La infección en un hospedador no reservorio tiende a producir una enfermedad clínica. (1,7,8)
El serovar predominante varia en cada especie animal:
Hardjo en vacuno; Pomona, Tarassovi y Australis en cerdos (4) Canicola en perros Icterohaemorrhagiae en perros y ratas. (1)
Los caballos y felinos no suelen verse afectados por Leptospira (1).
En nuestro caso clínico no ha sido posible la identificación de la leptospira debido a que el diagnóstico no incluyo las técnicas de cultivo y serotipificación.
Distribución
Perea y cols en 1991, analizaron en España en la provincia de Badajoz 35 explotaciones porcinas, 28 extensivas y 7 intensivas con los siguientes resultados:
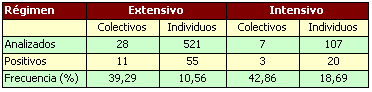
La Leptospirosis porcina debida a los serovares Pomona, Tarassovi e Icterohaemorrhagiae era frecuente en Europa Central. Hoy ha desaparecido casi completamente Pomona, Tarassovi en Reino Unido, Suiza, Dinamarca y Países Bajos. Icterohaemorrhagiae es casi desconocida en Reino Unido, habiéndose aislado en el cerdo una leptospira que pertenece al grupo Autumnalis aunque el grupo más frecuente es el Australis (12) seguido de Canicola e Icterohaemorrhagiae (4,5). En Francia los grupos Australis, Autumnalis, Grippotyphosa e Icterohaemorrhagiae son los que aparecen con más frecuencia. Son raros Pomona, y Tarassovi (4).
En Irlanda del Norte el grupo Australis es el más común con los serovares bratislava y muenchen con un 71 % de aparición en abortos y un 68 % de positividad en granjas examinadas (16).
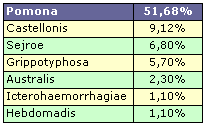
En USA es Pomona el serovar mas frecuente en cerdos (4).
Patogenesis
Las infecciones por leptospira son más graves en animales que no actúan como reservorios. Para cualquier serovar especifico, la infección en el animal reservorio pasa a menudo inadvertida clínicamente, si bien en un animal receptivo puede tener resultados adversos (1).
El resultado de su poder patógeno puede ser el resultado de una asociación con otros agentes como Parvovirus porcino o el resultado de un desequilibrio fisiológico global.
Leptospira tiene predilección por los riñones de los animales infectados (1). Penetran en el cuerpo a través de las mucosas (1) del tracto respiratorio, alimenticio y de la conjuntiva (7), o lesiones en la piel (5,7), necesitándose unos pocos microorganismos para infectar a un animal sensible.
Entran en sangre, se multiplican y a los 2-7 días pueden detectarse en vísceras.
A los 5-10 días se detectan anticuerpos circulantes aglutinantes (7) y en este estadío el microorganismo está localizado en los túbulos renales y cesa la leptospiremia (7). Durante la leptospiremia, la leptospira cruza la placenta, infecta al feto y penetra en las cavidades serosas y se establece en líquido cerebroespinal y en los túbulos renales proximales.
En infecciones agudas a consecuencia de la pirexia hay hemoglobinuria, ictericia, anorexia y uremia terminal. Cuando la infección no lleva a la muerte, la leptospira se elimina por orina (1,15) variando la duración según cada animal y según cada serovar (8,17).
En casos de infección por pomona y durante el primer mes, la intensidad de la eliminación es de más de un millón de leptospiras por ml de orina (Morse, 1958). En infecciones por bratislava la intensidad es mas baja.
Causa daños en el hígado y en otras vísceras. (5).
Se localizan también en el útero causando invasión fetal y abortos entre 10 días y 4 semanas después de la infección. La expulsión de los fetos ocurre a los 5-6 días de la muerte de los mismos. (5,10,16,17).
Se localizan también en vesículas seminales y conducto de Falopio. (5,16)
Si la invasión fetal ocurre cuando el feto no ha desarrollado todavía una adecuada respuesta inmunitaria, el resultado es la muerte del feto seguida de reabsorción, aborto o nacido muerto. En los casos en que la infección se establece al inicio de la gestación, el embrión es reabsorbido y se observa un fallo de gestación habiendo un bajo porcentaje de partos.
Cuando la infección se establece al final de la gestación se ve reducido el tamaño de la camada. Si ocurre cuando el feto puede desarrollar una respuesta inmune el suero de los lechones nacidos muertos contendrá anticuerpos contra la leptospira. En estos casos puede diagnosticarse la leptospirosis desde los fluidos fetales. (10).
Se han localizado leptospiras como bratislava y muenchen en los oviductos y úteros de cerdas, seguido de episodios de abortos con lechones infectados (14). En un estudio con 20 cerdas se obtuvieron las siguientes localizaciones: oviducto 15, útero 17 (entre ambas localizaciones estaban las 20 cerdas), vagina 13, riñón 15, nódulo linfático supramamario 6, en 9 cerdas (14).
Se recuperó bratislava de un nódulo linfático supramamario en una cerda Seronegativa, 147 días tras abortar fetos infectados por leptospira. Esto sugiere una persistencia que puede tener respuesta celular y no humoral o que la respuesta inmune humoral no fue detectada por el test MA (14).
Esta localización en nódulos supramamarios se ve también en infecciones por Brucella abortus en vacas (Brinley-Morgan y Mackinon, 1979).
Bratislava se ha recuperado también del tracto genital del macho (Ellis, 1985).
Se han localizado leptospiras muenchen en machos en diferentes partes del aparato genital (14).
De seis verracos se han encontrado leptospiras en: riñón 6, uretra 10, vesícula seminal 8, glándula bulbouretral 6, próstata 5, testes 9.
La alta prevalencia en la teste y en las vesículas seminales comparado con los riñones enfatiza la importancia del tracto genital como lugar de localización y persistencia de leptospiras y soporta la sugerencia de que puede darse infección venérea (14).
Todas estas leptospiras fueron del serogrupo Australis, hallándose 8 bratislavas y 3 muenchen por el análisis de la restricción de la endonucleasa y pruebas cromosómicas.
La protección frente a un serovar no protege frente a otros, ya que en un macho se encontraron ambas.
Dada la relación entre infertilidad y leptospirosis se ha pensado que la infertilidad sea debida al macho (14). Esto no se ha demostrado (Kiktenko, 1976) pero seria interesante analizar los machos a la entrada en las granjas dado que es el único animal a veces que entra. Realizando el MAT seria suficiente (14).
La persistencia de leptospiras en tejido renal y genital es mayor a 147 días posteriores al aborto para bratislava y 43 para muenchen (14)
El alto número de aislamientos de leptospiras del serogrupo Australis hace aventura algunas hipótesis sobre su significación clínica:
Leptospira puede ser un agente primario como causa de un aborto.
Son comensales y oportunistas del tracto genital cruzando a veces la barrera placentaria.
Los diferentes serovares dan diferentes sintomatologías (16).
Transmisión
La transmisión tiene lugar por contacto directo con orina infectada o por agua contaminada (5). También hay transmisión placental o vía venérea (5,16,15).
Las leptospiras sobreviven largo tiempo en agua limpia ligeramente alcalina.
No está demostrada la infección por moscas hematófagas.
La especificidad relativa de las leptospiras a los roedores y al cerdo ha sido abandonada. Hay gran número de especies salvajes que se presentan como hospedadores más especializados como hurones, liebres, cérvidos, jabalíes, e incluso ranas (4).
Los cerdos se muestran como reservorio más importante para los serovares bratislava y muenchen con persistencia en el tracto genital. (14).
La infestación por ratas de la granja es una fuente común de contagio en patologías asociadas a L. Icterohaemorrhagiae. (5,16)
Los cerdos infectados son fuente de infección para los perros y para el hombre (5).
El ratón común (Mus musculis) es considerado el hospedador para L.interrogans serovar ballum (Hathaway, 1981), pero hay pocos informes sobre su potencial papel en infecciones por pomona.
Spradbrown en 1968 demostró que el ratón era susceptible a una infección experimental por pomona vía intraperitoneal y que posteriormente pueden excretar leptospiras (9).
El erizo parece ser un reservorio para bratislava en Europa, pero en el Reino Unido ha sido hallada en caballos, ovejas, tejones, ratas, zorros, y perros. Pero dadas las modernas instalaciones porcinas hay que buscar otros reservorios como otros cerdos o pequeños roedores que tengan acceso a la granja y que contaminen a los animales sanos (16).
En nuestro caso clínico desconocemos cual fue el origen de la infección. Podemos suponer que como en esta explotación todos los animales de reposición son comprados a granjas externas pudo llegar la infección con algún animal del exterior. No obstante unas semanas antes al diagnóstico de la enfermedad hubo un incremento en la apreciación de los trabajadores de la granja en cuanto al número de roedores presentes en la misma. Sin embargo esta última hipótesis es más difícil de sostener en cuanto a que no tuvimos los signos clínicos habituales que da la leptospira trasmitida por roedores.
Lesiones
Son raras las muertes en cerdas y las lesiones observadas son debidas a hallazgos de matadero o a las lesiones de los lechones abortados. En brotes agudos se observa septicemia e ictericia en hígado y riñón.(5)
En fetos abortados de infecciones por pomona e icterohaemorrhagiae pueden estar momificados o con los órganos blanquecinos con o sin ictericia. Un incremento de líquido rojizo está presente a menudo en cavidades orgánicas.
En fetos abortados por leptospiras del grupo Australis no hay momificación y los abortos tienen lugar en el último tercio de la gestación. También aparecen camadas pequeñas y un incremento de nacidos muertos. (17)
Las lesiones renales son el hallazgo más común. La lesión común es un foco blanco grisáceo de 1 a 3 mm. de diámetro en el córtex. Pueden estar rodeadas por un área congestiva. También puede haber petequias (17).
Microscópicamente estos focos están formados por infiltración de células inflamatorias, con predominio de linfocitos aunque también hay monocitos y neutrófilos.
Los túbulos renales presentan degeneración del epitelio y los glomérulos están hinchados y algunos tienen monocitos, neutrófilos y linfocitos. Otros están rotos o atrofiados.(17)
Los envoltorios fetales pueden estar edematosos o necrotizados.
Sintomatología
Debido a la intensificación de las explotaciones porcinas se trata de formas subagudas o crónicas que dan lugar a:
.- abortos con fetos sin lesiones
.- nacidos muertos
.- mortalidad neonatal elevada
.- disminución del tamaño de la camada
.- nacimiento de lechones que muestran retrasos en el crecimiento. (4,5,8,10,11)
En lechones se observa un síndrome febril acompañado de meningoencefalitis. Las meningitis pueden estar asociadas a Strep. suis.
Ellis en 1989 aisló Strep. suis de 8 cerebros de lechones infectados también por bratislava. Cabe la posibilidad de una acción sinérgica de ambas bacterias (6).
Tras la infección por canicola, icterohaemorrhagiae, pomona y tarassovi hay fiebre (40 C) durante 3 a 5 días. Los cerdos afectados están apagados, anoréxicos y pueden tener diarrea, ictericia y hemoglobinuria, pudiendo haber alta mortalidad. Son raros los signos nerviosos. Puede encontrase un ligero enrojecimiento de la piel en cerdos de cebo (5, 17)
En cerdas hay infertilidad y retornos al servicio en rebaños no inmunes (6,8,10,11,12). Análisis serológicos y clínicos han mostrado diferencias estadísticas entre títulos serológicos positivos e infertilidad en cerdas (17).
Hay un incremento de mortalidad en lechones recién nacidos y destetados (5).
En granjas de monta natural es en el segundo parto cuando más perdidas se producen debido al uso de verracos infectados, ya que las primalas se cubren con verracos jóvenes no infectados todavía (6).
La incidencia de la enfermedad suele tener picos cada 2 años debido presumiblemente a las fluctuaciones en la inmunidad del rebaño. (6).
La sintomatología observada en nuestro caso se correspondía con los siguientes datos:
*Cerdas gestantes
- Presencia de alguna cerda con hemoglobinuria.
- Incremento de la mortalidad en las cerdas.
- Hipertermia, con cerdas que dejan de comer.
- Abortos a final de gestación, sin lesiones aparentes en los fetos abortados.
*Partos:
- Desigualdad en las camadas; tanto en número de lechones, como en el tamaño de las mismas.
- Incremento de lechones nacidos débiles, lo que implica un aumento de mortalidad en lactación.
*Lechones:
- En fase de destete, hubo un incremento de casos con signos nerviosos que se asemejaban a casos de meningitis; se observaban algunos lechones con aspecto blanquecino
*Cubriciones:
- Incremento de las repeticiones irregulares, relacionado con mortalidad embrionaria, típica del contagio en esta fase.
El cuadro lesional observado en las necropsias efectuadas fue el siguiente:
- Alteraciones renales (Riñones congestivos, con presencia de petequias)
- Hemoglobinuria (algunos casos)
Diagnóstico
Serológico
La prueba serológica empleada corrientemente el test de microaglutinación microscópica MAT (1,4,5,8,10,14).
La serología es sólo especifica para cada serogrupo y debida a la aglutinación cruzada con serovares emparentados, así como a la débil producción de anticuerpos, el diagnóstico exacto depende del aislamiento e identificación del microorganismo o su visualización.
El diagnóstico serológico de una infección activa depende de la demostración del aumento de título. La seroconversión no se produce en todos los animales infectados.
La interpretación de las reacciones serológicas en el MAT debe llevarse a cabo con precaución, teniendo en cuenta el cuadro clínico de la explotación en general y de los animales analizados en particular. En los trastornos reproductivos hay que efectuar un estudio del grupo (4).
Es difícil sobre todo el diagnóstico por bratislava. Puede dar títulos por debajo de significancia en animales infectados (8).
También se usa la técnica de inmunofluorescencia directa sobre material post-mortem.
Otros métodos
El aislamiento se debe efectuar desde:
- órganos internos como hígado, pulmón, cerebro o fluidos como sangre, líquido cerebro espinal, peritoneal y torácico de animales clínicamente afectados o de abortos en casos agudos.
- tracto genital, riñón y orina en casos crónicos. La no presencia de leptospiras en orina no quiere decir que ese animal sea negativo. (8).
También varia el tipo de muestra en función de los síntomas:
- en fase de hipertermia deben investigarse las leptospiras en sangre tomada con anticoagulante (5).
- pasados 10 días de la fase de hipertermia deben investigarse en orina.
- en casos con problemas reproductivos se investigará en fetos o en aparatos genitales. (4)
Las técnicas de diagnóstico se basan en el aislamiento, visualización microscópica sobre campo oscuro (5,10), reacción inmunofluorescente (8) reacción a la inmunoperoxidasa, cultivo y aislamiento (que presentan gran dificultad) y estudios en secciones histológicas de riñón a través de métodos con impregnación en plata (5).
Los cultivos deben hacerse usando orina fresca, riñones recién extraídos con la cápsula renal intacta o de la cámara anterior del ojo de lechones abortados. (5,10,15)
La evolución del papel desempeñando por las leptospiras en los abortos ha sido bastante cuestionado dadas las dificultades para aislar este germen de material biológico. Desarrollos técnicos en cultivos como los de Ellis en 1981 y 1982 y medios de cultivos desarrollados por Ellis en 1985 han hecho posible su cultivo a partir de lechones y abortos.
Otro método que se usa actualmente es el análisis basado en la restricción de la endonucleasa.
Diagnóstico Laboratorial del Caso Clínico:
Se efectuó en dos laboratorios:
- Facultad de Veterinaria de Murcia: Tipo de muestra enviada: Técnica analítica efectuada:
- SIMA de Derio: Tipo de muestra enviada: Técnica analítica efectuada
Tratamiento y Control
El tratamiento clásico de las leptospirosis son las inyecciones parenterales con estreptomicina a la dosis de 25 mg por Kg de peso vivo. No obstante hay mucha controversia sobre si este tratamiento elimina la condición de portador (1,5,8).
Otros antibióticos ensayados han sido la tiamulina y las tetraciclinas.
El tratamiento con estreptomicina una semana antes del servicio y 2 antes del parto se ha mostrado como efectivo para reducir las pérdidas por fallos reproductivos.
La vacunación puede ser eficaz para controlar la propagación de la enfermedad, cuando se realiza en animales no infectados, pero no reduce la eliminación por la orina en los animales infectados.
La vacunación de cerdas con vacunas muertas conteniendo los apropiados serotipos antes del servicio puede prevenir el aborto (5).
También pueden vacunarse los lechones en periodos de riesgo (6 a 10 semanas de edad).
La vacunación no previene la colonización renal por parte de las leptospiras (5).
La vacunación con una bacterina de bratislava ha demostrado mejoras en la fertilidad y un incremento de los lechones nacidos por parto (10).
La vacunación induce inmunidad de relativa poca duración. Reduce la prevalencia de la enfermedad en la piara pero no elimina la infección (8).
Frantz en 1989 propuso un programa vacunal con bacteriana conteniendo 6 serovares: pomona, bratislava, hardjo, icterohaemorrhagiae canicola y grippotyphosa con 2 dosis antes de la primera cubrición y otra de renuevo antes de las siguientes cubriciones. Los resultados son mejores en primalas que en multíparas. (10)
Ellis también en 1989 propuso una bacterina con bratislava que protege a los cerdos de 16 semanas de una infección renal y del aparato genital cuando los animales vacunados son expuestos experimentalmente a un ataque por leptospiras 6 semanas después de la segunda dosis pero no protege a las 26 semanas. Los cerdos que eran sensibles a la reinfección tenían títulos <= 1:40 en Elisa y los no sensibles >= 1:160. Este es el título mínimo protectivo para 26 semanas (aproximadamente una gestación). Por ello hay que vacunar en todas las gestaciones.
En este ensayo se vio que los cerdos no vacunados y expuestos al ataque por bratislava eran más sensibles a la infección renal que a la genital cuando lo normal es lo contrario. Los autores presumen que pudo ser debido a que los animales no eran sexualmente maduros en el momento de la infección(12).
La enfermedad puede erradicarse por higiene, vacunación, tratamiento y sacrificio de los portadores. No todas las medidas pueden ponerse en todos los países dado que existen diferencias en las legislaciones sobretodo en lo referente a las vacunas.
Las leptospiras pueden sobrevivir congeladas. Es por ello que la practica del feedback para el control, de la Parvovirosis puede predisponer a las reinfecciones(5,8)
El tratamiento que nosotros efectuamos se oriento sobre los siguientes apartados:
Tratamiento vía pienso:
- Oxitetraciclina: 750 ppm; durante un periodo de 15 días este tratamiento fue administrado a todo el efectivo.
Tratamiento inyectable:
- Estreptomicina: Se administraron inyecciones en las siguien- tes fases:
- Dos semanas antes del parto.
- Al destete. Este tratamiento se efectuó hasta la vacunación del efectivo.
Vacunación:
- Se efectuó una vacunación y posterior revacunación de todo el efectivo con una vacuna de las siguientes características:
Control: Se incrementaron las desinfecciones y se hizo un plan de desratización exhaustivo.
La desinfección se centro principalmente en la zona de destete de las cerdas, por ser este, el lugar de mayor contacto directo entre los animales.
Bibliografía
(4) Andre-Fontaine, Ganiere (1990).Jornadas Internacionales de Producción Porcina.Loudeac,Francia.
(3) Buard (1990).Jornadas Internacionales de Producción Porcina.Loudeac, Francia.
(15)Cargill, Davost (1981).Australian Veterinary Journal 57, 236-238
(16)Ellis, McParland, Bryson, Cassells (1986). Veterinary Record 118, 63-65.
(11)Ellis, Thiermann (1986).Am.J.Vet.Res 47, 1458-1459
(13)Ellis, McParland, Bryson, Cassells (1986).Veterinary Record 118,563
(14)Ellis, McParland, Bryson, Thiermann, Montgomery (1986). Veterinary Record 118, 294-295
(6) Ellis (1989) Pig Veterinary Journal 22, 83-92
(12)Ellis,Montgomery,McParland (1989). Veterinary Record 125, 319-321
(6) Ellis (1989) Pig Veterinary Journal 22, 83-92
(8) Ellis ( ) Pig Veterinary Journal
(10)Frantz, Hanson, Brown (1989). Am.J.Vet.Res 50, 1044-1047
(1) Gresham (1989)Comunicacion personal.
Hathaway, Little (1981). Veterinary Record 108,224-228
Hathaway, Little, Stevens (1981). Research in Veterinary Science 31, 169-173
Hathaway, Little, Stevens (1982). Veterinary Record 111, 100-102
(17)Hathaway, Little, Wrathall (1983). British Veterinary Journal 139, 393-414
Hathaway, Lttle, Stevens (1983). Research in Veterinary Science 35, 64-68
Pearson (1993). Pig Veterinary Journal 31, 92-100
(2) Perea, Garcia Gimeno, Carranza, Arenas, Maldonado, Tarradas, Mendez (1991). Anaporc 98, 18-19
(7) Pritchard, Little, Wrathall, Jones (1985). Pig Veterinary Journal 12, 65-82
(5) Taylor (1986 ) Pig Diseases
(9) Whyte,Ratcliff (1982). Australian Veterinary Journal 58, 169.
Temas relacionados
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicaciónUniversidad Nacional De Colombia (UNAL)
24 de noviembre de 2012
El brote que se nos presento, empezo con partos antes de tiempo, lechones debiles, piel gelatinosa y se mueren todos, son incapaces de mamar.
11 de junio de 2011
los sintomas presentados de paladar endico se deben a aspectos geneticos del reproductor; para lo cual se le sugiere el cambio del mismo y ojala evitar seleccionar reproductor en la misma porcicola de aquellas hembras que fueron inseminadas con reproductores que las mismas agencias distribuidoras de semen advierten que no se deben seleccionar los machos para continuar o mejoramiento genetico de la porcicola;
en cuanto a presencia de leptospira se debe vacunar contra leptospirosis las hembras que han presentado abortos y demas sintomas de leptospirosis
saludos
francisco
18 de noviembre de 2008
en una granja porcicola en el quindio colombia donde diagnosticaron por laboratorio leptospirosis en cerdos, luego cuando se reinició el proyecto, se sugirio desinfeccion termica con soplete de todas las porquerizas sin embargo luego de un tiempo reaparecieron los abortos, la muerte de lechones recien nacidos y la presencia de lechones muy debiles y presencia de reabsociones fetales cabe anotar que ello se presentaba en el ultimo tercio de la gestacion, para lo cual se recurrió en las hembras que en el anterior ciclo habian presentado problemas, la inyeccion intramuscular de 20cc de gluconato de calcio y 2 a 3cc de oxitetraciclina cada dos dias,desde los 20 dias antes del partolograndose terminar la gestacion con el nacimiento de todos los lechones( gran parte nacian de bajo peso,pero todos se criaban).los costos de cria,levante, ceba aumentaron.
23 de junio de 2015
Buenas tardes.
En el supuesto caso de que un cerdo posea leptospirosis si este es vacunado, hay riesgo de muerte del mismo?

21 de mayo de 2014
JUAN DOMINGO VERGARA, TE CONVIENE MAS MANDAR LAS MUESTRAS DE SANGRE QUE ATINARLE AL TRATAMIENTO, PRIMERO HAY QUE EMPEZAR POR LO BÁSICO, COMO ESTAN DANDO LOS SERVICIOS? CUANTAS MONTAS O SERVICIOS DAN? EN QUE MOMENTO? YA TIENEN CONOCIMIENTO DE QUE ENFERMEDADES CIRCULAN EN LA GRANJA? ESTE PROBLEMA ES NUEVO? CHECA MAS SIGNOS PARA QUE VEAS CONTRA QUE ENFERMEDADES VAS A MUESTREAR Y MANDAS 4 MUESTRAS.
19 de mayo de 2014
HOLA BUENAS TARDES ME PARECE MUY COMPLETO ESTE ARTICULO,DESEARIA SABER SI ALGUIEN ME PUEDE INFORMAR SI LAS CAUSAS DE LA POCA FERTILIDAD Y NO ENTRAR EN CELO DE LAS CHANCHAS MADRES PUEDE SER EL CAUSAL DE ESTA ENFERMEDAD LLAMADA LEPTOSPIROSIS,DE 40 MADRES QUE TENGO SOLO UN 10 0 15 POR CIENTO QUEDAN PREÑADAS CON MUY BAJA FERTILIDAD SOLO 4 0 5 LECHONES POR CADA UNA,LAS TENGO EN TRATAMEINTO CON ANTIBIOTICOS Y PADRILLO APARTADO HACIENDOLE SANIDAD,DESDE YA AGRADECERE TODA INFORMACION,EL VETERINARIO NO LE ENCUENTRA LA VUELTA AL CASO.POR ANALISIS DE SANGRADO LOS COSTOS SON ELEVADISIMOS AGRADECEDERE TODA INFORMACION.-

11 de abril de 2014
Muy buen artículo, tengo un caso de una cerda que salió positiva en Microaglutinación a L. wolffi, en general en la granja hay problemas de repeticiones, nacidos muertos y camadas pequeñas, se me hace raro que haya salido este serovar, por que por lo poco que he leído es mas común en bovinos y ahí no hay contacto con bovinos, ahora mi duda es, solo dar tx a los que presenten signos o dar tratamiento a todas las cerdas y sementales?
22 de noviembre de 2012
Lo felicito por las informaciones en su artículo. Me llama la atención que loa caballos no son afectado por la bacteria leptospirosis, podria darme referencias para ilustrarme del porque no. Trabajo leptospirosis en humanos pero tengo entendido que el caballo es considerado uno de los animales apegado al hombre del campo para su trabajo y si esta infectado de la bacteria leptospira infecta el ambiente y accidentalmente al hombre. Gracias.
26 de octubre de 2012
espero que alguien pueda ayudarme, trabajo en una granja de cerdos y tengo una marrana de casi dos meses de gestación, tiene dos días sin comer y sin tomar líquidos a voluntad, ha estado de pie desde entonces salivando y jadeando, no tiene fiebre pero en los poros de su piel hay presencia de sangre que incluso al bañarla tiñe el agua de rojo, es más evidente en la zona de la cabeza y orejas. Alguien sabe que enfermedad es y que tratamiento debo darle???
Gracias por sus respuestas




.jpg&w=3840&q=75)







.jpg&w=3840&q=75)